β-胡萝卜素强化剂对卤虫体内类胡萝卜素组成的影响
2023-09-06陈慧聪薛毓才王伟隆黄旭雄
陈慧聪,王 茜,薛毓才,王伟隆,2,3,黄旭雄,2,3
(1.上海海洋大学,水产科学国家级实验教学示范中心,上海 201306;2.上海海洋大学,上海市水产养殖工程技术研究中心,上海 201306;3.上海市水产动物良种创制与绿色养殖协同创新中心,上海 201306)
类胡萝卜素(carotenoids)是广泛存在于动植物及微生物中的一类基于C40异戊二烯结构的脂溶性色素[1]。在水产养殖中,类胡萝卜素由微生物合成,再通过浮游动物、甲壳动物、鱼类这条食物链逐级积累[2]。集约化水产养殖造成群落结构发生变化、食物链单一、有效色素源少,是导致养殖对象体内类胡萝卜素缺乏的重要原因[3]。在饲料中添加类胡萝卜素可以有效改善水产动物色乏、味寡、香弱、抗病力差及繁殖能力低下等问题,因而受到广泛关注[4]。目前在水产动物饲料中添加的类胡萝卜素主要为胡萝卜素类(结构中不含氧的烃类类胡萝卜素,以β-胡萝卜素为主)和叶黄素类(以隐黄质、玉米黄质、海胆酮、角黄素和虾青素为主)两大类。
β-胡萝卜素(β-carotene)作为维生素A的前体,具有很高的生物活性,可预防因维生素A缺乏导致的疾病[5]。水产动物可以直接利用饲料中添加的类胡萝卜素或将其转化为其他类胡萝卜素沉积在不同组织中[6]。作为抗氧化剂,β-胡萝卜素可以抑制脂质过氧化,保护生殖细胞免受氧化反应的损伤,提高水产动物的繁殖力及孵化率[7]。另外,β-胡萝卜素的强抗氧化作用可以有效淬灭活性氧和自由基,保护机体白细胞免受损伤,从而提高水产动物的非特异性免疫机能[8]。
卤虫(Artemia)幼体和成虫是海水养殖苗种培育中重要的生物饵料[9]。利用卤虫具有非选择性滤食的特性,将其作为活载体,使卤虫肠道包裹并携带特定强化剂,可以有效地满足水产动物对必需脂肪酸、氨基酸、脂溶性维生素等的需求[10]。本研究利用β-胡萝卜素作为强化剂,测定分析不同强化剂量对卤虫体内类胡萝卜素组成和含量变化的影响,评估卤虫作为类胡萝卜素生物载体的可行性,同时探索卤虫体内β-胡萝卜素的代谢规律,以期提高卤虫在水产养殖中的生物饵料价值。
1 材料与方法
1.1 实验材料
实验用渤海卤虫干卵购自山东滨州前华水产有限公司,卤虫卵在25 L孵化桶内进行孵化,孵化密度2 g·L-1,孵化在盐度25的过滤人工海水中进行,水温27~28℃,pH =8,连续光照充气,孵化24 h后分离一部分无节幼体用于后续β-胡萝卜素强化实验,另一部分无节幼体在实验室环境下继续培养至15日龄成虫后进行β-胡萝卜素强化实验。类胡萝卜素检测用的虾青素、玉米黄质、角黄素、海胆酮和β-胡萝卜素标准品均购于美国Sigma公司。
1.2 实验设计
1.2.1 β-胡萝卜素强化实验
配制5个浓度梯度的人工合成β-胡萝卜素强化剂。分别称取15、45、75、105、135 mg的人工合成β-胡萝卜素(纯度≥98%,Adamas)于1 L烧杯中,加入20 mL吐温80,充分搅拌,逐渐加入980 mL盐度25的海水,继续搅拌直至均匀乳化。并设1个不添加β-胡萝卜素的对照组,对照组只含有20 mL吐温80的海水(盐度25)。
将孵化好的卤虫无节幼体/成虫分别转移到装有14 L海水的20 L塑料桶中,卤虫无节幼体密度为30尾·mL-1,成虫密度为1尾·mL-1。每个实验桶分别添加1 L上述不同浓度(15、45、75、105、135 mg·L-1)的β-胡萝卜素强化剂以及对照组溶液,使得桶内β-胡萝卜素浓度分别为0、1、3、5、7、9 mg·L-1,共6个处理组,每组设3个平行。在光照2 000 lx、水温25℃、pH =8及持续充气的条件下,强化24 h后收集卤虫。
1.2.2 营养强化后饥饿实验
根据1.2.1方法用不同浓度β-胡萝卜素强化剂强化卤虫无节幼体(成虫)24 h后,用200目筛绢收集卤虫,并用盐度25的海水冲洗掉表面的β-胡萝卜素强化剂,转移至装有15 L海水的塑料桶中,在与1.2.1相同培养条件下,投喂适量无色素酵母12 h后收集卤虫。
1.3 类胡萝卜素含量测定
1.3.1 卤虫样品收集方法
无节幼体:从强化实验水体中取1 mL水样于浮游动物计数框中,用甲醛固定,在体式镜(LEICA S9E,Germany)下计数,重复6次。然后将水体中的卤虫无节幼体滤出,收集于10 mL离心管中,计算总数,冷冻干燥后用于类胡萝卜素检测。
成虫:随机取50只卤虫成虫收集于10mL离心管中,冷冻干燥后用于类胡萝卜素检测。
1.3.2 卤虫样品前处理
将丙酮-甲醇(v∶v,2∶1)萃取剂3 mL加入1.3.1收集的卤虫样本中,充分涡旋振荡,24 kHz下冰浴超声处理30 min,再35℃浸提1 h后,4 000 r·min-1离心10 min,取上清液,对残余料渣重复提取3次。合并上清液后用氮气吹干,加入3 mL甲醇-乙腈(v∶v,3∶7)溶剂使其完全溶解,经0.22μm亲水滤膜过滤后加入进样瓶中备检。
1.3.3 类胡萝卜素检测标准品标定
5种类胡萝卜素混合标准溶液:分别称取5种类胡萝卜素标准品1mg混合,用正己烷定容为50μg·mL-1的类胡萝卜素标准储备液。分别移取上述标准储备液0.04、0.20、0.40、1.00、4.00 mL于5个10 mL容量瓶中混合均匀,用氮气吹干后,加入含0.1% BHT的甲醇-乙腈(v∶v,3∶7)溶剂,将其定容为0.2、1.0、2.0、5.0、20.0 μg·mL-1的5个梯度类胡萝卜素混合标准溶液,经0.22μm亲水滤膜过滤后加入进样瓶中备检。每组中类胡萝卜素含量以μg·万只-1计。
采用超高效液相色谱仪(ultra-high performance liquid chromatography,UPLC,Waters,US)配用ACQUITY H-Class BEH C18色谱柱(1.7μm,2.1 mm ×150 mm)用于类胡萝卜素的分离和测定。流动相A:100% 超纯水;流动相B:甲醇-乙腈(v∶v,3∶7)溶液;流动相C:100% 叔丁基甲基醚溶液。梯度洗脱条件:10% A +90% B 16 min,20% C+80% B 14 min,流速0.3 mL·min-1,进样量10μL,柱温25℃,检测波长475 nm(图1)。
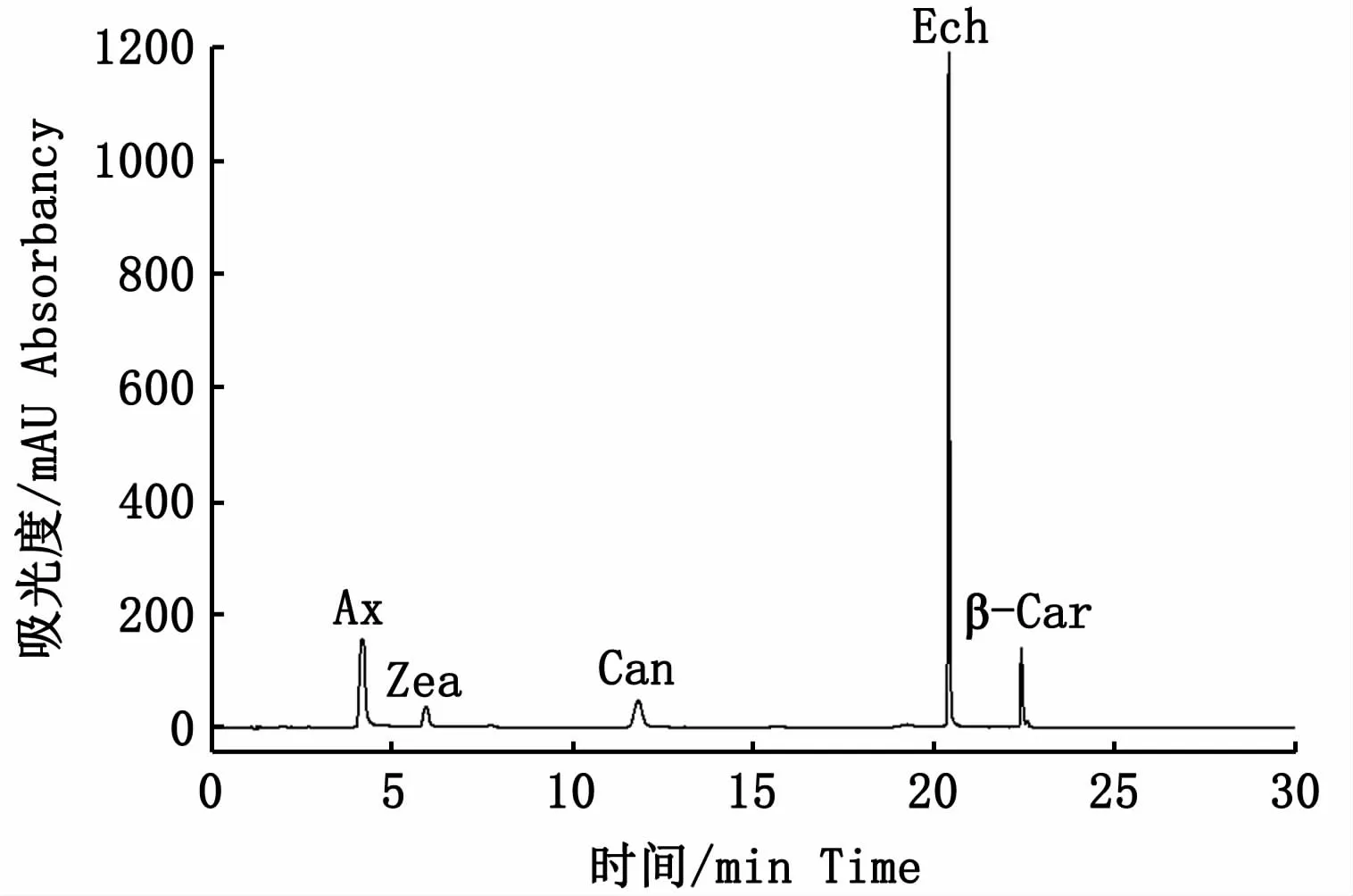
图1 梯度洗脱条件下5种类胡萝卜素混标峰图Fig.1 Peak curves of five carotenoids w ith gradient elution conditions
1.4 数据统计方法
实验结果用平均值 ±标准差(mean±SD)表示,数据采用SPSS 22.0软件进行单因素方差分析(one-way ANOVA),用Duncan’s法进行多重比较检验,用t检验分析饥饿前后卤虫体内类胡萝卜素含量差异。P<0.05表示差异显著。
2 结果与分析
2.1 卤虫无节幼体强化24 h后体内类胡萝卜素含量的变化
在强化前和对照组的卤虫无节幼体中仅检测到角黄素和海胆酮两种类胡萝卜素,未检测到β-胡萝卜素。强化24 h后,强化组无节幼体的β-胡萝卜素含量随着强化剂浓度的增加显著上升(P<0.05)(图2-a)。当β-胡萝卜素强化剂量大于3 mg·L-1时,无节幼体体内海胆酮含量显著高于强化前和对照组(P<0.05),其中5 mg·L-1和7 mg·L-1β-胡萝卜素强化组卤虫体内的海胆酮含量最高,且两组间无显著性差异(P>0.05)(图2-b)。经过24 h强化后,对照组无节幼体体内角黄素含量显著低于3 mg·L-1和5 mg·L-1强化组(P<0.05),其中5 mg·L-1强化组无节幼体体内角黄素含量最高。

图2 不同剂量β-胡萝卜素强化卤虫无节幼体24 h后体内类胡萝卜素含量变化Fig.2 Carotenoid content changes in Artem ia nauplius after different levels ofβ-carotene enrichment for 24 h
2.2 卤虫无节幼体强化24 h后再饥饿12 h体内类胡萝卜素含量变化
由图3可见,饥饿12 h后,各强化组无节幼体体内β-胡萝卜素含量均显著下降(P<0.05),低剂量强化组(1、3、5 mg·L-1)组间差异不显著(P>0.05)(图3-a)。饥饿后各组无节幼体体内海胆酮含量也呈现下降趋势,且对照组和3、5、7、9 mg·L-1强化组海胆酮含量较12 h前显著降低(P<0.05);饥饿12 h后,5 mg·L-1和7 mg·L-1强化组海胆酮含量显著高于其他组别,对照组显著低于其他组别(P<0.05)(图3-b)。饥饿后各组无节幼体角黄素含量较饥饿前有所下降,但均无显著性差异(P>0.05);饥饿后5 mg·L-1组无节幼体角黄素含量依然最高,显著高于其他组别(P<0.05),其他5组间无显著性差异(P>0.05)(图3-c)。
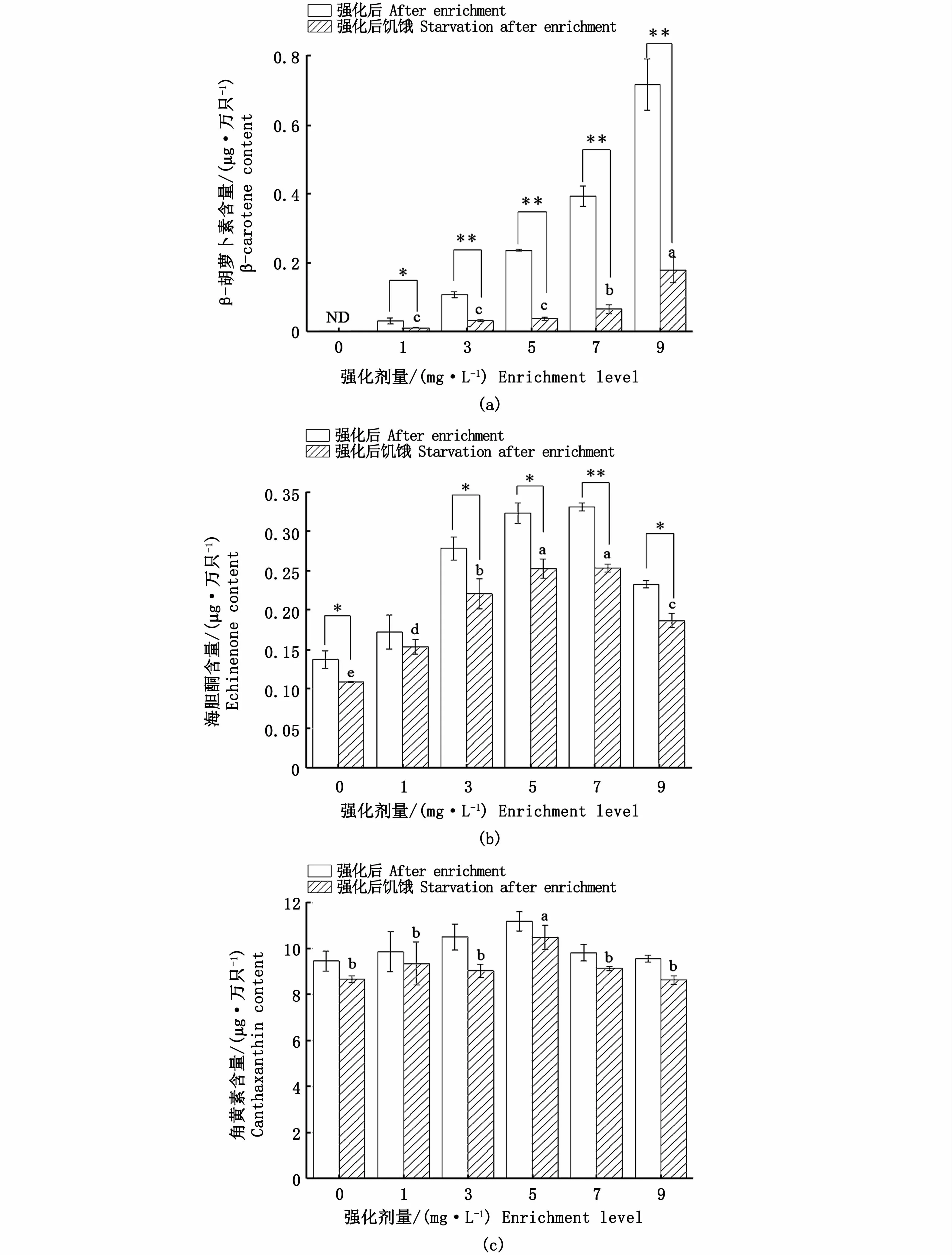
图3 不同剂量β-胡萝卜素强化卤虫无节幼体24 h后再饥饿12 h体内类胡萝卜素含量变化Fig.3 Carotenoid content changes in Artemia nauplius after different levels of β-carotene enrichment for 24 h and then starvation for 12 h
2.3 卤虫成虫强化24 h后体内类胡萝卜素含量变化
在强化前及对照组的卤虫成虫体内仅检测到角黄素和海胆酮两种类胡萝卜素,未检测到β-胡萝卜素。β-胡萝卜素强化后,各组卤虫成虫体内β-胡萝卜素含量随着强化剂量增大先呈上升趋势;当剂量大于7 mg·L-1时,卤虫体内β-胡萝卜素含量则下降(图4-a)。1、3、5 mg·L-1β-胡萝卜素强化组在强化24 h后,卤虫成虫体内海胆酮含量降低;而高剂量强化组(7 mg·L-1和9 mg·L-1)卤虫成虫体内海胆酮含量显著高于其他各组(P<0.05)(图4-b)。β-胡萝卜素强化后,强化组卤虫成虫体内角黄素含量显著高于强化前和对照组(P<0.05);其中,9 mg·L-1强化组又显著高于其他组别(P<0.05),而低剂量强化组(1、3、5 mg·L-1)之间没有显著性差异(P>0.05)(图4-c)。

图4 不同剂量β-胡萝卜素强化卤虫成虫24 h后体内类胡萝卜素含量变化Fig.4 Carotenoid content changes in Artem ia adu lts after different levels ofβ-carotene enrichm ent for 24 h
2.4 卤虫成虫强化24 h后再饥饿12 h体内类胡萝卜素含量变化
由图5可知,各强化组卤虫成虫饥饿12 h后,体内β-胡萝卜素含量较饥饿前均极显著降低(P<0.01);其中,9 mg·L-1强化组卤虫饥饿后体内β-胡萝卜素含量显著高于其他各组(P<0.05)(图5-a)。低剂量强化组(1、3、5 mg·L-1)在饥饿12 h后,体内海胆酮含量显著低于对照组和高剂量强化组(7、9 mg·L-1)(P<0.05)(图5-b)。对照组角黄素含量在饥饿前后没有发生显著性变化(P>0.05),强化组角黄素含量在饥饿后总体上呈上升变化的趋势,但各组饥饿前后差异均不显著(P>0.05);其中,9 mg·L-1强化组卤虫体内角黄素含量最高,且显著高于除7 mg·L-1强化组外的其他各组(P<0.05)(图5-c)。
3 讨论
以往研究表明,水产动物自身无法合成类胡萝卜素,仅可利用饲料中的类胡萝卜素直接储存或转化后沉积于体内[11]。野生水产动物由于其生长环境中富含能够合成类胡萝卜素的藻类和细菌,在生长过程中不会出现因类胡萝卜素营养缺乏导致的体色及免疫活性方面的问题[12]。但在高密度集约化养殖过程中,人工配合饲料组成中易发生有效色素源少且活性不稳定等情况,造成类胡萝卜素这一必须从外源食物中摄取的功能性代谢产物的严重缺乏,而类胡萝卜素长期不足将直接或间接导致养殖对象体色异常、风味差及抗病能力低于野生品种。
卤虫属于较低等的甲壳动物,在自然环境中主要以细菌和微藻为食,可作为第二营养级向高营养级传递能量,满足水产动物各时期的营养需求[13]。本文研究结果表明,在自然条件下生长的卤虫无论是在无节幼体还是成虫阶段,在色谱测定条件无变化和没有外源性胡萝卜素干扰的情况下,在卤虫体内只检测到角黄素和海胆酮两种类胡萝卜素。这一发现与HSU等[14]在加利福尼亚卤虫卵以及初孵无节幼体体内得到的检测结果一致。GILCHRIST和GREEN[15]的实验结果表明,卤虫体内检测到的β-胡萝卜素和虾青素等类胡萝卜素很可能来源于生长环境中富含能够生产相应类胡萝卜素的藻类(如杜氏盐藻Dunaliellasalina、雨生红球藻Haematococcuspluviali等)。为了进一步验证以上结论,本实验选用不同梯度的β-胡萝卜素分别对卤虫无节幼体及成虫进行营养强化。实验结果表明,在β-胡萝卜素强化24 h后,随着β-胡萝卜素强化剂浓度增加,卤虫体内β-胡萝卜素含量总体上呈现显著上升变化趋势。这一结果可能是由于强化后卤虫肠道内β-胡萝卜素没有排空,充分发挥了卤虫作为生物载体对营养物质的包裹富集作用,也论证了卤虫成为类胡萝卜素载体的可行性。
甲壳动物体内的类胡萝卜素包括胡萝卜素类(carotenes)和叶黄素类(xanthophylls)两类。胡萝卜素类以β-胡萝卜素为主;叶黄素类则是胡萝卜素的含氧衍生物,主要包括隐黄质、玉米黄质、海胆酮、角黄素和虾青素等[13-14]。其中,隐黄质、玉米黄质、海胆酮、角黄素和虾青素的化学结构与β-胡萝卜素相似,主要由中央多聚链和位于两侧的芳香环组成,区别在于每个芳香环上的3,3’和4,4’端具有不同数量的羟基和酮基。众所周知,物质结构决定其功能,这些类胡萝卜素以蛋白共轭或者脂肪酸酯合形式在甲壳动物组织中的选择性积累,不仅表明结构差异性对水产动物的生长发育和健康产生的不同生理作用,也增加了类胡萝卜素与其他生物分子之间相互作用的复杂性[15-16]。已有研究表明,甲壳动物可以通过代谢转化不同外源类胡萝卜素以满足机体正常发育过程中对类胡萝卜素的营养需求[4]。传统的“对虾模型”代谢转换方式,可以将β-胡萝卜素、隐黄质、角黄素和玉米黄质转化为虾青素,而酮基化酶和羟基化酶的功能特性决定了这两种酶在类胡萝卜素代谢转化过程中的关键作用[8,17]。而在代谢转化过程中,两种酶的交替作用也会产生多条不同的中间产物的补充途径[4]。迄今为止,类胡萝卜素代谢转化途径中所需关键酶基因及其作用机制的研究仅在少数自身能够合成虾青素的微生物中有比较系统与深入的开展,涉及甲壳动物的相关研究还较为匮乏[18-19],仅在测定桡足类高通量的转录组文库后,通过生物信息学分析筛选到代谢转化途径中差异表达的β-胡萝卜素羟基化酶基因[20],但对其作用机制的研究还未见报道。在观察强化后卤虫体内角黄素和海胆酮含量变化的过程中发现,强化24 h后的卤虫成虫体内角黄素含量较强化前总体上呈显著上升趋势,且在饥饿12 h后卤虫肠道β-胡萝卜素排空的情况下,其体内角黄素含量不降反升,充分证实卤虫体内存在从β-胡萝卜素到角黄素的转化途径。分析海胆酮(4-keto-β-carotene)和角黄素(4,4’-diketo-β-carotene)两种物质结构,发现这两种类胡萝卜素都属于酮基类胡萝卜素。而且在卤虫卵、初孵无节幼体以及成虫中均未检测出玉米黄质(3,3’-dihydroxy-β-carotene)和虾青素(3,3’-dihydroxy-4,4’-diketo-βcarotene)等羟基类胡萝卜素中间代谢产物,可以推测卤虫体内类胡萝卜素代谢转化过程中,可能只有β-胡萝卜素酮基化酶的参与,而缺少羟基化酶的作用。实验结果还表明,卤虫成虫的转化能力较无节幼体更强,能够在胡萝卜素传递过程中满足多级营养需求。
为提高营养强化效率,今后研究还可从以下几个方面开展:选择合适的外源类胡萝卜素强化剂;加强卤虫类胡萝卜素营养动力学研究;细化品系筛选和强化条件;发掘卤虫体内参与代谢转化的功能酶基因等。
