浙江省健跳港蛎江滩牡蛎多样性和资源量的时空变化
2023-09-06施文静张文考陈丽芝祁拥华叶春宇李楠楠范瑞良全为民
施文静,张文考,陈丽芝,祁拥华,叶春宇,姜 伟,李楠楠,范瑞良,全为民
(1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院东海水产研究所,农业农村部渔业遥感重点实验室,上海 200090;3.三门县水产技术推广站,浙江三门 317100;4.三门县农业农村局,浙江三门 317100)
牡蛎是重要的海岸带“生态系统工程师(ecosystem engineer)”之一,通过牡蛎聚集生长而形成的牡蛎礁曾经广布于全球河口、海湾和滨海[1-3],发挥着净化水体[4]、营造生境[2-3,5-6]、防护岸线[1-2]、固碳[7]等生态功能。但由于过度捕捞、环境污染、生境破坏和病害等原因,过去100年来,全球约85%的牡蛎礁已经消失,野生牡蛎资源量已经下降了65%[1-2]。
20世纪90年代之前,我国南北沿海的许多河口和海湾都分布有自然牡蛎礁,但随着人类活动的增加,绝大多数牡蛎礁已经退化或消失[8-9]。2000年以后,我国逐渐开始关注牡蛎礁的生态功能[2],并对天津大神堂[10]、江苏小庙洪[3-4]、河北曹妃甸[9]等地区现存的活体牡蛎礁的生态现状进行了调查研究,结果显示,大部分牡蛎礁礁体已经严重退化或消失。目前,我国对牡蛎礁的生态学调查研究还相对不足[9],无法准确掌握我国自然牡蛎礁的地理分布和生态现状,这也制约了我国海岸带生境的保护与修复。
健跳港是浙江中部三门湾内的一条狭长而弯曲的内港,是典型的海湾型淤泥质潮汐汊道,全长约17 km,总面积16.7 km2[11]。健跳港上游湾区底部的水质较好、初级生产力较高,潮间带遍布自然砾石,为牡蛎的附着与生长提供了适宜环境,形成以近江牡蛎(Crassostreaariakensis)和熊本牡蛎(C.sikamea)为优势种的自然牡蛎礁[12],当地称之为蛎江滩。但近年来,由于流域开发和过度捕捞等原因,导致蛎江滩自然牡蛎礁面积减少、牡蛎资源量下降和种质退化[12]。为保护该水域牡蛎种质资源及其形成的自然牡蛎礁生境,本研究系统调查了蛎江滩中牡蛎的种类、资源量和幼体补充量,并分析了牡蛎的遗传多样性及资源量和幼体补充量的时空变化特征,以期为蛎江滩牡蛎礁的保护和修复提供科学依据。
1 材料与方法
1.1 研究地点
本文研究地点位于浙江省三门县健跳港上游湾区的蛎江滩(121°32′17″~121°32′40″E、29°00′55″~29°01′25″N)(图1)。健跳港内潮汐为非正规半日潮,春季平均潮差为4.11 m,夏季平均潮差达4.36 m[11]。海水温度5.2~30.1℃,盐度3.5~15.1。蛎江滩牡蛎礁位于潮间带低潮区,礁区上边界和下边界高程相差约2 m,由牡蛎聚集附着于自然砾石发育而成,成斑块状分布,礁区面积约0.33 km2。
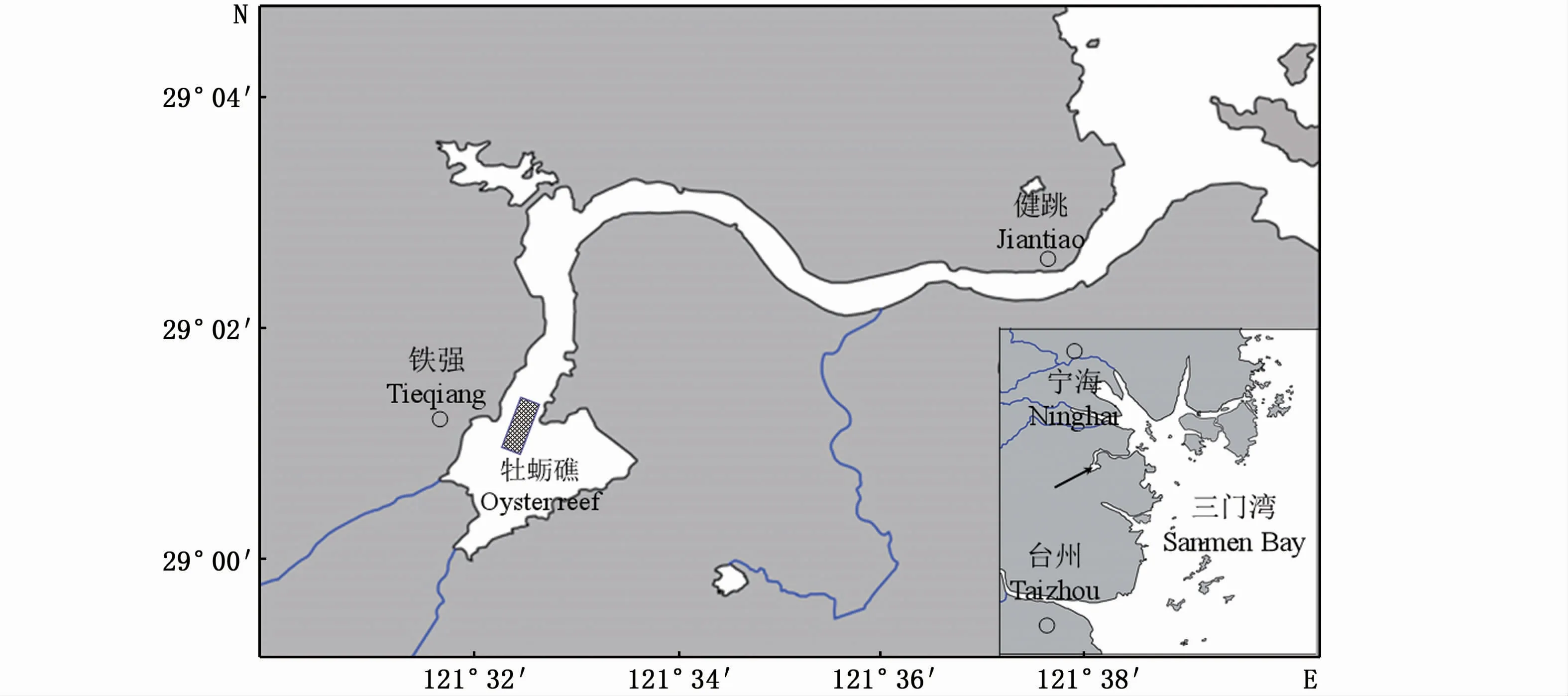
图1 健跳港蛎江滩牡蛎礁位置示意图Fig.1 Location of Lijiangtan oyster reef in Jiantiao Bay
1.2 牡蛎资源调查
分别于2021年夏初(6月8日)和秋季(10月8日)开展蛎江滩牡蛎礁的生态现状调查,两季调查区域和站位基本一致。将牡蛎礁区按高程划分为低礁区、中礁区、高礁区,夏初和秋季分别在每个礁区随机布设9个和6个0.4 m×0.4 m的样方,同一礁区不同样方的间距大于20 m,采集每个样方内的所有活体牡蛎作为1个样品,装入封口袋。另在礁体上定性采集牡蛎样品。
采用形态学和分子生物学方法鉴定牡蛎种类,根据外壳形态可以鉴定大部分牡蛎个体,对于部分外壳形态特征较模糊的牡蛎样本,采用线粒体16S rDNA基因序列分析确定其种类[12-14],并据此分析牡蛎的遗传多样性。另从夏初调查获取的牡蛎样品中,每种牡蛎选取30个,使用COI通用引物LCO1490:5′-GGTCAACAAATCATA AAGATATTGG-3′和HCO2198:5′-TAAACTTCAGGG TGACCAAAAAATCA-3′,对选取的牡蛎进行PCR扩增并送上海生工生物工程有限公司测序。通过ClustalX(Version 1.83)软件进行多序列比对和分析,采用MEGA 11软件确定各序列的碱基组成、多态位点及个体间遗传距离等。采用DNASP 5.0软件计算基于16S rDNA和COI基因片段的4种牡蛎的多态位点数(S)、变异位点数(V)、单倍型数(H)、单倍型多样性指数(Hd)、核苷酸多样性指数(Pi)、平均核苷酸差异数(K)等遗传多样性参数[13]。
在实验室内计数每个样品中活体牡蛎的数量,牡蛎的密度统计为单位面积内每种牡蛎的数量(个·m-2)。另从每个样品中随机抽取30个牡蛎,用数字游标卡尺测量其壳高(SH),精确至1 mm,个体数量不足30个时则全部测量。牡蛎密度数据经lg(x+1)转换后,采用两因素方差分析(two-way ANOVA)方法对牡蛎密度的季节(夏初、秋季)变化和空间(高礁区、中礁区和低礁区)变化进行分析(Tukey检验,P<0.05)。所有数据分析均采用Sigmaplot12.5软件实现。
1.3 牡蛎补充量监测
用3根长3.5 m、直径10 cm的不锈钢管垂直插入海底(插入深度约1 m),组装成边长0.5 m的等边三角形实验用附苗架。2021年6月在低礁区设置5个附苗架,附苗架平行于水边线布置,尽量使5个附苗架处于相同高程。附苗器为15 cm(长)×15 cm(宽)×1 cm(厚)的瓷砖片。在每个附苗架中,分别在离海底0.6 m和1.6 m处水平安装1个聚乙烯网片(网目尺寸1 cm),每个网片上放置1个附苗器,附苗器粗糙面朝上。牡蛎补充量于2021年6月8日开始监测,2021年10月8日结束监测,约15 d设为1个监测时段,6月8日放置第1个附苗器,然后分别于6月26日、7月10日、7月27日、8月9日、8月21日、9月6日、9月21日将附苗器取下放入封口袋中带回实验室,并换上新的附苗器,10月8日取回最后一个附苗器。实验室内,用解剖镜检验和计数每个附苗器粗糙面附着的牡蛎稚贝数量,并换算为牡蛎补充量(个·cm-2)。每次从每个实验潮区牡蛎稚贝样品中随机取30个,采用上述分子生物学方法鉴定其种类。牡蛎补充量数据经lg(x+1)转换后采用两因素方差分析(two-way ANOVA)方法分析牡蛎补充量的时间变化和空间变化(Tukey检验,P<0.05)。
2 结果与分析
2.1 牡蛎种类和遗传多样性
牡蛎样品的16S rDNA基因测序结果表明,蛎江滩牡蛎礁中分布有6种牡蛎,分别是近江牡蛎、熊本牡蛎、福建牡蛎(C.angulata)、香港牡蛎(C. hongkongensis)、猫爪牡蛎(Talonostrea talonata)和长牡蛎(C.gigas)。
前4种常见牡蛎的16S rDNA和COI基因片段的碱基组成结构均呈现出A+T明显高于C+G、C的比例最低的特点(表1)。2种基因片段不同之处在于碱基A和T占比不同,在16S rDNA基因片段中,A与T的占比相差不大,而在COI基因片段中,T的占比明显高于A的占比(表1)。4种牡蛎的遗传多样性见表2。

表1 4种牡蛎16S rDNA和COI基因片段碱基组成Tab.1 Base com position of 16S rDNA and COI gene fragments of 4 oyster species(%)

表2 基于16S rDNA和COI基因片段的4种牡蛎遗传多样性Tab.2 Genetic diversity of 4 oyster species based on 16S rDNA and COI gene fragments
2.2 牡蛎资源量及其时空变化
定量生态调查仅采集到3种牡蛎(表3)。在数量上,熊本牡蛎占绝对优势,香港牡蛎和近江牡蛎的占比均较低(表3)。由高礁区至低礁区,熊本牡蛎的占比和出现频率总体上逐步下降,而近江牡蛎和香港牡蛎的占比和出现频率总体上逐步上升(表3)。
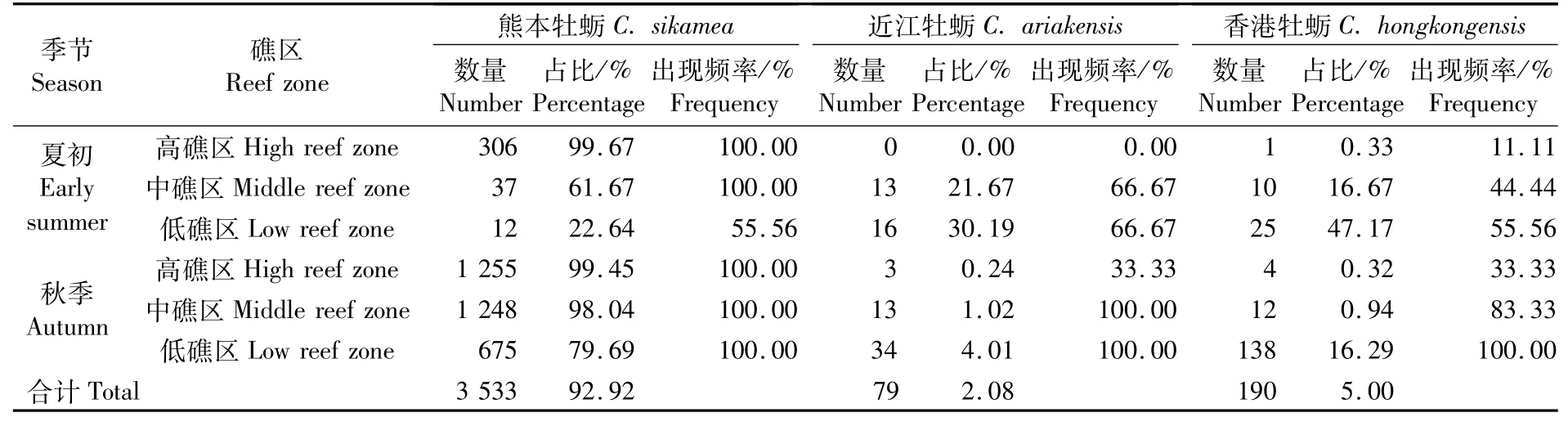
表3 蛎江滩定量调查中3种牡蛎的数量、占比和出现频率Tab.3 Number,percentage and frequency of 3 oyster species in quantitative sam pling at Lijiangtan oyster reef
蛎江滩中3种牡蛎的密度均呈现显著的季节变化(熊本牡蛎:F=90.817,P<0.001;近江牡蛎:F=13.622,P<0.001;香港牡蛎:F=26.474,P<0.001)和空间变化(熊本牡蛎:F=4.378,P=0.019;近江牡蛎:F=16.956,P<0.001;香港牡蛎:F=19.333,P<0.001)。
熊本牡蛎的密度夏初高礁区显著高于低礁区,秋季3个礁区间无显著差异;在同一礁区,秋季熊本牡蛎密度均显著高于夏初(图2-A)。近江牡蛎密度在中礁区和低礁区均为秋季显著高于夏初(图2-B)。香港牡蛎密度夏初低礁区显著高于高礁区,秋季3个礁区的高低排序为:高礁区<中礁区<低礁区;在中礁区和低礁区,香港牡蛎密度秋季显著高于夏初(图2-C)。
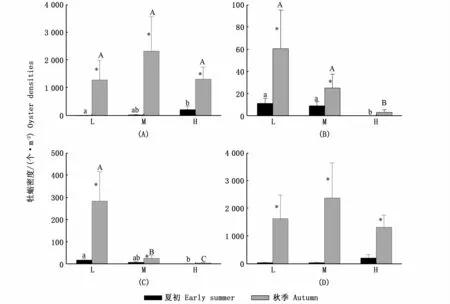
图2 夏初和秋季蛎江滩熊本牡蛎(A)、近江牡蛎(B)、香港牡蛎(C)和总体(D)密度的时空变化Fig.2 Spatial-temporal changes in densities of Crassostrea sikamea(A),C.ariakensis(B),C.hongkongensis(C)and total(D)oysters at Lijiangtan oyster reef in early summer and autumn
夏初蛎江滩牡蛎平均总密度为(97±40)个·m-2,秋季牡蛎平均总密度为(1 770±467)个·m-2。牡蛎总密度具有显著的季节变化(F=69.566,P<0.001),但空间变化不显著(F=0.508,P=0.606),礁区和季节之间没有互作效应(F=0.660,P=0.522)。在同一礁区,牡蛎总密度秋季均显著高于夏初(图2-D)。
图3显示了夏初和秋季蛎江滩牡蛎礁牡蛎(整体)壳高-频率分布。夏初牡蛎壳高范围为6~87 mm,平均为35 mm,稚贝(壳高<20 mm)比例为19.42%;秋季牡蛎壳高范围为2~77 mm,平均为21 mm,稚贝(壳高<20 mm)的比例为51.95%。
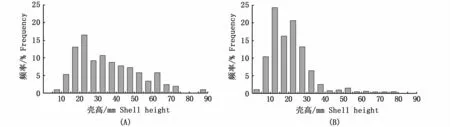
图3 夏初(A)和秋季(B)蛎江滩牡蛎的壳高-频率分布Fig.3 Distribution of shell height-frequency of oysters at Lijiangtan oyster reef in early summer and autumn
2.3 牡蛎幼体补充量
幼体补充量分析中,运用分子生物学方法共鉴定8批次644个牡蛎样品(表4)。其中,熊本牡蛎590个、占比91.61%,近江牡蛎42个、占比6.52%,福建牡蛎、香港牡蛎和猫爪牡蛎数量占比分别为0.78%、0.47%和0.62%。近江牡蛎、香港牡蛎、福建牡蛎和猫爪牡蛎更多附着于0.6 m潮区,而熊本牡蛎在1.6 m潮区附着量略高于0.6 m潮区(表4)。除了第1个监测时段0.6 m潮区的补充群体中近江牡蛎占比高于熊本牡蛎,其余各时段和潮区熊本牡蛎均占绝对优势。
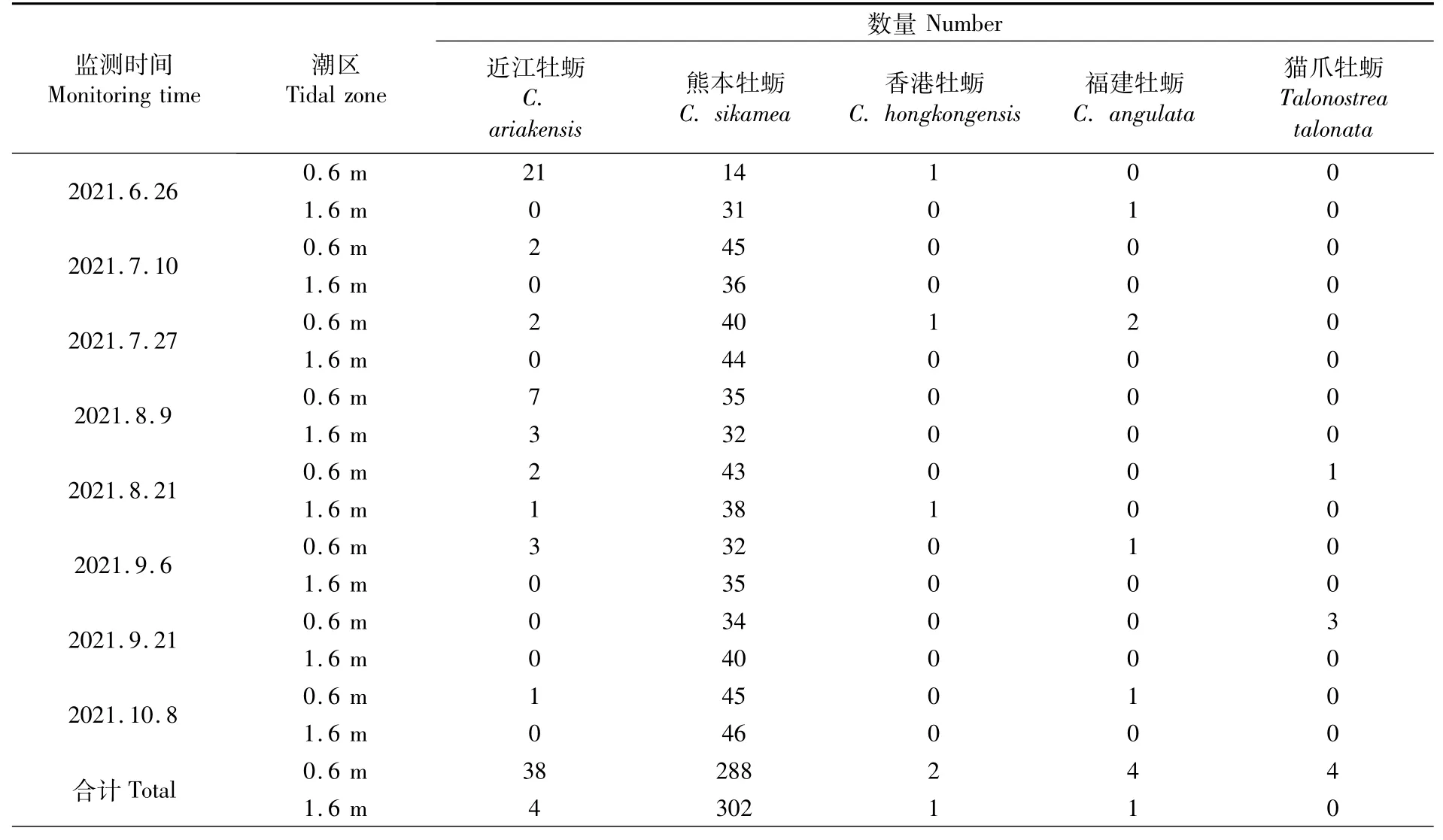
表4 蛎江滩牡蛎补充群体的种类组成Tab.4 Species com position of oyster recruitment communities at Lijiangtan oyster reef
图4显示了蛎江滩牡蛎礁牡蛎补充量的时空变化情况。0.6 m潮区牡蛎补充量峰值出现于8月9日附苗器采样和9月21日附苗器采样时段;1.6 m潮区牡蛎补充量变化趋势与0.6 m潮区基本相似,但第1个补充高峰出现时间比0.6 m潮区约早半个月。牡蛎补充量具有显著的时间变化(F=52.651,P<0.001)和空间变化(F=12.448,P<0.001),两因子之间有互作效应(F=3.254,P=0.005)。除初始2个监测时段和最后1个监测时段外,牡蛎补充量在2个潮区间均具有显著性差异(图4)。
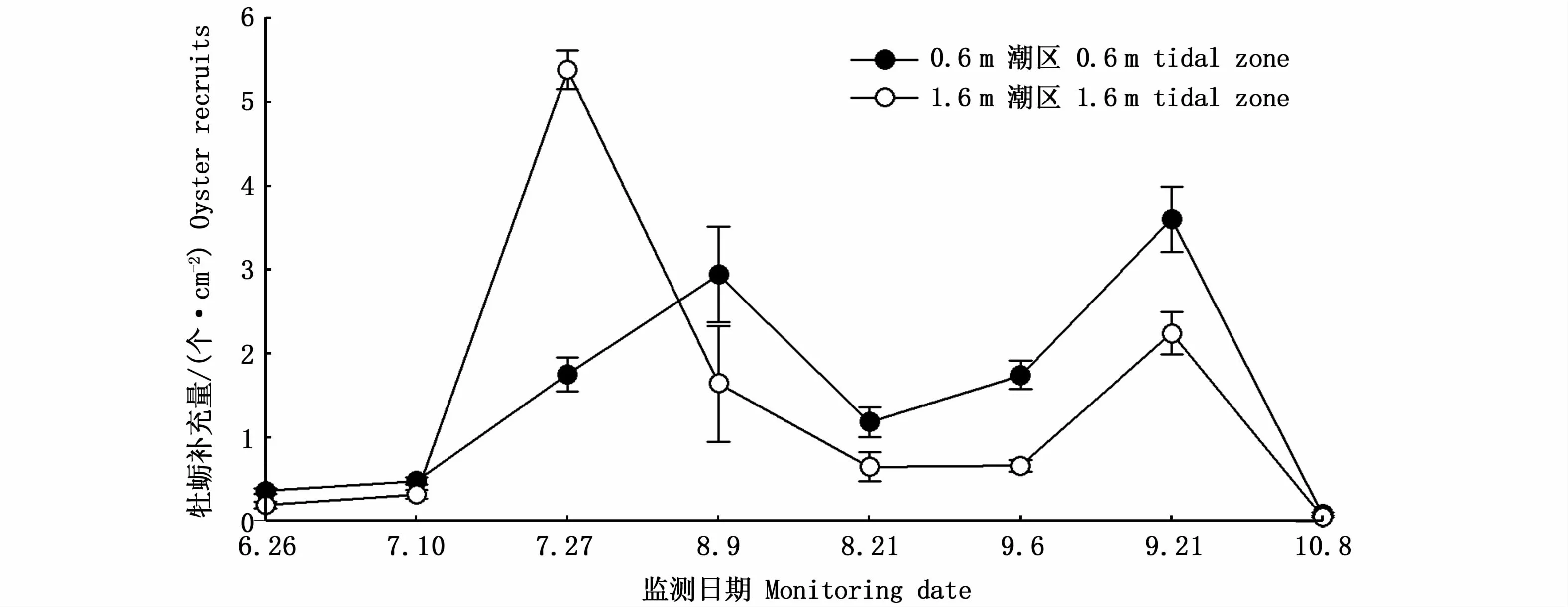
图4 蛎江滩牡蛎补充量的时空变化Fig.4 Spatial-tem poral changes in oyster recruits at Lijiangtan oyster reef
3 讨论
3.1 蛎江滩牡蛎种类及遗传多样性
中国沿海牡蛎种类繁多,由于牡蛎表型变化大,很难运用形态学方法准确鉴定牡蛎种类[15-16]。本研究采用分子生物学方法,发现2021年蛎江滩中分布有6种牡蛎,相比2020年调查时发现的4种牡蛎[12,17],又增加了猫爪牡蛎和长牡蛎。与其他邻近海域相比[4,18-20],蛎江滩具有较高的牡蛎物种多样性,应该是浙江沿海牡蛎物种分布的“热点”区域之一,具有较高的保护价值。猫爪牡蛎零星分布于我国渤海、黄海、东海和南海沿岸,是潮间带偶见种[21]。长牡蛎自然分布于我国江苏连云港以北沿海,本研究为首次报道长牡蛎自然分布于浙江沿海,同时期,作者也在江苏海门蛎岈山检测到长牡蛎群体,以上结果显示,该种有向黄海南部和东海北部扩散的趋势,其原因有待进一步研究。与江苏海门、上海芦潮港、浙江象山港牡蛎群体的16S rDNA遗传多样性对比[5],蛎江滩中熊本牡蛎的单倍型多样性指数和核苷酸多样性指数均是最低的,近江牡蛎的单倍型多样性指数也低于邻近的3个自然群体[4],表明蛎江滩熊本牡蛎和近江牡蛎遗传多样性均较低,这可能是因为该牡蛎礁位于健跳港上游湾区,狭长的海湾限制了湾内牡蛎群体与外部群体的基因交流。
3.2 蛎江滩牡蛎资源量和补充潜力
本研究显示,蛎江滩熊本牡蛎、近江牡蛎和香港牡蛎的密度均呈现显著的季节变化和空间变化,秋季牡蛎密度显著高于夏初,表明该牡蛎礁在夏季发生了显著的资源补充。但3种牡蛎补充的空间格局不同,熊本牡蛎在3个礁区中均有显著补充,而近江牡蛎和香港牡蛎仅在中、低礁区有显著补充,表明这3种牡蛎在自然分布上呈现明显的空间生态位分区(zonation)格局,这种分区格局与健跳港上游湾区基岩海岸[12]、长江口[7]、江苏海门[22]和上海芦潮港[23]的研究结果一致。例如,陈丽芝等[12]调查了相同研究地点的基岩潮间带中这3种牡蛎的自然分布,发现近江牡蛎和香港牡蛎的空间生态位一致,仅分布于最底层的潮区,且随着高程降低这2种牡蛎的密度逐步升高;熊本牡蛎最高密度出现于中潮区,且随着高程降低其密度逐步降低。WANG等[23]研究表明,熊本牡蛎比近江牡蛎具有更强的耐干露能力和更轻的软组织干重,且两种牡蛎浮游幼体的分布水层存在明显差异。本研究综合分析认为,附着潮区差异和附着后的物理条件(空气暴露、温度、失水等)与生物条件(竞争和捕食)差异可能是造成3种牡蛎的分布呈现潮间带分区格局的原因。
牡蛎密度是表征牡蛎礁生态现状的常用指标之一[24]。夏初和秋季蛎江滩牡蛎礁中牡蛎平均总密度分别为(97±40)个·m-2和(1 770±467)个·m-2,夏初牡蛎密度较低的原因可能是2020年冬季的持续过度采捕;秋季牡蛎的密度较高表明夏季发生了显著的资源补充,该牡蛎密度高于许多自然或人工修复牡蛎礁中的牡蛎密度[7,20,24-26]。
阐明牡蛎幼体附着与补充的时空格局对于制定有效的牡蛎礁修复策略至关重要[27]。与2020年监测结果相比[17],2021年蛎江滩牡蛎礁牡蛎补充期相对较短(6月初至10月初左右),繁殖期间牡蛎补充量变化趋势由2020年正态“单峰”曲线变化转变为2021年“双峰”曲线变化,表明牡蛎补充格局的年际变化较大。从2个实验潮区的监测结果来看,总体上0.6 m潮区补充量高于1.6 m潮区,即中间潮区更适宜于牡蛎幼体的附着和补充,主要原因可能是0.6 m潮区既可避免底层环境高悬沙沉积的影响,也可有效降低空气暴露对牡蛎附着、生长与存活的物理胁迫[27]。本研究表明,蛎江滩牡蛎礁分布着一个有较高物种多样性的牡蛎群落,应加强保护和管理。下一步需研究泥沙淤积和香港牡蛎入侵对蛎江滩生境和牡蛎种质资源的影响。
