Ferulaldehyde的体外抗流感作用研究
2023-09-02范韦佟李洪梅李蓉涛
周 艳,宿 露,王 云,范韦佟,李洪梅,李蓉涛,刘 丹
昆明理工大学生命科学与技术学院,昆明 650500
流感是由流感病毒引起的一种急性呼吸道传染病,具有季节性和流行性的特点[1]。流感病毒属于正粘病毒科,分为A型、B型、C型和D型四种类型。预防和治疗流感,疫苗和抗病毒药物仍是最有效的选择。就降低发病率和死亡率而言,疫苗被认为是控制流感病毒大流行最理想的方法[2]。然而,流感疫苗只有在疫苗毒株与流行性病毒株相匹配时才有效[3]。流感最常见的临床治疗药物主要是NA抑制剂,包括奥司他韦、扎那米韦和帕拉米韦,以及M2质子通道阻滞剂,包括金刚烷胺和金刚乙胺[4]。不幸的是,一些新出现的甲型流感病毒株,自然携带药物突变基因,导致对这些药物产生耐药性[5]。因此寻找新型抗流感药物刻不容缓。流感病毒感染机体后可触发各种免疫反应,引起调控细胞因子如肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1)、白细胞介素-6(IL-6)等的释放,而过度的免疫反应也会导致靶器官的炎性损伤,甚至影响脏器功能。据此,降低由流感病毒引起的炎性损伤也是治疗流感的一个主要方面[6]。
苯丙素类是天然存在的一大类化合物,包括苯丙醇、苯丙醛、苯丙酸、香豆素、木质素等,现代药理研究发现这类化合物具有减轻氧化应激损伤、抗肿瘤以及抗流感病毒的作用。有研究证明,中药制剂板蓝根的抗流感的作用也与其中的苯丙素类成分密切相关。苯丙素类小分子化合物ferulaldehyde(FDE)[7]广泛存在于甘草、神经脂草、洋甘菊等植物中,被报道具有抗氧化和抗炎的活性[8]。我们从蜘蛛香(ValerianajatamansiJones)和赤芍(Paeoniae Rubra Radix)中都分离获得了FDE结构,并首次发现了其显著的抗流感病毒的作用。蜘蛛香和赤芍作为我国传统中药,药用历史悠久,在流感治疗方面也有相关的记载,因此从中筛选有效化合物并研究其活性成分的作用机理,对其综合开发和利用具有重要的意义。因此本研究旨在探索FDE对流感病毒生命过程的影响以及对流感病毒感染引起的炎症反应的作用。
1 材料与方法
1.1 试剂与材料
小鼠单核巨噬细胞白血病细胞RAW264.7购自中国科学院典型培养物保藏委员会昆明细胞库;磷酸奥司他韦(Oseltamivir)(安耐吉化学,批号:CK030008);DMEM高糖培养基(美国纽约Gibco公司,批号:8122554);胎牛血清(FBS)(美国纽约Gibco公司,批号:2176404);胰蛋白酶(中国Solarbio公司,批号:510T0419);MTT(中国Solarbio公司,批号:530R0515);DAPI染料(中国Beyotime公司,批号:073120201023);神经氨酸酶测定试剂盒(中国Beyotime公司,批号:071420211012);CellTiter-Glo®发光法细胞活力检测试剂盒(美国Promega公司,批号:0000424721);放射免疫沉淀测定(RI-PA)裂解液(中国Beyotime公司,批号:22308515);小鼠抗核蛋白(NP)单克隆抗体(英国Abcam公司,批号:GR3397701-3);山羊抗小鼠IgG结合FITC荧光二抗(中杉金桥生物技术公司,批号:133449);化合物FDE由本课题组通过各种色谱方法从蜘蛛香和赤芍中分离得到,并通过NMR和MS等波谱方法进行结构鉴定[9,10]。
1.2 仪器
多功能读板仪Spectra Max M2(美国Molecular Devices);光学倒置显微镜CKX41(德国O-lympus);CO2细胞培养箱3111(美国Thermofisher);高速冷冻离心机1-14K(德国Sigma);尼康激光共聚焦显微镜A1R/A1(日本Nikon)。
1.3 细胞毒性实验
使用MTT法测FDE的细胞毒性。将FDE倍比稀释成5个浓度(6.25、12.5、25、50和100 μmol/L),分别加入到已长成单层细胞的96孔培养板中,设正常细胞对照组,每组设置3个复孔,于37 ℃、5% CO2培养箱中培养48 h,采用MTT法测定细胞活度[11],使用Spetra Max M2检测波长为490 nm的吸光度。
1.4 体外抗流感病毒活性筛选
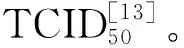
1.5 噬斑实验
MDCK细胞以3×105个/孔的数量接种于12孔板中,培养24 h,直至长成单层细胞。用WSN(250 TCID50)感染2 h,用预冷的PBS清洗两遍,洗去未与细胞结合的病毒,加入含有不同浓度药物的无血清培养基,待其完全凝固后,倒置放入37 ℃,5% CO2培养箱。培养72 h后,4%多聚甲醛固定30 min,去除琼脂糖覆盖层,用0.1%结晶紫染色。
1.6 加药时间点实验
MDCK细胞以3 × 105个/孔接种于12孔板中,培养24 h。用WSN(250 TCID50)感染细胞,分别在0~2、0~5、0~8和0~10 h(采用预防给药的方式,WSN和FDE共同作用前2 h,然后洗去WSN,加入FDE,0~2 h为WSN和药物共同作用的2 h,下同)进行FDE(60 μmol/L)处理。收集裂解细胞,分析NP含量变化[14],到达给药时间后,将细胞用80 μL裂解液(含1%的PI和PMSF)裂解40 min,收集裂解液,加入20 μL的5× loading buffer变性10~15 min后,用10% SDS-PAGE进行凝胶电泳,后将蛋白质从凝胶转移至PVDF膜上,脱脂牛奶封闭,一抗、二抗孵育后通过化学发光显影并拍摄分析。
1.7 免疫荧光实验
MDCK细胞以1×105个/孔的数量接种于共聚焦皿中,培养24 h。WSN(250 TCID50)感染细胞,分别在0~2、0~5、0~8和0~10 h进行FDE(60 μmol/L)处理。处理后细胞经4 %多聚甲醛溶液固定10 min,0.1% Triton X-100打孔10 min后,一抗孵育过夜,二抗孵育1 h,DAPI染核10min后用共聚焦显微镜进行拍摄。
1.8 血凝素活性抑制试验
根据病毒血凝滴度稀释病毒。将一系列浓度(6.25、12.5、25、50和100 μmol/L)的化合物与稀释后的病毒涡旋混匀后加入到V型96孔板中,之后加入等体积1%的红细胞悬液,室温静置30 min,观察并记录V型96孔板中红细胞的凝集效果。
1.9 神经氨酸酶抑制剂筛选实验
通过神经氨酸酶抑制剂筛选试剂盒检测化合物对NA活性的抑制作用。将70 μL NA缓冲液和10 μL NA溶液混合均匀,然后分别加入10 μL梯度稀释的待测化合物,混合均匀后。加入10 μL显色底物,混合均匀后室温震荡1 min,37℃恒温培养箱中孵育30 min,使用多功能酶标仪检测激发波长322 nm和发射波长450 nm的荧光信号。根据荧光值计算化合物对NA活性的抑制作用。
1.10 ELISA检测流感病毒感染巨噬细胞中IP-10表达量
巨噬细胞细胞以5 × 105个/孔的数量接种于12孔板中,将15、30、60 μmol/L三个浓度的FDE与100 TCID50的WSN共同作用细胞24 h,收集细胞上清,使用ELISA试剂盒检测上清溶液中IP-10趋化因子的含量。
2 结果
2.1 FDE对流感病毒感染的MDCK细胞具有明显的保护作用
研究发现,FDE(见图1)在6.25~100 μmol/L浓度范围对WSN感染的MDCK细胞具有明显的保护作用(见图2A、2C),WSN感染MDCK细胞48 h,只加病毒的WSN组与未加病毒和FDE的对照组(control 1,Con 1)相比,细胞发生明显病变,当用6.25~100 μmol/L的FDE与WSN共同作用时,细胞病变率显著降低,其EC50为19.83±2.03 μmol/L,阳性药奥司他韦(oseltamivir,OST)EC50为6.85±0.12 μmol/L,MTT法证实该化合物在该浓度范围内对MDCK细胞活度几乎没有影响(见图2B),CC50大于100 μmo/L。同时,噬斑实验结果也证实了FDE的这一作用(见图2D),WSN感染48 h后细胞大面积脱落形成较多空斑,未加WSN和FDE的对照组只有边缘有部分细胞脱落,FDE治疗组中空斑的数量随药物浓度的增加而减少。

图1 Ferulaldehyde的化学结构Fig.1 The chemical structure of ferulaldehyde

图2 FDE的抗流感病毒活性和对MDCK的细胞毒性Fig.2 The anti-influenza virus activity and cytotoxicity of MDCK cells of FDE注:A:与Con 1组比较,# # # P < 0.001;与WSN组比较,* * * P < 0.001;C:40×:于40倍光学倒置显微镜下拍摄。Note:A:Compared with the Con 1 group,# # # P < 0.001;Compared with the WSN group,* * * P < 0.001;C:40×:Photographed under a 40× optical inverted microscope.
2.2 FDE对流感病毒生命周期的影响
为了确定FDE作用于病毒感染受体细胞生命周期的哪一个阶段,我们设计了加药时间点实验,分别在WSN感染的0~2、0~5、0~8、0~10 h时间段(见图3A)进行FDE(60 μmol/L)处理,药物作用时间分别覆盖了病毒吸附、入核、复制和子代病毒释放过程。免疫印记实验结果(见图3B)显示,在该化合物作用的各时间段内,MDCK细胞内病毒NP蛋白的量与对照组(DMSO组:加入与FDE组等量WSN且加入了和FDE组所加药物溶剂等量DMSO的对照组,DMSO)相比都具有不同程度的减少,在0~8 h内,FDE组与DMSO组和OST组相比NP蛋白的含量降低最为显著。用250 TCID50的WSN感染MDCK细胞,在同样给药时间处理条件下,通过免疫荧光法显示细胞内NP蛋白的定位从而追踪病毒的活动(见图3C),发现给药2 h后,DMSO组和FDE组的病毒均可以吸附到宿主细胞上,FDE组病毒量略少于DMSO组。给药5 h和8 h后,病毒进入细胞核进行复制,此时FDE组细胞核内的病毒量明显少于DMSO组。而给药8 h后,DMSO组中病毒依然大量复制并开始从细胞核输出释放到细胞质中,此时FDE组中感染病毒的细胞数量和细胞中的病毒量明显要少,这也与免疫印迹结果相互印证,因此猜测该化合物可能抑制了流感病毒的复制。给药10 h后,病毒大量从胞质释放到细胞外,从免疫印迹的结果只能看出FDE组的病毒量显著少于DMSO组,具体FDE对WSN的出胞是否有影响还需进一步研究。综上可知,FDE对WSN的进入过程略有影响,但主要还是抑制了其复制过程。
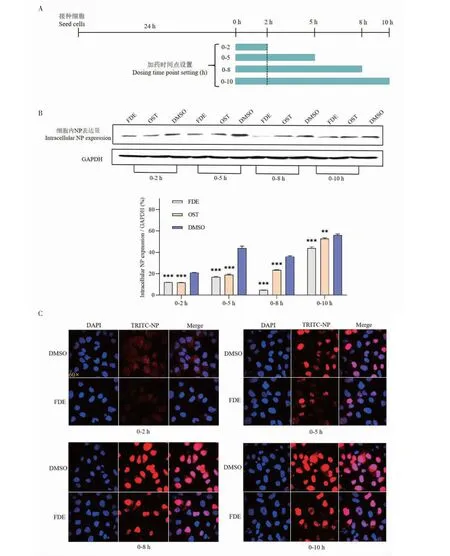
图3 FDE对流感病毒复制周期的影响Fig.3 Effects of FDE on replication cycle of influenza virus in cells注:B:与DMSO组比较,* * P < 0.01,* * * P < 0.001;C:60×:于60倍激光共聚焦显微镜下拍摄。Note:B:Compared with the DMSO group,* * P < 0.01,* * * P < 0.001;C:60×:Photographed under a 60× laser confocal microscope.
2.3 FDE对流感病毒HA和NA的影响
血凝素HA是流感病毒上的一种包膜蛋白,在病毒入侵细胞中起关键作用。成熟的HA由两个亚基HA1和HA2组成。HA1主要介导病毒与细胞表面唾液酸受体的结合,HA2主要介导膜融合和vRNP脱壳过程。血凝素活性抑制实验常用于确认药物的作用靶点是否为HA1[15]。血凝素活性抑制试验结果如图所示(见图4A),未加入WSN的对照组(control 2,Con 2),红细胞沉降于孔底呈点状,当加入以1:128倍稀释的WSN后,红细胞发生凝集在孔底平铺呈网状,而当有FDE和WSN共同作用时,100 μmol/L FDE处理能在一定程度上抑制红细胞的凝集,25、50 μmol/L FDE有微弱的作用但并不显著。结果表明,该化合物在高浓度时(100 μmol/L)可能会对流感病毒与宿主细胞的结合有一定的抑制作用,可能是通过与流感病毒的表面抗原HA1结合,抑制WSN的早期吸附过程,但浓度低于50 μmol/L其影响作用有限。

图4 FDE对流感病毒HA和NA的影响Fig.4 Effect of FDE on influenza virus HA and NA
甲型流感病毒的子代病毒颗粒从细胞表面出芽后,病毒表面的神经氨酸酶能使病毒本身从细胞表面脱落,能切割细胞表面与糖结合的N-乙酰神经氨酸,释放子代病毒,完成感染周期[16]。神经氨酸酶抑制实验结果显示(见图4B),化合物FDE具有一定的抑制神经氨酸酶作用,且抑制效果呈现剂量依赖关系。
2.4 FDE能与NP和NA功能域结合
为了进一步探索FDE与流感病毒的相互作用,我们用AutoDock进行分子对接,模拟FDE与NP和NA蛋白质氨基酸残基之间的相互作用。FDE与NP蛋白分子对接结果显示(见图5A),FDE能以氢键与NP蛋白342位精氨酸(Arg342)、417位天冬酰胺(Asn417)结合,以Π-烷基作用(疏水作用力的一种)与419位赖氨酸(Pro419)结合,这3个位点刚好处于核定位信号(Nuclear localization signal,NLS3)320~400残基和NP-NP结合区371~465残基的区域之中[17]。另外有研究报道,Ile408、Pro410、Phe412、Val414和Pro419的疏水侧链位于核蛋白尾环中,该处的环结合腔可能是小分子药物的理想靶点,并且尾环的结构特征预计会干扰核蛋白的寡聚[18]。因此,说明FDE可能通过与NP蛋白的结合干扰NP蛋白的功能从而抑制病毒的复制。
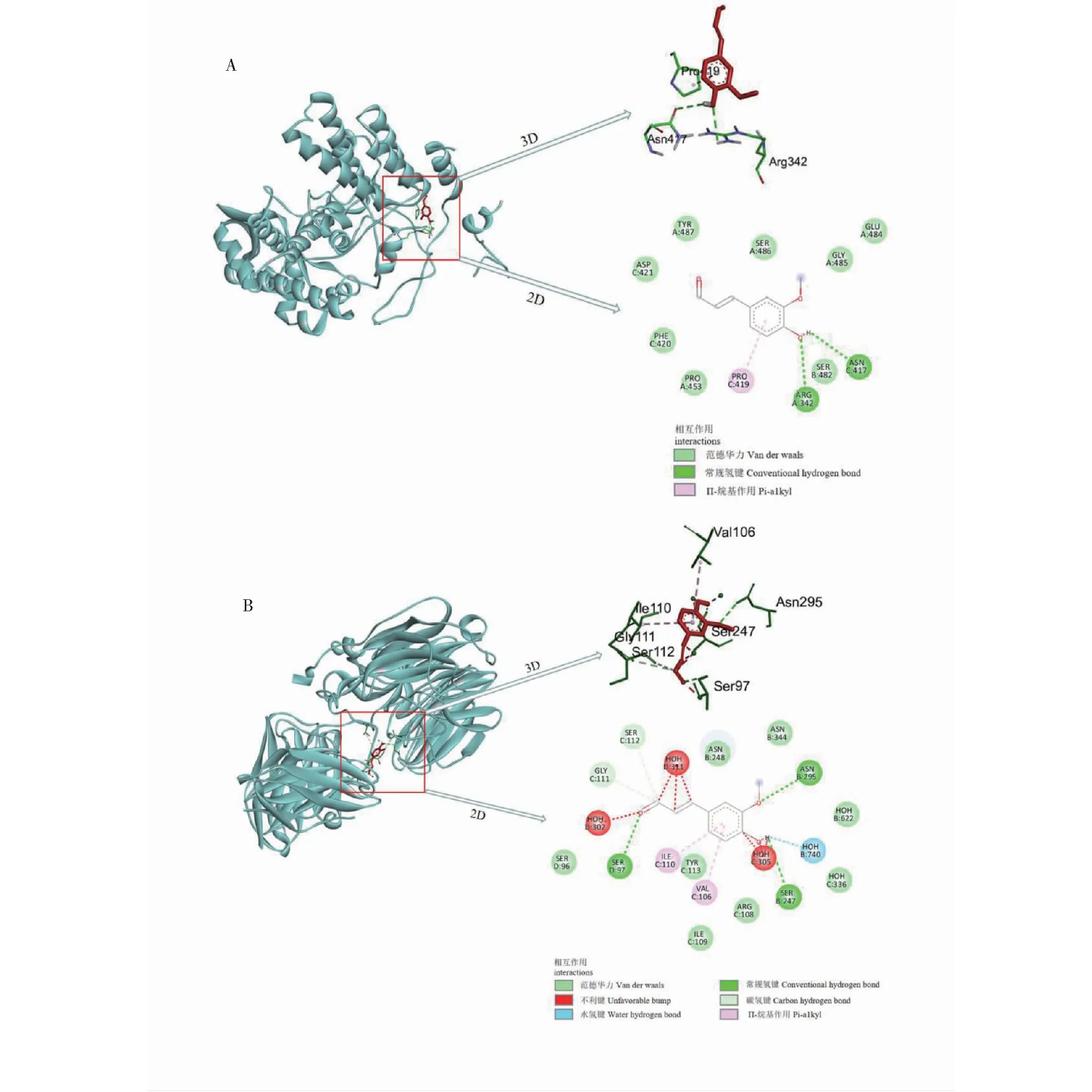
图5 FDE与NP(A)和NA(B)的分子对接结果Fig.5 Molecular docking results of FDE with NP(A) and NA(B)
FDE与NA蛋白分子对接结果显示(见图5B),FDE能以氢键与NA蛋白97位丝氨酸(Ser97)、247位丝氨酸(Ser247)、295位天冬酰胺(Asn295)结合,以Π-烷基作用(疏水作用力的一种)与106位缬氨酸(Val106)、110位异亮氨酸(Ile110)结合,以碳氢键与111位甘氨酸(Gly111)、112位丝氨酸(Ser112)结合。已有研究报道NA蛋白的247位的丝氨酸突变可能具有很高的抵抗流感病毒的作用[19]。因此,说明FDE很可能通过与NA蛋白的结合干扰流感病毒的出胞。
2.5 FDE能降低流感病毒感染的巨噬细胞的炎症相关蛋白和趋化因子的表达
FDE曾被发现在LPS诱导的巨噬细胞炎症模型中抑制NO的产生[20]。巨噬细胞在流感病毒感染后也会被激活并激发免疫反应,抵抗流感病毒的同时也可能造成机体的损伤。诱导型一氧化氮合酶(iNOS)和环氧合酶(COX-2)在炎症发生中是影响NO和PGE2生成的关键酶,我们检测发现FDE处理影响WSN感染的巨噬细胞中iNOS、COX-2(见图6A)的表达,如图所示,与Con 1(与结果2.1中对照设置方法一样,也为未加WSN和FDE)相比,WSN感染后巨噬细胞中iNOS、COX-2表达显著增加,而FDE处理剂量依赖性明显抑制细胞中的iNOS和COX-2的表达。同时,我们还发现,FDE还影响趋化因子IP-10的分泌(见图6B)。WSN感染引起的巨噬细胞中IP-10表达量的增加可以被FDE有效的抑制,提示FDE还可能影响进一步的炎性细胞的招募聚集。
图6 FDE治疗对流感病毒感染的巨噬细胞的iNOS、COX-2蛋白和趋化因子IP-10的影响Fig.6 Effect of FDE treatment on iNOS,COX-2 protein and chemokine IP-10 in influenza virus-infected macrophages注:与Con 1组比较,# # # P < 0.001;与WSN组比较,* * * P < 0.001。Note:Compared with the Con 1 group,# # # P <0.001;Compared with the WSN group,* * * P <0.001.
3 讨论与结论
我们从蜘蛛香和赤芍两种药材中都分离获得了苯丙素类化合物FDE,含量分别为0.02%和0.012%,尽管苯丙素类成分并不是蜘蛛香和赤芍的主成分,但其在这两种中药的抗流感应用中很可能发挥了重要的作用,本研究就发现FDE具有显著的抗流感病毒的作用。高浓度的FDE能够影响红细胞的凝集,提示其可能干扰流感病毒与受体细胞的结合,但其在低浓度时作用并不显著。进入宿主细胞的流感病毒借助宿主细胞的多种元件进行转录和复制,病毒vRNP是流感病毒最基本的复制单位,是由病毒RNA和碱性聚合酶1(PB1)、碱性聚合酶2(PB2)、酸性聚合酶(PA)及核蛋白(NP)组成的复合体。vRNP通过运输进入细胞核,并通过引物依赖的方式进行转录合成病毒mRNA,mRNA出核翻译合成病毒蛋白[4]。通过加药时间点实验我们发现FDE可以降低病毒NP蛋白的生成,很可能干预了病毒的复制过程,分子对接结果显示FDE确实可以与NP蛋白的活性位点结合,NP有可能是FDE的有效靶点,另外,我们通过神经氨酸酶活抑制实验发现了FDE对NA活性的影响,分子对接实验也支持这一结果,提示FDE很可能还抑制了流感病毒的出胞过程。此外,流感病毒本身并不是导致重症及致死的关键,病毒导致的肺组织损伤或更加严重的急性呼吸窘迫综合征是流感病毒尤其是高致病性流感病毒的高致病力和致死的主要原因[6]。我们检测发现FDE可减弱流感病毒感染的巨噬细胞中iNOS、COX-2的表达,还抑制了病毒引起的巨噬细胞中IP-10的表达量,提示FDE还可能影响进一步的炎性细胞的招募聚集,降低炎性反应。以上结果说明FDE发挥抗流感病毒活性可能不止一个作用靶点,小分子化合物存在多个作用靶点有可能使其更高效和更不易产生耐药现象,但也往往使其在体内的作用也更为复杂甚至可能有更多的毒副作用。
综上所述,本研究发现蜘蛛香和赤芍中的苯丙素FDE在体外具有抗流感病毒活性。通过探索FDE对流感病毒的生命周期的影响,发现其抗流感机制主要是干扰了流感病毒的复制和释放过程,流感病毒NP和NA蛋白很可能是它作用的靶点。同时,该化合物还能抑制由流感病毒引起的炎症相关蛋白和趋化因子的表达,从而缓解病毒感染引起的机体的免疫损伤。
