葡萄穗霉属真菌Stachybotrys sp.CPCC 401591中phenylspirodrimane类化合物抗肿瘤活性研究
2023-09-02荣小婷何文妮李鑫鑫余利岩
荣小婷,何文妮,郭 哲,李鑫鑫,王 璐,高 坤,余利岩*,张 涛*
1 中国医学科学院 &北京协和医学院医药生物技术研究所,北京 100050;2 江苏科技大学生物技术学院,镇江 212100
葡萄穗霉属真菌(Stachybotrys)隶属于葡萄穗霉科(Stachybotryaceae),多营腐生或弱寄生生活,广泛存在于土壤、植物和潮湿的室内环境[1]。该属真菌产生的次级代谢产物结构类型丰富,包括单端孢霉烯类(trichothecenes)、二萜类、phenylspirodrimanes(PSM)类、聚酮类、氧杂蒽酮类、环肽类和细胞松弛素类(alachalasins)等[2,3]。这些化合物在抗肿瘤、抗菌、抗疟疾、抗病毒、抑制胆固醇酯酶和抗炎等方面具有显著的生物学活性[3-6]。近年来,葡萄穗霉属来源的结构新颖的活性化合物分子仍然不断被分离报道。Li等[7]从海绵中分离的纸葡萄穗霉(S.chartarum)WGC-25C-6中分离鉴定到单端孢霉烯类化合物。其中,mytoxinA和satratoxin G等化合物对HCT-11 6,HepG2,BGC-823等细胞株具有显著的抗肿瘤活性,其IC50< 0.01 μmol/L。Yang等[8]从海洋来源的纸葡萄穗霉菌J403-SS6中鉴定6个二萜化合物,atranone Q对致病菌包括白色念珠菌和粪肠球菌具有显著的抑制作用,MIC值分别为8和16 μg/mL。
PSM类化合物家族庞大,自1980年Miyazaki等[9]在葡萄穗霉菌S.complementi中分离得到补体抑制剂K-76,已有近120余个PSM类化合物分子被分离鉴定。Ma等[4]从S.chartarumMXH-X73中分离获得11个PSM类单体化合物,研究表明stachybotrin D能够抑制野生型HIV-1和非核苷类逆转录酶抑制剂(NNRTIs)耐受型HIV(如HIV-1RT-K103N等),EC50值为6.2~23.8 μmol/L。Liu等[10]从S.chartarumCGMCC 3.5365中分离获得11个PSM类二聚体分子(bistachybotrysins L~V),其中,化合物bistachybotrysin L对HepG2,HCT-116和NCI-H460等细胞株具有显著的抑瘤活性,IC50为1.8~3.5 μmol/L。
本研究选取内生真菌Stachybotryssp.CPCC 401591进行深入研究。结合OSMAC技术、LC-MS/MS质谱分子网络分析和PSM类化合物紫外吸收特征对菌株CPCC 401591的大米固体发酵产物的乙酸乙酯相分离纯化。同时,结合人肝癌细胞株HepG2等肿瘤细胞筛选模型,以期从该菌株中挖掘分离抗肿瘤活性分子。研究表明,葡萄穗霉真菌CPCC 401591能够产生PSM类化合物,是一株值得深入研究的资源菌。
1 材料与方法
1.1 实验材料
1.1.1 仪器与试剂
安捷伦1290高效液相色谱分析仪器(美国Agilent公司);600M NMR Spectrometer(TMS为内标,德国Bruker公司);Thermo Scientific LTQ XL ESI质谱仪(美国Thermo公司);SepaFlashTM硅胶快速分离柱购自常州三泰科技有限公司;C18spherical反相分离柱购自美国Agela公司。甲醇、二氯甲烷、乙酸乙酯等均为分析纯(北京通广精细化工公司);色谱纯乙腈和甲醇购自德国Merck公司;三氟乙酸、氘代甲醇等购自北京百灵科技有限公司。
1.1.2 菌株来源
菌株Stachybotryssp.CPCC 401591为葡萄穗霉属真菌,现保存于中国药学微生物菌种保藏管理中心。人肝癌细胞株HepG2、人宫颈癌细胞株HeLa以及人结肠癌细胞株HCT116均购自中国医学科学院基础医学研究所细胞资源中心,现保存于中国药学微生物菌种保藏管理中心。
1.1.3 试剂与配制
麦芽提取物肉汤琼脂培养基(MEPA):麦芽提取物肉汤15 g,1.5 g黄豆粉,20 g琼脂粉,1 L蒸馏水,MEB培养基购自美国BD公司。F2培养基:葡萄糖 2 g,甘油1 mL,黄豆粉0.2 g,蔗糖1 g,蛋白胨1 g,聚乙二醇0.25 g,K2HPO40.03 g,NaNO30.3 g,(NH4)2SO40.2 g,100 mL蒸馏水。BY培养基:马铃薯葡萄糖水培养基3 g,甘露醇1 g,麦芽糖1 g,酵母提取物1 g,K2HPO40.3 g,MgSO4.7H2O 0.03 g,海盐1 g,100 mL蒸馏水。PDB:马铃薯葡萄糖水培养基(BD公司)3 g,100 mL蒸馏水。大米发酵培养基(RICE):大米100 g,去离子水100 mL,121 ℃灭菌25 min。
1.2 实验方法
1.2.1 菌株的发酵
将菌株CPCC 401591从甘油管中接种于MEPA平板培养基,于28 ℃恒温培养7 d,用无菌接种环挑取适量菌体接种于种子培养基(200 mL PDB培养基/500 mL三角瓶)中,28 ℃震荡培养96 h得到种子液(180 r/min)。将种子液5 mL接种至灭菌后的大米发酵培养基中,28 ℃静置培养30 d,共发酵100瓶。
1.2.2 色谱及质谱条件
Agilent- ZORBAX SB C18色谱柱(4.6 nm × 250 mm,5 μm);体积流量1 mL/min;PDA全波长扫描;柱温30 ℃;进样量10 μL。以为流动相乙腈(A)和1.5%甲酸水溶液(B),梯度洗脱:0~20 min,10%→100% A;20.01~25.00 min,100%A;25.01~30.00 min,10% A。
采用电喷雾离子化源(ESI),正离子扫描模式,MS条件:离子喷雾电压:4 500 V;离子源温度:550 ℃;碰撞能量:45 eV;扩散碰撞能量:15 eV;去簇电压:100 V;雾化器压力:379 kPa;辅助气压力:379 kPa;气帘气压力:241 kPa;扫描范围m/z150~2 000。
1.2.3 菌株CPCC 401591天然产物分子网络的建立
按照色谱及质谱条件进样,质谱仪采集样品的二级质谱,获得正离子模式下葡萄穗霉菌Stachybotryssp.CPCC 401591乙酸乙酯粗提物的Q-TOF-MS/MS二级质谱文件。将原始数据通过ProteoWizard软件转化为mzXML格式并上传至GNPS平台(https://gnps.ucsd.edu),进行分子网络聚类分析,结合开放数据库对生成的分子网络中的化合物进行推测与分析。
1.2.4 化合物的提取和分离
发酵产物用等体积乙酸乙酯萃取3次,减压浓缩得到浸膏(80 g)。将80 g浸膏以1∶1的比例用200-300目硅胶填充至样品柱,以二氯甲烷-甲醇体系进行梯度洗脱(洗脱条件100∶0→95∶5→90∶10→85∶15→80∶20→75∶25→70∶30→65∶35→60∶40→55∶45→50∶50→45∶55→40∶60→0∶100),流速为50 mL/min。每个梯度250 mL收集1瓶,对所有收集的流分经TLC薄层色谱分析后合并,共收集10个流分(A1~A10)。根据HPLC-DAD指纹图谱和PSM类化合物紫外吸收特征,选取流分A13,A12和A14进行分离纯化。流分A13(0.62 g)经半制备高效液相色谱(pHPLC),流动相为乙腈-水(45∶55+0.01% TFA;3 mL/min),分离得到化合物1(8.3 mg,tR= 6.2 min),化合物2(21.5 mg,tR= 6.7 min)和化合物3(9.1 mg,tR7.7 = min)。流分A12(0.5 g)继续采用pHPLC制备,流动相为乙腈-水(40∶60+0.01% TFA;3 mL/min),纯化得到化合物4(2.4 mg,tR21.3 = min),化合物5(21.0 mg,tR31.7 = min)。流分A14(1.0 g)利用中压快速液相色谱,流动相为乙腈-水梯度洗脱(0~15 min,15∶85;15∶85→40∶60,40 min;40∶60→90∶10,30 min;90∶10→100∶0,10 min;100∶0,15 min;流速为20 mL/min),共收集洗脱液16瓶(B1~ B16)。 流分B6 采用半制备型HPLC制备,流动相乙腈-水(37∶63+0.01% TFA;3 mL/min),分离得到化合物6(4.2 mg,tR= 11.8 min);化合物7(3.6 mg,tR= 14.6 min)。流分B9继续采用半制备型HPLC制备,流动相为乙腈-水(45∶55+0.01% TFA;3 mL/min),纯化得到化合物8(11.2 mg,tR= 14.6 min)。
1.2.5 CCK-8检测化合物的细胞毒活性
将储存于-80 ℃的细胞复苏,体外培养于含10%胎牛血清的DMEM培养基,5% CO2、37 ℃、饱和湿度条件下培养。HepG2,HCT116和HeLa细胞以5×104个/mL接种于96孔细胞培养板,每孔体积100 μL,同时96孔细胞培养板的边缘孔以无菌PBS缓冲液填充,尽量避免边缘效应。待24 h后加药(待测样品通过DMSO溶解稀释分别为5个浓度梯度)。不同梯度的待测样品加入96孔板,各个浓度均做3个复孔,并设置等量DMSO的对照组和无细胞仅含培养基的空白组,顺铂处理组为阳性对照组。将培养板板置于5% CO2、37 ℃培养箱培养48 h,每孔加入20 μL CCK-8溶液,于细胞培养箱37 ℃继续孵育2 h。经酶联免疫检测OD450测量各孔的吸光值,按下式计算抑制率。
细胞抑制率=
(OD对照组-OD实验组)/(OD对照组-OD空白组)× 100%
对照组:具有细胞、CCK-8溶液但不加药物;实验组:具有细胞、CCK-8溶液和药物溶液;空白组:含CCK-8溶液,不含细胞和药物。
2 实验结果
2.1 OSMAC策略优化菌株Stachybotrys sp.CPCC 401591发酵培养基
OSMAC策略广泛应用于微生物次级代谢产物挖掘和发现,也是应用最为广泛且成熟的方法[11,12]。葡萄穗霉菌Stachybotryssp.CPCC 401591在4种不同发酵培养基中次级代谢产物化学多样性分析结果如图1所示。HPLC分析280 nm检测条件下,三种液体发酵培养基(PDB、BY和F2)化合物出峰时间多集中于5~13 min,大米发酵培养基主要集中在10~18 min。同时,菌株CPCC 401591大米固体发酵物代谢谱更为丰富,且代谢物产量更大(图1A、1B)。进一步分析大米发酵提取物中一类化合物的紫外吸收特征(230、285、330 nm)(见图1A)。为此,选取大米发酵培养基作为菌株CPCC 401591大规模发酵的培养基开展后续化合物分离纯化工作。

图1 Stachybotrys sp.CPCC 401591在四种不同发酵培养基中的代谢谱分析Fig.1 Metabolic spectrum analysis of Stachybotrys sp.CPCC 401591 on four different fermentation media注:A1:280 nm波长下检测的色谱图差异;B:ELSD检测差异;A2:A1图中红框内化合物紫外吸收图谱。Note:A1:The differences of detection by measuring UV absorbance spectra at 280 nm;B:The differences of detection by measuring ELSD;A2:UV absorption spectra of the compounds shown in red box of Fig.A1.
2.2 菌株Stachybotrys sp.CPCC 401591大米发酵提取物的GNPS分析
为分析菌株CPCC 401591的次级代谢产物并挖掘其潜在的新成分,采用高效液相色谱-串联质谱(LC-MS/MS)结合分子网络GNPS策略,对粗提物的成分进行快速表征。基于MS/MS光谱的相似性,菌株大米发酵粗提物的可视化分子网络聚簇被建立。其中,1个明显的分子笼中,在正离子模式下,该簇内共包含了13个节点。其相对分子质量范围在m/z209.108~540.520 之间,结构涉及PSM类化合物分子(见图2)。特别地,通过文献报道和数据库分析,节点m/z386.962和430.857分别被鉴定为chartarlactam F和stachybotrin或其同分异构体[13]。同时,PSM类分子笼中还有一些分子量(520.56和524.68等)未见报道[3],提示我们这些化合物可能是新的PSM类化合物。
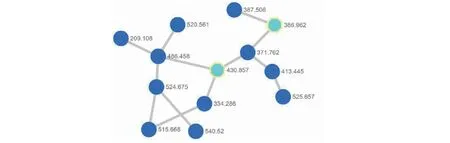
图2 PSM类化合物分子网络聚簇分析Fig.2 GNPS-based cluster of the PSM derivatives
2.3 结构鉴定
化合物1橘色粉末;ESI-MS:m/z430.4[M+H]+,分子式为C25H35NO5;1H NMR(600 MHz,CD3OD)δ:6.40(1H,s,H-3′),4.47(2H,s,H-7′),3.79(2H,t,J= 5.6 Hz,H-2′′),3.66(2H,t,J= 5.6 Hz,H-1′′),3.28(1H,m,H-3),3.18(1H,d,J= 16.2 Hz,H-11b),2.76(1H,d,J= 16.2 Hz,H-11a),2.23(1H,dd,J= 12.4,2.7 Hz,H-5),2.02(1H,m,H-2b),1.85(1H,m,H-8),1.76(1H,m,H-1b),1.68(1H,m,H-7b),1.65(1H,m,H-6b),1.61(1H,m,H-6a),1.58(1H,m,H-7a),1.55(1H,m,H-2a),1.14(1H,m,H-1a),1.09(3H,s,H-15),1.04(3H,s,H-14),0.95(3H,s,H-13),0.72(3H,d,J= 6.6 Hz,H-12);13C NMR(150 MHz,CD3OD)δ:25.3(C-1),26.3(C-2),77.3(C-3),38.8(C-4),41.2(C-5),22.3(C-6),32.0(C-7),38.8(C-8),100.8(C-9),43.3(C-10),32.2(C-11),15.9(C-12),23.5(C-13),28.7(C-14),16.6(C-15),114.4(C-1′),158.6(C-2′),102.6(C-3′),146.2(C-4′),107.1(C-5′),159.9(C-6′),52.8(C-7′),170.3(C-8′),45.9(C-1′′),61.4(C-2′′)。以上数据与文献[14]中报道一致,因此鉴定化合物1为chartarlactam H。
化合物2黄色粉末;ESI-MS:m/z386.4 [M+H]+,分子式为C23H31NO4;1H NMR(600 MHz,CD3OD)δ:6.35(1H,s,H-3′),4.27(2H,s,H-7′),3.25(1H,m,H-3),3.18(1H,d,J= 16.2 Hz,H-11b),2.76(1H,d,J= 16.2 Hz,H-11a),2.20(1H,dd,J= 3.0,12.4 Hz,H-5),1.96(1H,m,H-2b),1.83(1H,m,H-8),1.81(1H,m,H-1b),1.68(1H,m,H-7b),1.65(1H,m,H-6b),1.60(1H,m,H-7a),1.59(1H,m,H-6a),1.55(1H,m,H-2a),1.13(1H,m,H-1a),1.05(3H,s,H-15),1.00(3H,s,H-14),0.90(3H,s,H-13),0.68(3H,d,J= 6.6 Hz,H-12);13C NMR(150 MHz,CD3OD)δ:25.3(C-1),26.2(C-2),77.2(C-3),38.9(C-4),41.2(C-5),22.2(C-6),32.0(C-7),38.8(C-8),100.8(C-9),43.3(C-10),32.2(C-11),15.9(C-12),23.5(C-13),28.7(C-14),16.7(C-15),114.4(C-1′),159.0(C-2′),102.8(C-3′),148.6(C-4′),106.7(C-5′),160.3(C-6′),46.9(C-7′),173.2(C-8′)。以上数据与文献中[14]报道一致,因此鉴定化合物2为chartarlactam F。
化合物3黄色粉末;ESI-MS:m/z430.5 [M+H]+,分子式为C25H35NO5;1H NMR(600 MHz,CD3OD)δ:6.67(1H,s,H-3′),4.57(1H,d,J= 17.1 Hz,H-8b′),4.42(1H,d,J= 17.1 Hz,H-8a′),3.79(2H,t,J= 5.7 Hz,H-2′′),3.69(2H,t,J= 5.7 Hz,H-1′′),3.33(1H,m,H-3),3.23(1H,d,J= 16.2 Hz,H-11b),2.84(1H,d,J= 16.2 Hz,H-11a),2.14(1H,m,H-5),2.03(1H,m,H-2b),1.85(1H,m,H-1b),1.84(1H,m,H-8),1.58(2H,m,H-7),1.56(2H,m,H-6),1.55(1H,m,H-2a),1.06(1H,m,H-1a),1.05(3H,s,H-15),0.98(3H,s,H-14),0.90(3H,s,H-13),0.73(3H,d,J= 6.6 Hz,H-12);13C NMR(150 MHz,CD3OD)δ:25.4(C-1),26.0(C-2),76.5(C-3),38.6(C-4),41.4(C-5),22.1(C-6),32.3(C-7),38.4(C-8),99.7(C-9),43.5(C-10),33.0(C-11),15.9(C-12),23.0(C-13),29.0(C-14),16.5(C-15),118.8(C-1′),155.2(C-2′),102.1(C-3′),134.6(C-4′),114.2(C-5′),7.69(C-6′),171.4(C-7′),48.3(C-8′),46.3(C-1′′),61.3(C-2′′)。以上数据与文献[15]中报道一致,因此鉴定化合物3为stachybotrin。
化合物4白色粉末;ESI-MS:m/z444.4 [M+H]+,分子式为C25H33NO6;1H NMR(600 MHz,CD3OD)δ:6.65(1H,s,H-3′),4.82(1H,m,H-3),4.47(1H,d,J= 17.1 Hz,H-8b′),4.31(1H,d,J= 17.1 Hz,H-8a′),4.07(1H,m,H-2),3.30(1H,d,J= 16.2 Hz,H-11b),2.94(1H,d,J= 16.2 Hz,H-11a),2.09(3H,s,H-2′′),1.92(1H,H-5),1.87(1H,m,H-8),1.76(1H,m,H-1b),1.59(1H,m,H-6b),1.55(1H,m,H-7b),1.50(1H,m,H-6a),1.49(1H,m,H-7a),1.41(1H,dd,J= 4.6,12.5 Hz,H-1a),1.14(3H,s,H-15),1.01(3H,s,H-14),0.93(3H,s,H-13),0.80(3H,d,J= 6.6 Hz,H-12);13C NMR(150 MHz,CD3OD)δ:34.7(C-1),65.8(C-2),81.5(C-3),39.2(C-4),41.7(C-5),21.1(C-6),32.2(C-7),37.7(C-8),99.3(C-9),44.8(C-10),32.1(C-11),15.8(C-12),22.1(C-13),28.4(C-14),17.3(C-15),116.3(C-1′),155.5(C-2′),102.3(C-3′),134.9(C-4′),116.3(C-5′),157.5(C-6′),173.9(C-7′),44.8(C-8′),172.9(C-1′′),21.6(C-2′′)。以上数据与文献[14]中报道一致,因此鉴定化合物4为chartarlactam K。
化合物5白色粉末;ESI-MS:m/z386.5[M+H]+,分子式为C23H31NO4;1H NMR(600 MHz,CD3OD)δ:6.73(1H,s,H-3′),4.46(1H,d,J= 17.1 Hz,H-8b′),4.30(1H,d,J= 17.1 Hz,H-8a′),3.33(1H,m,H-3),3.27(1H,d,J= 16.2 Hz,H-11b),2.87(1H,d,J= 16.2 Hz,H-11a),2.17(1H,dd,J= 3.0,12.4 Hz,H-5),1.95(1H,m,H-2b),1.86(1H,m,H-8),1.85(1H,m,H-1b),1.66(1H,m,H-7b),1.65(1H,m,H-6b),1.60(1H,m,H-7a),1.59(1H,m,H-6a),1.57(1H,m,H-2a),1.12(1H,m,H-1a),1.09(3H,s,H-15),1.01(3H,s,H-14),0.91(3H,s,H-13),0.77(3H,d,J= 6.6 Hz,H-12);13C NMR(150 MHz,CD3OD)δ:25.4(C-1),26.0(C-2),76.5(C-3),38.6(C-4),41.3(C-5),43.5(C-6),32.3(C-7),38.4(C-8),99.7(C-9),22.1(C-10),33.0(C-11),16.0(C-12),29.0(C-13),23.0(C-14),16.5(C-15),119.0(C-1′),157.8(C-2′),116.7(C-3′),134.7(C-4′),102.1(C-5′),155.2(C-6′),174.1(C-7′),43.9(C-8′)。以上数据与文献[16]中道一致,因此鉴定化合物5为stachybotrylactam。
化合物6白色粉末;ESI-MS:m/z402.4[M+H]+,分子式为C23H31NO5;1H NMR(600 MHz,CD3OD)δ:6.70(1H,s,H-3′),4.42(1H,d,J= 17.1 Hz,H-8b′),4.29(1H,d,J= 17.1 Hz,H-8a′),3.99(1H,m,H-2),3.29(1H,m,H-3),3.29(1H,d,J= 16.2 Hz,H-11b),2.92(1H,d,J= 16.2 Hz,H-11a),1.90(1H,H-5),1.87(1H,m,H-8),1.78(1H,m,H-1b),1.59(1H,m,H-7a),1.59(1H,m,H-6b),1.55(1H,m,H-7b),1.52(1H,m,H-6a),1.32(1H,dd,J= 12.5,4.6 Hz,H-1a),1.10(3H,s,H-15),1.05(3H,s,H-14),0.89(3H,s,H-13),0.76(3H,d,J= 6.6 Hz,H-12);13C NMR(150 MHz,CD3OD)δ:33.1(C-1),67.2(C-2),79.7(C-3),39.5(C-4),40.6(C-5),21.8(C-6),32.2(C-7),38.0(C-8),99.4(C-9),44.7(C-10),34.0(C-11),15.9(C-12),29.3(C-13),22.5(C-14),17.4(C-15),118.8(C-1′),155.3(C-2′),102.2(C-3′),134.8(C-4′),116.7(C-5′),157.6(C-6′),174.0(C-7′),43.9(C-8′)。以上数据与文献中[2]报道一致,因此鉴定化合物6为chartarlactam J。
化合物7白色粉末;ESI-MS:m/z488.5 [M+H]+,分子式为C27H37NO7;1H NMR(600 MHz,CD3OD)δ:6.65(1H,s,H-3′),4.47(1H,d,J= 17.1 Hz,H-8b′),4.31(1H,d,J= 17.1 Hz,H-8a′),3.95(1H,m,H-2),3.67(1H,m,H-1b′′),3.59(1H,m,H-1a′′),3.32(1H,m,H-3),3.25(1H,d,J= 16.2 Hz,H-11b),2.87(1H,d,J= 16.2 Hz,H-11a),2.05(1H,H-5),1.98(2H,m,H-2′′),1.86(1H,m,H-8),0.75(3H,d,J= 6.6Hz,H-12),1.75(1H,m,H-1b),1.60(1H,m,H-7b),1.60(1H,m,H-3b′′),1.55(1H,m,H-6b),1.52(1H,m,H-7a),1.52(1H,m,H-3b′′),1.48(1H,m,H-6a),1.31(1H,dd,J= 4.6,12.5 Hz,H-1a),1.09(3H,s,H-15),1.04(3H,s,H-14),0.91(3H,s,H-13);13C NMR(150 MHz,CD3OD)δ:34.0(C-1),67.2(C-2),79.7(C-3),39.5(C-4),40.7(C-5),21.8(C-6),32.2(C-7),38.0(C-8),99.4(C-9),44.7(C-10),33.1(C-11),15.9(C-12),22.6(C-13),29.3(C-14),17.4(C-15),118.6(C-1′),155.3(C-2′),102.2(C-3′),135.0(C-4′),114.3(C-5′),157.4(C-6′),171.2(C-7′),48.5(C-8′),43.1(C-1′′),24.8(C-2′′),32.2(C-3′′),176.6(C-4′′)。为进一步确定2,3位的构型,通过钼试剂诱导CD(Snatzke法)[17]进行验证,如图3所示,在310 nm附近为负Cotton效应,2位和3位羟基均为S构型。以上数据与文献[18]中报道一致,因此鉴定化合物7为Mer-VGF724B。
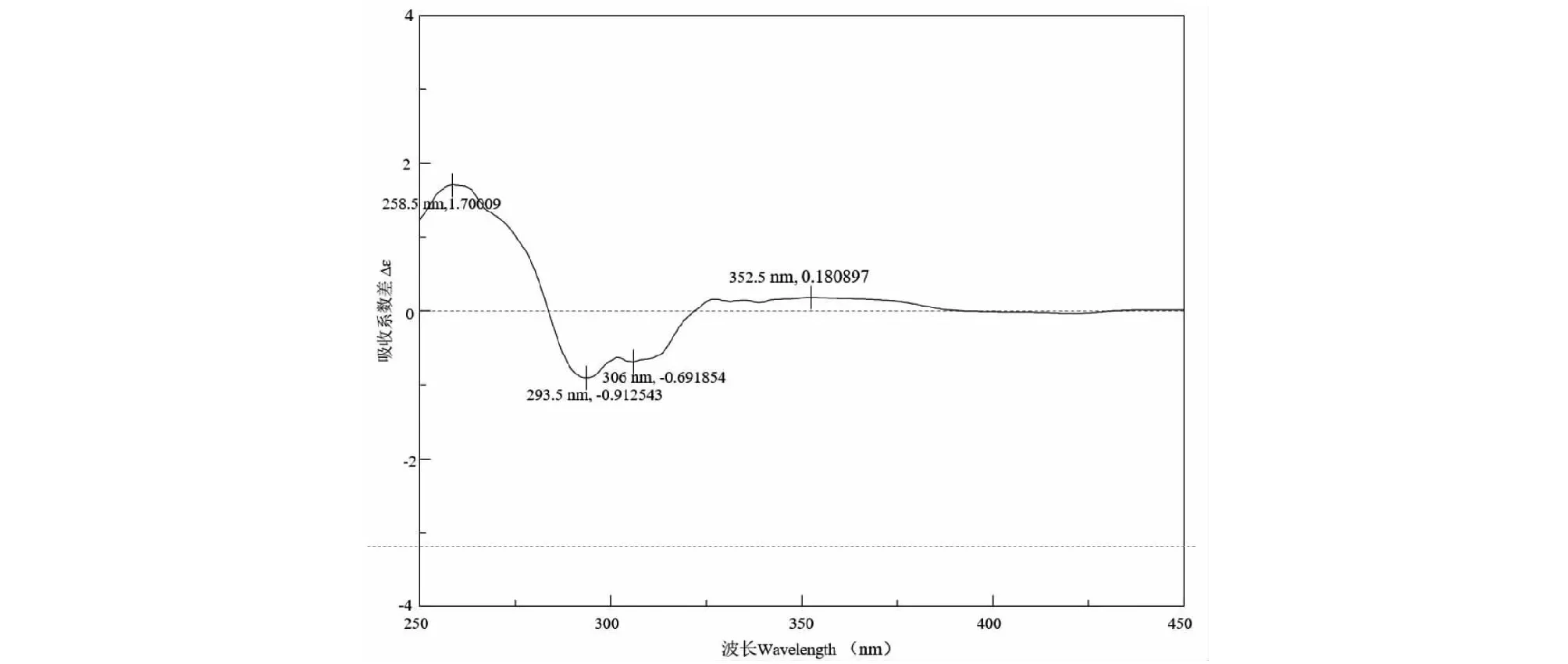
图3 化合物7的CD图谱Fig.3 The CD spectrum of compound 7
化合物8浅黄色粉末;ESI-MS:m/z458.5[M+H]+,分子式为C26H35NO6;1H NMR(600 MHz,CD3OD)δ:6.68(1H,s,H-3′),4.95(1H,q,J= 6.6 Hz,H-1′′),4.56(1H,d,J= 17.1 Hz,H-8b′),4.37(1H,d,J= 17.1 Hz,H-8a′),3.35(1H,br,s,H-3),3.23(1H,d,J= 16.2 Hz,H-11b),2.83(1H,d,J= 16.2 Hz,H-11a),2.13(1H,H-5),1.97(1H,m,H-2b),1.86(1H,m,H-1b),1.86(1H,m,H-8),1.60(1H,d,J= 6.6 Hz,H-3′′),1.53(1H,m,H-2a),1.53(2H,m,H-6),1.52(2H,m,H-7),1.09(1H,m,H-1a),1.06(3H,s,H-15),0.97(3H,s,H-14),0.88(3H,s,H-13),0.73(3H,d,J= 6.6 Hz,H-12);13C NMR(150 MHz,CD3OD)δ:25.4(C-1),26.0(C-2),76.4(C-3),38.6(C-4),41.4(C-5),22.1(C-6),32.2(C-7),38.5(C-8),99.8(C-9),43.5(C-10),33.0(C-11),15.9(C-12),23.0(C-13),29.0(C-14),16.6(C-15),119.1(C-1′),155.2(C-2′),102.1(C-3′),134.6(C-4′),114.7(C-5′),157.6(C-6′),171.4(C-7′),45.7(C-8′),51.1(C-1′′),15.9(C-2′′),174.8(C-3′′)。以上数据与文献中[19]报道的化合物4一致,因此,将化合物8命名为3α-hydroxyl-N-isopropyl carboxyl-phenylspirodrimane。
化合物1~8的结构见图4。
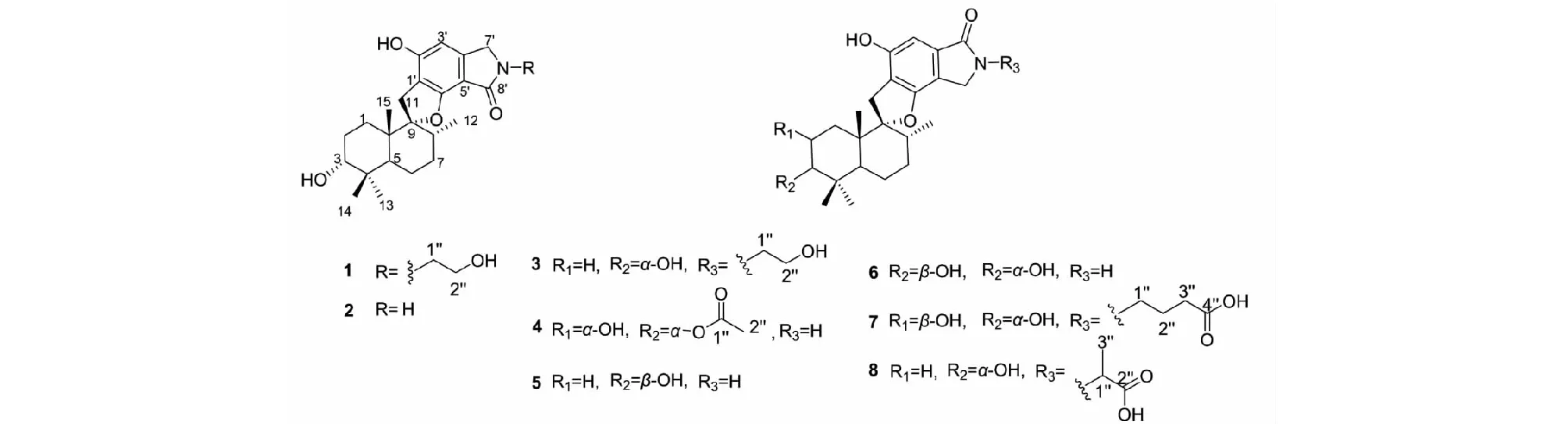
图4 化合物1~8的化学结构Fig.4 The structures of compound 1-8
2.4 体外细胞毒活性检测
采用CCK-8法对化合物1~8进行细胞毒活性检测。测试细胞包括人肝癌细胞株(HepG2)、人宫颈癌细胞株(HeLa)以及人结肠癌细胞株(HCT116),以顺铂作为阳性对照药进行活性评价(见表1)。活性测试结果显示,PSM类化合物对HepG2、HeLa和HCT116细胞株有较好的抑瘤活性,但低于阳性对照药。其中,化合物2对3株肿瘤细胞的抑制活性相对较高,化合物3和7对HeLa细胞株的抑瘤活性显著降低。对比化合物2和7的化学结构,化合物7中C2位羟基化和N位的丁酸基团取代可能降低了抗肿瘤细胞活性(见表1)。
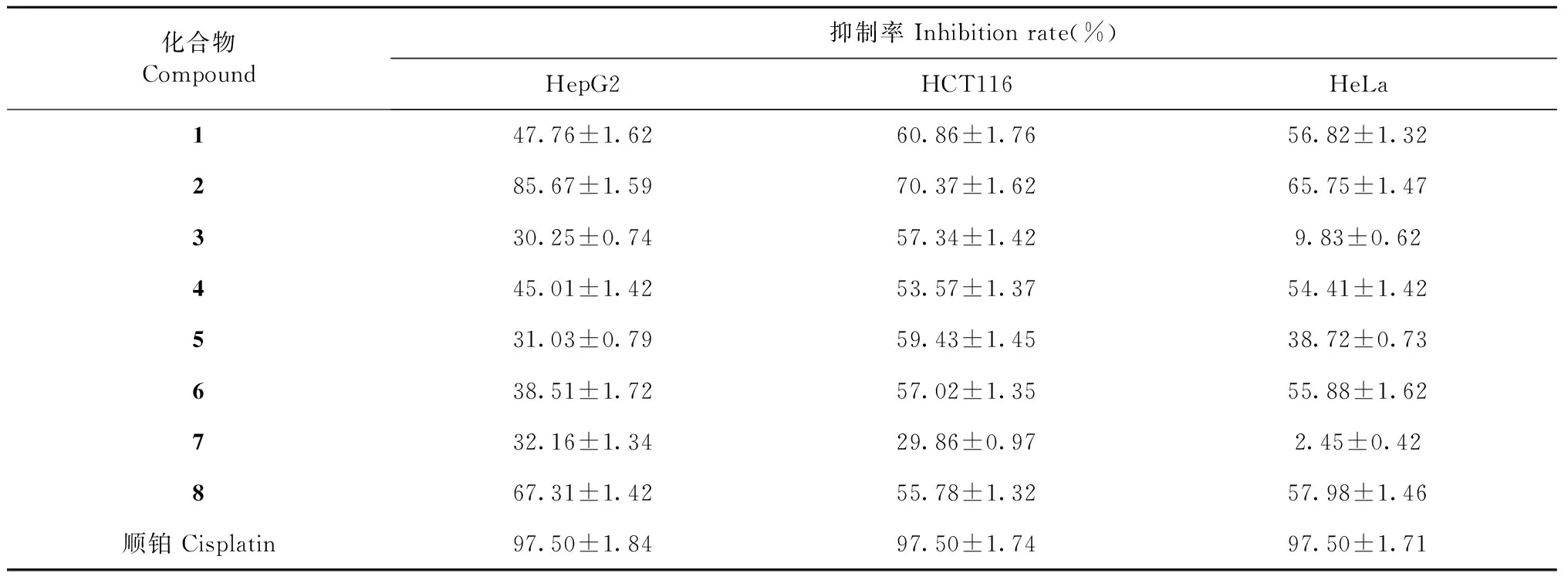
表1 化合物1~8的细胞毒活性Table 1 The cytotoxic activities of compounds 1-8
3 讨论与结论
本研究利用OSMAC技术、LC-MS/MS质谱分子网络分析策略,结合多种色谱及现代波谱手段从葡萄穗霉菌Stachybotryssp.CPCC 401591中分离得到8个PSM类化合物。近年来,对丝状真菌基因组数据的挖掘分析发现大多数真菌通常含有40~60个与天然产物生物合成有关的生物合成基因簇(BGCs),但目前分离鉴定的代谢产物仍然是“冰山一角”。丝状真菌基因组中大多数BGCs是沉默或隐蔽的,可能编码的“暗物质”仍未得到鉴定。OSMAC技术不针对特定的沉默基因簇的激活,而是针对容易操作的培养参数的系统改变(包括培养基成分、pH值和培养温度等),从而获得结构新颖的生物活性分子[14]。这使得OSMAC技术成为用于激活微生物次级代谢的一种廉价高效、可用通用且相对简单易行的研究方法。本研究针对菌株CPCC 401591,采用OSMAC策略研究PDB、BY、F2和大米发酵培养基对真菌次级代谢产物的影响。综合菌株次级代谢产物的丰度和产量,确定了大米培养基是最佳发酵培养基,表明OSMAC技术对该菌株挖掘次级代谢产物的效率有显著提高。同时,本研究将GNPS分子网络分析策略运用到对菌株CPCC 401591发酵提取物乙酸乙酯相分析,将待分析物的二级质谱数据与数据库中的化合物质谱数据进行比对,快速指认出待分析样品中所包含的化合物类别,并进一步助力生物活性分子的高效发现。
PSM类化合物目前只在葡萄穗霉属和刺黑乌梅属真菌中分离得到,因此该类化合物为这两类真菌的标志性分子[20]。化合物stachybotrin D具有显著的抗HIV活性,对HIV-1wt、HIV-1RT-K103N等突变株的EC50值介于6.2~23.8 μM[4]。Jia等[5]研究发现bistachybotrysin K对HCT116和NCI-H460等肿瘤细胞株的IC50值介于1.1~4.7 μM。本研究对菌株Stachybotryssp.CPCC 401591中的次级代谢产物开展研究,结合化合物特征性紫外吸收(230、285、330 nm),利用多种色谱技术以及现代波谱技术,分离并确定了8个PSM类化合物的结构。进一步结合GNPS分析,发现该菌株的发酵提取物中仍含有多个单体和PSM类二聚体化合物分子,但因为含量少未能得到单体化合物。因此,可通过进一步提高发酵量、优化发酵条件并结合HPLC-UV-MS技术寻找更多的PSM类分子。目前,我们已经完成菌株Stachybotryssp.CPCC 401591的全基因组测序,通过基因组挖掘手段定位到2个可能的PSM类化合物的生物合成基因簇psd1和psd2。两个基因簇均含有聚酮合酶和倍半萜合酶编码基因,同时该基因簇编码丰富的后修饰酶(包括氧化酶P450s、短链脱氢酶和乙酰转移酶等)。这为我们后续借助基因敲除策略,从而为解析PSM类化合物生物合成途径和鉴定关键生物酶功能的研究奠定基础。因此,本研究表明葡萄穗霉真菌Stachybotryssp.CPCC 401591能够产生PSM化合物,丰富了该菌次级代谢产物的结构多样性,是一株值得深入研究的重要资源菌。
