解析北京等级考试题,探索化学教育教学路径
2023-09-02王耀宗陈瑞雪温利权
秦 蕾 王耀宗* 陈瑞雪 温利权
(1.北京大学附属中学 北京 100086;2.北京教育考试院 北京 100083;3.北京市朝阳区教育科学研究院 北京 100021;4.北京市第二中学 北京 100010)
教育评价事关教育方向,有什么样的评价引导,就有什么样的教学导向。2020年6月,中央全面深化改革委员会第十四次会议审议通过了《深化新时代教育评价改革总体方案》,提出稳步推进中高考改革,构建引导学生德智体美劳全面发展的考试内容体系,改变相对固化的试题形式,增强试题开放性,减少死记硬背和“机械刷题”现象。考试评价尤其是高考命题工作,作为教育评价的重要组成部分,对教学实践有显著的导向作用,在培育良好教育生态、减轻学生课业负担以及校外培训负担上应发挥其独特的积极作用。
北京市化学科考试作为自主命题和素质教育的关键环节,其核心功能是立德树人、服务选才、引导教学。自2014年以来,随着高考改革的不断深化,以“有利于促进学生健康发展,有利于科学选拔各类人才,有利于维护社会公平”为基本出发点和落脚点,化学科考试一直坚持“四个突出、四个考出来”命题理念,在不断深化考试内容改革发挥命题的育人导向功能的过程中,积极通过考试的教育引导作用撬动中学教学变化。经过多年发展,化学科考试通过增强教考良性互动,引导教学减负,促进课堂提质,实现育人增效。考试的内容、形式和结果直接影响教学内容的设置和教育教学的形式。现以2022 年北京等级考化学卷的部分试题分析为例,探索日常的化学教育教学路径。
一、秉承绿色化学观念和可持续发展意识,坚持学科立德树人根本任务
2022 年北京等级考化学卷命题充分体现了化学在生产和生活中的广泛应用,尤其是突出了绿色化学观念和可持续发展意识,充分体现了学科选拔人才秉承的立德树人根本任务。表1将全卷涉及的题面和立意进行了简要汇总。

表1 2022年北京等级考化学卷试题中体现的立德树人思想
由表1 可见,全卷19 道试题中有10 道试题基于化学学科在生产和生活中的实际应用。现以第15题为例,结合课程标准要求进一步说明对教育教学的启示。
1.原题呈现
2022年第15题(节选):
工业中可利用生产钛白的副产物FeSO4·7H2O 和硫铁矿(FeS2)联合制备铁精粉(FexOy)和硫酸,实现能源及资源的有效利用。
(3)FeSO4·7H2O 加热脱水后生成FeSO4·H2O,再与FeS2在氧气中掺烧可联合制备铁精粉和硫酸。FeSO4·H2O分解和FeS2在氧气中燃烧的能量示意图如图1 所示。利用FeS2作为FeSO4·H2O 分解的燃料,从能源及资源利用的角度说明该工艺的优点。

图1
2.试题解析
试题给出分析问题“能源及资源利用”的两个角度,学生需要关联并选取题干的相关信息,就工艺优点做出分析。首先,从能量变化的角度来看这两个反应。2FeSO4·H2O的分解反应是吸热反应,FeS2在氧气中掺烧的反应是放热反应。从能源利用的角度可以联合两个反应,FeS2在氧气中掺烧放热为2FeSO4·H2O的分解提供能量,从而达到能源的有效利用。其次,从物质变化的角度来看这两个反应。两个反应的产物中均有Fe2O3,是制备铁精粉(FexOy)的原料,产物中的SO2、SO3是制备硫酸的主要原料,从而达到资源的有效利用。
3.教学启示
学科核心素养是学科育人价值的集中体现,在课程标准的不同主题中,均结合学习活动和情境素材,在学习过程中帮助学生认识化学学科在环境保护、资源合理开发利用等方面做出的贡献,让学生能够秉承绿色化学观念和可持续发展意识,能够运用已有的知识和方法综合分析解决化学过程中可能带来的问题和影响,学生通过学科学习逐步培养科学态度与社会责任素养,以形成正确的价值观和必备品格。化学考试和化学教学必须旗帜鲜明地将立德树人作为根本任务,不断加强学科学习的育人功能,树立学科学习的积极导向作用,培养能够践行社会主义核心价值观的社会主义建设者和接班人。[1]具体见表2 课程标准中的部分内容。[2]
二、基于认识物质性质及化学反应的学科角度和方法进行学习建构
1.原题呈现
2022年第7题:

A.H2分子的共价键是s-s σ键,Cl2分子的共价键是s-p σ键
B.燃烧生成的HCl 气体与空气中的水蒸气结合呈雾状
C.停止反应后,用蘸有浓氨水的玻璃棒靠近集气瓶口产生白烟
D.可通过原电池将H2与Cl2反应的化学能转化为电能
2.试题解析
本题的素材选取考生非常熟悉的氢气在氯气中燃烧的实验,四个选项的设置分别基于分子的成键类型、实验现象、产物的性质以及化学反应能量变化的应用四个角度,层层递进,考查考生对基本知识的理解和掌握情况。
A 选项源自选修2 物质结构模块,主要考查考生对H2、Cl2分子中共价键成键方式的认识,H2分子中是通过s-s 形成的σ 键,Cl2分子中是通过p-p 形成的σ键。A选项不正确。
B 选项源自必修1 模块氯气的性质,主要考查考生对于物质性质的认识和实验现象的理解。H2在Cl2中燃烧放热,生成HCl 气体,挥发到集气瓶口处,HCl极易溶于水,遇到空气中的水蒸气呈雾状。
C选项源自必修1模块氯化氢和氨气的性质。用蘸有浓氨水的玻璃棒靠近集气瓶口,浓氨水有挥发性,NH3遇到HCl 迅速发生反应NH3+HCl===NH4Cl,NH4Cl为白色固体,在空气中为白烟。
D 选项源自选修1 模块对于原电池原理的认识。H2与Cl2的反应中发生了电子转移,其本质为氧化还原反应,且反应自发,这样可以通过原电池将H2与Cl2反应的化学能转化为电能,体现课程标准中关于“制作简单的燃料电池”的要求。
3.教学启示
本题基于熟悉的化学反应,通过必修1、选择性必修1、选择性必修2三个不同模块内容的巧妙融合,在一道选择题中尽现高中化学在不同阶段的学习认识发展。素材选取贴近教材,注重基础,通过设问引导日常教学重视落实基于学科本质的认识发展进阶。梳理必修和选修模块学习中对于物质性质和化学反应的认识如图2所示,在不同模块教学阶段应注意建构化学科认识世界的学科视角和学科方法,在不同的学习阶段开启的是同一个客观的世界,只是认识的角度在不断地丰富,认识的层面在不断地深入。对于物质性质的认识从宏观表象到微观结构,帮助学生“看到”了一个看不见的微观世界,凸显化学学习的奥妙;对于化学反应从本质的认识到创造性的应用反应、创造新的物质,帮助学生理解化学学习的学科价值和社会价值。教学内容的结构化设计有助于学生在学习建构过程中体会化学科学是人类认识世界和改造世界的工具。

图2 对物质性质和化学反应认识的学习进阶
三、基于核心素养、结合技术手段,挖掘实验功能、促进学习发展
1.原题呈现
2022年第14题:
CO2捕获和转化可减少CO2排放并实现资源利用,原理如图3所示。反应①完成之后,以N2为载气,将恒定组成的N2、CH4混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图4 所示。反应过程中始终未检测到CO2,在催化剂上检测到有积炭。下列说法不正确的是( )。

图3

图4
A.反应①为CaO+CO2==CaCO3;反应②为CaCO3
B.t1-t3,n(H2)比n(CO)多,且生成H2的速率不变,推测有副反应
C.t2时刻,副反应生成H2的速率大于反应②生成H2的速率
D.t3之后,生成CO 的速率为0,是因为反应②不再发生
2.试题解析
t2时刻,反应②生成H2的速率即为生成CO 的速率,图4 中H2总流速与CO 流速的差值即为副反应的速率,由t2时刻的纵坐标可知副反应生成H2的速率小于反应②生成H2的速率。C选项不正确。
t3之后,生成CO 的速率为0,推测反应②不再发生。D选项正确。
3.教学启示
本题通过分析单位时间流出气体各组分的物质的量随反应时间的变化,推测反应体系中存在的副反应、主反应与副反应在不同时段的主次关系、反应的进程等,均是基于宏观可“观测”到的实验现象,充分体现了对宏观辨识与微观探析、证据推理与模型认知化学学科核心素养的考查。随着时代的进步,化学反应的“现象”已远不限于通过感官可以观察到的颜色、气味、状态等的变化,更多的是借助现代化的仪器和设备来表征的实验“现象”,比如用pH计监测反应过程中溶液酸碱度的变化,用电导率测定溶液中离子浓度的变化等,时代的进步为化学学科认识微观世界插上了技术的翅膀。
实验是化学学科认识世界的基本方法,是化学学习的重要手段。如何以实验为载体推动中学化学的课程建设,如何发挥实验的育人功能值得深入挖掘。现以必修1课程标准中要求的“配制一定物质的量浓度的溶液”实验为例(见表3),可以通过引入紫外可见分光光度计、色度计等仪器,定量表征配制溶液浓度的实验结果。

表3 必修1“配制一定物质的量浓度的溶液”实验改进
“配制一定物质的量浓度的溶液”实验,以前学生做就是照方抓药,改进后将溶质由氯化钠换成了硫酸铜,借助紫外可见分光光度计或色度计来定量测定溶液的浓度,这样不但可以直接评价浓度配制的结果,比较结果偏差的相对大小,促进学生理解实验过程、规范实验操作,还可以基于实验结果关联实验过程做出误差分析,培养科学的学习态度。在学习评价中引入了两人以及全班的合作,旨在培养学生的合作精神和责任意识。配制一定物质的量浓度的溶液以实验为载体,借助现代化仪器,以定量评价为手段,既用定量的结果推动了高质量学习的发生,又促成了育人功能的实际落实。
结合高考试题,图像呈现的是气体流速的变化,依据数据的变化对反应做出假设或判断,再通过证据推理来揭示物质间的化学变化,试题呈现基于学科核心素养的考查,借助技术手段使得化学反应“可视化”。随着技术日新月异地发展,基于图像、图表、数据等对化学反应做出分析和判断已成为时代对化学学习的要求,因此需要在化学学习中努力挖掘实验的功能,进一步促进学习的认识和发展,切实发挥化学实验的学习功能和育人功能,让实验真正成为培养社会主义接班人的学科路径。
四、融合学科本质价值、学科育人价值和学科社会价值进行学习建构
1.原题呈现
2022年第18题(节选):
白云石的主要化学成分为CaMg(CO3)2,还含有质量分数约为2.1 %的Fe2O3和1.0 %的SiO2。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
已知:

物质Ksp Ca(OH)2 5.5×10-6 Mg(OH)2 5.6×10-12 CaCO3 3.4×10-9 MgCO3 6.8×10-6
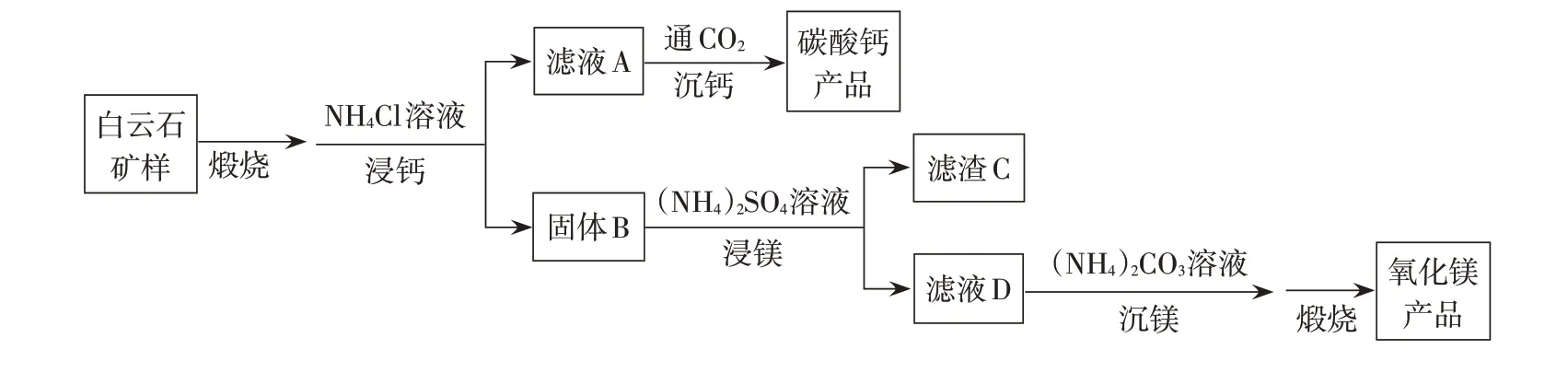
(1)白云石矿样煅烧完全分解的化学方程式为________________________________________。
(2)NH4Cl用量对碳酸钙产品的影响如下表所示。
①解释“浸钙”过程中主要浸出CaO的原因。
②沉钙反应的离子方程式为______________。
③“浸钙”过程不适宜选用n(NH4Cl):n(CaO)的比例为_________。
④产品中CaCO3纯度的实测值高于计算值的原因是_______________________________________。
(3)“浸镁”过程中,取固体B与一定浓度的(NH4)2SO4溶液混合,充分反应后MgO 的浸出率低于60%。加热蒸馏,MgO 的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是_____________________________________。
(4)滤渣C中含有的物质是_________________。
(5)该流程中可循环利用的物质是___________。
2.试题解析
首先,白云石矿样煅烧完全分解化学方程式的书写,一种方法是关联CaCO3高温分解生成CaO 和CO2的反应,利用Ca、Mg均为IIA族元素性质相似的特点,判断MgCO3高温分解生成MgO 和CO2;另一种方法是关联(2)中NH4Cl溶液浸出的是氧化物MO,判断出煅烧产物为CaO、MgO,再根据元素守恒判断出第3种产物为CO2,写出煅烧反应方程式
其次,浸钙过程涉及反应i.CaO+H2O==Ca(OH)2、ii.Ca(OH)2+2NH4Cl==CaCl2+2NH3+2H2O,反应i 与反应ii 相加为浸钙的总反应iii:CaO+2NH4Cl==CaCl2+2NH3+H2O。同理,浸镁的总反应为iv:MgO+2NH4Cl==MgCl2+2NH3+H2O。根据反应的物质的量之比,理论上浸钙所需的n(NH4Cl)/n(CaO)=2∶1,浸镁所需的n(NH4Cl)/n(MgO)=2∶1。

备注:i.MO浸出率=(浸出的MO质量/煅烧得到的MO质量)×100%(M代表Ca或Mg)ii.CaCO3纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中CaCO3纯度。
解释“浸钙”过程中主要浸出CaO的原因,需要关联CaO、MgO 对应的Ca(OH)2、Mg(OH)2,二者均为二元碱,且Ksp[Ca(OH)2]≫Ksp[Mg(OH)2],因此易溶于水的碱先反应,即CaO先浸出。
据煅烧产物n(CaO)∶n(MgO)=1∶1,若要将CaO、MgO 全部浸出,需n(NH4Cl)/n(CaO)=4∶1。解读表中前3 列数据,第1 列为n(NH4Cl)/n(CaO),其比值分别是2.1∶1、2.2∶1、2.4∶1,n(NH4Cl)的用量仅比CaO 需要的多一点儿,哪一组铵盐的用量也不能把钙盐和镁盐全部浸出。
由第2列和第3列的数据可以看出,随着n(NH4Cl)/n(CaO)的增加,一是CaO 和MgO 的浸出率均有升高,即二者的浸出存在竞争;二是当n(NH4Cl)/n(CaO)升至2.4∶1时,浸出率的提升MgO明显高于CaO,对于浸出CaO来说会引入更多的Mg2+杂质,因此控制n(NH4Cl)/n(CaO)的用量<2.4∶1,可以使浸钙的主要浸出物为CaO,从而实现钙镁分离。
第三,沉钙是向滤液A 中通入CO2。关联浸钙反应iii:CaO+2NH4Cl==CaCl2+2NH3+H2O,若向CaCl2溶液中直接通入CO2气体,CaCl2+H2O+CO2←CaCO3+2HCl,反应环境为酸性,无法生成CaCO3沉淀,判断是浸钙生成的NH3调节了沉钙反应的酸碱性,保证沉钙是在碱性条件下进行,因此沉钙的离子反应为Ca2++,直到NH3消耗完为止;同理,沉镁的离子反应为沉钙、沉镁的反应关联浸钙、浸镁的反应(CaO+2NH4Cl == CaCl2+2NH3+H2O、MgO+2NH4Cl ==MgCl2+2NH3+H2O)发现,沉钙、沉镁提供的NH3全部来源于浸钙、浸镁产生的NH3,即通入的CO2气体最多将浸出的Ca2+、Mg2+全部沉淀。
沉钙产品的纯度分析,表格中第4-6 列数据,一是CaCO3纯度的实测值高于计算值,二是第3 行数据即使有6%的MgO浸出时,产品中Mg杂质的含量仍然非常少,才只有2.2%。关联信息Ksp(CaCO3)=3.4×10-9、Ksp(MgCO3)=6.8×10-6,发现Ksp(CaCO3)<Ksp(MgCO3),得知沉钙过程中CaCO3首先析出。通入CO2的过程由于NH3极易挥发,还会带走一部分NH3,则剩余NH3的量已不足以保证MgCO3析出的反应环境。
第四,浸镁的反应原理与浸钙的类似,具体反应为i.MgO+H2O==Mg(OH)2,ii.Mg(OH)2+(NH4)2SO4==MgSO4+2NH3+2H2O。浸出率在加热蒸馏之后出现明显变化,说明低于60%的时候,浸镁的过程已经达到了反应的限度,即化学平衡状态,说明浸镁的反应是一个可逆反应
在加热蒸馏的过程中,NH3极易挥发先从反应体系中逸出,水蒸气也会逸出,随着馏出液体积增多则NH3的逸出会更多,反应体系中c(NH3)不断降低,上述平衡正向移动,MgO的浸出率增大。
第五,分析滤渣C中含有的物质。一是白云石矿样中的Fe2O3和SiO2均不溶于铵盐,因此留在滤渣中。二是MgO 的浸出率最终达98.9%,说明还有1.1%的MgO 并未完全浸出,滤渣中还会有Mg(OH)2(MgO)。三是浸钙过程中钙有残留,以n(NH4Cl)/n(CaO)=2.2∶1的一组数据为例,还有1.2%的CaO 进入浸镁的过程;浸镁选用(NH4)2SO4代替NH4Cl 作为铵盐,阴离子为,而CaSO4微溶,只有在浸镁过程中以CaSO4沉淀的形式分离出钙,才能保证获得高纯度的镁,故滤渣C中含有CaSO4。
第六,分析该过程中可循环使用的物质。一是要区别“循环使用”和“回收利用”。循环使用指的是阶段反应的产物能回到流程中再次使用,形成一个“循环”;回收利用指的是产物还能被回收利用,不一定回到流程中形成循环,回收他用也可。
综上所述,该过程中可循环使用的物质分别为NH4Cl、(NH4)2SO4、NH3、CO2。
3.教学启示
首先,教学中应着重基于学科本质价值进行学习建构。
本题以工业生产煅烧白云石制备高纯度的碳酸钙和氧化镁为载体,借助高中化学常见元素化合物之间的反应,在对沉淀溶解平衡、盐类水解平衡、弱电解质电离平衡等基础性内容考查的同时,兼顾了解决实际问题的能力考查。
在数据的解读和分析过程中,帮助学生理解化学科学在该工艺中创造性地多次运用了化学平衡思想来解决实际问题:
①控制n(NH4Cl)/n(CaO)比值,使得“浸钙”过程中主要浸出的是CaO;
②沉钙过程充分利用浸钙所得的NH3来调节沉钙溶液的酸碱性,又利用NH3具有挥发性,使得沉钙既有利于钙的沉降,又减少镁的沉降;
③浸镁过程采用蒸馏的方法,水蒸出反应体系,c(Mg2+)升高,抑制浸镁,c(NH)降低缓慢,有利于浸镁,工艺上充分利用NH3易挥发的特点随着水蒸出反应体系,大大降低了反应体系中c(NH3)的浓度,拉动浸镁的平衡正向移动,MgO的浸出率最终高达98.9%;
该工艺浸钙、浸镁与沉钙、沉镁的反应原理虽然类似,但根据工艺目标,通过对反应条件及反应限度的不同调控,完美实现了物质的制备和分离,是学科本质价值的高阶体现。
教学中需要沿着化学科学认识世界、改造世界和创造世界的学习路径来进行建构,促成学生在真实问题解决的过程中充分运用理解与辨析能力、分析与推测能力、归纳与论证能力、探究与创新能力,不断感受化学科学的魅力和奇妙,认识化学科学对资源开发与利用,人类进步和发展的贡献,从而实现化学教育教学的学科本质价值。
其次,教学中应着重挖掘基于学科育人价值和社会价值进行学习建构。
本题所涉及的元素化合物全部是高中常见的、熟悉的元素化合物,所涉及的反应原理均为水溶液平衡的主干内容,综合考查学生对流程、数据和信息的接受、吸收、整合和加工的能力,以及用化学学科用语分析和表达能力。引导中学教学重视基本反应规律和化学反应原理的实际应用,培养学生关注反应体系在反应过程中的变化,反应环境对反应先后顺序和反应竞争的影响,能够辩证地看待变化,有序、有角度地调用学科思维思考问题,切实落实宏观辨识与微观探析、变化观念与平衡思想、证据推理与模型认知、科学态度与社会责任等化学学科核心素养,充分理解并落实教学是通过学习来进行人才培养的过程。
本题涉及的化学工艺,处处体现绿色化学的理念。化学工艺中每一步试剂的选取都是既实现该步骤的目标,又兼顾整个工艺流程中物质的循环利用;从物质利用和资源节约的角度最大限度地提升原子利用效率。引导中学教学重视理解化学在解决生产、生活问题中的社会价值,体会化学科学在资源开发与利用、保护生态环境等问题上发挥的重要作用,树立学生的化学环保意识和社会责任感,体会化学学习的责任担当,努力成为一名真正的自然科学的学习者和社会责任的笃行者。
现以侯德榜制碱法为例,谈谈从学科本质价值、育人价值和社会价值来进行学习建构。侯德榜制碱法的工艺流程图如图5(鲁科版教材图)[3]所示。

图5 侯德榜制碱法工艺流程图
(1)基于反应原理认识学科本质价值(表4)。

表4 基于反应原理认识学科本质价值
(2)基于制碱研制历程发掘学科育人价值和社会价值。
侯德榜先生制碱研制的主要历程和时代背景如图6所示[5]。

图6 侯德榜先生制碱研制的主要历程和时代背景
侯氏制碱法通过循环使用母液,使得食盐的利用率从原来的72%~74%提高到98%;省去了原料石灰石的使用、石灰窑和蒸氨等设备,消除了索尔维制碱法废渣堆积、废液污染等潜在资源隐患;联合合成氨工业不但充分利用了其副产品CO2,而且生产出相当产量的氯化铵来作为氮肥,节约了合成氨工业制硫酸铵所使用的硫酸;所得的产品纯碱纯度达98.5%以上,氯化铵纯度达99%以上。
侯德榜和范旭东先生能够带领团队,不受时局所限,克服重重困难,因地制宜地不断进行技术创新,巧妙地多次运用化学平衡思想,通过物质的加入顺序和反应条件的调控,不但充分利用了物质资源,而且实现了工艺的连续生产,其研究成果不但为社会主义建设做出了贡献,更以跨越国界的科学精神与世界分享技术成果,为世界的化工发展作出了巨大的贡献。
白云石制备高纯度碳酸钙和氧化镁的试题在化学平衡思想的创造性应用、物质资源的利用等多个方面与侯德榜制碱法有异曲同工之妙,化学学习只有基于学科的社会需求,才能体现学科学习的价值,而当学习服务于社会需求时,才是真正实现了学科的育人价值,基于学科本质的学习才真正有了意义。
综上所述,以2022年北京等级考化学卷的部分试题分析为例,探索日常的化学教育教学路径,一是明确学科学习为人才培养服务,只有坚持以立德树人作为教学的根本任务,才能培养出为国家、为社会服务的人才;二是学科学习帮助学生建构的是认识世界、改造世界、创造世界的学科角度和方法,是可以脱离开知识,可以进行远迁移的学科能力、学科思维和学科素养,因此教学中应着力基于学科本质建构高中三年的学习内容,让每一课都为学生的终身发展打好学科基础;三是学科学习要注意挖掘化学实验的功能,化学实验作为学科学习的重要载体和手段,要赋予学科核心素养的涵义,要结合时代发展的技术手段,让化学实验为化学学习插上翅膀;四是学科学习一定要融合学科本质价值、学科育人价值和学科社会价值进行建构,以真实问题为载体,帮助学生体会化学学习的责任和担当,使化学课不但是科学课,更成为人生成长的必修课。
