外泌体miRNAs在脊髓损伤中的研究进展
2023-09-01周孝敏鱼丽萍
周孝敏,鱼丽萍
脊髓损伤(spinal cord injury,SCI)是指由于各种因素导致的中枢神经系统创伤,可引起损伤平面以下运动、感觉和括约肌等功能障碍。全球SCI 的发病率约为25~50 万人/年[1,2]。目前SCI 的治疗方法包括手术减压、糖皮质激素及康复训练[3]等,但目前疗效仍十分有限。寻找更有效的SCI治疗新方法具有重要的意义。
间充质干细胞(mesenchymal stem cells,MSCs)移植在SCI 中的作用已被广泛研究,但细胞移植仍受许多限制,如低生存率、免疫排斥反应、致瘤性等[4]。研究表明,基于细胞治疗的有益结果一部分源于供体细胞释放的外泌体,而这些外泌体中的微小RNA(MicroRNAs,miRNAs)对SCI 修复有积极的影响[5]。本文对近几年关于外泌体miRNAs 在SCI 中的诊治作用研究进展做一综述,为外泌体miRNAs与SCI的进一步研究提供一定的参考及临床治疗新思路。
1 概述
1.1 外泌体
1983年,外泌体首次在绵羊网织红细胞中被发现,最初被认为是细胞废物[6]。研究发现,体内几乎所有类型的细胞都可以分泌外泌体[7],且其存在于几乎所有的体液中,包括血液、脑脊液、唾液、尿液等[8]。此外,外泌体含有不同的核酸,如mRNA、miRNA 和lncRNA,这些核酸被认为是疾病诊断的潜在标志物[9]。最近研究表明,外泌体由于能够携带功能性miRNAs 或其他小分子,可以作为诊断和治疗疾病的潜在工具。同时,还可以选择性的改变外泌体的内容物,这也有助于运用于疾病的靶向治疗。
1.2 miRNAs和外泌体miRNAs
miRNAs 是指平均长度约为22 个核苷酸的内源性非编码小RNA,主要调控转录后的基因表达,并参与许多细胞过程的调控[10]。miRNAs在哺乳动物的中枢神经系统中高表达,研究表明,多种miRNAs 都参与了SCI 的一系列病理生理过程[11]。外泌体miRNAs 是指通过外泌体介导的miRNAs,包括外泌体中内容物含有的miRNAs及通过转染等方法使外泌体过表达的miRNAs。研究提示,miRNAs是治疗SCI的重要靶点及早期SCI 的生物标志物。具有双层膜结构的外泌体不仅可以保护miRNAs 免于快速被降解,还可以作为miRNAs 靶向治疗SCI 的有效载体,外泌体还可以穿透血脑屏障、血脊髓屏障,这有益于增强miRNAs 的治疗效果[12]。
2 外泌体miRNAs对SCI的作用
2.1 外泌体miRNAs对SCI的治疗作用
目前关于SCI 治疗的研究中,多种外泌体miRNAs 被纳入研究,本综述主要介绍miRNA-126、miRNA-21和miRNA-29b。2.1.1 miRNA-126 miRNA-126 作为一种内皮细胞特异性的miRNA,具有介导血管发育、生成的功能。研究发现,将过表达miRNA-126的MSCs移植入SCI大鼠脊髓损伤区可促进神经功能的恢复,其可能机制是抑制了损伤区的炎症反应[13]。HUANG JH等[14]研究发现,在SCI大鼠模型中,转染miRNA-126的间充质干细胞外泌体(MSC-exos)可以促进血管生成和神经发生、抑制细胞凋亡,促进SCI 后的功能恢复。体外实验还发现,来自miRNA-126 修饰的MSC-exos 通过抑制EVH1 结构域蛋白1(1PRED1)和磷酸肌醇-3 激酶调节亚基2(PIK3R2)的表达,促进血管生成和人脐静脉内皮细胞的迁移。随后一项研究也得出相似结论,miRNA-126修饰的MSC-exos显著改善了SCI大鼠后肢运动功能、降低损伤脊髓体积、保护神经元并促进SCI后的轴突再生,其潜在机制是miRNA-126抑制了RhoA,同时激活了ERK1/2、STAT3 和CREB[15]。这些研究提示,外泌体miRNA-126可促进血管生成和神经发生,从而促进损伤脊髓的修复,但目前具体分子机制尚未明确。
2.1.2 miRNA-21 miRNA-21 是实体肿瘤中的一个抗凋亡基因。研究提示,SCI中上调miRNA-21有利于促进损伤脊髓的修复[16]。关于外泌体miRNA-21 与SCI 的相关研究近年来也引起学者们广泛关注。JI 等[17]研究发现,肥胖大鼠骨髓间充质干细胞(bone marrow mesenchyml stem cells,BMSCs)表现出胰岛素抵抗,而BMSCs 的这种胰岛素抵抗降低了其分泌的外泌体miRNA-21 水平,失去了对SCI 的保护作用。通过在肥胖大鼠BMSCs 中转染miRNA-21 后恢复了骨髓间充质干细胞外泌体对SCI的保护作用。这提示,主要是外泌体miRNA-21对SCI起积极作用。KANG等[18]在SD大鼠的SCI模型中发现miRNA-21表达降低,抑癌基因(PTEN)和程序性细胞死亡因子4(PDCD4)表达增加,用转染后过表达miRNA-21的MSC-exos静脉注射治疗发现,miRNA-21可下调PTEN/PDCD4信号通路,抑制细胞死亡,增加神经细胞活力从而改善SCI大鼠的运动功能。XU等[19]进行的体内、外实验也得出了同样的结论。然而,NING等[20]的研究却得出矛盾的结果,在他们的研究中,SCI 大鼠中miRNA-21水平显著增加,且通过在SCI区注射miRNA-21抑制剂可下调IL-6 受体蛋白、酪氨酸激酶(JAK)和转录激活因子3(STAT3),抑制炎症反应,从而促进SCI的恢复。导致研究结果之间差异性的原因可能是SCI 是一个动态变化的过程,在不同时期miRNAs表达具有差异,其作用也不尽相同,提示应在损伤不同时期进行动态检测相应miRNAs的变化。
2.1.3 miRNA-29b YU 等[21]分别运用BMSCs、miRNA-29b 转染的BMSCs、BMSCs 提取的外泌体和转染miRNA-29b 后从BMSCs 提取的外泌体对SCI 大鼠进行治疗,对比发现miRNA-29b 外泌体和miRNA-29b 转染的BMSCs 对SCI 大鼠的运动功能均有改善,且神经丝蛋白200(NF200)、生长相关蛋白43(GAP-43)增加,以及神经胶质原纤维酸性蛋白(GFAP)减少。统计分析发现,通过注射miRNA-29b 转染后提取的BMSCs外泌体比直接注射miRNA-29b转染的BMSCs恢复效果更显著(P<0.05)。提示miRNA-29b 是其中起作用的主要物质,且外泌体比直接移植干细胞疗效更佳。最近研究发现,转染miRNA-29b 的人神经上皮干细胞外泌体可以通过下调PTEN/caspase-3信号通路,进而抑制神经细胞的凋亡,促进SCI大鼠功能的恢复[22]。
2.1.4 其他外泌体miRNA 近两年来,越来越多的外泌体miRNAs被大家纳入研究,BMSCs来源的外泌体miRNA-544显著抑制了SCI后促炎细胞因子IL-1a、TNF-a、IL-17b和IL-36b的产生,表明外泌体miRNA-544 可以通过减轻SCI 后的炎症、促进神经元存活从而改善功能恢复[23]。LI 等[24]通过外泌体miRNA-124-3 实验发现,其通过调节内质网核心信号1(Ern1)和M2巨噬细胞的极化,减轻了脊髓缺血再灌注损伤(SCIRI)诱导的神经损伤。在2020年,ZHANG等[25]研究发现,骨髓源性巨噬细胞外泌体miRNA-421-3p可以结合到mTOR的3‘非翻译区(3’UTR)直接抑制雷帕霉素靶蛋白(mTOR),从而促进自噬、减少细胞凋亡、修复损伤的脊髓。ZHANG 等发现,外泌体中miRNA-338-5p 的过表达显著提高了神经丝蛋白-m(NF-m)和GAP-43的表达水平,降低了髓鞘相关糖蛋白(myelin associated glycoprotein,MAG)和胶质纤维酸性蛋白(glia fibrillary acidic protein,GFAP)的表达水平,从而促进轴突生长,促进功能恢复。同时体外发现,在外泌体中miRNA-338-5p 的过表达抑制了过氧化氢诱导的PC12细胞氧化应激损伤后的细胞凋亡,其潜在机制是miRNA-338-5p 通过激活PI3K/Akt 信号通路,从而抑制神经细胞的凋亡[26]。这些研究均提示外泌体miRNAs 对SCI具有修复作用,主要包括抑制细胞凋亡、减少脊髓生长的相关抑制因子、减轻炎症反应等机制来促进功能恢复,但具体信号通路尚不清楚,见表1。
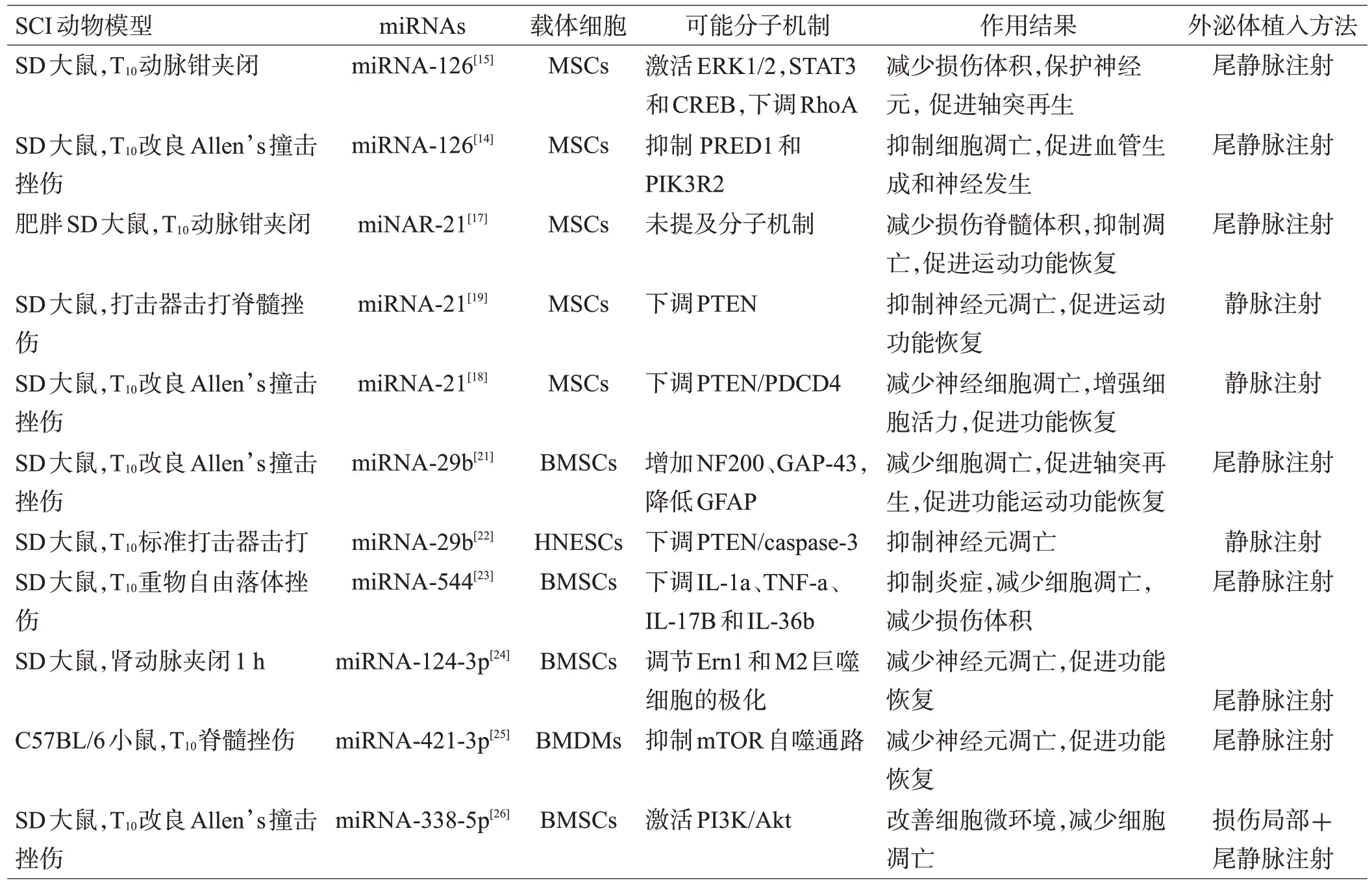
表1 外泌体miRNAs在SCI中的治疗作用
2.2 外泌体miRNAs对SCI的生物标志作用
目前SCI患者病情严重程度和预后判断的方法主要依靠美国SCI 协会(the American Spinal Injuries Association,ASIA)评分、神经系统体格检查及影像学检查。但ASIA 评分受到许多限制,如脊髓休克期、患者昏迷状态下均难以执行评估,同时存在主观性强以及费时等缺点。而连续的影像学检查对于患者来说是不现实的。因此,临床工作中需寻找易于检测且具有特异性的标志物来评估SCI 患者病情和临床预后。近年来随着对miRNAs 不断研究发现,它们在体液中相对稳定且具有组织特异性。因此,miRNAs 可能是一个非常好的候选标志物[27]。TIGCHELAAR[28]等研究发现,SCI 患者血清和脑脊液中分别有83个miRNAs和204个miRNAs在不同时期出现差异性表达,同时多种miRNAs与预后改善相关,其中miRNA-423-3p与半年后的功能恢复正相关。WANG等[29]纳入113例SCI后神经性疼痛患者的研究结果提示,miRNA-204-5p、miRNA-519d-3p、miRNA-20b-5p、miRNA-6838-5p 可能是SCI 患者的潜在生物标志物。
然而,外泌体miRNAs 广泛分布于体液中,相较于游离miRNAs 具有许多优点,如可以穿透血脑屏障、血脊髓屏障;外泌体的脂质双分子膜可以增强miRNAs 的稳定性,同时中枢神经系统中特定miRNAs 可被运输到外周循环并集中在外泌体中,从而提高检测时体液中miRNAs 扩增的敏感性以及降低出现假阴性结果的可能性[30,31]。DING 团队运用下一代测序对比分析了假手术组和SCI大鼠血清外泌体的miRNAs谱。结果显示,与对照组相比,SCI可导致血清外泌体miRNAs发生改变,其中98 个miRNAs 上调,43 个miRNAs 下调。这提示虽然单个miRNAs 可能缺乏特异性,但结合这些有价值的miRNAs,如miRNA-30b-5p、miRNA-152-3p、miRNA-200c-3p、miRNA-125b和miRNA-124-3p 形成检测谱对SCI 的诊断和预后具有重要意义[32]。KHAN等[33]发现,SCI小鼠模型血浆中外泌体miRNAs主要 包 括 :miRNA-93-5p、miRNA-486-5p、miRNA-21-5p、miRNA-29b-3p 和miNAR-206 在伤后发生了显著的变化,且其变化与炎症刺激后星形胶质细胞释放的外泌体miRNAs的变化相似。当将其注射到SCI 小鼠侧脑室时,增加了脑皮质的促炎基因及反应性星形胶质细胞基因的表达,提示SCI 后血浆外泌体可能与创伤后脑炎相关。提示这些改变的miRNAs及其相关分子机制也许可以解释SCI 的潜在病理机制,外泌体miRNAs不但可以作为SCI 早期的生物标志物,而且对相关机制研究以及治疗都有一定的启发作用。
3 小结与展望
综上所述,SCI 无论是对患者还是家庭和社会都产生不可忽视的影响。然而,目前尚无成功的临床治疗方法。外泌体miRNAs因其特有的稳定性、能通过血脑屏障和血脑脊髓屏障、广泛分布于各种体液等特点,逐渐成为医学研究的热点。外泌体miRNAs 与SCI 的多种病理生理密切相关,同时多项研究提示外泌体miRNAs 具有促进SCI 功能恢复的作用,同时具有帮助SCI早期诊断的生物标志作用。但目前外泌体miRNAs促进SCI 相关功能恢复的具体分子机制及信号通路尚不明确,且目前的研究都处于体内、体外模型实验阶段,运用到临床仍有许多问题亟待解决。在不久的将来,外泌体miRNAs 有望成为一种具有特异性且简便可行的新方法协助SCI 的早期诊断,也可能作为一种生物活性载体结合生物材料和药物等实现其对疾病的靶向治疗。
