头孢他啶阿维巴坦钠治疗碳青霉烯类耐药革兰氏阴性菌感染的疗效与安全性Δ
2023-08-31毛娇娇曹国文苏州大学附属第二医院药学部江苏苏州215004
毛娇娇,曹国文,朱 珠,陶 宏,许 峰 (苏州大学附属第二医院药学部,江苏 苏州 215004)
细菌耐药已成为威胁人类健康的主要因素之一。近年来,由于碳青霉烯类药物的广泛使用,碳青霉烯类耐药革兰氏阴性菌(carbapenem-resistant organism,CRO)检出率逐年增加。由于该类菌株可寄生于肠道长达数月,从而导致耐药菌在医院播散,最终引发院内感染[1—2],给临床治疗带来了巨大挑战。与碳青霉烯类敏感菌相比,CRO 感染的临床治疗负担更大,包括更长的住院时间、更高的感染相关死亡率和更高的医疗费用[3]。有研究表明,碳青霉烯类耐药是患者死亡的独立危险因素[4]。因此,有效的抗菌药物治疗是控制CRO 感染、提高患者生存率的关键,但目前用于CRO 感染的抗菌药物较少,且最优治疗策略的循证医学证据有限。
头孢他啶阿维巴坦钠(ceftazidime and avibactam sodium,CAZ/AVI)是一种新型的β-内酰胺酶抑制剂复合制剂[5]。相较于以往的β-内酰胺酶抑制剂,CAZ/AVI 具有独特的理化性质及空间构象,可发挥稳定、长效的抑菌作用[1]。除超广谱β-内酰胺酶(extended-spectrum beta-lactamases,ESBL)外,AVI 对AmpC 酶、OXA-48D类酶和肺炎克雷伯菌碳青霉烯酶(Klebsiella pneumoniaecarbapenemase,KPC)等均具有良好的抑制作用,是治疗CRO 感染的新选择。但目前国内对于CAZ/AVI治疗CRO感染的疗效与安全性尚未明确,基于此,本研究回顾性评价了CAZ/AVI治疗CRO感染的疗效与安全性,旨在为临床合理用药提供参考。
1 资料与方法
1.1 资料来源
回顾性收集2019 年9 月—2022 年3 月于苏州大学附属第二医院住院治疗的CRO感染患者的资料。本研究的纳入标准为:(1)年龄≥18 岁;(2)接受CAZ/AVI 或硫酸多黏菌素B治疗≥72 h;(3)至少培养出1种CRO菌株。本研究的排除标准为:(1)CRO定植菌(每株细菌由医师与临床药师根据宿主情况、细菌因素、抗菌药物影响等共同判断)携带者;(2)疾病处于终末期且存在严重不可逆并发症者;(3)数据缺失者。本研究方案经该院医学伦理委员会批准,审查决定号为JD-HG-2022-70。
根据上述标准,本研究最终纳入96 例患者,按治疗方案的不同分为对照组(48 例)和观察组(48 例)。两组患者的年龄、性别、急性生理与慢性健康Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHE Ⅱ)评分、序贯器官衰竭(sequential organ failure assessment,SOFA)评分、合并症、感染部位等基本资料比较,差异均无统计学意义(P>0.05),具有可比性。结果见表1。
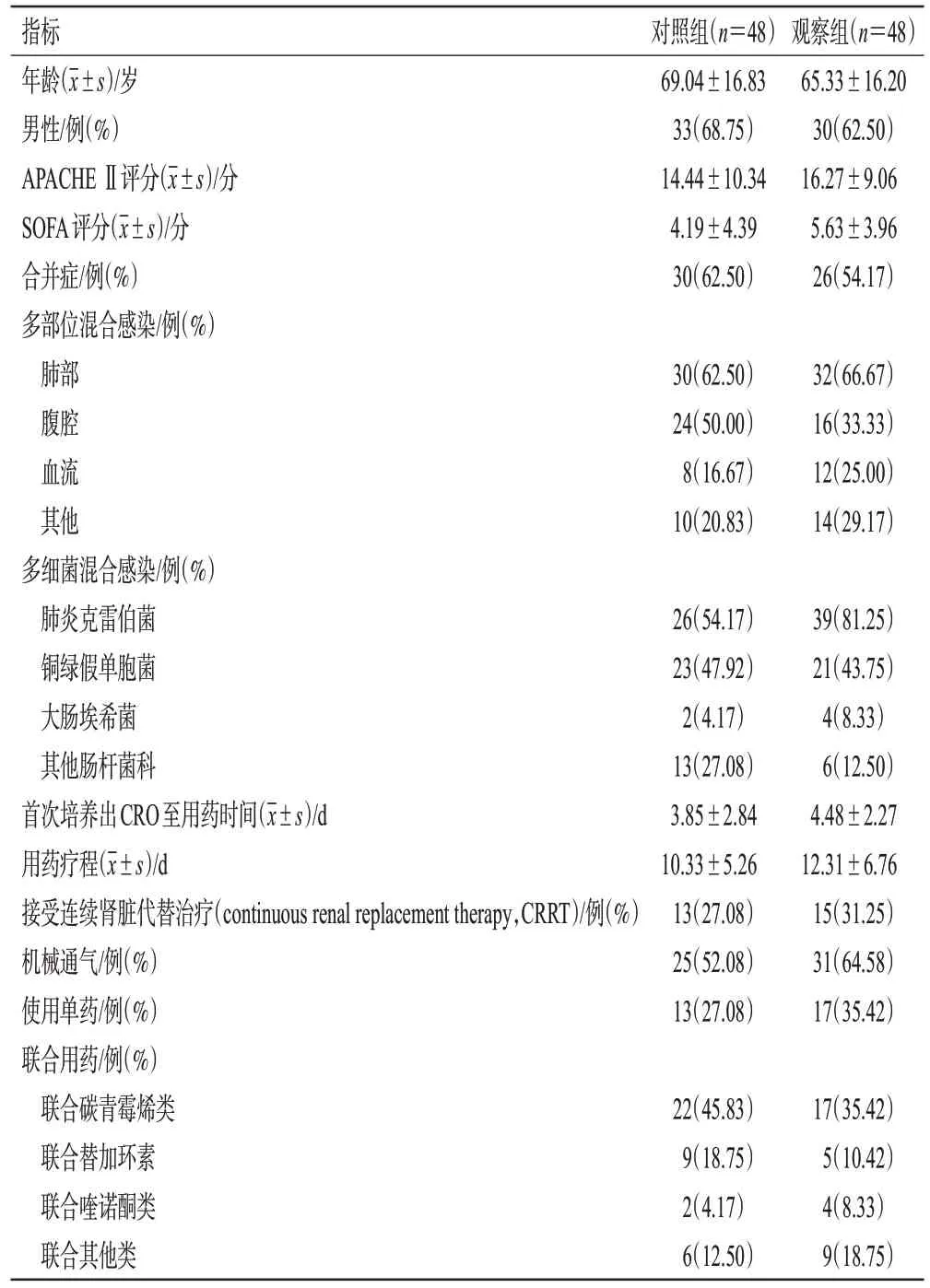
表1 两组患者基本资料比较
1.2 治疗方案
对照组患者静脉滴注注射用硫酸多黏菌素B(上海上药第一生化药业有限公司,国药准字H31022631,规格50万单位)50万单位,q12 h;肾功能不全或接受CRRT者均不进行剂量调整。观察组患者以微量泵持续静脉泵入注射用CAZ/AVI(意大利ACS Dobfar S.p.A.,注册证号H20190038,规格2.5 g)2.5 g,q8 h,持续2 h;肾功能不全者根据肌酐清除率调整剂量,接受CRRT者不进行剂量调整。两组均有患者联合使用了其他抗CRO感染药物,如碳青霉烯类、替加环素等。
1.3 疗效评定标准
1.3.1 临床疗效
根据《抗菌药物临床试验技术指导原则》将临床疗效分为——(1)有效:症状、体征、病原微生物学和各项检验、检查指标均明显好转;(2)无效:患者病情未改善或加重,需更换其他抗菌药物[6]。有效率=有效例数/总例数×100%。
1.3.2 微生物学疗效
根据《抗菌药物临床试验技术指导原则》将微生物学疗效分为——(1)清除:用药后感染部位未培养出原病原菌;(2)部分清除:用药后感染部位有1种或多种病原菌被清除,或病原菌菌量明显减少;(3)假定清除:用药后症状、体征消失,但未获得标本培养结果;(4)未清除:用药后感染部位仍培养出原病原菌或其他新的病原菌,且菌量未减少或增加;(5)假定未清除:无效且未获得标本培养结果[6]。微生物清除率=(清除例数+部分清除例数+假定清除例数)/总例数×100%。
1.4 观察指标
观察两组患者治疗前和治疗后(停药后3 d)的体温、白细胞(white blood cell,WBC)、C 反应蛋白(Creactive protein,CRP)、降钙素原(procalcitonin,PCT);停药后28 d,观察两组患者的预后情况,包括康复出院、转普通病房、死亡情况;记录两组患者治疗期间腹泻、药物性肝损伤、急性肾损伤、神经系统异常等不良反应的发生情况。
1.5 统计学方法
采用SPSS 26.0软件对数据进行统计分析。计量资料以±s表示,组间比较采用t检验或秩和检验;计数资料以率表示,采用χ2检验。采用Logistic 回归分析影响疗效的因素。检验水准α=0.05。
2 结果
2.1 两组患者的临床疗效比较
观察组中有33例患者为有效,有效率为68.75%;对照组中有23例患者为有效,有效率为47.92%;观察组患者的有效率显著高于对照组(P=0.038)。
2.2 两组患者的微生物学疗效比较
观察组患者的微生物清除率显著高于对照组(P=0.021),结果见表2。此外,观察组未清除患者中有1 例检出CAZ/AVI耐药菌株,对照组患者未检出多黏菌素B耐药菌株。
2.3 两组患者治疗前后体温、WBC、PCT、CRP比较
治疗前,两组患者的体温、WBC、PCT、CRP比较,差异均无统计学意义(P>0.05)。治疗后,两组患者的体温、PCT、CRP均显著低于同组治疗前,且观察组CRP显著低于同期对照组(P<0.05);两组患者治疗后的WBC比较,差异无统计学意义(P>0.05)。结果见表3。
表3 两组患者治疗前后体温、WBC、PCT、CRP 比较(±s)

表3 两组患者治疗前后体温、WBC、PCT、CRP 比较(±s)
a:与同组治疗前比较,P<0.05;b:与同期对照组比较,P<0.05。
组别对照组(n=48)观察组(n=48)CRP/(mg/L)126.08±81.53 79.08±46.14a 158.74±85.28 40.57±43.26ab时间点治疗前治疗后治疗前治疗后体温/℃38.17±1.13 37.45±0.88a 37.85±0.92 37.06±0.71a WBC/(×109 L—1)11.73±6.62 10.50±3.69 11.78±8.82 10.04±2.76 PCT/(ng/mL)7.54±16.00 0.71±0.72a 10.19±21.30 1.15±1.14a
2.4 两组患者预后情况比较
治疗28 d后,两组的康复出院、转普通病房、死亡患者比例比较,差异均无统计学意义(P>0.05)。结果见表4。

表4 两组患者预后情况比较[例(%)]
2.5 两组患者不良反应发生情况比较
治疗期间,两组患者腹泻、药物性肝损伤、急性肾损伤、神经系统异常发生率及总不良反应发生率比较,差异均无统计学意义(P>0.05)。结果见表5。
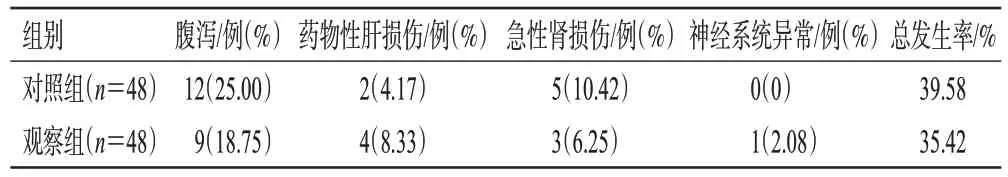
表5 两组患者不良反应发生率比较
2.6 影响疗效的因素分析
根据临床疗效将患者分为有效组(56 例)和无效组(40例),以患者年龄、性别、合并症等为指标进行单因素分析。结果显示,高龄、肺部感染、接受CRRT及单药治疗可能是导致CRO感染治疗无效的危险因素(P<0.05),使用CAZ/AVI、延长用药疗程、联合碳青霉烯类可能是提高治疗有效率的有利因素(P<0.05)。结果见表6。
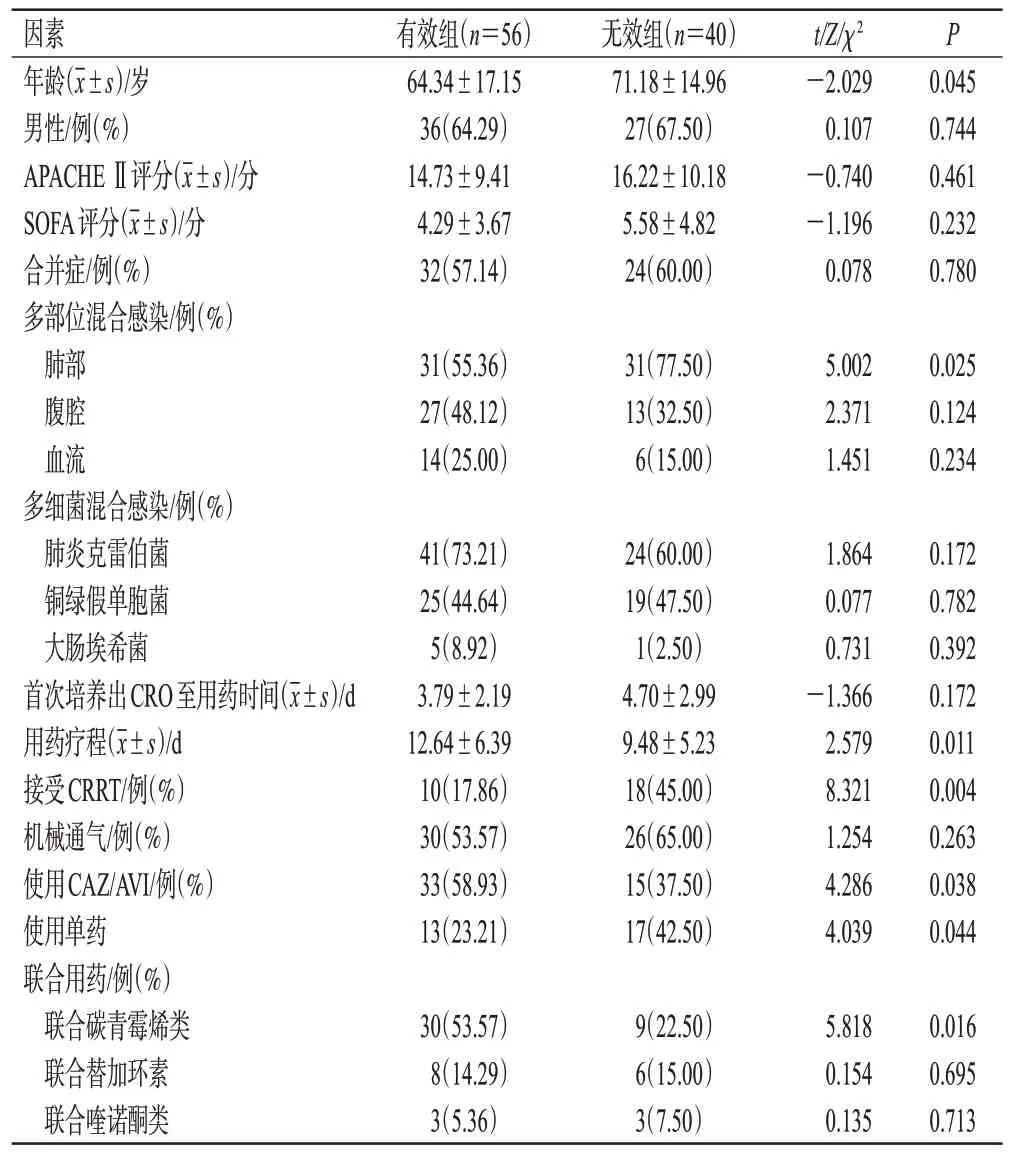
表6 影响疗效的单因素分析结果
将上述分析中差异有统计学意义的因素纳入Logistic 回归分析,结果显示,肺部感染、接受CRRT 治疗可能是导致CRO 感染治疗失败的独立危险因素,使用CAZ/AVI、延长用药疗程可能实现临床获益。结果见表7。

表7 影响疗效的多因素Logistic回归分析结果
3 讨论
美国疾病控制与预防中心的研究数据表明,美国每年约有280 万例耐药菌感染患者,其中约有3.5 万人死亡[7]。近年来,我国CRO 检出率逐年增加[8]。2022 年CHINET 监测网最新数据显示,碳青霉烯类耐药肺炎克雷伯菌(carbapenem-resistantKlebsiella pneumoniae,CRKP)的检出率已从2005 年的2.9%上升至2022 年的27.5%(耐美罗培南数据)[9]。目前,用于治疗CRO 感染的抗菌药物较少,可能有效的药物主要包括CAZ/AVI、多黏菌素和替加环素等。CAZ/AVI 是于2015 年2 月由美国FDA批准上市的新型β-内酰胺酶抑制剂复合制剂。1 项CAZ/AVI 用于严重革兰氏阴性菌感染患者的Meta分析(12 项研究、4 951 例患者)结果显示,与碳青霉烯类、黏菌素类比较,CAZ/AVI能显著降低患者病死率,提高临床疗效[10],但纳入研究的病原菌大多不是CRO 菌株,参考价值有限。CAZ/AVI 在我国上市时间较短,用于CRO 感染的临床数据有限,故该药能否成为治疗CRO感染的新选择尚需进一步研究。
本研究结果显示,观察组患者的有效率和微生物清除率均显著高于对照组,且治疗后两组患者的体温、PCT、CRP均显著降低,且观察组CRP显著低于对照组,表明CAZ/AVI在治疗CRO感染方面的效果可能优于多黏菌素B。1 项回顾性研究纳入了37 例接受CAZ/AVI治疗的CRO 感染患者,其临床有效率为59%[11],略低于本研究的68.75%,这可能与上述文献纳入的患者中有30%为实体移植者,免疫功能较低,存在反复感染和尿路定植,且有30%的抗微生物治疗失败患者存在CAZ/AVI耐药有关。1项CAZ/AVI和多黏菌素治疗CRKP感染的疗效比较研究表明,使用CAZ/AVI或多黏菌素者的30 d 病死率分别为8%、33%,CAZ/AVI 组患者的病死率低于多黏菌素组[12],也低于本研究的死亡患者比例。其原因可能与纳入患者的致病菌种类存在差异有关:本研究除CRKP感染患者外,还纳入了耐碳青霉烯类铜绿假单胞菌感染患者,这可能会导致死亡风险增加。在安全性方面,两组患者的总不良反应发生率比较,差异无统计学意义,提示两药的安全性相当。
Logistic 回归分析结果显示,肺部感染、接受CRRT治疗可能是导致CRO 感染治疗失败的独立危险因素。研究指出,药物在肺泡上皮衬液中的平均浓度远低于血浆浓度[13—14],未达到CRO抗菌治疗目标浓度可能是肺部感染患者疗效欠佳的原因。重症患者体内药物的分布容积较大,接受CRRT时药物清除率高,体内药物暴露不足,也可能导致疗效降低。此外,本研究还发现,延长用药疗程可能实现临床获益。既往有文献报道,4~9 d的短疗程治疗会显著增加患者的病死率[15]。本研究中,无效组患者的平均用药疗程为9.48 d,与既往研究相似。但用药疗程受多种因素影响,盲目延长用药疗程可能会导致治疗过度,抗菌药物选择压力过大,而疗程不足又会导致治疗失败,临床应权衡利弊后谨慎选择。
已有多个文献、指南推荐联合用药用于改善CRO感染患者的临床结局和防止耐药的发生[1,8,16—17],且联合用药与患者较低的病死率相关[18]。本研究的单因素分析结果显示,联合碳青霉烯类药物可能具有更好的临床疗效。国内报道指出,对于产KPC 的肠杆菌科细菌感染,CAZ/AVI 联合美罗培南可能更有效,提示CAZ/AVI联合碳青霉类药物可能对CRO感染治疗有益[19]。
综上所述,CAZ/AVI 治疗CRO 感染的疗效和安全性均较好,适当延长用药疗程可能会获得更高的有效率,而肺部感染或接受CRRT可能会导致治疗失败。本研究的局限性为:(1)本文为回顾性研究,研究对象并未随机分配;(2)CAZ/AVI的临床应用时间较短,纳入的患者样本量有限,且用药初期未常规开展CAZ/AVI药敏试验,故尚不能明确治疗无效的患者是否存在耐药。
