毛蕊异黄酮对脑出血后继发急性炎症损伤的改善作用及机制Δ
2023-08-31柳晓蕊许智朝王兆涛张媚媚简晓顺彭怀东广州医科大学附属肿瘤医院药学部广州50095广州医科大学附属第二医院神经外科广州5060广州医科大学附属第二医院药学部广州5060
柳晓蕊 ,许智朝 ,王兆涛 ,张媚媚 ,简晓顺 ,彭怀东 (.广州医科大学附属肿瘤医院药学部,广州 50095;.广州医科大学附属第二医院神经外科,广州 5060;.广州医科大学附属第二医院药学部,广州 5060)
脑出血是指非外伤导致的脑实质内血管破裂出血,具有高发病率、高致残率和高病死率等特点[1]。在脑出血的急性期,过度的炎症反应会导致小胶质细胞过度活化,进而产生大量毒性促炎因子,破坏血脑屏障并加剧脑水肿,最终导致神经元凋亡[2—3]。因此,抑制脑出血后急性期过度的炎症反应可能是治疗脑出血的有效途径[4]。脑出血后的炎症损伤机制十分复杂,涉及多个分子和信号通路。其中,Toll样受体4(Toll-like receptor 4,TLR4)是一种保守的天然免疫受体,在脑出血后的炎症反应中具有重要作用,其表达下调与抑制脑出血后炎症反应有关,是治疗脑出血的有效手段[5—6]。毛蕊异黄酮(calycosin,CA)是从中药材黄芪中提取的黄酮类成分,具有抗炎、抗氧化作用,对受损脑组织具有保护的作用[7—8]。基于此,本研究通过构建脑出血小鼠模型,初步探讨CA 对脑出血的改善作用,并通过体外培养原代小胶质细胞和原代神经元进一步探讨该成分是否能通过抑制TLR4 表达而减轻脑出血后继发的急性炎症损伤,为进一步开发CA用于临床治疗脑出血提供实验基础。
1 材料
1.1 主要仪器
68025型脑立体定位仪购自深圳市瑞沃德生命科技有限公司;2406-2 型细胞CO2培养箱购自美国Thermo Fisher Scientific公司;LX71型荧光倒置显微镜购自日本Olympus 公司;LB 942 型多功能酶标仪购自德国Berthold Technologies 公司;Transwell 板(12 孔,孔径0.4 μm)购自美国Corning公司;ChemiScope 6100型荧光及化学发光成像系统购自上海勤翔科学仪器有限公司。
1.2 主要药品与试剂
CA 对照品(货号WXHY-000687,纯度>98%)购自天津万象恒远科技有限公司;磷酸盐缓冲液(PBS)、牛血清白蛋白(BSA)、Ⅶ型胶原酶(货号分别为E607008、A600332、A005332)均购自生工生物工程(上海)股份有限公司;DMEM 高糖培养基、胎牛血清(FBS)、B27 添加剂、Neurobasal培养基(货号分别为11995040、10099141、17504044、21103049)均购自美国Gibco 公司;一步法TUNEL 细胞凋亡检测试剂盒、Triton X-100 试剂、鼠源β-actin 单克隆抗体、红细胞(RBC)裂解液(货号分别为C1088、P0096、AA128、C3702)均购自上海碧云天生物技术有限公司;ACCUTASE 细胞消化液、多聚甲醛(货号分别为A6964、P6148)均购自美国Sigma公司;兔源离子钙结合衔接分子1(ionized calcium-binding adaptor molecule 1,Iba1)多克隆抗体(货号019-19741)购自日本WAKO公司;兔源TLR4、白细胞介素1β(interleukin-1β,IL-1β)、神经元特异性核蛋白(neuron specific nuclear protein,NeuN)多克隆抗体(货号分别为ab13556、ab1234437、ab104225)均购自英国Abcam 公司;兔源肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、诱导型一氧化氮合酶(inducible nitric-oxide synthase,iNOS)多克隆抗体和Alexa Fluor 555 标记的驴抗兔IgG 二抗(货号分别为11948S、13120S、4413)均购自美国Cell Signaling Technology 公司;辣根过氧化物酶标记的山羊抗小鼠IgG 二抗、辣根过氧化物酶标记的山羊抗兔IgG二抗(货号分别为115-035-146、111-035-003)均购自美国Jackson ImmunoResearch 公司;4′,6-二脒基-2 苯基吲哚(DAPI)、RIPA裂解和提取缓冲液(货号分别为62248、89900)均购自美国Thermo Fisher Scientific公司。
1.3 实验动物
SPF级C57BL/6小鼠(雄性,体重22~25 g,8~10周龄)、孕小鼠(体重40~48 g,8 周龄,其出生1~3 d 的乳鼠用于提取原代小胶质细胞)均购自广东省医学实验动物中心,动物生产许可证号为SCXK(粤)2018-0002。所有动物均饲养于广州医科大学附属第二医院实验动物中心(环境温度20~26 ℃,相对湿度40%~70%,12 h/12 h明暗交替),自由摄食、饮水。本实验方案经广州医科大学附属第二医院动物伦理委员会审查批准(审查编号A2021-006)。
2 方法
2.1 CA药液的配制
取CA对照品适量,溶于二甲基亚砜(DMSO)中,配制成CA储备液。取上述CA储备液适量,用9倍体积的PBS 稀释至DMSO 含量为1%。根据实验需要,再用PBS或培养基稀释成所需的浓度。
2.2 体内动物实验
2.2.1 小鼠分组、脑出血模型的构建和给药
将雄性小鼠随机分为假手术组、模型组和不同剂量CA组。脑出血模型的制备参考文献方法[9]:将小鼠用异氟醚麻醉后固定于脑立体定位仪(脑立体定位仪坐标为前囟右侧2.0 mm,前囟前0.5 mm,腹侧2.8 mm)上,将0.2 U的Ⅶ型胶原酶(0.5 μL)缓慢注射到右侧基底节区,注射时间为1 min;假手术组小鼠同法注射PBS(0.5 μL)。注射后,针头于注射部位保持5 min后拔出,用骨蜡密封,再用丝线缝合。上述过程中,小鼠体温应维持在37 ℃左右,并于术后自由摄食、饮水。以小鼠苏醒后行为和功能异常,且改良神经功能缺损程度(modified neurological severity score,mNSS)评分明显下降为造模成功[10]。在诱导脑出血20 min后,假手术组和模型组小鼠一次性腹膜内注射PBS,不同剂量CA 组小鼠分别一次性注射相应剂量的药物(根据前期预实验设置给药剂量分别为15、30、60、120 mg/kg)。小鼠脑出血造模实验平行2 批进行,每批每组12 只(其中2~3 只备用):第1批小鼠用于mNSS评分、脑出血体积计算和脑含水量测量实验,第2批小鼠用于其余实验。
2.2.2 小鼠mNSS评分的测定
取假手术组、模型组和15、30、60、120 mg/kg CA 组小鼠各8只(第1批编号前8只),分别于手术24、48、72 h后对其进行mNSS 评分。mNSS 评分由运动实验,感觉实验,反射丧失和不正常运动,以及癫病、肌阵挛、肌张力障碍4个部分组成,4个部分得分相加即为总分(最高18分),总分越高则神经功能缺损越严重[10]。
2.2.3 小鼠脑出血体积的计算
取假手术组、模型组和30、60 mg/kg CA组(CA组剂量参考“2.2.2”项下结果设置,下同)小鼠各4 只(第1 批编号前4只),于手术72 h后处死,取出脑组织,用PBS稀释的4%多聚甲醛固定后,制备连续脑切片(厚度约1 mm)并进行数字摄影,使用Image-Pro Plus(Media Cybernetics)软件计算脑出血体积:脑出血体积=每个切片血凝块面积×切片厚度。
2.2.4 小鼠脑含水量的测定
取假手术组、模型组和30、60 mg/kg CA 组小鼠各5只(第1 批编号第5~9 只),于手术72 h 后处死,迅速取出脑组织并称重,得湿重;随后,将脑组织于160 ℃下干燥24 h,再次称重,得干重,按下式计算脑含水量:脑含水量(%)=(湿重—干重)/湿重×100%。
2.2.5 小鼠脑组织中Iba1蛋白表达阳性率的检测
采用免疫荧光染色法进行检测。取假手术组、模型组和30、60 mg/kg CA 组小鼠各3 只(第2 批编号前3只),于手术72 h后处死,取出脑组织,经固定、脱水后切片(厚度约15 μm)。上述切片用PBS 稀释的3%Triton X-100试剂在室温下孵育15 min,洗涤后再用PBS稀释的5%BSA封闭1 h;加入Iba1一抗(稀释比例为1∶1 000),于4 ℃下孵育过夜;加入Alexa Fluor 555 标记的IgG 二抗(稀释比例为1∶ 1 000),在室温下孵育2 h;用PBS洗涤3次,用DAPI 复染细胞核10 min,封片后使用显微镜观察。除假手术组选择小鼠大脑右侧基底节区的脑组织外,其余各组随机选择每张切片脑出血病变及周边区域(包括脑出血损伤周围1 mm区域)5个不重叠的高倍(×200)视野拍摄,计算每个视野中被染成红色的细胞数与被染成蓝色的有核细胞数的比值,其平均值即为Iba1蛋白的表达阳性率,以该表达阳性率表示小胶质细胞的激活程度。
2.2.6 小鼠脑组织中TLR4及其下游炎症因子蛋白表达的检测
采用蛋白质印迹法进行检测。取假手术组、模型组和30、60 mg/kg CA 组小鼠各4 只(第2 批编号第4~7只),于手术72 h 后处死,取出脑组织,除假手术组选择小鼠大脑右侧基底节区的脑组织外,其余各组选择小鼠脑出血病变及周边区域脑组织(包括脑出血损伤周围1 mm区域),用RIPA裂解,收集蛋白样品;以BCA法测定蛋白浓度后,于100 ℃变性5 min;取变性蛋白样品(30 μg)进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,并转移到聚偏二氟乙烯膜上,用含5%BSA 的1×TBST 缓冲液于室温下封闭1 h;加入TLR4、TNF-α、iNOS、IL-1β、β-actin 一抗(稀释比例均为1∶1 000),于4 ℃下孵育过夜;加入相应IgG 二抗(稀释比例均为1∶10 000),孵育1 h;以ECL 试剂显色后,使用荧光及化学发光成像系统成像。采用Image J软件分析蛋白条带灰度值,计算目标蛋白与内参蛋白(β-actin)的条带灰度值比值,再以假手术组为标准作归一化处理,即得目标蛋白的相对表达水平。
2.2.7 小鼠脑组织中凋亡细胞阳性率的检测
采用凋亡染色法进行检测。取假手术组、模型组和30、60 mg/kg CA 组小鼠各3 只(第2 批编号第8~10只),于手术72 h 后处死,取出脑组织并制作脑冰冻切片。将上述切片放至湿盒中复温后,用PBS洗涤2次,再用4%多聚甲醛固定30 min;用PBS 洗涤2 次,加入PBS稀释的0.5%Triton X-100 试剂,于室温下孵育5 min;用PBS 洗涤2 次,加入TUNEL 检测液,于37 ℃下孵育60 min;用DAPI 室温避光孵育5 min;用PBS 洗涤4 次,滴加含荧光淬灭剂的封片剂后封片,使用显微镜观察。除假手术组选择小鼠大脑右侧基底节区的脑组织外,其余各组随机选取每张切片脑出血病变及周边区域(包括脑出血损伤周围1 mm 区域)5 个不重叠的高倍(×200)视野拍摄,计算每个视野中被染成绿色的细胞数与被染成蓝色的有核细胞数的比值,其平均值即为凋亡细胞阳性率,以该阳性率表示细胞的凋亡程度。
2.3 体外细胞验证实验
2.3.1 原代小胶质细胞中TLR4及其下游炎症因子蛋白表达的检测
取刚出生1~3 d的C57BL/6乳鼠,分离出其大脑皮层。将皮层组织在含有20%FBS和1%青-链霉素双抗的DMEM高糖培养基中剪碎,用含有100 U/mL DNA酶Ⅰ的ACCUTASE 细胞消化液消化并重悬后,将所得细胞接种到聚-D-赖氨酸包被的培养瓶中,于37 ℃、5%CO2条件下培养7 d;分离杂质并更换培养基,继续培养10~14 d,收集小胶质细胞。将小胶质细胞以每孔100 000个接种于6 孔板中,分为对照组、RBC 组和20、40 μmol/L CA组(根据前期预实验结果设置药物浓度)。RBC组细胞加入1 μg/mL的RBC裂解液以模拟体内脑出血状态,CA组细胞加入RBC裂解液和相应浓度的药液;培养72 h后,收集各组细胞,按“2.2.6”项下蛋白质印迹法检测各组细胞中TLR4、TNF-α、iNOS、IL-1β蛋白的相对表达水平。上述实验重复4次。
2.3.2 原代神经元与原代小胶质细胞共培养中神经元凋亡程度的检测
从15~18 d孕龄的C57BL/6孕小鼠中取出胚胎,分离出胚胎鼠的大脑皮层。将皮层组织在含有20%FBS的DMEM高糖培养基中剪碎,用含有100 U/mL DNA酶Ⅰ的ACCUTASE细胞消化液消化并重悬后离心、过滤;用含有2%B27和1%谷氨酰胺的Neurobasal培养基重悬后,将所得神经元接种到聚-D-赖氨酸包被的12 孔板中。原代小胶质细胞提取和培养同“2.3.1”项下。使用Transwell小室共培养原代神经元和原代小胶质细胞:在Transwell上室接种20 000个原代小胶质细胞,下室接种10 000个原代神经元。按“2.3.1”项下分组和给药,培养72 h后弃去培养基,细胞用4%多聚甲醛固定30 min后,用PBS 稀释的0.3%Triton X-100 通透20 min;用PBS 洗涤后,用含5%BSA 的PBS 封闭1 h;加入NeuN 一抗(稀释比例为1∶1 000),于4 ℃下孵育过夜;加入Alexa Fluor 555标记的IgG二抗(稀释比例为1∶1 000),继续孵育2 h;用PBS 洗涤3 次后,滴加DAPI 避光孵育5 min,PBS 洗涤后封片并使用显微镜观察。随机选取每张荧光染色图片5个不重叠的高倍(×200)视野拍摄,计算每个视野中被染成红色的细胞数与被染成蓝色的有核细胞数的比值,其平均值即为原代神经元的存活率。上述实验重复3次。
2.4 统计学方法
采用SPSS 20.0软件对数据进行统计分析。计量资料均以±s表示,多组间比较采用One-way ANOVA 分析,进一步两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 体内动物实验结果
3.1.1 CA对小鼠mNSS评分的影响
手术24、48、72 h 后,15 mg/kg CA 组小鼠的mNSS评分与模型组比较,差异均无统计学意义(P>0.05);30、60、120 mg/kg CA 组小鼠的mNSS 评分均较模型组显著降低(P<0.05),结果见图1。120 mg/kg CA组小鼠的mNSS评分与60 mg/kg CA组差异较小,因此选取30、60 mg/kg作为CA的干预剂量进行后续实验。
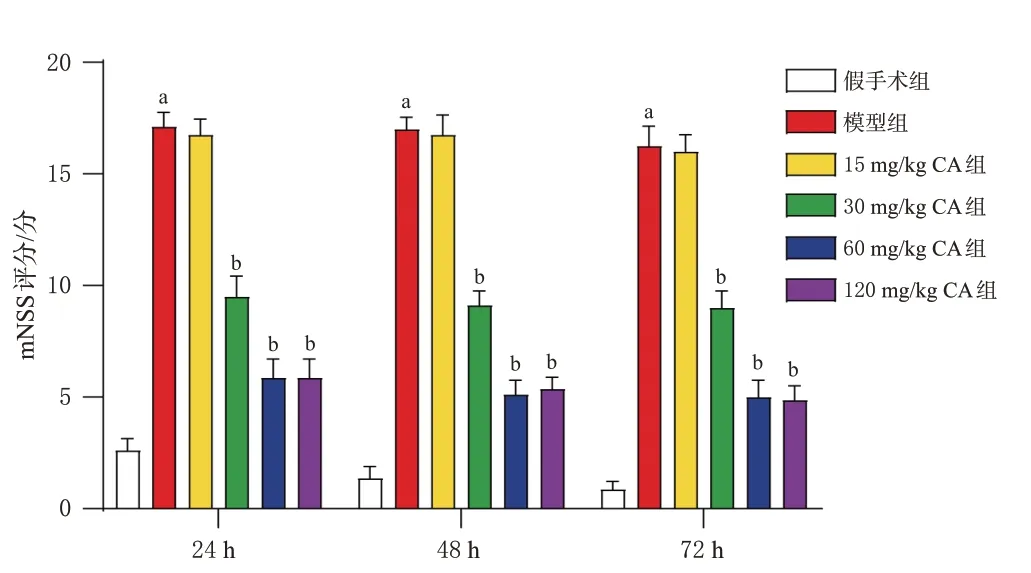
图1 CA对小鼠脑出血后mNSS评分的影响(±s,n=8)
3.1.2 CA对小鼠脑出血体积和脑含水量的影响
假手术组小鼠无明显的脑出血区域;与假手术组比较,模型组小鼠可见脑出血现象,其脑出血体积为(7.82±0.52)mm3;与模型组比较,30、60 mg/kg CA 组小鼠的脑出血区域有所缩小,其脑出血体积[分别为(4.81±0.26)mm3、(2.33±0.19)mm3]均显著降低(P<0.05)。结果见图2。

图2 各组小鼠代表性脑切片图
与假手术组小鼠的脑含水量[(78.22±1.66)%]比较,模型组小鼠的脑含水量[(85.22±2.85)%]显著升高(P<0.05);与模型组比较,30、60 mg/kg CA组小鼠的脑含水量[分别为(81.12±2.63)%、(80.26±2.59)%]均显著降低(P<0.05)。
3.1.3 CA对小鼠脑组织中Iba1蛋白表达的影响
与假手术组小鼠脑组织中Iba1 蛋白的表达阳性率[(4.84±0.78)%]比较,模型组小鼠脑组织中Iba1蛋白呈聚集现象,其表达阳性率[(42.18±2.32)%]显著升高(P<0.05);与模型组比较,30、60 mg/kg CA组小鼠脑组织中Iba1蛋白有所减少,其表达阳性率[分别为(17.38±1.86)%、(9.27±1.61)%]均显著降低(P<0.05)。结果见图3。
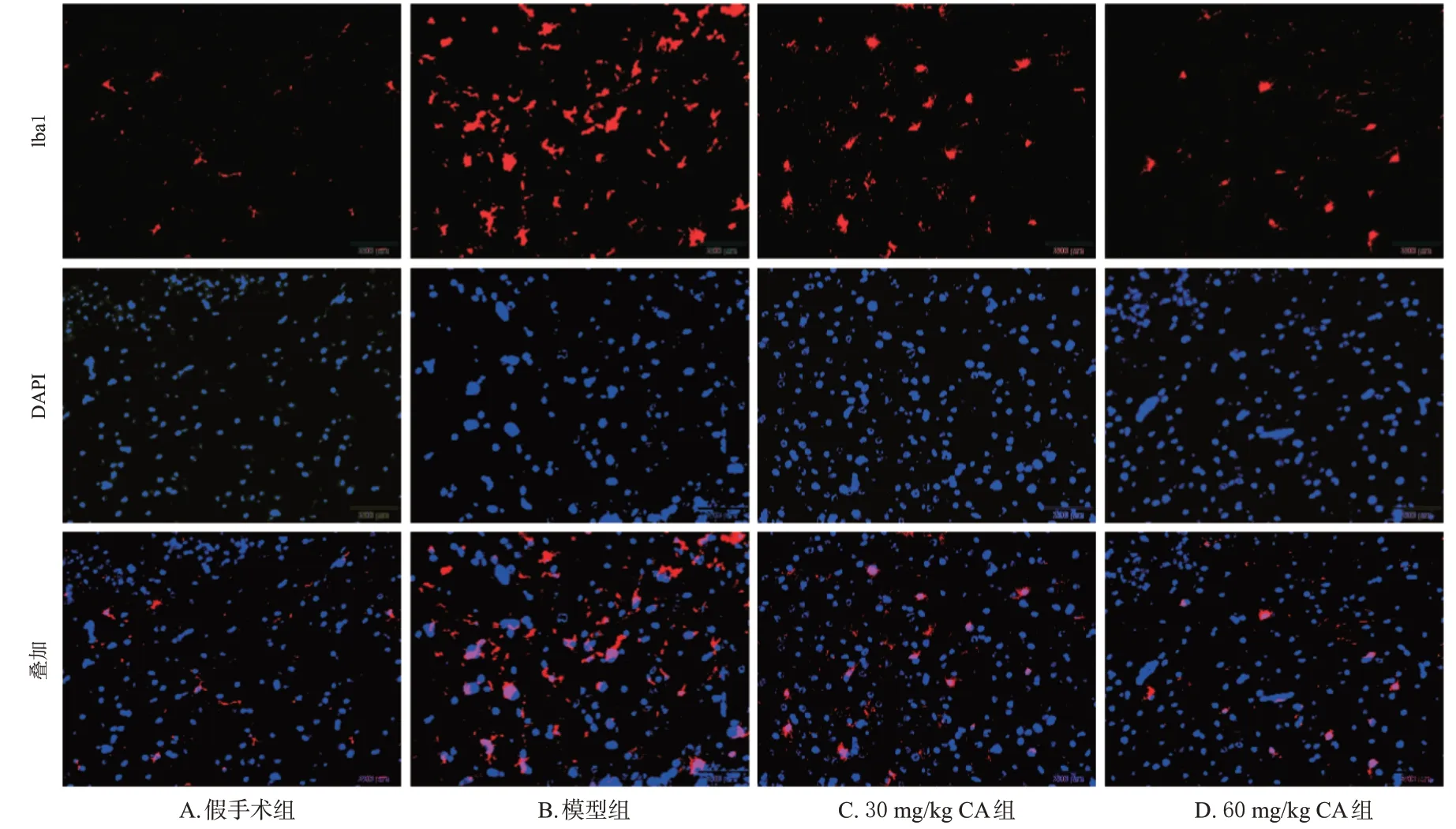
图3 CA对小鼠脑组织中小胶质细胞激活影响的免疫荧光染色图(Iba1标记,×200)
3.1.4 CA 对小鼠脑组织中TLR4 及其下游炎症因子表达的影响
与假手术组比较,模型组小鼠脑组织中TLR4 及其下游炎症因子TNF-α、iNOS、IL-1β蛋白的相对表达水平均显著升高(P<0.05);与模型组比较,30、60 mg/kg CA组小鼠脑组织中上述蛋白的相对表达水平均显著降低(P<0.05)。结果见图4。
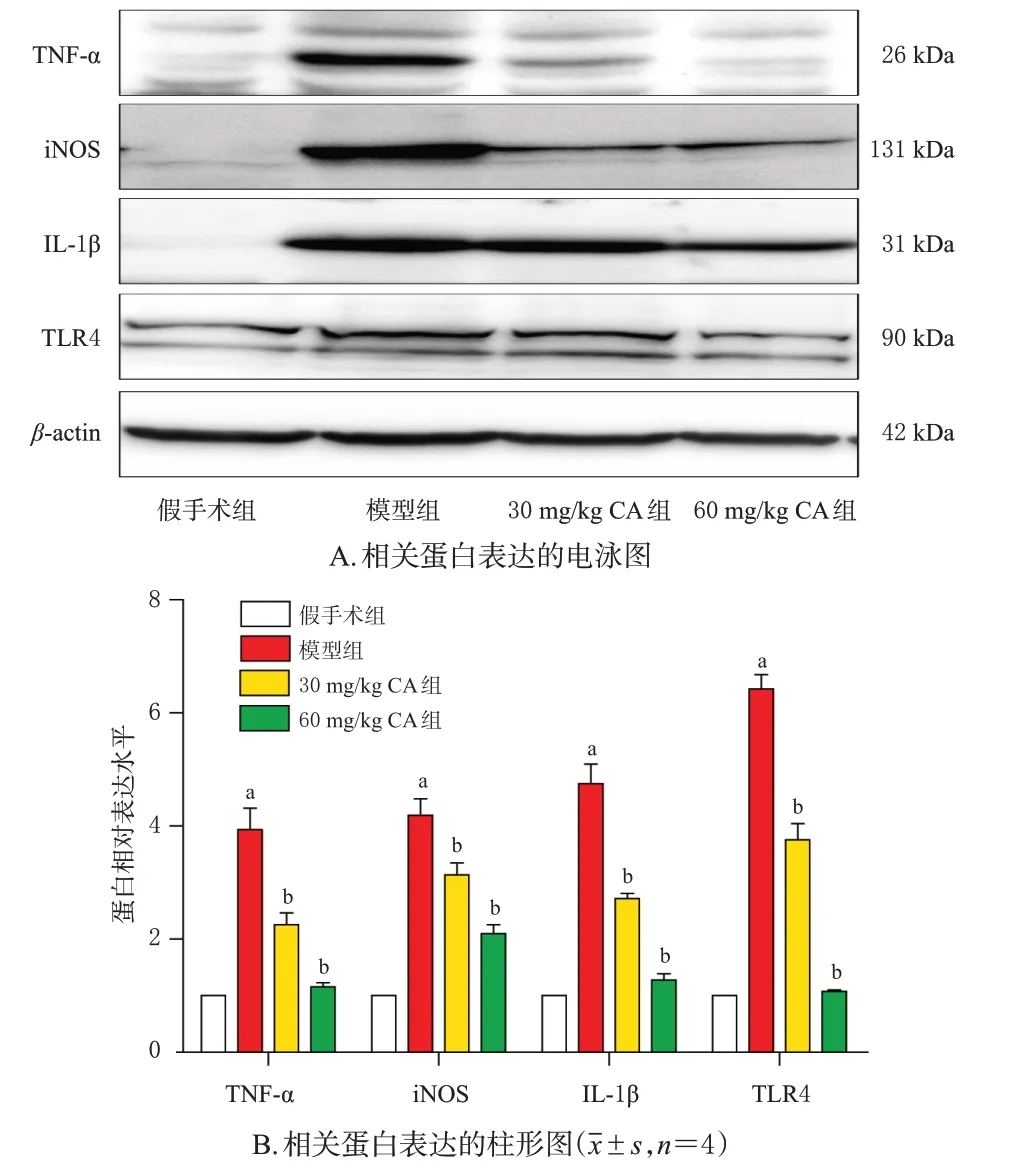
图4 CA 对小鼠脑组织中TLR4 及其下游炎症因子蛋白表达的影响
3.1.5 CA对小鼠脑组织细胞凋亡的影响
与假手术组小鼠脑组织中凋亡细胞阳性率[(4.74±0.57)%]比较,模型组小鼠相应部位凋亡细胞增多,凋亡细胞阳性率[(45.18±2.74)%]显著升高(P<0.05);与模型组比较,30、60 mg/kg CA组小鼠相应部位凋亡细胞减少,凋亡细胞阳性率[分别为(23.38±1.86)%、(10.87±2.04)%]均显著降低(P<0.05)。结果见图5。

图5 CA对小鼠脑组织细胞凋亡的影响(TUNEL染色,×200)
3.2 体外细胞验证实验结果
3.2.1 CA 对原代小胶质细胞中TLR4 及其下游炎症因子蛋白表达的影响
与对照组比较,RBC 组细胞中TLR4 及其下游炎症因子TNF-α、iNOS和IL-1β蛋白的相对表达水平均显著上升(P<0.05);与RBC 组比较,20、40 μmol/L CA 组细胞中TLR4 及其下游炎症因子TNF-α、iNOS 和IL-1β 蛋白的相对表达水平均显著下降(P<0.05),结果见图6。
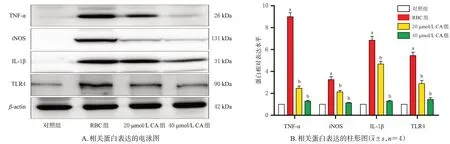
图6 CA对原代小胶质细胞中TLR4及其下游炎症因子蛋白表达的影响
3.2.2 CA对原代神经元和原代小胶质细胞共培养体系中神经元凋亡的影响
与对照组共培养体系中神经元的存活率[(88.15±4.42)%]比较,RBC 组共培养体系中神经元的存活率[(32.85±3.45)%]显著降低(P<0.05);而与RBC 组比较,20、40 μmol/L CA 组共培养体系中神经元的存活率[分别为(53.38±4.57)%、(69.94±4.66)%]均显著升高(P<0.05)。结果见图7。
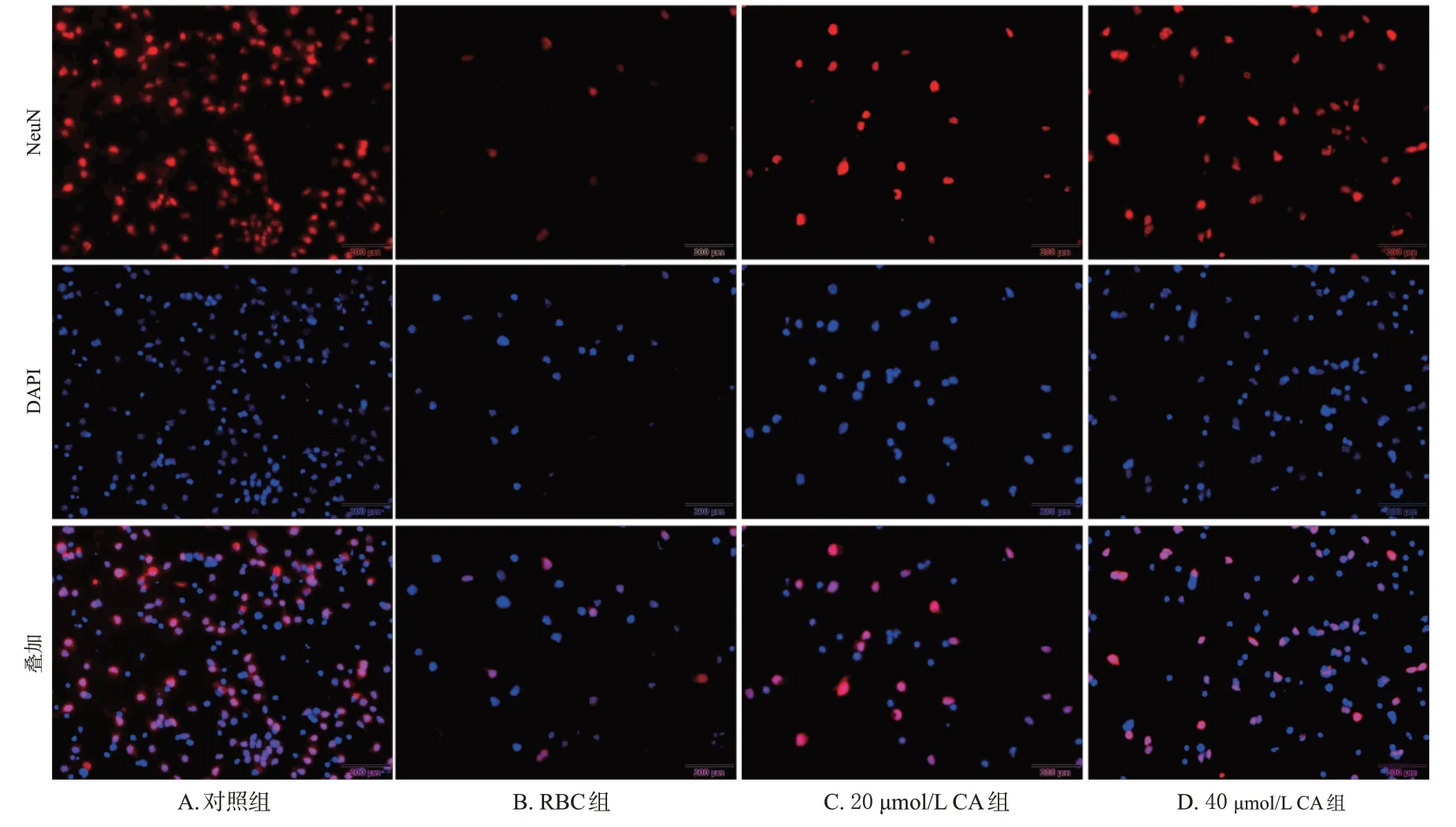
图7 CA对原代神经元凋亡影响的免疫荧光染色图(NeuN标记,×200)
4 讨论
脑出血是一种极具破坏性的卒中亚型,可导致原发性损伤和继发性损伤[1—2]。原发性脑损伤通常由于血肿形成、压迫相邻的脑组织而造成机械性损伤;继发性脑损伤则与炎症反应、氧化应激反应、铁的细胞毒性和凝血酶等有关[11—12]。目前,微创手术可减少患者的原发性脑损伤,但尚无有效手段缓解脑出血后继发性脑损伤。
炎症反应在脑出血后继发性脑损伤中起关键作用[2,4]。当脑出血发生后,大量的RBC进入脑实质,并逐渐裂解释放各种有毒物质(如游离血红素、铁离子等),进而诱导炎症反应。TLR4参与各种炎症介质的分泌过程和小胶质细胞的激活过程,该分子及其下游信号通路都是导致脑出血后炎症损伤的关键因素[5—6]。已有动物实验表明,一方面血红素以TLR4 依赖性方式激活小胶质细胞和巨噬细胞,小胶质细胞激活后其特异性的标记蛋白Iba1表达显著升高[13];另一方面血红素也可显著上调小胶质细胞中TLR4和TNF-α等促炎因子的表达。小胶质细胞是大脑中的主要免疫效应细胞,被激活后可分泌大量促炎因子(TLR4、TNF-α、IL-1β 等),从而加重炎症损伤,可见激活的小胶质细胞是脑出血后促炎因子的主要来源[14—15],也是导致神经元凋亡的重要原因[11,16]。敲除TLR4基因或应用TLR4 抗体可抑制血红素诱导的小胶质细胞活化,可显著改善小鼠的神经功能缺损和脑水肿情况[17—18]。因此,TLR4 是诱导脑出血后急性炎症反应的主要信号分子,抑制TLR4 介导的炎症反应可能是治疗脑出血的重要有效途径[19]。本研究发现,CA 能在体内下调脑出血病变及周边组织中TLR4及其下游促炎因子的表达,抑制小鼠脑出血病变及周边组织中小胶质细胞的激活;在体外下调RBC裂解液激活的小胶质细胞中TLR4 及其下游促炎因子的表达,减少了原代神经元与原代小胶质细胞共培养体系中神经元的凋亡,这些可能是脑出血后CA发挥脑保护作用的机制。
目前,脑出血仍缺乏有效的治疗药物,寻找有效、低毒的治疗药物是临床亟待解决的问题。本研究发现,在脑出血模型小鼠的体内实验中,CA 能够减少其脑出血体积、脑含水量、脑出血后的神经功能缺损;同时,在模拟脑出血的原代神经元与原代小胶质细胞共培养体外实验中,CA能够减少神经元的凋亡。
上述结果都证实了CA在脑出血中可发挥脑保护作用,且这种作用与其抑制TLR4介导的炎症反应有关,可见CA具有治疗脑出血的潜力。本研究存在一定的局限性:TLR4 介导的炎症反应信号通路的激活和调节是复杂的,本研究未深入研究CA 调控TLR4 的具体机制,也未使用TLR4基因敲除动物进行验证。总之,CA可以通过抑制TLR4 减少脑出血后继发的急性炎症损伤,但更为详细的机制仍需进一步研究。
