酵母微囊作为口服药物递送载体的研究进展Δ
2023-08-31刘瑛琪李静如邢昊楠郑爱萍华北理工大学药学院河北唐山06310军事医学研究院毒物药物研究所北京100850
刘瑛琪 ,李静如 ,孟 繁 ,邢昊楠 ,郑爱萍 (1.华北理工大学药学院,河北 唐山 06310;.军事医学研究院毒物药物研究所,北京 100850)
药物递送载体的主要作用是提高药物稳定性、增加溶解度、增强靶向性等,对于口服制剂的递送载体还需具备克服胃液破坏和肠道消化酶降解等能力。载体材料依据来源不同可分为天然材料及化学合成材料两大类,其中天然来源的载体材料(如外泌体[1]、白蛋白[2]、铁蛋白[3]、细菌外膜囊泡[4]等)在生物安全性及耐受性方面独具优势,备受学者关注。作为天然微生物,酵母具有生长速度快、生长周期短、尺寸(2~4 μm)较均一、水中分散性好、使用成本低等优点,加之其具有真核细胞的典型结构,细胞壁和细胞膜均有一定的强度和通透性,是理想的微囊材料[5]。酿酒酵母是一种常见的酵母,广泛用于酿酒、面包等食品发酵领域,被美国FDA 认证为一种安全的微生物;同时,酿酒酵母能有效刺激机体的非特异性免疫,常被作为免疫佐剂[6—7]。已有研究证实,以来源于酿酒酵母的酵母微囊为递送载体的药物在抗菌、抗病毒、抗肿瘤等需要免疫激活的疾病治疗中具有较好的应用前景[6]。本文综述了酵母微囊的组成、制备方法及其在疫苗、抗肿瘤药物等递送领域的应用进展,以期为酵母微囊的进一步研发和应用提供思路。
1 酵母微囊的主要组成
酿酒酵母的细胞壁占细胞干重的20%~30%,由β-葡聚糖、甘露聚糖、蛋白质、脂类和少量几丁质组成[8]。其中,β-葡聚糖由β-1,3-葡聚糖和β-1,6-葡聚糖组成,两者质量比约为85∶15。β-1,3-葡聚糖是葡聚糖网络刚性结构的主要成分,也是酵母微囊的免疫活性来源[5,9]。β-1,3-葡聚糖的骨架结构有利于卷曲以形成螺旋结构,这种结构可被受体特异性识别,从而引起特殊的生物学效应,如该成分可被髓样淋巴细胞(如树突细胞、巨噬细胞和嗜中性粒细胞)上高度表达的模式识别受体(pattern recognition receptor,PRR)特异性识别,从而激活固有免疫[10—11]。同时,细胞壁外层的甘露聚糖及其连接的糖蛋白可通过糖基磷脂酰肌醇(glycosylphosphatidyl inositol,GPI)锚定在β-1,6-葡聚糖分支上(图1)[12]。层层多糖和蛋白质网络构成了厚度为110~200 nm的交联多孔状酵母细胞壁[13],起到了支撑细胞和促进物质交换的作用。酵母微囊主要来源于酵母细胞壁成分中的β-葡聚糖,其高度交联的葡聚糖网络具有多孔刚性结构,其筛孔可用于装载小分子药物或纳米颗粒[14—15]。
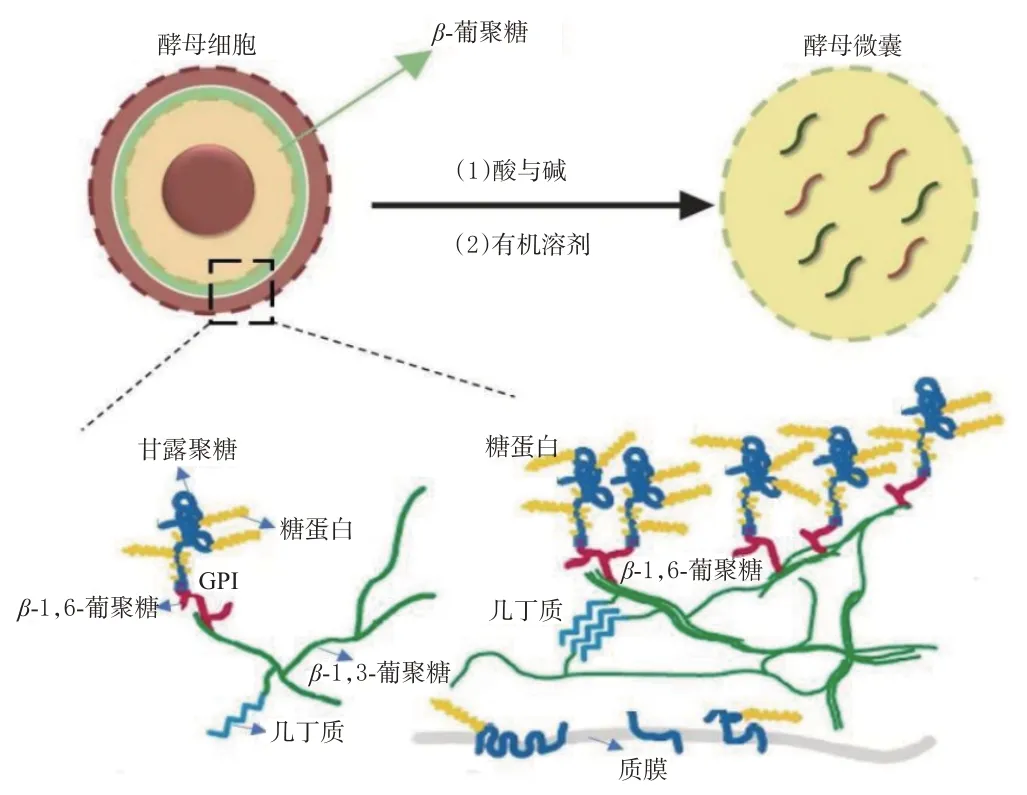
图1 酵母微囊的主要组成及制备过程
2 酵母微囊的制备与载药原理
将酵母细胞进行酸碱处理溶解细胞膜后,使用有机溶剂洗涤除去其内容物和细胞壁表面除β-葡聚糖以外的其他多糖,即可得表面粗糙多孔、核心中空的亚微米椭球状酵母微囊(图1)。其中,酸碱溶剂和有机溶剂处理的时长对微囊的物理化学性质(如粒径、表面Zeta 电位)有一定影响,进而可影响药物包封率和载药量[13]。此外,载药温度也会影响药物装载效率,研究发现,酵母微囊所载药物的有效扩散系数与温度成线性关系,较低的温度可有助于减少小分子药物的泄漏[16]。
酵母微囊内部中空、表面多孔且带负电荷,多数药物均可被封装在酵母微囊内部或附着于酵母微囊表面(图2),进而被机体吸收。对于药物的装载有如下几种途径:(1)带正电荷的药物分子可通过静电相互作用被吸附到带负电荷的酵母微囊内部。例如,Hou 等[17]利用静电作用将鼠结肠癌细胞裂解物和聚精氨酸包裹在酵母微囊内部,成功实现了抗原的口服递送。(2)带负电荷的药物可先通过非共价相互作用(例如氢键或疏水作用等)与含亚胺或酰胺的载体材料组装成带正电荷的药物颗粒,随后再通过静电相互作用将上述药物颗粒封装到带有负电荷的酵母微囊中。例如,Aouadi等[18]根据静电吸附原理合成干扰小RNA(small interfering RNA,siRNA)和聚乙烯亚胺(polyethylenimine,PEI)复合物,再将酵母微囊包裹在外,从而实现了siRNA 的口服递送。(3)不带电的药物则可通过被动扩散和疏水作用装载到酵母微囊内部。例如,Salari等[19]利用疏水作用将小檗碱装载到酵母微囊中;Mirza 等[20]利用被动扩散作用将百里酚包封到酵母微囊中,药物包封率可达95%;Sun等[21]首先利用碱性溶液将甲氨蝶呤(methotrexate,MTX)扩散至酵母微囊内,然后再降低溶液pH(酸性条件下,MTX 的溶解度将降低)使MTX 沉淀在酵母微囊内部,再用水凝胶固定,最终获得了高载药量的MTX 酵母微囊。(4)对于因自身性质无法被装载的部分药物,可将其附着在衍生化酵母微囊的表面,并通过注射途径来实现药物的体内递送。例如,Soto等[22]通过还原胺化和点击化学等步骤,使酵母微囊发生衍生化,进而使有效载荷药物或包含有效载荷药物的纳米颗粒(包括离子化合物、疏水化合物、蛋白质分子等)通过共价和非共价作用附着在酵母微囊表面,利用酵母微囊的高靶向性将药物递送至免疫细胞内,从而提高药物的利用度。
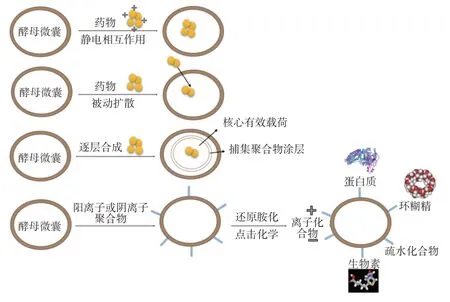
图2 酵母微囊的载药原理
3 酵母微囊在胃肠道内的转运吸收及靶向机制
多肽、蛋白质和核酸类药物/疫苗容易在胃酸性环境下降解,且胃肠道吸收较差,因此难以通过口服途径给药。研究证实,唾液及胃液无法消化β-葡聚糖,且酵母微囊在胃酸的低pH 环境中仍能保持稳定,故将药物包封在酵母微囊内可保护药物免受胃酸影响。Shi等[23]研究了载药酵母微囊在胃酸中的稳定性,结果显示,装载顺铂的酵母微囊在模拟胃酸环境下几乎不释放药物,表明其稳定性良好;Sabu等[24]以酵母微囊联合海藻盐为载体口服递送胰岛素,发现该载体可保护胰岛素不被胃酸降解,并可将胰岛素通过淋巴系统运输到体循环,进而成功降低小鼠血糖水平。
微皱褶细胞(microfold cell,MC)作为肠道黏膜相关淋巴组织特化毛囊上皮细胞,具有运输微生物和可溶性大分子药物的作用。酵母微囊经过胃到达肠道后,微囊表面的β-葡聚糖可靶向肠道MC表面的C型植物凝集素样受体dectin-1,从而协助MC特异性识别酵母微囊并将其转运至派尔斑(Peyer’s patches,PP)。PP 作为抗原加工和免疫细胞成熟的场所,含有丰富的T 细胞、B 细胞、树突细胞和巨噬细胞等免疫细胞[25]。作为免疫佐剂的酵母微囊进入PP 后可靶向至表面表达dectin-1[起到关键识别作用的dectin-1 由1 个胞外羧基末端C 型凝集素识别结构域(carbohydrate recognition domain,CRD)、1个跨膜结构域和1 个含免疫受体酪氨酸激活基序(immunoreceptor tyrosine-based activation motif,ITAM)的细胞质域组成,可通过CRD识别β-葡聚糖,从而识别酵母微囊]的树突细胞和巨噬细胞,从而利用ITAM来实现细胞因子、炎症小体激活与抗原呈递等胞内信号转导[26—27];同时,酵母微囊可刺激树突细胞的成熟,上调细胞表面功能分子的表达,促进白细胞介素1β(interleukin-1β,IL-1β)、IL-6、IL-12、IL-23 等分泌,减少调节性T细胞的数量并促进抗原特异性效应细胞的产生[28]。随后,酵母微囊表面的β-葡聚糖结构被消化为可溶性片段并分泌至胞外,通过补体受体3(complement receptor 3,CR3)被自然杀伤细胞和中性粒细胞识别,刺激自然杀伤细胞成熟并产生穿孔素和颗粒酶素[29]。进入淋巴组织的药物可通过淋巴管依次到达锁骨下静脉和肺动脉,最终到达包含肝、脾、肺、肾的单核巨噬细胞系统(mononuclear phagocyte systems,MPS)[30],进而进入体循环,最终蓄积在脾、淋巴结和骨髓[31],从而提高药物利用度。可见,酵母微囊可通过口服途径将所载药物递送至肠道黏膜,并在肠道内实现淋巴靶向、免疫激活,并在一定程度上发挥免疫佐剂的作用,在疫苗、免疫治疗药物递送方面显示出极佳的应用前景。
4 酵母微囊在药物递送中的应用
4.1 口服疫苗
肠道内分布着约70%的免疫细胞,是体内最大的免疫器官。相比于常规的注射类疫苗,口服疫苗有望通过刺激肠道内丰富的免疫细胞,产生局部黏膜免疫反应,从而防止病原体入侵肠道。但由于疫苗的有效抗原大多属于蛋白质,口服疫苗普遍存在抗原易被胃肠道消化酶降解、无法有效穿透肠黏液层到达淋巴细胞的问题。因此,口服疫苗需要合适的递送载体以克服消化道环境的影响,保证抗原有效传递并被肠道的免疫细胞所识别、摄取。酵母微囊是理想的口服递送载体,其能在胃液中保持稳定,并可保护装载的抗原不被胃蛋白酶降解,同时其微米级粒径和亲水表面也有助于穿透肠上皮屏障并靶向淋巴组织,从而引发有效的免疫反应[32]。
受酵母微囊孔隙大小和亲水性质的限制,部分抗原难以被装载到酵母微囊中,为解决该问题,有学者考虑将抗原连接到酵母微囊的表面,并选择合适的载体予以保护。例如,Liu 等[33]选择带正电荷的层状双氢氧化物(layered double hydroxide,LDH)纳米材料作为抗原保护剂和载体,通过静电相互作用使其连接在带负电荷的酵母微囊表面;给小鼠灌胃该制剂后发现,酵母微囊可帮助LDH 完整地到达肠道PP 内,进而被淋巴细胞摄取,LDH 可帮助抗原逃避溶酶体的降解并将其完整地释放到细胞质内,实现了胞内抗原的交叉呈递,从而有效诱导1型/17型辅助性T细胞混合免疫应答反应的发生,显著提高疫苗保护效果。为解决单纯铝佐剂不能诱导CD4+、CD8+T淋巴细胞应答这一问题,Liu等[34]先将抗原吸附到高度带电的氢氧化铝或磷酸铝凝胶上,再与酵母微囊共同孵育以制备新型疫苗;动物研究结果显示,酵母微囊可提高单纯铝佐剂的效力,并可成功激活小鼠1型辅助性T细胞的免疫应答。Specht等[35—36]给小鼠灌胃封装了隐球菌抗原蛋白的酵母微囊后,成功在小鼠体内检测到高滴度的特异性抗体及明显增多的抗原特异性CD4+T 淋巴细胞;细菌挑战实验结果也显示,酵母微囊组小鼠的存活率较空白组小鼠更高。有研究证实,酵母微囊递送抗原可在相对较低的剂量下诱导机体产生强烈且持久的免疫反应,如Huang 等[37]初次给予小鼠装载有卵清蛋白抗原的酵母微囊后,小鼠体内产生了较为显著的免疫反应。以上实例证实,酵母微囊在疫苗领域有广阔的应用前景。
4.2 炎症性疾病治疗药物
在抗炎方面,直接口服非甾体抗炎药和类固醇等非靶向抗炎药物可引发胃肠道出血和免疫抑制等副作用,而酵母微囊可克服这些缺点。Che等[38]将抗炎药物吲哚美辛与PEI组装成抗炎纳米药物颗粒并封装在酵母微囊中,再将其分别灌胃给急性炎症模型大鼠和正常大鼠,结果显示,大鼠肿胀足中的抗炎药物浓度较高,而正常足中的抗炎药物浓度较低,表明酵母微囊具有靶向炎症组织的能力。糖尿病作为一种慢性疾病,也被认为是一种慢性炎症,Sabu 等[24]将胰岛素沉积到酵母微囊中,再在酵母微囊表面涂布一层藻酸盐,以进一步保护胰岛素免受胃肠道环境的影响并延长其在胃肠道的停留时间,结果显示,该酵母微囊可将所载胰岛素成功递送至淋巴组织,再经由淋巴循环运输至体循环。Zhang 等[39]先将无毒、可降解且带正电荷的纳米管和微RNA365(microRNA365,miRNA365)组装成阳性纳米颗粒,再将该纳米颗粒装载到酵母微囊中,可实现创伤性骨关节炎miRNA 类药物的口服递送。姜黄素具有良好的抗炎效果,但其溶解度和稳定性较差,口服生物利用度不高[40]。Young等[41]利用酵母微囊包载姜黄素并灌胃给结肠炎模型小鼠,结果显示,小鼠体内的促炎性细胞因子水平大大降低,表明姜黄素发挥了明显的抗炎作用。此外有研究指出,肠道环境中的高胆汁盐可有助于酵母微囊中姜黄素的释放,因此酵母微囊在实现肠道局部递送的同时,还具有一定的缓释作用,可发挥更持久的抗炎活性[42]。用来治疗炎症性肠道疾病的免疫抑制剂MTX 同样可被封装于酵母微囊内部,口服给药后可通过靶向肠道巨噬细胞而发挥抗炎作用,从而减轻小鼠的结肠组织损伤[21]。上述研究表明,酵母微囊对炎症性疾病具有高靶向性,可提高所载药物的生物利用度。
4.3 抗肿瘤药物
在抗肿瘤药物方面,酵母微囊可降低细胞毒性药物的毒副作用,实现口服递送生物大分子药物和提高药物生物利用度的目标。Zhou 等[43]将顺铂的前体药物纳米颗粒装载到酵母微囊中并灌胃给小鼠后发现,酵母微囊中的药物可被成功释放到肿瘤细胞内并保持活性,其药效与静脉注射相当,且安全性更高。Hou 等[17]以鼠结肠和直肠肿瘤细胞裂解物为抗原制备了肿瘤疫苗,并将其封装于酵母微囊中,给小鼠灌胃该制剂后发现,小鼠体内的肿瘤生长受到了明显抑制。另外,可通过递送siRNA 类药物酵母微囊来实现抗肿瘤基因治疗。核因子κB(nuclear factor kappa-B,NF-κB)蛋白的上调与肿瘤的发生密切相关,Tencerova等[44]利用酵母微囊封装靶向NF-κB的siRNA,并发现该制剂可抑制小鼠肝脏库普弗细胞中NF-κB的表达。与此同时,酵母微囊也可提高难溶药物的口服生物利用度。Ren等[45]将吉非替尼多功能脂质体装载到酵母微囊中并灌胃给小鼠后发现,该制剂可表现出比市售药品更高的生物利用度和抗肿瘤效果。Li等[46]也发现,以酵母微囊封装卡巴他赛可提高药物的生物利用度并延长药物在肿瘤组织中的滞留时间。综上可见,以酵母微囊作为抗肿瘤药物的载体,可协助所载药物发挥更持久的抗肿瘤作用。
5 酵母微囊的安全性
酵母作为国际上公认的无毒可食用微生物,被广泛应用于制药、畜牧和食品工业领域。例如,有学者以大鼠为实验对象开展了单剂量急性、慢性毒性实验,结果证明酿酒酵母无毒,即使灌胃剂量高达2 000 mg/kg也并未观察到大鼠死亡或异常情况,连续给药91 d也未见不良反应或毒性反应发生[47]。Beier 等[48]给小型猪口服酵母后发现,酵母细胞从肠道运输到基础免疫细胞需要1 h,此时多数酵母细胞存在于肠道淋巴组织中;24 h 后,酵母细胞并未在猪PP 中被检出,表明酵母细胞已被完全降解。可见,口服酵母具有良好的安全性。但有研究指出,酵母微囊的主要成分β-葡聚糖具有一定的毒性效应(如导致肝脾肿大和肉芽肿形成),但仅在静脉注射时出现,口服给药仍显示安全无毒[49]。综上,酵母微囊属于酵母加工品,保留了酿酒酵母口服安全性高的特点,在用于口服药物递送的报道中,尚未发现其具有毒副作用。
6 总结与展望
酵母微囊制备简单、安全无毒,大量的β-葡聚糖保障了药物在胃液中的稳定性,故酵母微囊具备作为口服药物递送载体的潜力。酵母微囊结构疏松多孔,利于载药,其所含β-葡聚糖可被免疫细胞表面的dectin-1识别,从而激活免疫反应,并可在被摄取后随淋巴细胞的运动将所载药物运送至病变部位。可见,酵母微囊非常适合递送疫苗、抗炎药物及抗肿瘤药物,其不仅可实现上述药物的口服递送,而且能增强药物的效果,提高药物的靶向性。本文综述了酵母微囊作为递送载体用于疫苗、抗炎药物、抗肿瘤药物的递送特点,发现酵母微囊作为口服药物递送载体具有较高的安全性,能克服恶劣的胃肠环境,靶向淋巴组织并实现在炎症或肿瘤部位的聚集。虽然以酵母微囊为载体的口服疫苗和口服制剂有诸多优点,但其全身转运机制的相关研究较少,尚需更多的基础研究来明确其原理,或开发更加高效的联合给药系统并收集相关临床证据,使其真正发挥口服药物递送系统的临床价值。
