贯叶金丝桃对大鼠脑缺血再灌注损伤的保护作用及机制研究Δ
2023-08-31刘伟伟天津市医药科学研究所天津300020
王 宏,康 利,江 茜,刘伟伟,张 岩,傅 予 (天津市医药科学研究所,天津 300020)
卒中是一种急性脑血管疾病,是由于脑血管突然破裂或阻塞致血液供应不足而引发的脑组织损伤性疾病。《柳叶刀》最新报告指出,全球卒中发病率逐年增高,现已成为世界第二大死亡原因和第三大残疾原因[1]。卒中通常分为缺血性和出血性两大类,其中缺血性脑卒中约占70%,缺血再灌注损伤是其重要的病理机制之一[2]。
贯叶金丝桃,又名圣·约翰草,为藤黄科植物贯叶金丝桃Hypericum perforatumL.的干燥地上部分,始载于《本草纲目》。该药被2020年版《中国药典》(一部)收录,性寒、味辛,归肝经,具有疏肝解郁、清热利湿、消肿通乳的功效[3]。贯叶金丝桃作为抗抑郁药物在欧洲已有数百年的历史,以其提取物为主要成分的药物更是抑郁症治疗的首选[4]。此外有研究表明,贯叶金丝桃对卒中后抑郁表现出较好的治疗效果[5]。近期研究指出,贯叶金丝桃对缺血性脑损伤有保护作用[6—7]。缺血性脑损伤的病理机制较为复杂,其中促红细胞生成素(erythropoietin,EPO)介导的Janus 激酶2(Janus kinase 2,JAK2)/信号转导及转录激活因子3(signal transduction and activator of transcription 3,STAT3)信号通路已被证实与保护脑缺血再灌注损伤的作用有关[8]。基于此,本研究拟利用改良线栓法制备大鼠大脑中动脉闭塞再灌注模型,探讨贯叶金丝桃对大鼠脑缺血再灌注损伤的保护作用,并初步分析其潜在分子机制是否与EPO 介导的JAK2/STAT3 信号通路有关,以期为贯叶金丝桃的临床应用提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括Ci-L 型显微镜、Ni-U 型荧光显微镜(日本Nikon公司),Infinite M2000型酶标仪(瑞士TECAN公司),Mini PROTEAN Tetra型电泳仪(美国Bio-Rad公司),ImageQuant LAS 500型一体化成像仪(美国GE 公司),ABI7500 型反转录聚合酶链式反应(RT-PCR)仪(美国ABI公司)等。
1.2 主要药品与试剂
贯叶金丝桃药材(产地四川,批号20190503)购自安徽亳州中药材批发市场,经天津市医药科学研究所王文彤研究员鉴定为藤黄科植物贯叶金丝桃H. perforatumL.的干燥地上部分;尼莫地平片(阳性对照,批号2003004,规格20 mg)购自天津市中央药业有限公司;注射用盐酸替来他明盐酸唑拉西泮(批号8ADTA,规格为替来他明125 mg+唑拉西泮125 mg)购自法国Virbac公司;盐酸赛拉嗪注射液(批号20201118,规格2 mL∶0.2 g)购自吉林省华牧动物保健品有限公司。
TTC试剂(批号L09A10S83253)购自上海源叶生物科技有限公司;苏木精、伊红染色液(批号分别为G1140、G1100)均购自北京索莱宝科技有限公司;TUNEL 细胞凋亡检测试剂盒(荧光素)购自瑞士Roche公司;兔源EPO、促红细胞生成素受体(erythropoietin receptor,EPOR)、JAK2、磷酸化STAT3(p-STAT3)、STAT3多克隆抗体和鼠源β-肌动蛋白(β-actin)多克隆抗体(批号分别为08D01、ZP8069BP69、BST17874165、ZP7411BP11、BOS6738BP3380、AC-15)均购自武汉博士德生物工程有限公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗(批号7074S)购自美国CST公司;BCA蛋白定量试剂盒、超敏ECL 化学发光试剂盒、HRP 标记的山羊抗鼠IgG二抗(批号分别为OS28、EL2001001、916A035)均购自爱必信(上海)生物科技有限公司;TRIzol 试剂、HiFi-Script cDNA链合成试剂盒、UltraSYBR Mixture(批号分别为01761、33020、30506)均购自江苏康为世纪生物科技有限公司;PCR引物由生工生物工程(上海)股份有限公司合成,引物序列及产物长度见表1。

表1 PCR引物序列及产物长度
1.3 实验动物
SPF级雄性SD大鼠75只,体重160~180 g,由北京维通利华实验动物技术有限公司提供,动物生产许可证号为SCXK(京)2016-0006。所有动物均饲养于天津市医药科学研究所动物房内,自由摄食、饮水。本研究所涉及的动物操作均符合天津市医药科学研究所实验动物伦理的相关规定,并经过伦理委员会批准(批准编码IMPS-EAEP-Z-Z2019017-01)。
2 方法
2.1 贯叶金丝桃提取物浸膏的制备
取贯叶金丝桃药材5 850 g,粉碎,用70%乙醇冷浸提取7 d×3次,合并提取液,浓缩干燥,即得贯叶金丝桃提取物浸膏(每克浸膏相当于生药14.48 g)。
2.2 大鼠脑缺血再灌注损伤模型的建立
采用改良线栓法制备大鼠大脑左侧中动脉闭塞再灌注模型:在麻醉(注射用盐酸替来他明盐酸唑拉西泮25 mg/kg+盐酸赛拉嗪注射液2.5 mg/kg,肌内注射,后同)状态下,于大鼠颈部正中2 cm切口,钝性分离左侧颈总、颈内和颈外动脉,用3-0号无菌手术线结扎颈总和颈外动脉,用动脉夹夹闭颈内动脉远心端;于颈内动脉近心端备线,在颈总动脉距离分叉约1 cm处用眼科剪剪一小口,将线栓送入切口,经颈内动脉顺行至线栓标记黑点处,结扎颈内动脉近心端以固定线栓,造成缺血;缺血2 h 后取出线栓,实现再灌注[9]。其中,部分大鼠(10 只)仅分离血管但不结扎、不插线栓,将其作为假手术组。参考Zea-Longa评分法,评分1~3分为造模成功[10]。
2.3 大鼠分组与给药
将造模成功的大鼠按体重分为模型组、阳性对照组(尼莫地平,0.012 g/kg,以水为溶剂;剂量根据临床等效剂量换算而得)和贯叶金丝桃高、低剂量组[5.212、1.303 g/kg,按生药量计,以水为溶剂;低剂量按圣·约翰草提取物片(商品名为路优泰)的临床等效剂量换算而得],同时设置假手术组,每组10只。各药物组大鼠于术后第2天开始灌胃相应药液,每天1 次,连续7 d。假手术组和模型组大鼠灌胃等体积水。
2.4 大鼠神经功能评分
分别于药物干预前(造模后第1天)和末次给药后按Zea-Longa 评分法对各组大鼠进行神经功能评分,具体标准如下:无神经损伤症状,记0分;不能伸展对侧前爪,记1分;行走时向偏瘫侧转圈,记2分;向偏瘫侧倾倒,记3分;不能自发行走且意识丧失,记4分[10]。
2.5 大鼠脑梗死情况观察
采用TTC 染色法进行观察。末次给药1 h 后,随机取各组大鼠5只,麻醉后,迅速断头取脑,用预冷生理盐水冲洗,并于—20 ℃下放置10 min,待脑组织稍硬后,切除嗅球、垂体、低位脑干,由前向后行等分冠状位切片。将上述脑组织切片置于1%TTC 磷酸盐缓冲液中,于37 ℃下避光温育30 min(每隔10 min上下翻动1次);经4%多聚甲醛固定后,观察各组大鼠脑组织的梗死情况(正常脑组织呈玫瑰红色,梗死组织呈白色)并拍照。采用Image-Pro Plus 6.0软件分析图片并计算脑梗死比例:脑梗死比例=脑梗死总面积/脑切片总面积×100%。
2.6 大鼠脑皮层和海马组织病理形态学观察
采用苏木精-伊红(HE)染色法进行观察。末次给药1 h后,取各组剩余大鼠5只,麻醉后,剖取其缺血再灌注侧脑组织(假手术组大鼠取相同部位脑组织),纵切,将包含皮层和海马的脑组织固定于4%多聚甲醛中,经梯度乙醇脱水、石蜡包埋后切片(厚度为4 μm),行HE 染色后,使用显微镜观察各组大鼠脑皮层和海马组织的病理改变情况。
2.7 大鼠脑皮层和海马组织神经细胞凋亡检测
采用TUNEL染色法进行检测。取“2.6”项下各组大鼠脑组织切片,于60 ℃下烘烤60 min,经二甲苯脱蜡、梯度乙醇脱水后,滴加新配制的蛋白酶K 工作液(20 mg/L),于37 ℃下孵育10 min;用磷酸盐缓冲液清洗3次,滴加TUNEL 检测液适量,于37 ℃下避光孵育60 min;用磷酸盐缓冲液清洗3次,以DAPI染液染核,使用荧光显微镜观察各组大鼠脑皮层和海马组织中神经细胞的凋亡情况(凋亡细胞被染成红色),并采用Image Scope软件计算其凋亡率:凋亡率=凋亡细胞数/细胞总数×100%。
2.8 大鼠脑组织中EPO、EPOR、JAK2、p-STAT3、STAT3蛋白表达情况检测
采用Western blot法进行检测。取“2.6”项下各组大鼠的缺血再灌注侧脑组织(假手术组大鼠取相同部位脑组织),加入蛋白裂解液后研磨,提取总蛋白并采用BCA法进行定量。蛋白变性后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,并转移到聚二氟乙烯膜上,以5%脱脂奶粉室温封闭1 h 后,分别加入EPO、EPOR、JAK2、p-STAT3、STAT3、β-actin一抗(稀释比例均为1∶500),4 ℃孵育过夜;用TBST缓冲液清洗5 min×3次,加入相应二抗(稀释比例均为1∶1 000),室温孵育2 h;用TBST缓冲液清洗5 min×3 次,以超敏ECL 化学发光试剂显色,并置于一体化成像仪下成像。采用Image J软件分析条带灰度值,以目的蛋白与内参蛋白(β-actin)条带的灰度值比值表示目的蛋白的表达水平,结果以假手术组为参照进行归一化处理。
2.9 大鼠脑组织中EPO、EPOR、JAK2、STAT3 mRNA表达情况检测
采用RT-PCR 法进行检测。取“2.6”项下各组大鼠的缺血再灌注侧脑组织(假手术组大鼠取相同部位脑组织),用TRIzol试剂提取总RNA,测定浓度并稀释至250 mg/L,进一步逆转录得cDNA。以所得cDNA 为模板进行PCR 扩增。PCR 反应体系(20 μL)包括:2×Ultra-SYBR Mixture 10 μL,上、下游引物各0.8 μL,cDNA 模板1.6 μL,ddH2O 6.8 μL。反应条件为:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火1 min,共40 个循环。以β-actin 作为内参,采用2—ΔΔCt法计算EPO、EPOR、JAK、STAT3 mRNA的表达水平,结果以假手术组为参照进行归一化处理。
2.10 统计学方法
采用GraphPad Prism 6.0 软件对数据进行统计分析。计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 贯叶金丝桃对模型大鼠神经功能评分的影响
与假手术组比较,模型组大鼠在药物干预前、末次给药后的神经功能评分均显著升高(P<0.01);与模型组比较,阳性对照组和贯叶金丝桃高剂量组大鼠末次给药后的神经功能评分均显著降低(P<0.05或P<0.01)。结果见表2。
表2 各组大鼠的神经功能评分和脑梗死比例比较(±s)
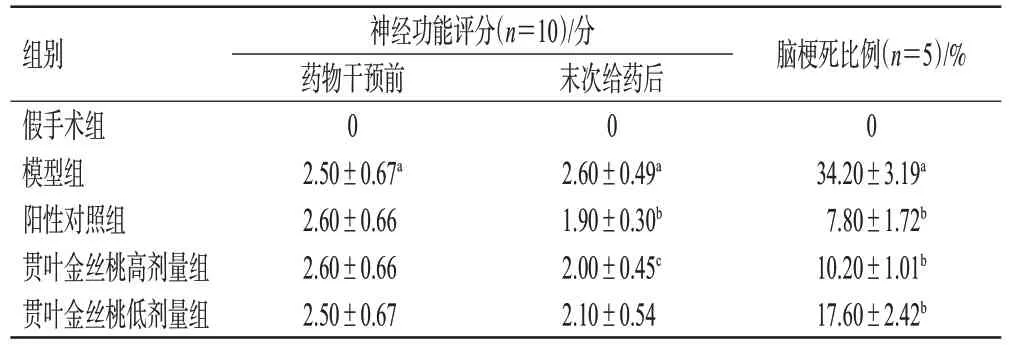
表2 各组大鼠的神经功能评分和脑梗死比例比较(±s)
a:与假手术组比较,P<0.01;b:与模型组比较,P<0.01;c:与模型组比较,P<0.05。
组别假手术组模型组阳性对照组贯叶金丝桃高剂量组贯叶金丝桃低剂量组神经功能评分(n=10)/分药物干预前0 2.50±0.67a 2.60±0.66 2.60±0.66 2.50±0.67末次给药后0 2.60±0.49a 1.90±0.30b 2.00±0.45c 2.10±0.54脑梗死比例(n=5)/%0 34.20±3.19a 7.80±1.72b 10.20±1.01b 17.60±2.42b
3.2 贯叶金丝桃对模型大鼠脑梗死比例的影响
与假手术组比较,模型组大鼠的脑梗死区域明显增大,脑梗死比例显著升高(P<0.01);与模型组比较,阳性对照组和贯叶金丝桃高、低剂量组大鼠的脑梗死区域有所缩小,脑梗死比例均显著降低(P<0.01)。结果见图1、表2。

图1 各组大鼠的脑梗死情况
3.3 贯叶金丝桃对模型大鼠脑皮层和海马组织病理形态的影响
假手术组大鼠脑皮层组织神经细胞形态正常,结构完整,核仁清晰,细胞质无红染;海马组织神经细胞结构完整,排列有序。模型组大鼠缺血再灌注侧脑皮层组织神经细胞大片消失,锥体细胞明显减少,结构受损,排列紊乱;海马组织可见神经细胞变性,核固缩深染,细胞质红染,排列较紊乱。阳性对照组和贯叶金丝桃高、低剂量组大鼠缺血再灌注侧脑组织上述部位的病理形态均较模型组有不同程度的改善。结果见图2、图3。
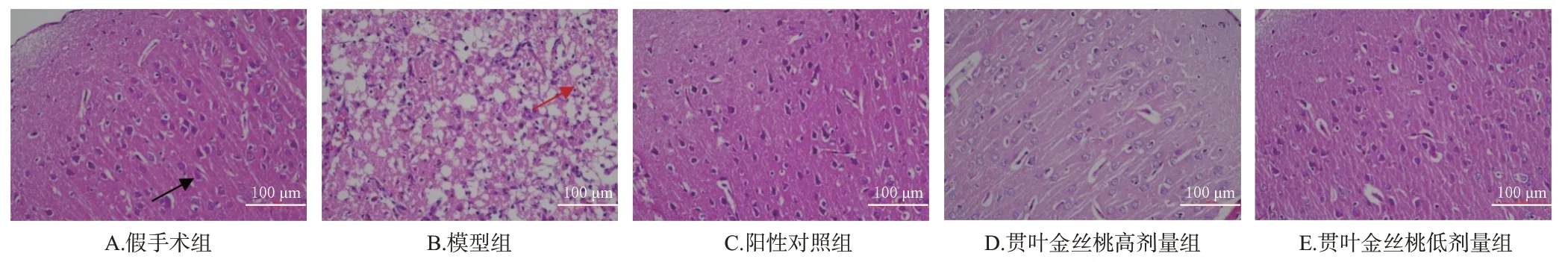
图2 各组大鼠脑皮层组织病理形态变化的显微图(HE染色)
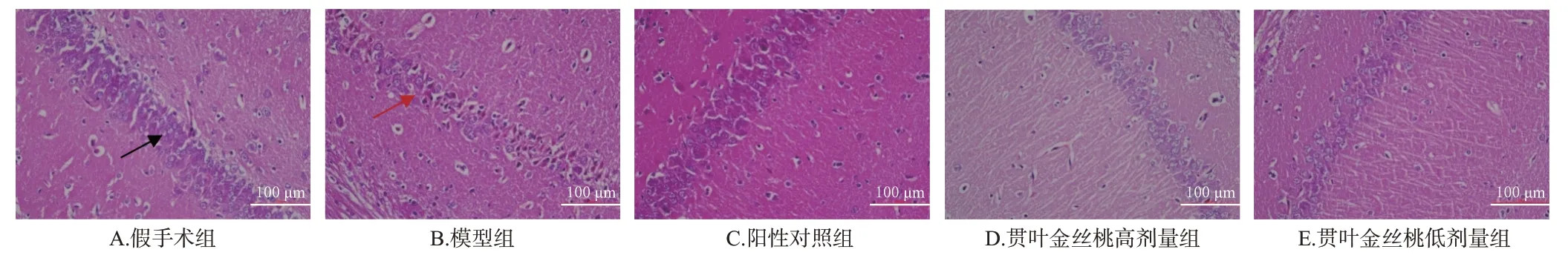
图3 各组大鼠海马组织病理形态变化的显微图(HE染色)
3.4 贯叶金丝桃对模型大鼠脑皮层和海马组织神经细胞凋亡的影响
与假手术组比较,模型组大鼠缺血再灌注侧脑皮层和海马组织中凋亡的神经细胞(红染)明显增多,凋亡率显著升高(P<0.01);与模型组比较,阳性对照组和贯叶金丝桃高、低剂量组大鼠缺血再灌注侧脑皮层和海马组织中凋亡的神经细胞均明显减少,凋亡率均显著降低(P<0.01)。结果见图4、图5、表3。
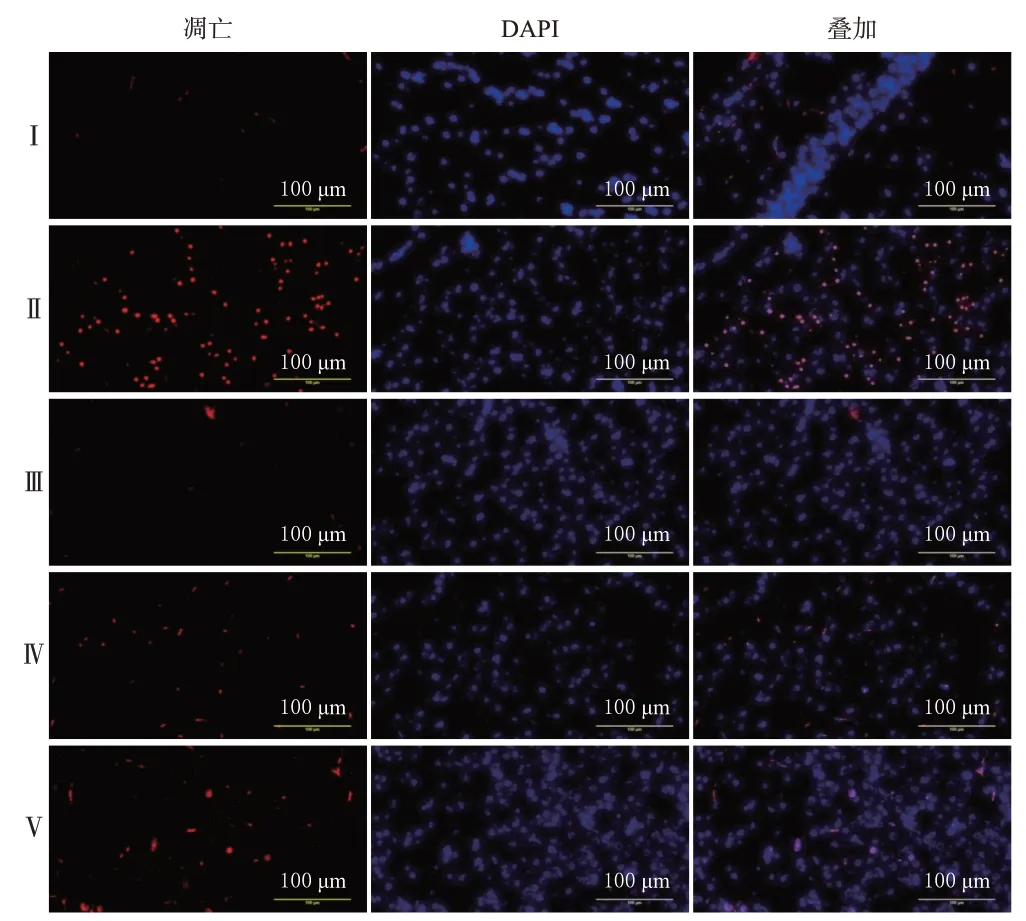
图4 各组大鼠脑皮层组织中神经细胞凋亡的荧光显微图(TUNEL染色)
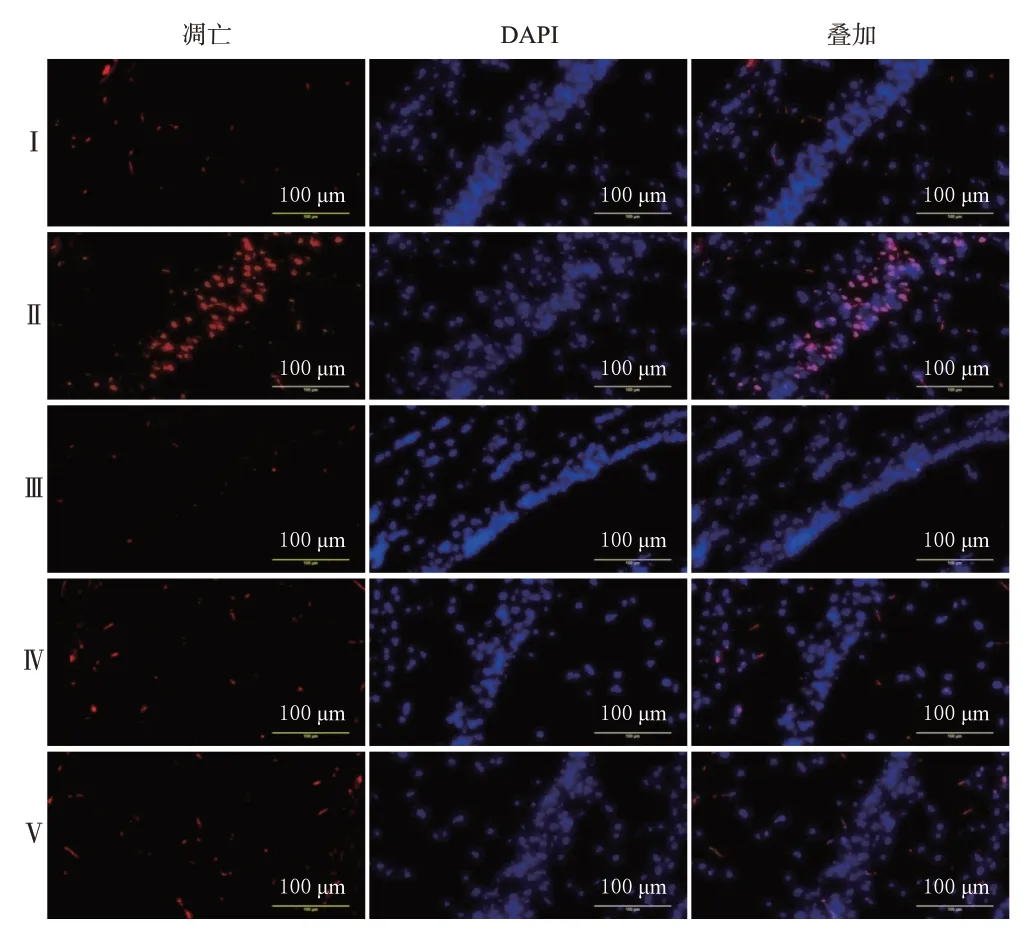
图5 各组大鼠海马组织中神经细胞凋亡的荧光显微图(TUNEL染色)
表3 各组大鼠脑皮层和海马组织中神经细胞的凋亡率比较(±s,n=5,%)
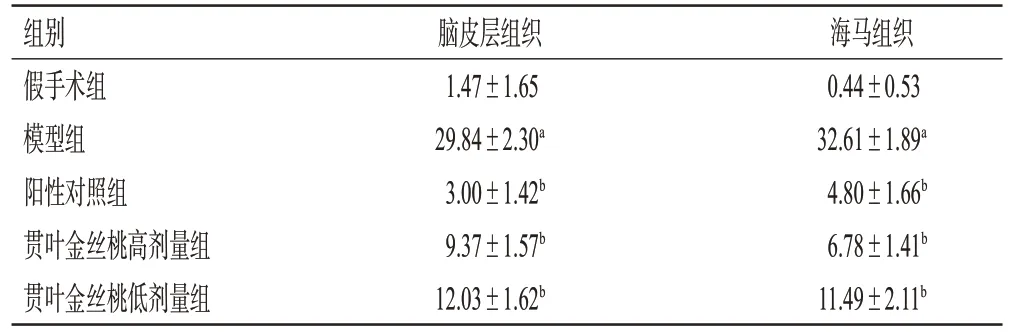
表3 各组大鼠脑皮层和海马组织中神经细胞的凋亡率比较(±s,n=5,%)
a:与假手术组比较,P<0.01;b:与模型组比较,P<0.01。
组别假手术组模型组阳性对照组贯叶金丝桃高剂量组贯叶金丝桃低剂量组海马组织0.44±0.53 32.61±1.89a 4.80±1.66b 6.78±1.41b 11.49±2.11b脑皮层组织1.47±1.65 29.84±2.30a 3.00±1.42b 9.37±1.57b 12.03±1.62b
3.5 贯叶金丝桃对大鼠脑组织中EPO、EPOR、JAK2、p-STAT3、STAT3蛋白表达的影响
与假手术组比较,模型组大鼠缺血再灌注侧脑组织中EPO、EPOR 蛋白的表达水平均显著降低(P<0.01),JAK2、p-STAT3、STAT3 蛋白的表达水平均显著升高(P<0.01);与模型组比较,各药物组大鼠缺血再灌注侧脑组织中EPO、EPOR 蛋白的表达水平均显著升高(P<0.01),JAK2、p-STAT3、STAT3(阳性对照组除外)蛋白的表达水平均显著降低(P<0.01)。结果见图6、表4。
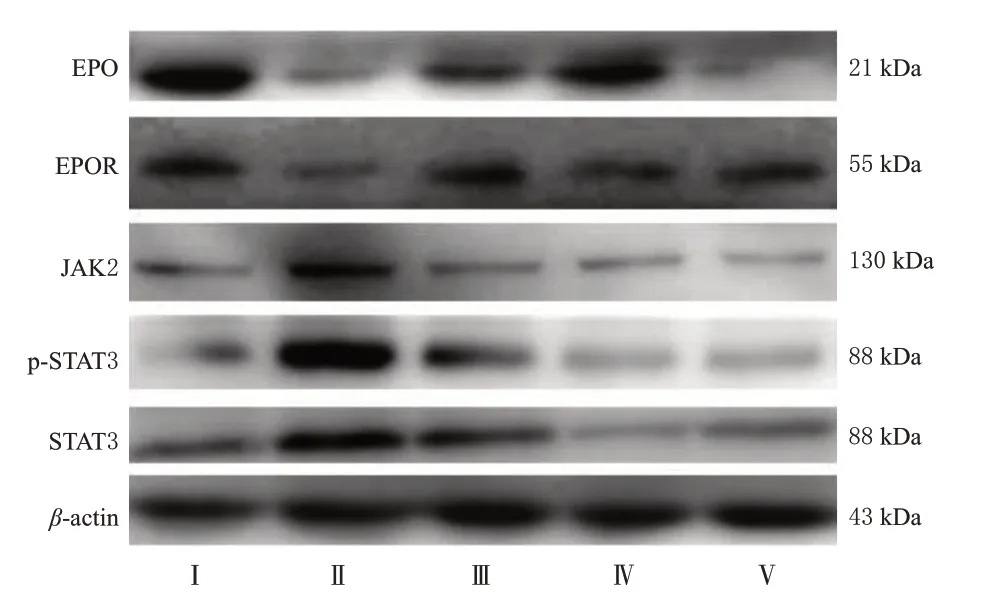
图6 各组大鼠脑组织中EPO、EPOR、JAK2、p-STAT3、STAT3蛋白表达的电泳图
表4 各组大鼠脑组织中EPO、EPOR、JAK2、p-STAT3、STAT3蛋白表达水平比较(±s,n=5)
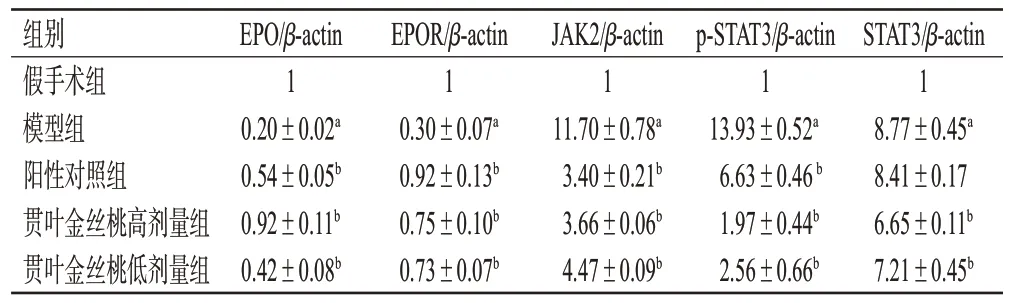
表4 各组大鼠脑组织中EPO、EPOR、JAK2、p-STAT3、STAT3蛋白表达水平比较(±s,n=5)
a:与假手术组比较,P<0.01;b:与模型组比较,P<0.01。
组别假手术组模型组阳性对照组贯叶金丝桃高剂量组贯叶金丝桃低剂量组STAT3/β-actin 1 8.77±0.45a 8.41±0.17 6.65±0.11b 7.21±0.45b EPO/β-actin 1 0.20±0.02a 0.54±0.05b 0.92±0.11b 0.42±0.08b EPOR/β-actin 1 0.30±0.07a 0.92±0.13b 0.75±0.10b 0.73±0.07b JAK2/β-actin 1 11.70±0.78a 3.40±0.21b 3.66±0.06b 4.47±0.09b p-STAT3/β-actin 1 13.93±0.52a 6.63±0.46 b 1.97±0.44b 2.56±0.66b
3.6 贯叶金丝桃对大鼠脑组织EPO、EPOR、JAK2、STAT3 mRNA表达的影响
与假手术组比较,模型组大鼠缺血再灌注侧脑组织中EPO、EPOR mRNA 的表达水平均显著降低(P<0.01),JAK2、STAT3 mRNA的表达水平均显著升高(P<0.01);与模型组比较,各药物组大鼠缺血再灌注侧脑组织中EPO、EPOR mRNA 的表达水平均显著升高(P<0.05 或P<0.01),JAK2、STAT3 mRNA 的表达水平均显著降低(P<0.05或P<0.01)。结果见表5。
表5 各组大鼠脑组织中EPO、EPOR、JAK2、STAT3 mRNA表达水平比较(±s,n=5)
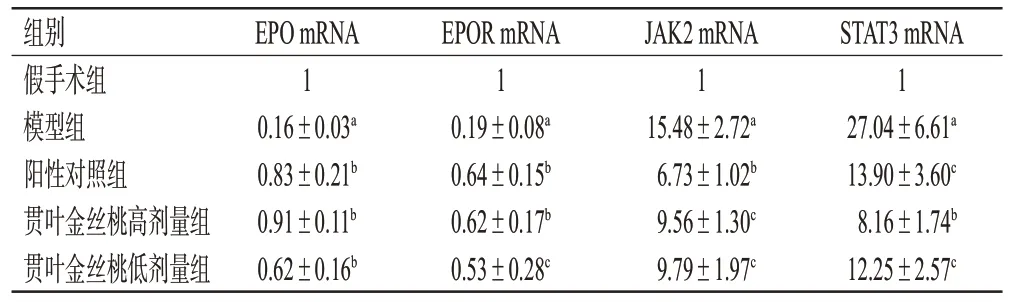
表5 各组大鼠脑组织中EPO、EPOR、JAK2、STAT3 mRNA表达水平比较(±s,n=5)
a:与假手术组比较,P<0.01;b:与模型组比较,P<0.01;c:与模型组比较,P<0.05。
STAT3 mRNA 1 27.04±6.61a 13.90±3.60c 8.16±1.74b 12.25±2.57c组别假手术组模型组阳性对照组贯叶金丝桃高剂量组贯叶金丝桃低剂量组EPO mRNA 1 0.16±0.03a 0.83±0.21b 0.91±0.11b 0.62±0.16b EPOR mRNA 1 0.19±0.08a 0.64±0.15b 0.62±0.17b 0.53±0.28c JAK2 mRNA 1 15.48±2.72a 6.73±1.02b 9.56±1.30c 9.79±1.97c
4 讨论
脑缺血再灌注损伤是由缺血区血液供应恢复引起的继发损伤,也是缺血性卒中治疗后的严重并发症[11]。本研究选择尼莫地平为阳性对照药,该药为二氢吡啶类钙通道阻滞剂,可用于缺血性脑血管疾病的临床治疗。本课题组前期研究证实了尼莫地平对缺血性脑损伤有较好的干预效果[12]。本研究所用线栓与大鼠体重相配,有固定长度标记且粗细一致,能够保证造模大鼠脑缺血程度的一致性。同时,本课题组前期比较了药物干预3 d和7 d的效果,结果显示,贯叶金丝桃干预3 d的效果不明显,可能与干预时间偏短有关,故最终选用了药物干预7 d 的方案。本研究结果显示,模型组大鼠的神经功能评分和脑梗死比例均较假手术组显著升高,缺血再灌注侧脑皮层和海马组织明显受损,凋亡的神经细胞明显增多且凋亡率显著升高;而高、低剂量的贯叶金丝桃均能不同程度地降低模型大鼠的神经功能评分和脑梗死比例,改善其缺血再灌注侧脑皮层和海马组织的受损情况,减少其凋亡神经细胞数量并降低凋亡率,提示贯叶金丝桃对大鼠脑缺血再灌注损伤有明显的改善作用。
研究表明,JAK2/STAT3 信号通路与脑缺血再灌注损伤关系密切[13—14]。该信号通路由3 个部分组成:接收信号的酪氨酸激酶相关受体、传递信号的JAK2 和产生效应的STAT3[15]。EPO是红细胞生成所需的主要刺激因子,为人体内源性糖蛋白激素,主要通过与其受体结合而发挥促进红细胞成熟的作用[16]。Liu 等[17]研究证实,EPO可作为神经细胞保护因子,对缺血性脑损伤具有一定的修复作用。当脑缺血发生后,EPO/EPOR轴可通过与JAK2 的相互作用而被激活;随后,JAK2 可使STAT3发生磷酸化,生成的p-STAT3进一步二聚化并异位至细胞核内,与具有特定位点的靶标[如B 细胞淋巴瘤2(B cell lymphoma 2,Bcl-2)、Bcl-XL等]结合,从而抑制神经细胞的凋亡[18—19]。可见,EPO 能通过介导JAK2/STAT3信号通路在中枢神经系统损伤中发挥保护作用。Western blot 和RT-PCR 实验结果显示,高、低剂量的贯叶金丝桃可显著上调大鼠缺血再灌注侧脑组织中EPO、EPOR 蛋白及mRNA 的表达,下调JAK2、p-STAT3、STAT3蛋白和JAK2、STAT3 mRNA的表达,提示贯叶金丝桃的上述作用可能是通过EPO 介导的JAK2/STAT3信号通路来完成的。
综上所述,贯叶金丝桃对大鼠脑缺血再灌注损伤有保护作用,其机制可能与调节EPO 介导的JAK2/STAT3信号通路有关。本课题组后续将应用通路抑制剂,进一步阐释上述通路在贯叶金丝桃改善脑缺血再灌注损伤中的具体机制。
