护肝布祖热方对大鼠肝内胆汁淤积性肝损伤的影响及机制Δ
2023-08-31阿依孜巴图尔洪杨建华王晓梅王新玲胡君萍新疆医科大学药学院乌鲁木齐8300新疆医科大学第一附属医院药学部乌鲁木齐8300
阿依孜巴·图尔洪 ,杨建华 ,王晓梅 ,王新玲 ,胡君萍 (.新疆医科大学药学院,乌鲁木齐 8300;.新疆医科大学第一附属医院药学部,乌鲁木齐 8300)
胆汁淤积是多种肝胆疾病常见的基本病理改变[1]。作为一种进行性肝病,该症与肝外胆管、肝内胆管梗阻或肝细胞分泌胆汁方式改变所致胆汁流中断有关,表现为有毒胆汁成分(包括胆汁酸、胆固醇和胆红素等)在肝脏内过度蓄积,从而损害肝细胞,最终引发肝脏炎症、肝纤维化甚至肝硬化[2]。WHO统计数据显示,肝硬化是中低收入国家人群第八大死亡原因,且对于终末期肝病患者而言,唯一可用的治疗方法是肝移植[3]。由于目前缺乏治疗胆汁淤积性肝病的有效药物,因此中医药治疗胆汁淤积的疗效及其作用机制研究备受学界关注。
护肝布祖热方(Hugan buzure formula,HBF)是保肝护肝的经典方之一,由菊苣根、菊苣子、芹菜根、芹菜子、茴香根皮、小茴香、菟丝子7味药材组成,具有补益肝胃、散气止痛、利胆、利水的功效,用于临床治疗急慢性乙型肝炎、黄疸性肝炎、急慢性胆囊炎、胆管炎等肝胆疾病,其成方制剂为护肝布祖热颗粒。本课题组前期研究表明,HBF对四氯化碳诱导的人肝星状细胞损伤和大鼠急性肝损伤、肝纤维化均具有良好的改善作用[4—6],但其是否具有体内抗胆汁淤积作用尚不清楚。有文献报道,该方主要活性成分芹菜素可通过影响法尼酯X 受体(farnesoid X receptor,FXR)信号通路对胆汁淤积性肝病发挥改善作用[7],由毛菊苣加工制成的单味制剂清热卡森颗粒可通过调控该通路而改善大鼠的肝内胆汁淤积[8]。此外,FXR受体在抑制胆汁酸合成酶、抑制肝摄取转运体、诱导胆汁外流转运体、促进肝脏胆汁酸代谢等方面也发挥着重要的调节作用,因此被称为“胆盐受体”,是目前肝内胆汁淤积的关键治疗靶点[9]。基于此,本文研究了HBF对大鼠肝内胆汁淤积性肝损伤的影响,并从FXR信号通路角度初步探讨了其潜在机制,旨在为拓展该方的临床用途提供依据。
1 材料
1.1 主要仪器
本文所用主要仪器有Multiskan GO型酶标仪(美国Thermo Fisher Scientific 公司)、Eclipse Ni-U 型显微镜(日本Nikon 公司)、QuantStudioTM6 Flex 型实时荧光定量聚合酶链式反应(PCR)仪(美国Life Technologies 公司)、FluorChem E 0723 型超灵敏全自动成像分析系统(美国ProteinSimple公司)等。
1.2 主要药品与试剂
菊苣根(批号JJZ-YP-200527)、菊苣子(批号JJZYP-191209)、茴香根皮(批号HXGP-YP-210115)均购自新疆宝康药业有限公司,芹菜根(批号Z30142203)、芹菜子(批号G30131002)均购自新疆维吾尔自治区维吾尔医医院,小茴香(批号XHX-YP-170803)、菟丝子(批号150701)均购自新疆和济中药饮片有限公司,以上药材经新疆医科大学药学院胡君萍教授鉴定均为真品。
α-异硫氰酸萘酯(alpha-naphthyl isothiocyanate,ANIT)对照品(货号551-06-4,纯度98%)购自上海麦克林生化科技股份有限公司;熊去氧胆酸(ursodeoxycholic acid,UDCA)胶囊(阳性对照,货号L20237A,规格250 mg)购自德国Losan Pharma 公司;天冬氨酸转氨酶(aspartate aminotransferase,AST)、丙氨酸转氨酶(alanine aminotransferase,ALT)、碱性磷酸酶(alkaline phosphatase,ALP)、总胆汁酸(total bile acid,TBA)、总胆红素(total bilirubin,TBIL)、直接胆红素(direct bilirubin,DBIL)、谷胱甘肽(glutathione,GSH)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)检测试剂盒(批号分别为20210708、20210708、20210708、20210707、20210709、20210618、20210709、20210708、20210709)均购自南京建成生物工程研究所;苏木精-伊红(HE)染色试剂(批号G1003)购自武汉赛维尔生物科技有限公司;反转录试剂盒、扩增试剂盒(批号分别为AL50946A、AL51019A)均购自日本Takara公司;兔源FXR 抗体、辣根过氧化物酶(HRP)标记的羊抗鼠IgG 二抗(货号分别为25055-1-AP、SA00001-1)均购自武汉三鹰生物技术有限公司;兔源胆盐输出泵转运蛋白(bile salt export pump,BSEP)、多药耐药蛋白2(multidrug resistance protein 2,MRP2)抗体和鼠源β-微管蛋白(β-tubulin)抗体(货号分别为AF7593、DF3873、AF7018)均购自美国Affinity 公司;鼠源钠离子依赖性牛磺胆酸共转运蛋白(Na+-taurocholate cotransporting polypeptide,NTCP)抗体(货号YT5372)购自苏州睿瀛生物技术有限公司;兔源核因子κB p65(nuclear factor kappa B p65,NF-κB p65)抗体、HRP 标记的羊抗兔IgG 二抗(货号分别为8242T、7074S)均购自美国Cell Signaling Technology公司。
1.3 实验动物
SPF级雄性Wistar大鼠,体重(200±20)g,购自新疆医科大学实验动物中心,实验动物生产许可证号为SCXK(新)2018-0002。所有大鼠均饲养于受控环境(温度23~24 ℃,相对湿度50%~60%,光照/黑暗循环12 h)中,适应性喂养1周开始后续实验。本实验方案经新疆医科大学第一附属医院实验动物伦理委员会批准,批准号为IACUC-20180222-62。
2 方法
2.1 HBF药液的制备
参照HBF原方组成,称取芹菜根、菊苣子、茴香根皮各212 g,芹菜子、菊苣根、小茴香各106 g,菟丝子53 g,粉碎,混合,加水煎煮3 次,煎煮时间分别为2、1.5、1 h;合并3次煎液,浓缩得到干浸膏233.2 g,得率为23.16%。给药前,用水溶解,制成不同浓度的HBF药液,备用。
2.2 分组、给药与造模
将大鼠随机分为对照组(control组)、模型组(model组)、UDCA组(阳性对照,60 mg/kg)和HBF低、中、高剂量组[HBF-L、HBF-M、HBF-H 组,0.4、0.8、1.6 g/kg(按生药总量计)],每组6 只。UDCA 的剂量参考相关文献[10]设置;HBF的临床人用剂量为18 g/d,折算得大鼠中剂量为0.8 g/kg,再以此为基础得低、高剂量分别为0.4、1.6 g/kg。各药物组大鼠每天灌胃相应药液1 次,连续7 d;control组和model组大鼠灌胃等体积水。所有大鼠在造模前均禁食不禁水12 h;实验第5天,除control组大鼠灌胃等体积橄榄油外,其余各组大鼠均单次灌胃ANIT 橄榄油溶液(100 mg/kg)建立肝内胆汁淤积性肝损伤模型[2,11]。
2.3 大鼠生理状况观察
实验期间,每天记录各组大鼠的死亡情况,以及尿色、脱毛、精神状态等生理状况的变化情况。
2.4 标本采集与处理
实验第7天末次给药(即ANIT造模48 h)后,麻醉大鼠并于腹主动脉取血,以3 000 r/min 离心10 min,收集上层血清,于—80 ℃下保存,用于血清生化指标的检测。随后,处死各组大鼠,取一部分肝组织固定在4%多聚甲醛中,用于组织病理形态观察;其余肝组织立即冻存于液氮中,于—80 ℃下保存,用于相关蛋白及mRNA 的检测。
2.5 大鼠血清生化指标检测
取—80 ℃下保存的血清样品,按相关试剂盒说明书操作,以酶标仪检测各组大鼠血清中肝功能指标(AST、ALT、ALP、TBA、DBIL、TBIL)含量和氧化应激指标(MDA、GSH、SOD)水平。
2.6 大鼠肝组织病理形态观察
取固定于4%多聚甲醛中的肝组织适量,脱水,常规石蜡包埋,切片(厚度4~5 μm),经HE 染色后,置于显微镜下观察各组大鼠肝组织的病理形态变化。
2.7 大鼠肝组织中炎症和FXR 信号通路相关因子mRNA表达检测
采用实时定量PCR法进行检测。取—80 ℃下保存的肝组织适量,用Trizol 试剂提取总RNA(50 mg)并将其反转录为cDNA;以上述cDNA 为模板,进行PCR 扩增。反应体系(20 µL)包括:正、反引物各0.8 µL,TB Green Premix Ex Taq(2×)10 µL,ROX Reference Dye 2(50×)0.4 µL,cDNA 模板 2 µL,灭菌水6 µL。反应程序为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,共40 个循环。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,采用2—ΔΔCt法计算各组大鼠肝组织中炎症相关因子[肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)]和FXR信号通路相关因子[FXR、小异源二聚体伴侣受体(small heterodimer partner,SHP)、NTCP、有机阴离子转运多肽2(organic anion-transporting polypeptide 2,OATP2)、BSEP、MRP2、胆固醇7α羟化酶(cholesterol 7α-hydroxylase,CYP7A1)]mRNA 的表达水平,结果以control 组为参照进行归一化处理。引物由生工生物工程(上海)股份有限公司设计、合成,引物序列及产物长度见表1。
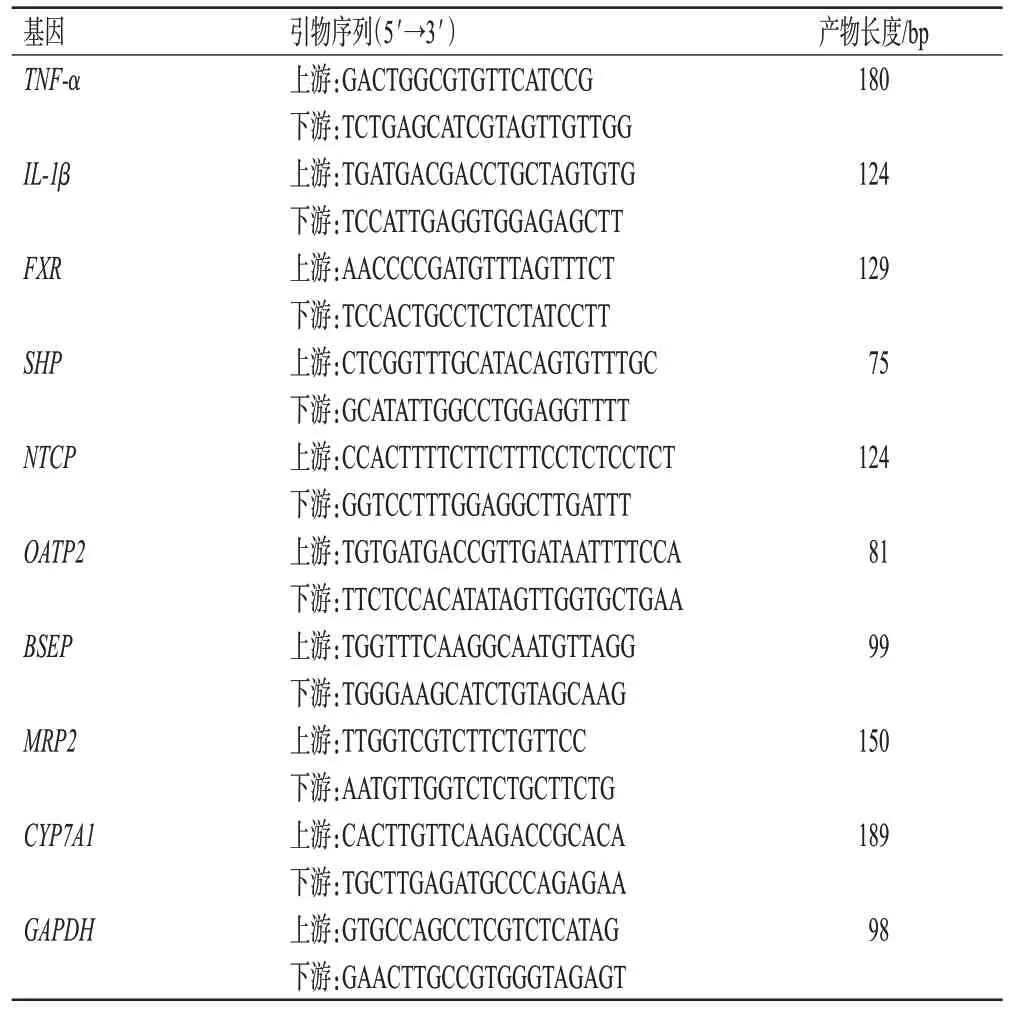
表1 PCR扩增引物序列及产物长度
2.8 大鼠肝组织中FXR 信号通路相关蛋白和NF-κB p65蛋白表达检测
采用Western blot法进行检测。取—80 ℃下保存的肝组织适量,经裂解、研磨、静置后,以12 000 r/min离心10 min,取上清液,测定蛋白浓度后煮沸变性;取变性蛋白样品适量,经电泳分离后转膜,封闭;加入FXR、MRP2、BSEP、NTCP、β-tubulin 和NF-κB p65 一抗(稀释比例分别为1∶4 000、1∶1 000、1∶1 000、1∶1 000、1∶5 000、1∶1 000),于4 ℃下孵育过夜;加入相应二抗(稀释比例1∶2 000),于室温下孵育1 h;以化学发光法显色,使用全自动成像分析系统成像。以β-tubulin为内参,计算目的蛋白与内参蛋白的灰度值比值,用以表示目的蛋白的相对表达量。
2.9 统计学方法
采用SPSS 25 软件对数据进行统计分析。数据以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 HBF对大鼠一般生理状况的影响
造模前,各组大鼠的精神状态、活动、尿色、毛发等生理状况均正常。造模后,与control 组比较,其余各组大鼠均出现不同程度的活动减少、皮肤瘙痒、尿黄等;与model 组比较,各药物组大鼠的上述生理状况均有一定程度的改善。各组大鼠均未死亡。
3.2 HBF对大鼠血清中肝功能指标的影响
与control 组比较,model 组大鼠血清中AST、ALT、ALP、TBA、DBIL、TBIL 含量均显著升高(P<0.01)。与model组比较,HBF-H组大鼠上述指标均显著降低(P<0.05或P<0.01),而HBF-L组、HBF-M组、UDCA组大鼠均只有部分指标显著降低(P<0.05 或P<0.01)。结果见表2。
表2 HBF 对大鼠血清中肝功能指标的影响(±s,n=6)
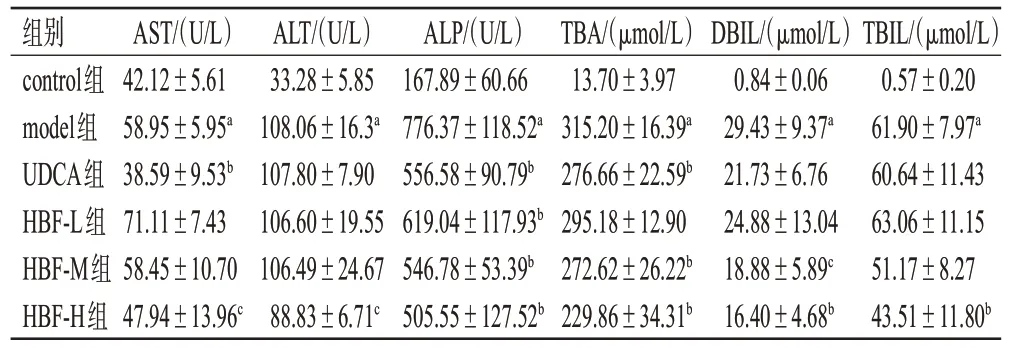
表2 HBF 对大鼠血清中肝功能指标的影响(±s,n=6)
a:与control组比较,P<0.01;b:与model组比较,P<0.01;c:与model组比较,P<0.05。
TBIL/(μmol/L)0.57±0.20 61.90±7.97a 60.64±11.43 63.06±11.15 51.17±8.27 43.51±11.80b组别control组model组UDCA组HBF-L组HBF-M组HBF-H组AST/(U/L)42.12±5.61 58.95±5.95a 38.59±9.53b 71.11±7.43 58.45±10.70 47.94±13.96c ALT/(U/L)33.28±5.85 108.06±16.3a 107.80±7.90 106.60±19.55 106.49±24.67 88.83±6.71c ALP/(U/L)167.89±60.66 776.37±118.52a 556.58±90.79b 619.04±117.93b 546.78±53.39b 505.55±127.52b TBA/(μmol/L)13.70±3.97 315.20±16.39a 276.66±22.59b 295.18±12.90 272.62±26.22b 229.86±34.31b DBIL/(μmol/L)0.84±0.06 29.43±9.37a 21.73±6.76 24.88±13.04 18.88±5.89c 16.40±4.68b
3.3 HBF对大鼠血清中氧化应激指标的影响
与control组比较,model组大鼠血清中MDA水平显著升高,GSH、SOD 水平均显著降低(P<0.05 或P<0.01)。与model 组比较,HBF-M 组、HBF-H 组、UDCA组大鼠血清中MDA、GSH 水平均显著逆转(P<0.05),HBF-L组大鼠血清中仅MDA水平显著逆转(P<0.05或P<0.01)。结果见表3。
表3 HBF 对大鼠血清中氧化应激指标的影响(±s,n=6)
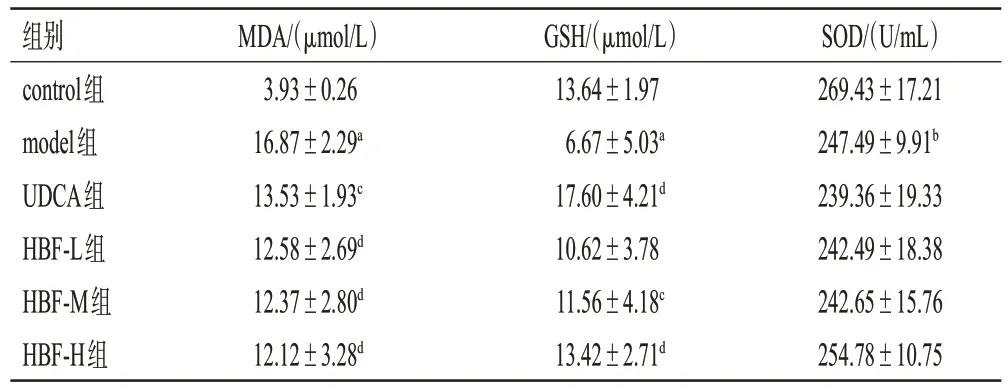
表3 HBF 对大鼠血清中氧化应激指标的影响(±s,n=6)
a:与control组比较,P<0.01;b:与control组比较,P<0.05;c:与model组比较,P<0.05;d:与model组比较,P<0.01。
组别control组model组UDCA组HBF-L组HBF-M组HBF-H组MDA/(μmol/L)3.93±0.26 16.87±2.29a 13.53±1.93c 12.58±2.69d 12.37±2.80d 12.12±3.28d GSH/(μmol/L)13.64±1.97 6.67±5.03a 17.60±4.21d 10.62±3.78 11.56±4.18c 13.42±2.71d SOD/(U/mL)269.43±17.21 247.49±9.91b 239.36±19.33 242.49±18.38 242.65±15.76 254.78±10.75
3.4 HBF对大鼠肝组织病理形态的影响
control 组大鼠肝组织形态结构完整,肝索结构清晰,肝细胞排列紧密,界限清晰且大小正常,未见明显异常;model 组大鼠肝组织受损严重,细胞边界缺失,中央静脉周围可见肝细胞灶性坏死,伴明显的炎症细胞浸润;UDCA 组大鼠肝组织中肝细胞形态结构较为完整,未见明显坏死;HBF-L 组大鼠肝组织形态结构有所好转,但仍伴有少量肝细胞灶性坏死和炎症细胞浸润;HBF-M组大鼠大部分肝细胞形态结构完整,伴有少量肝细胞灶性坏死和炎症细胞浸润;HBF-H组大鼠肝组织形态与control组相似,肝细胞形态结构保持完整,较model组显著好转。结果见图1。
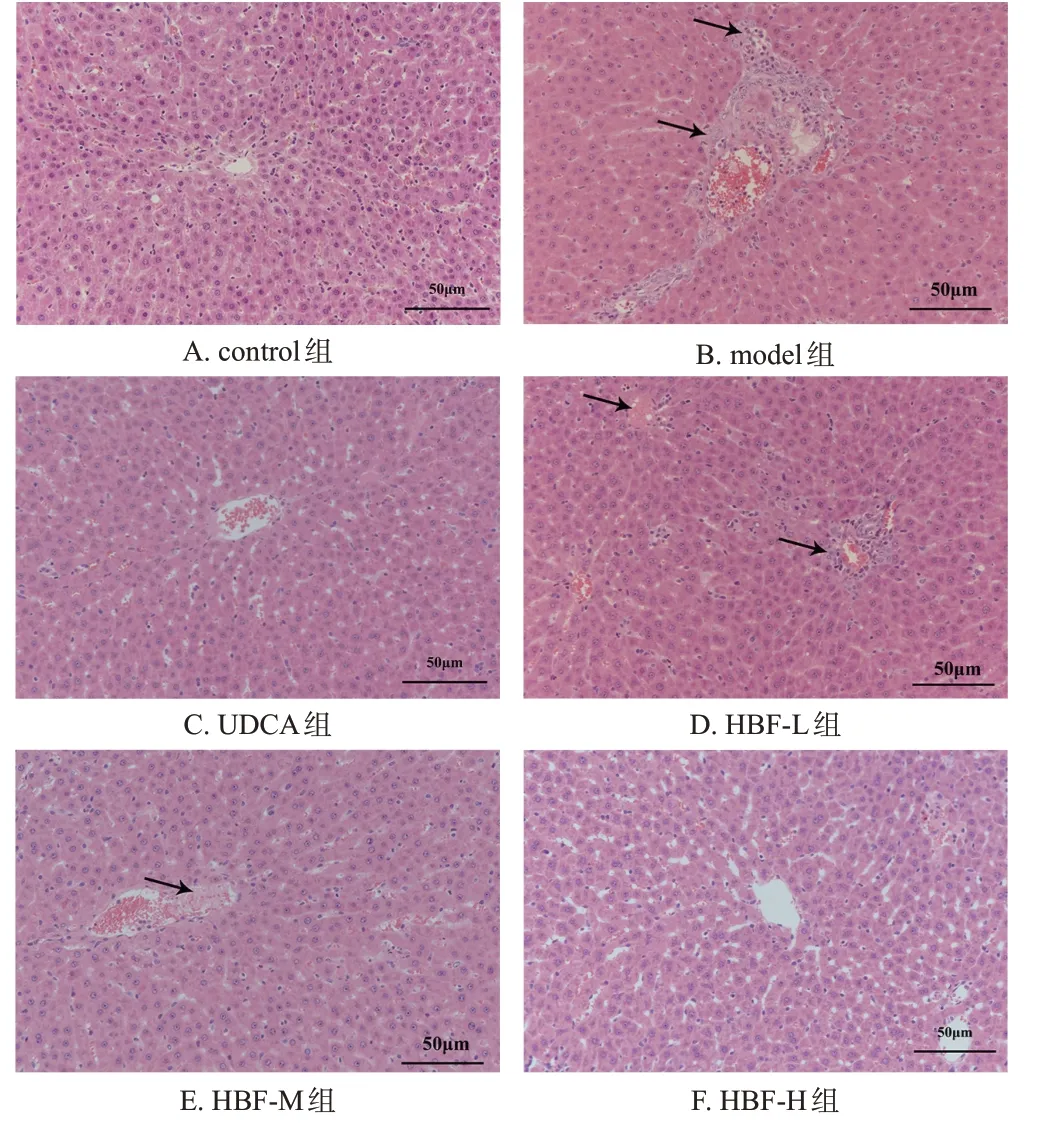
图1 HBF 对大鼠肝组织病理形态变化影响的显微图(HE染色)
3.5 HBF对大鼠肝组织中炎症相关因子mRNA表达的影响
与control 组比较,model 组大鼠肝组织中促炎因子TNF-α、IL-1β mRNA 的表达水平均显著升高(P<0.05或P<0.01)。与model 组比较,HBF-H 组大鼠肝组织中TNF-α、IL-1β mRNA 的表达水平均显著降低(P<0.05或P<0.01),HBF-M 组大鼠肝组织中仅TNF-α mRNA的表达水平显著降低(P<0.05)。结果见表4。
表4 HBF 对大鼠肝组织中炎症相关因子mRNA 表达的影响(±s,n=6)

表4 HBF 对大鼠肝组织中炎症相关因子mRNA 表达的影响(±s,n=6)
a:与control组比较,P<0.01;b:与control组比较,P<0.05;c:与model组比较,P<0.05;d:与model组比较,P<0.01。
IL-1β/GAPDH 1.02±0.21 1.57±0.20b 1.18±0.31 2.38±0.69 1.52±0.52 0.96±0.32c组别control组model组UDCA组HBF-L组HBF-M组HBF-H组TNF-α/GAPDH 1.12±0.65 8.12±2.66a 7.53±3.42 7.80±2.11 4.88±2.34c 2.92±2.90d
3.6 HBF对大鼠肝组织中FXR信号通路相关因子mRNA表达的影响
与control 组比较,model 组大鼠肝组织中FXR、SHP、MRP2、BSEP、NTCP、OATP2 mRNA的表达水平均显著降低,CYP7A1 mRNA 的表达水平显著升高(P<0.05 或P<0.01)。与model 组比较,HBF-H 组大鼠上述指标均显著逆转(P<0.05 或P<0.01),而HBF-L 组、HBF-M 组、UDCA 组大鼠均只有部分指标显著逆转(P<0.05或P<0.01)。结果见表5。
表5 HBF 对大鼠肝组织中FXR 信号通路相关因子mRNA表达的影响(±s,n=6)
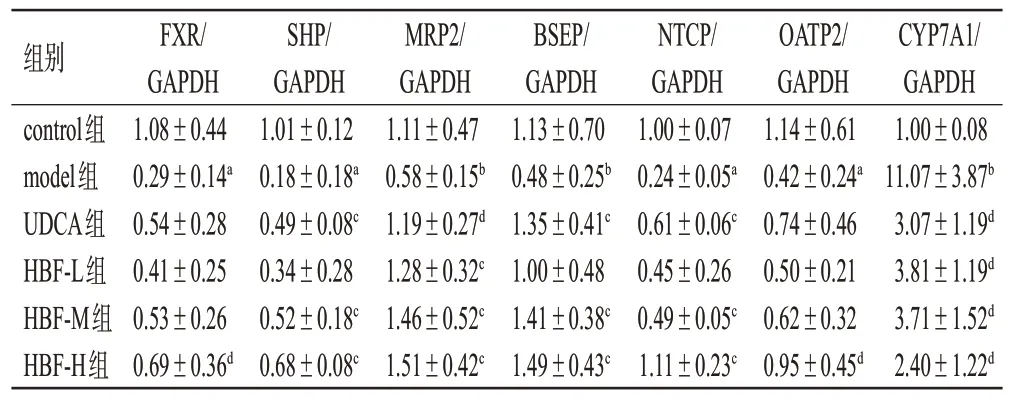
表5 HBF 对大鼠肝组织中FXR 信号通路相关因子mRNA表达的影响(±s,n=6)
a:与control组比较,P<0.01;b:与control组比较,P<0.05;c:与model组比较,P<0.01;d:与model组比较,P<0.05。
CYP7A1/GAPDH 1.00±0.08 11.07±3.87b 3.07±1.19d 3.81±1.19d 3.71±1.52d 2.40±1.22d组别control组model组UDCA组HBF-L组HBF-M组HBF-H组FXR/GAPDH 1.08±0.44 0.29±0.14a 0.54±0.28 0.41±0.25 0.53±0.26 0.69±0.36d SHP/GAPDH 1.01±0.12 0.18±0.18a 0.49±0.08c 0.34±0.28 0.52±0.18c 0.68±0.08c MRP2/GAPDH 1.11±0.47 0.58±0.15b 1.19±0.27d 1.28±0.32c 1.46±0.52c 1.51±0.42c BSEP/GAPDH 1.13±0.70 0.48±0.25b 1.35±0.41c 1.00±0.48 1.41±0.38c 1.49±0.43c NTCP/GAPDH 1.00±0.07 0.24±0.05a 0.61±0.06c 0.45±0.26 0.49±0.05c 1.11±0.23c OATP2/GAPDH 1.14±0.61 0.42±0.24a 0.74±0.46 0.50±0.21 0.62±0.32 0.95±0.45d
3.7 HBF 对大鼠肝组织中FXR 信号通路相关蛋白及NF-κB p65蛋白表达的影响
与control 组比较,model 组大鼠肝组织中FXR、MRP2、BSEP、NTCP蛋白的相对表达量均显著降低,NFκB p65 蛋白的相对表达量显著升高(P<0.01)。与model组比较,HBF-H组大鼠上述指标均显著逆转(P<0.05或P<0.01),而HBF-L组、HBF-M组、UDCA组大鼠均只有部分指标显著逆转(P<0.05 或P<0.01)。结果见图2、表6。
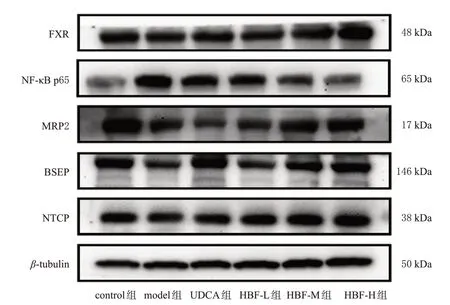
图2 HBF 对大鼠肝组织中FXR 信号通路相关蛋白及NF-κB p65蛋白表达影响的电泳图
表6 HBF 对大鼠肝组织中FXR 信号通路相关蛋白及NF-κB p65蛋白表达的影响(±s,n=6)
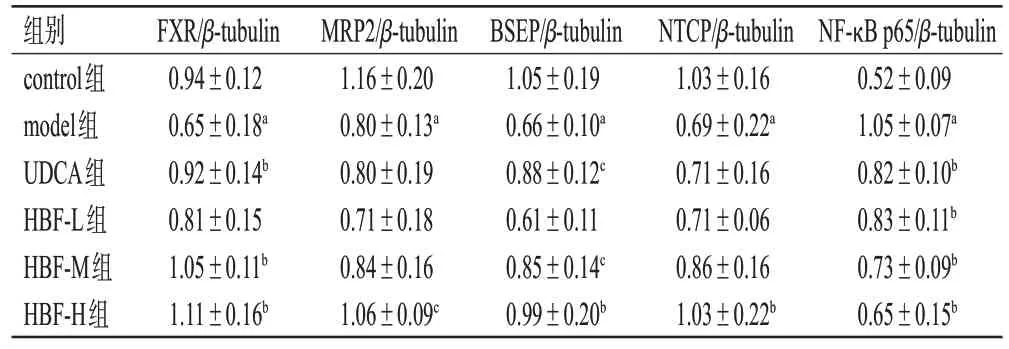
表6 HBF 对大鼠肝组织中FXR 信号通路相关蛋白及NF-κB p65蛋白表达的影响(±s,n=6)
a:与control组比较,P<0.01;b:与model组比较,P<0.01;c:与model组比较,P<0.05。
NF-κB p65/β-tubulin 0.52±0.09 1.05±0.07a 0.82±0.10b 0.83±0.11b 0.73±0.09b 0.65±0.15b组别control组model组UDCA组HBF-L组HBF-M组HBF-H组FXR/β-tubulin 0.94±0.12 0.65±0.18a 0.92±0.14b 0.81±0.15 1.05±0.11b 1.11±0.16b MRP2/β-tubulin 1.16±0.20 0.80±0.13a 0.80±0.19 0.71±0.18 0.84±0.16 1.06±0.09c BSEP/β-tubulin 1.05±0.19 0.66±0.10a 0.88±0.12c 0.61±0.11 0.85±0.14c 0.99±0.20b NTCP/β-tubulin 1.03±0.16 0.69±0.22a 0.71±0.16 0.71±0.06 0.86±0.16 1.03±0.22b
4 讨论
ANIT是常用的肝脏毒性物质,可阻断胆汁流动,使胆汁酸在肝脏内蓄积,导致胆汁淤积[12]。因此,本研究采用ANIT 诱导建立大鼠胆汁淤积性肝损伤模型,用以探讨HBF 防治胆汁淤积的作用及潜在机制。AST、ALT、ALP、TBA、DBIL、TBIL 是临床评价胆汁淤积性肝损伤的基本血清生化指标,ANIT干预后48 h,血清中的上述指标均可达到峰值[11]。本研究结果显示,model 组大鼠血清中AST、ALT、ALP、TBA、DBIL、TBIL 含量均显著高于control 组,其肝组织受损严重,可见肝细胞灶性坏死和炎症细胞浸润,提示ANIT 致胆汁淤积性肝损伤大鼠模型复制成功。与model 组比较,HBF 和UDCA均能不同程度地逆转上述肝功能指标的升高,并能不同程度地改善肝组织病理形态变化,其中HBF-H组大鼠上述肝功能指标均显著低于model 组,肝组织形态与control组相似。
氧化应激在多种肝脏疾病的发生和发展中发挥关键作用。GSH、SOD、MDA是评估人体抗氧化能力的重要指标。本研究结果显示,与model 组比较,HBF-H 组大鼠肝组织中MDA水平显著降低,GSH水平显著升高,提示高剂量的HBF 可以缓解大鼠胆汁淤积性肝损伤造成的氧化应激。可见,HBF 对ANIT 诱导的胆汁淤积性肝损伤有良好的防治作用。
肝细胞是具有极性结构的上皮细胞,分为胆小管区和基底外侧区。作为肝细胞的基底侧膜转运体,胆汁酸摄取转运体NTCP和OATP2负责胆汁酸的重吸收,而胆汁酸可负向降低NTCP 和OATP2 的表达[13]。作为胆小管区转运蛋白的BSEP 和MRP2 能促使胆汁酸、胆盐从肝细胞排泄到胆管[11]。此外,CYP7A1 是胆汁酸合成的关键酶,FXR 的激活会诱导SHP 的表达,从而抑制CYP7A1的活性[14]。FXR是首个被学界正式确认的核受体,广泛分布于肝脏、肠道、肾脏和肾上腺等器官/组织[15]。胆汁酸是天然的FXR 配体[16],上述细胞因子均由FXR直接或间接调控,FXR与类视黄醇X受体形成的异源二聚体可通过激活SHP 来调节胆汁酸的稳态。在病理状态下,NTCP 表达的下调可能导致胆汁酸的摄入减少,从而导致胆汁淤积的发生或现有胆汁淤积性疾病的加重[15]。胆汁酸的蓄积可触发肝细胞中促炎因子的产生,从而启动炎症反应[12]。NF-κB p65 是调节炎症反应的关键转录因子,当胆汁淤积性肝损伤模型大鼠受到炎症因子TNF-α、IL-1β 刺激时,NF-κB p65 蛋白的表达将会升高,从而进一步加重炎症反应[17]。此外,还有研究表明,FXR也可通过与NF-κB亚基结合来抑制NF-κB的活性,从而调节炎症反应[13]。本研究结果显示,高剂量的HBF 可显著上调模型大鼠肝组织中FXR、BSEP、MRP2、NTCP mRNA 及蛋白的表达,抑制NF-κB p65 蛋白的表达,同时还可上调SHP、OATP2 mRNA的表达,下调CYP7A1和促炎因子TNF-α、IL-1β mRNA的表达,表明HBF 可能通过调控FXR 信号通路、抑制炎症反应来预防大鼠胆汁淤积性肝损伤。
综上所述,HBF对大鼠肝内胆汁淤积性肝损伤具有预防作用,此作用可能是通过激活FXR 信号通路、减轻炎症和氧化应激来实现的。
