小细胞肺癌的临床用药方案现状及潜在靶点药物治疗方案新进展Δ
2023-08-31章欢琪沈姝颖李杨玲浙江大学药学院临床药学研究中心杭州10006浙江大学医学院附属第一医院胸外科杭州10006浙江大学医学院附属杭州市第一人民医院临床药理研究室浙江省临床肿瘤药理与毒理学研究重点实验室杭州10006
章欢琪 ,林 旭 ,沈姝颖 ,李杨玲 (1.浙江大学药学院/临床药学研究中心,杭州 10006;.浙江大学医学院附属第一医院胸外科,杭州 10006;.浙江大学医学院附属杭州市第一人民医院临床药理研究室/浙江省临床肿瘤药理与毒理学研究重点实验室,杭州 10006)
肺癌是全球发病率和病死率均排名首位的恶性肿瘤[1]。依照组织病理学特征可将肺癌分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(nonsmall cell lung cancer,NSCLC),其中SCLC 约占肺癌的15%[2]。SCLC 恶性程度高,异质性和侵袭性均较强,且容易发生淋巴结转移。多数SCLC患者确诊时已处于广泛期,且常伴有内分泌异常,病情发展迅速,转移部位以脑、肝、肾上腺、骨和骨髓较为常见[3]。SCLC治疗药物主要包括以铂类药物为代表的化疗药和以靶向程序性死亡受体配体1(programmed death-ligand 1,PD-L1)抑制剂为代表的免疫药物,涉及众多具有潜在发展前景的治疗靶点。长期以来,SCLC 的药物治疗方案始终以包含非特异性DNA 损伤剂的化疗方案为基础,但该方案的毒副作用较大。近年来,新型免疫药物和细胞毒性药物的出现在一定程度上提高了SCLC 患者的生存率,基于新靶点的药物研发为SCLC患者的临床治疗提供了新选择,为复发/难治型SCLC患者带来了治疗希望。本文就SCLC临床用药方案的现状及潜在靶点药物治疗方案的新进展进行综述,旨在为SCLC 的药物治疗管理和新治疗靶点的选择提供参考。
1 临床用药方案现状
依托泊苷联合顺铂或卡铂是广泛期SCLC(extensive stage SCLC,ES-SCLC)标准一线治疗的基础,可使患者的总缓解率达到60%~80%,但存在易耐药、易复发的问题[4]。随着免疫治疗的发展,免疫治疗联合化疗被证实可改善ES-SCLC患者的总生存期,其中PD-L1抑制剂阿替利珠单抗、度伐利尤单抗和阿得贝利单抗联合化疗方案先后被美国FDA批准作为ES-SCLC患者的首选治疗方案,其可改善患者病情,且安全可控[5—7]。此外,国产程序性死亡受体1(programmed death-1,PD-1)抑制剂斯鲁利单抗联合化疗方案已在我国获批用于ESSCLC 的一线治疗[8]。由此可见,免疫疗法已成为ESSCLC 一线治疗的重要选择,其作用靶点主要集中在DNA、拓扑异构酶Ⅱ和免疫检查点分子PD-1/PD-L1。
综合国内外权威肺癌诊疗相关指南,SCLC 的二线治疗方案除传统化疗药物[如拓扑替康(topotecan)、多西他赛、口服型依托泊苷、吉西他滨、伊立替康、紫杉醇、长春瑞滨等]外,近年还新增了芦比替定(lurbinectedin)[9—12]。SCLC的三线治疗药物包括小分子酪氨酸激酶抑制剂安罗替尼等[13—14]。SCLC 二、三线治疗方案药物的作用靶点主要集中在DNA、RNA、微管蛋白和血管内皮生长因子受体等。
SCLC 一、二、三线治疗药物的临床研究现状见表1。
2 潜在靶点药物治疗方案新进展
受SCLC 一线化疗方案的启发,学者们深入探索了DNA 损伤应答(DNA-damage response,DDR)通路抑制剂对肿瘤细胞生长的影响[15]。研究发现,DDR通路抑制剂包括针对极光激酶A(aurora kinase A,AAK)、多腺苷二磷酸核糖聚合酶[poly(ADP-ribose)polymerase,PARP]、共济失调毛细血管扩张突变因子Rad3相关激酶(ataxia telangiectasia and Rad3-related,ATR)、WEE1、细胞周期检测点激酶1/2(checkpoint kinase 1/2,CHK1/2)、共济失调毛细血管扩张突变基因(ataxia telangiectasiamutated gene,ATM)等的抑制剂,其不但可作为传统放化疗增敏的突破口,而且可有效提升免疫治疗的效果[16—18]。除此之外,抗神经节苷脂、抗Notch信号转导等与免疫通路相关的治疗方案也正在进行临床试验。目前,正在进行的SCLC潜在靶点药物治疗方案的临床试验见表2。
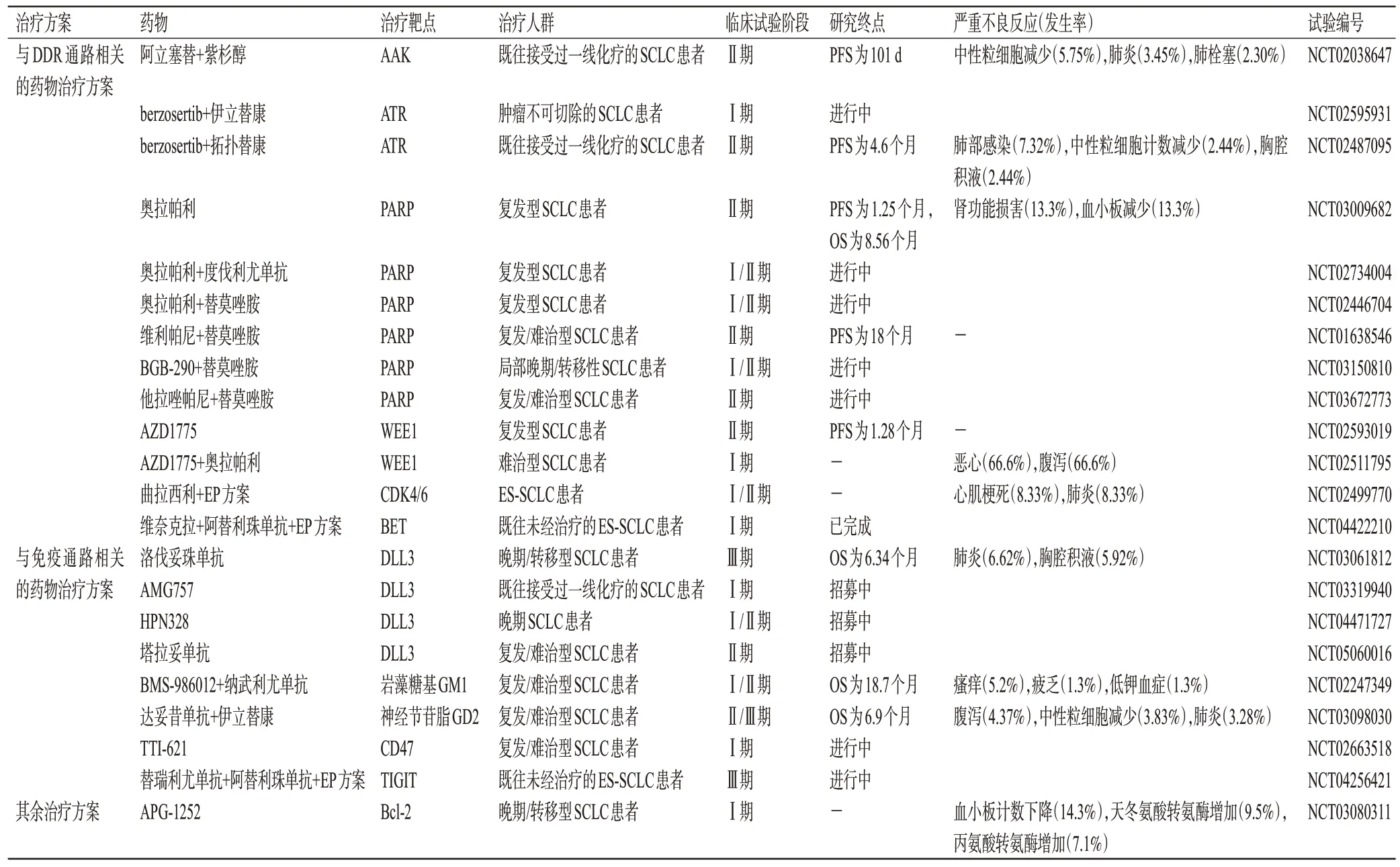
表2 正在进行的SCLC潜在靶点药物治疗方案的临床试验
2.1 以AAK为靶点的潜在药物治疗方案
AAK是一种转录因子,可与骨髓细胞瘤病毒癌基因(cellular-myelocytomatosis viral oncogene,c-MYC)结合,通过调节细胞周期来影响细胞的凋亡行为[19]。研究指出,以AAK抑制剂破坏AAK和c-MYC复合物可诱导细胞凋亡,该抑制剂可能是一种有吸引力的潜在治疗策略;同时,c-MYC 在18%~31%的SCLC 标本中呈高表达,其表达量会在一定程度上正向影响AAK 抑制剂的疗效[20]。阿立塞替是一种可供口服的AAK 抑制剂,在SCLC 的治疗中有一定的安全性,其严重不良反应多涉及血液系统,以中性粒细胞减少、白细胞减少和贫血较为常见[21]。目前,以阿立塞替联合紫杉醇为SCLC 二线治疗方案的Ⅱ期试验(试验编号NCT02038647)已经结束,结果显示,该方案可有效延长既往接受过一线化疗SCLC患者的PFS。
2.2 以ATR为靶点的潜在药物治疗方案
ATR是S期复制检查点的调节蛋白,ATR抑制剂可通过阻滞细胞周期来发挥对肿瘤细胞的杀伤作用[22]。Ⅱ期临床试验(试验编号NCT02487095)评价显示,ATR抑制剂berzosertib联合拓扑异构酶Ⅰ抑制剂拓扑替康可在既往接受过一线化疗的SCLC患者体内发挥抗肿瘤活性,且具有较好的耐受性;Ⅰ期临床试验(试验编号NCT02595931)评价显示,berzosertib联合伊立替康用于治疗肿瘤不可切除SCLC患者的安全性可控。
2.3 以PARP为靶点的潜在药物治疗方案
PARP 可参与DNA 的损伤修复,在SCLC 组织中的表达水平较高。尽管尚未获得上市批准,烷化剂替莫唑胺在治疗复发型SCLC 方面表现出色,尤其对脑转移患者的疗效更为显著;同时,联用PARP抑制剂还可改善替莫唑胺的耐药情况[23]。 临床试验(试验编号NCT01638546)也发现,替莫唑胺联合PARP抑制剂维利帕尼可有效提高复发/难治型SCLC患者的ORR,并可通过检测Schlafen家族成员11蛋白的表达来评价PARP抑制剂的疗效[24]。另外,PARP抑制剂还可显著增加SCLC细胞表面PD-L1蛋白的表达水平,促进肿瘤浸润T淋巴细胞的增殖,进而达到与抗PD-L1 治疗相辅相成的效果,表现出联合治疗SCLC的潜力[25]。
2.4 以WEE1为靶点的潜在药物治疗方案
WEE1 是一种重要的蛋白激酶,能抑制周期蛋白的磷酸化。在SCLC 群体中,WEE1 的表达水平显著高于正常人和NSCLC 患者,差异倍数分别为4.23 和1.66[26]。虽然相应抑制剂的Ⅱ期临床试验没有明确患者的ORR,但不能否认WEE1 仍然是SCLC 治疗中重要的潜在靶点,在治疗复发/难治型SCLC方面具有巨大的潜力[27]。
2.5 以周期相关激酶为靶点的潜在药物治疗方案
CHK1和CHK2分别是ATR和ATM的下游靶点,在SCLC 细胞中表现出较高的表达水平,应用其抑制剂可能会造成DNA 损伤增加,进而诱导肿瘤细胞的老化和凋亡。然而,由于CHK1/2抑制剂的选择能力较差,加之脱靶相关严重不良反应最终导致了临床试验的结束[28]。2021年,CDK4/6抑制剂曲拉西利被美国FDA批准用于ES-SCLC 患者的临床治疗,其与EP 的联合方案能有效减少化疗所致的骨髓抑制,提高患者的生存质量[29]。
2.6 以DLL3为靶点的潜在药物治疗方案
DLL3是Notch受体配体家族成员之一,能有效抑制Notch激活,是SCLC治疗药物研发的另一个重要靶点。研究发现,DLL3在约80%的SCLC标本中均有表达,而在正常成人组织中的表达率较低[30]。AMG757 是针对DLL3 和CD3 的双特异性抗体,在临床前研究工作中表现出较好的安全性和干预效果,目前正在积极推进Ⅰ期试验(试验编号NCT03319940),以期为既往接受过一线化疗的SCLC患者提供新的治疗选择[31]。
2.7 以神经节苷脂为靶点的潜在药物治疗方案
大多数SCLC患者肿瘤组织中神经节苷脂的表达均有所上调[32]。岩藻糖基GM1是一种神经节苷脂,在70%的SCLC 标本中均有表达。BMS-986012 作为一种单克隆抗体,对岩藻糖基GM1具有特异性亲和力,单用可提高复发/难治型SCLC患者的OS(可达5.4个月)[33—34]。达妥昔单抗(dinutuximab)是一种嵌合抗体,可与神经节苷脂GD2 特异性结合[35]。该药联合伊立替康用于复发/难治型SCLC 患者的Ⅱ/Ⅲ期临床试验(试验编号NCT03098030)结果显示,该联合方案可使患者的OS达到6.9个月。
2.8 以CD47为靶点的潜在药物治疗方案
CD47 属于免疫球蛋白超家族,普遍表达于细胞表面,当CD47 与巨噬细胞表面信号调节蛋白α 的相互作用被阻断时,由此介导的肿瘤细胞免疫逃逸将有所减少。目前,针对CD47的免疫检查点抑制剂TTI-621正处于Ⅰ期临床研究阶段,旨在评价该药用于复发/难治型SCLC等恶性肿瘤的安全性和耐受性[36]。
2.9 以TIGIT为靶点的潜在药物治疗方案
TIGIT一旦被激活,便会对细胞免疫反应产生抑制,且相较于正常细胞,TIGIT 及其主要配体CD155 在SCLC 细胞中均呈较高表达。替瑞利尤单抗(tiragolumab)作为一种TIGIT抗体,目前正在推进其联合阿替利珠单抗、EP 方案用于既往未经治疗的ES-SCLC 患者的Ⅲ期临床试验(试验编号NCT04256421)[37]。
2.10 以Bcl-2为靶点的潜在药物治疗方案
Bcl-2是一种抗凋亡蛋白,在高达75%的SCLC标本中呈高表达,且与化疗耐药密切相关[38]。APG-1252是一种有效的Bcl-2抑制剂,目前已完成Ⅰ期临床试验,初步结果显示,该抑制剂具有较高的治疗指数,血小板计数下降等不良反应会在2~6 d内消退,尚未发现有明显的血液毒性[39]。
3 结语
目前,SCLC 的标准治疗方案主要涵盖细胞毒性药物和免疫药物,作用靶点主要集中在DNA、免疫抑制性检查点PD-1/PD-L1、微管蛋白等。其中,化疗方案能有效治疗大多数SCLC患者,但存在耐药和复发的情况;二线化疗方案的副作用也较为明显,基于DNA 损伤的细胞毒性药物有进一步减少不良反应的必要。免疫疗法的出现为SCLC 的治疗注入了新的动力,其主要通过调动机体内免疫防御功能而发挥抗肿瘤的作用,毒副作用大多为免疫性炎症反应。针对SCLC 治疗后易复发、易耐受的难题,免疫治疗联合化疗方案是临床肿瘤治疗的主要手段。目前,SCLC 潜在治疗药物的靶点主要集中在DDR、免疫等通路,可通过不同作用机制而实现延长患者生存期的治疗目标。更多免疫联合治疗方案正在积极探索中,通过探寻其余可增强免疫反应的靶点或明确具有预测作用的生物标志物,进而逐步完善SCLC 的治疗方案,以充分保证免疫疗法的治疗效果。
