百令胶囊上调miR-145-5p 逆转TGF-β1/Smad3通路机制初探*
2023-08-29姬泽萱陈丽萍
冯 平,姬泽萱,陈丽萍,王 布
(河北北方学院附属第一医院,河北 张家口 075000)
1 材料与方法
1.1 仪器、试药、动物与细胞
仪器:Finepointe 型无限制肺功能测试体积描记仪(美国Buxco 公司);DSX1000 型光学显微镜和摄影系统、BX53 型荧光显微镜(日本Olympus 公司);SJ - 8 型微孔板读取器(美国Thermo Fisher Scientific 公司);CR30NX 型离心机(美国Eppendorf 公司);UV2700 型紫外-可见分光光度计(日本Shimadzu公司)。
试药:BLC(杭州中美华东制药有限公司,批号为2005118D);卷烟(芙蓉王滤嘴卷烟,湖南中烟工业有限责任公司,批号为063814,每支含焦油11 mg、尼古丁1.0 mg、一氧化碳12 mg);Smad3 一抗(美国Cell Signaling Technologies 公司,批号为ybs9316);Alexa Fluor 488共轭二抗(英国Abcam 公司,批号为330192);4',6-二氨基-2-苯基吲哚(DAPI,批号为Az402),Trizol 试剂(批号为R0024),DMEM 培养基(批号为1105119),均购自美国Invitrogen公司;CCK-8分析试剂盒(日本Dojindo公司,批号为abs50013);转化生长因子(TGF)-β1酶联免疫吸附试验(ELISA)试剂盒(天津一安生物技术有限公司,批号为DB203F);TaqMan microRNA 逆转录试剂盒(批号为T90F42)、SYBR green(批号为S9137),均购自美国Applied Biosystems 公司;Mayer 苏木精(批号为A200407),1%伊红(批号为A217362),均购自南京生航生物技术有限公司;10% 胎牛血清(FBS,批号为SH30070.03),100 IU/mL 青霉素和100µg/mL 链霉素(批号为J130061),均购自美国Hyclone公司。
动物:SD大鼠,雌雄各半,年龄6~8 周,体质量(200 ±20)g,购自上海斯莱克实验动物有限责任公司,实验动物生产许可证号SCXK(沪)2022 - 0008。在相对湿度(50±10)%、温度(25±2)℃和光照(12 h 光/暗循环)下适应性饲养7 d,自由进食饮水。
菌种及细胞:肺炎克雷伯菌(中国典型培养物保藏中心,编号为M2019851);BEAS-2B 细胞株(美国细胞培养收藏中心,编号为H-EMC-63)。
1.2 方法
1.2.1 在体实验
模型建立[7]:将大鼠置密闭空间(50 cm × 60 cm ×70 cm),暴露于8 支香烟的烟雾中,每天2 次,每次30 min,前2 周内无烟间隔3 h;随后的10 周内,暴露于15 支香烟的烟雾中,每天3 次,每次30 min,无烟间隔3 h。前8 周内每5 天接种1 次肺炎克雷伯菌悬液(6 ×108cfu/mL,100µL)。对照大鼠暴露于空气中。
分组及给药:建模第9 周,将60 只大鼠分为正常对照组(2 mL 生理盐水)、模型组(2 mL 生理盐水)、BLC 组(5.5 mg/kg[8])、miR-145-5p inhibitor 阴性对照片段(inhibitor NC)组[5.5 mg/kg BLC+6µL(0.02 nmol/µL生理盐水)inhibitor NC]、miR-145-5p inhibitor(inhibitor)组[5.5 mg/kg BLC+6µL(0.02 nmol/µL 生理盐水)inhibitor],各12 只。大鼠分别灌胃相应药物及生理盐水,每天1 次,连续8 周;inhibitor NC 及inhibitor 以尾静脉给药,每周1 次,连续8 周。本研究方案经医院医学伦理委员会批准(批件号K2020047)。
主要对波纹结构对流动的影响进行分析,取入口速度恒为1m/s。设为速度入口边界;压力出口边界,压力值为0Pa;管道壁面设为无滑移边界。
肺功能:大鼠予腹腔注射戊巴比妥钠(35 mg/kg)麻醉,置连接Buxco 气流传感器的参考室内。每4 周评估1 次潮气量(TV)、呼气峰流量(PEF)和分钟通气量(MV)。第16 周,麻醉大鼠,测定用力肺活量(FVC)和第0.3秒用力呼气容积(FEV0.3)。
病理形态:末次给药后,收集大鼠左下叶肺组织样本,用10%过氧化氢(H2O2)溶液固定,石蜡包埋,制成4 µm 厚切片。1)用Mayer 苏木精和1%伊红染色,置光学显微镜下观察。使用Adobe Photoshop CC 软件的计数工具计算肺泡平均线性截距(µm)和平均肺泡数(单位面积为1 mm2)。2)将切片在二甲苯中脱蜡,用分级乙醇水合;置121 ℃高压灭菌器中10 min 提取抗原,在25 ℃条件下、以3%H2O2孵育0.5 h 以阻断内源过氧化物酶活性。将切片用磷酸盐缓冲液(PBS)清洗,并用10% 山羊血清孵育0.5 h,然后与Smad3 的一抗(1∶500,V/V)孵育过夜。次日,在37 ℃条件下用过氧化物酶结合的二抗孵育60 min,再用3,3' - 二氨基联苯胺进行免疫染色,以苏木精进行复染,置光学显微镜下观察。
TGF - β1表达:末次给药后,取0.2 g 大鼠肺组织,于2 mL生理盐水中匀浆,1 000 r/min离心15 min,得上清液,用ELISA法测定TGF-β1的表达水平。
miR - 145- 5p mRNA 表达:采用实时荧光定量聚合酶链反应(RT-qPCR)法。以Trizol法提取RNA,鉴定其纯度和完整性并反转录制备cDNA;PCR 反应条件为,95 ℃预变性1 min;95 ℃变性15 s,58 ℃退火20 s,72 ℃延伸20 s,循环40 次;72 ℃延伸5 min 终止反应。RT-qPCR 反应结束后,定量分析获得的熔解曲线和扩增曲线结果,并设定循环阈值(Ct),以U6 小RNA 为内源性对照,用2-ΔΔCt法计算RNA 的相对表达量。引物如下:miR - 145 - 5p(正向,5' - GGACGGACAGGGAGGCCAAA - 3';反向,5' - TTTGGCCTCCTCTCGCTCGCGCGTCC - 3')和U6(正向,5' - CTCGCTTCGGCAGCACA-3';反向,5'-AACGCTTCGCGCAGGCAA-3')。各组设3个复孔,实验重复3次。
1.2.2 离体实验
香烟烟雾提取物(CSE)制备[9]:将2 支点燃香烟的烟雾鼓入10 mL DMEM 培养基中,并经0.22µm 过滤器滤过,制备新鲜原始溶液,测定吸光度(OD)。将320 nm波长处的溶液作为100%CSE。
BLC 药物血清(BLC - S)制备:取10 只大鼠,均灌胃5.5 mg/kg BLC,每天1次,连续7 d。末次给药后2 h,腹主动脉取血,3 000 r/ min 离心15 min,取上清液;56 ℃条件下灭活30 min,经0.22 µm 过滤器滤过,得BLC-S,贮藏于-80 ℃,备用。另取10 只大鼠灌胃等体积生理盐水,同法制备空白血清。
细胞活力:采用CCK-8法检测。BEAS-2B细胞培养于含10%FBS、100 IU/mL 青霉素和100µg/ml 链霉素的DMEM 培养基中。取对数生长期的细胞,以每孔3 000 个的细胞密度接种于96 孔培养板中,孵育12 h,将细胞暴露于0(空白对照),3%,5%,10%,20% CSE中,加5%,10%,20%,40%BLC - S 孵育48 h;加10 µL CCK - 8 溶液孵育2 h,检测450 nm 波长处的OD。细胞活力(%)=(ODBLC-S-ODblank)/(ODcon-ODblank)×100%。实验重复3次。
TGF-β1表达:取对数生长期的细胞,以BEAS-2B细胞与5%CSE 和20%BLC - S 孵育48 h,收集培养基,3 000 r/ min 离心15 min,取上清液,用ELISA 法测定TGF-β1的表达水平。
Smad3 表达:取对数生长期的细胞,与5%CSE 和20%BLC-S 孵育48 h,4 ℃条件下以4%多聚甲醛冰凉溶液固定20 min,用0.5%Triton X - 100 渗透,用3%BSA在室温下封闭1 h。将细胞与Smad3一抗(1∶200,V/V)在4 ℃下孵育过夜;洗涤,将细胞与Alexa Fluor 488 共轭二抗(1∶5 000,V/V)在室温下孵育2 h;洗涤,用DAPI对细胞核染色5 min,置荧光显微镜下观察。
miR-145-5p mRNA表达:取对数生长期的细胞,将BEAS - 2B 细胞与5%CSE 和20%BLC - S 孵育48 h。按相应方法检测miR-145-5p mRNA的表达水平。
1.2.3 统计学处理
2 结果
2.1 大鼠肺功能
与正常对照组比较,模型组大鼠TV,MV,PEF,FVC,FEV0.3均显著降低(P<0.05);与模型组比较,BLC 组及inhibitor NC 组大鼠上述指标均显著升高(P<0.05);与inhibitor NC 组比较,inhibitor组大鼠上述指标均显著降低(P<0.05)。详见图1(其中与正常对照组/ 空白对照比较,*P<0.05,**P<0.01;与模型组/5%CSE 条件比较,#P<0.05,##P<0.01;与inhibitor NC 组/5%CSE+20%BLC-S+inhibitor NC 条件比较,&P<0.05。图2,图4至图7同。)。
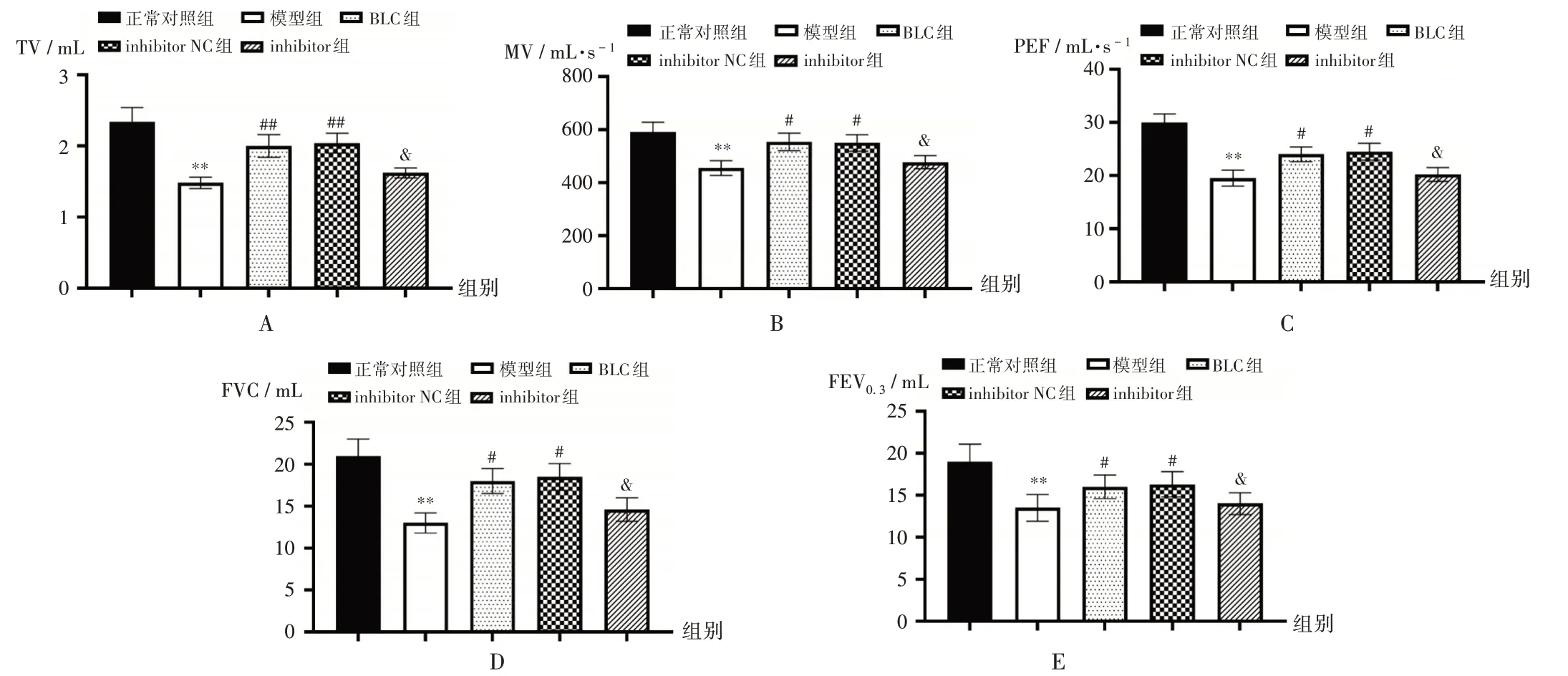
图1 各组大鼠肺功能指标Fig.1 Lung function indicators in each group
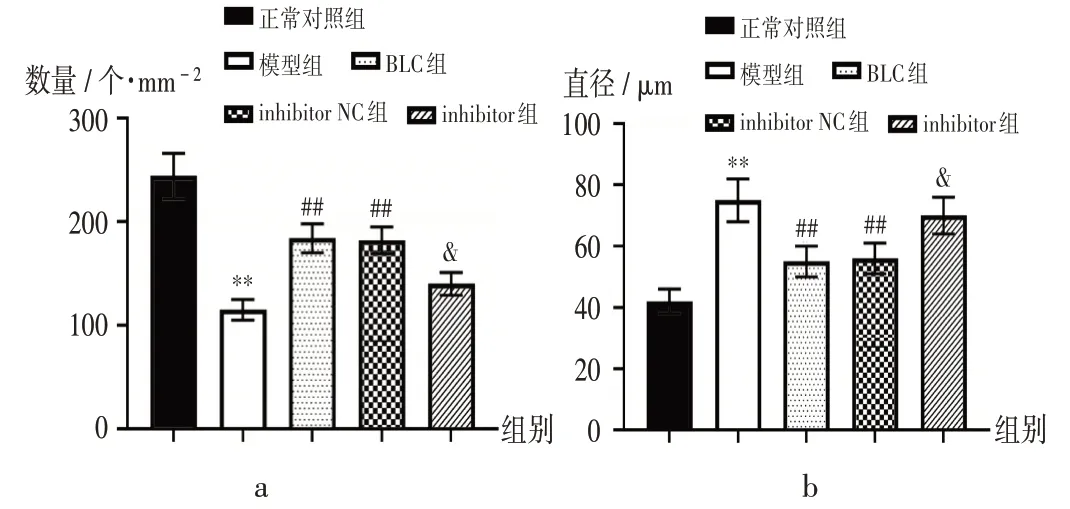
图2 各组大鼠肺泡数及直径Fig.2 Alveolus count and diameter in each group
2.2 大鼠肺组织病理形态
模型组大鼠肺组织出现如肺泡破坏和肺泡腔扩张等严重病理变化。与模型组比较,BLC组及inhibitor NC组大鼠肺组织病理形态显著改善,平均肺泡数显著增加,肺泡直径显著减小(P<0.05);与inhibitor NC 组比较,inhibitor组大鼠肺组织病理形态未改善,且平均肺泡数显著减少,肺泡直径显著增长(P<0.05)。详见图2、图3。
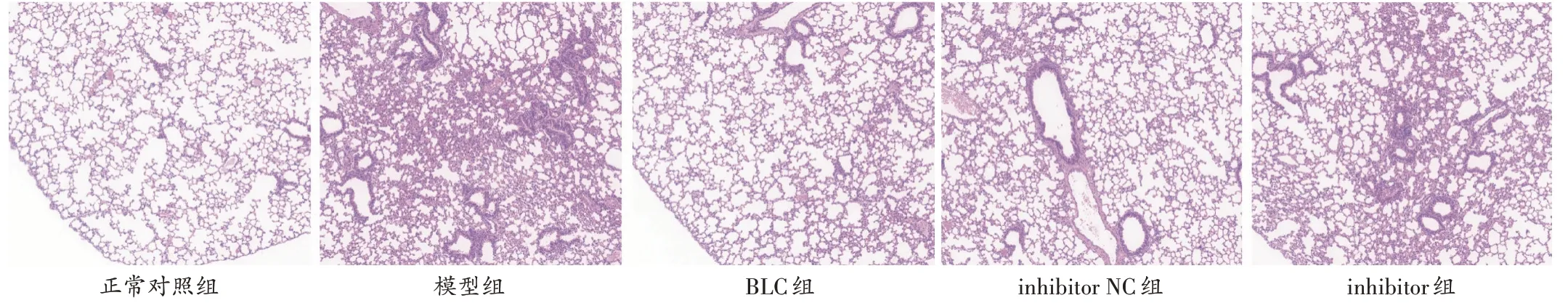
图3 各组大鼠肺组织形态(HE,×100)Fig.3 Morphology of lung tissue in each group(HE,× 100)
2.3 细胞活力
5%CSE作用48 h时,细胞活力降低约50%(图4 A)。与空白对照比较,5%~40%BLC-S 未显示出明显的细胞毒性(图4 B),故选择20%BLC-S 为后续实验浓度。与5%CSE 条件比较,5%CSE+20%BLC-S 条件下的细胞活力显著增强(P<0.05,图4 C)。
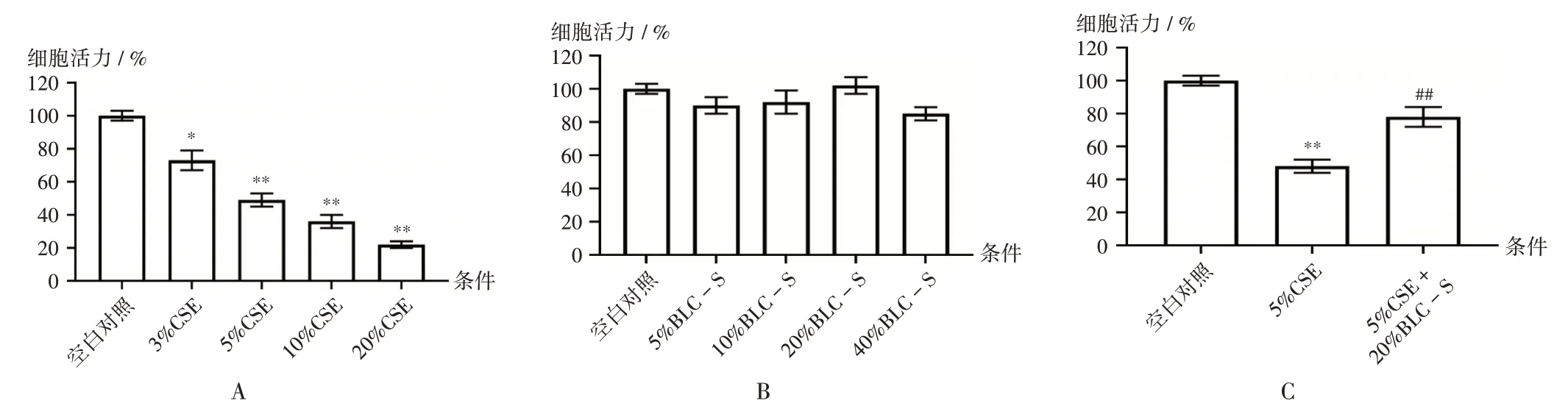
图4 细胞活力Fig.4 Cell viability
2.4 Smad3 表达水平
与正常对照组比较,模型组大鼠肺组织中Smad3表达水平显著升高(P<0.05);与模型组比较,BLC 组和inhibitor NC 组大鼠肺组织中Smad3 表达水平显著降低(P<0.05);与inhibitor NC 组比较,inhibitor 组大鼠肺组织中Smad3 表达水平显著升高(P<0.05)。详见图5 A。与空白对照比较,5%CSE 条件下细胞中Smad3表达水平显著升高(P<0.05);与5%CSE 条件比较,5%CSE+20%BLC-S 条件下细胞Smad3表达水平显著降低(P<0.05);与5%CSE + 20%BLC - S + inhibitor NC 条件比较,同水平inhibitor 条件下细胞Smad3 表达水平显著升高(P<0.05)。详见图5 B。
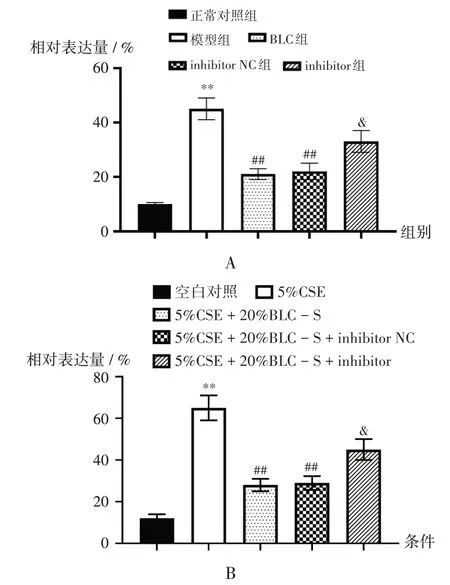
图5 Smad3的表达Fig.5 Expression of Smad3
2.5 TGF-β1 表达水平
与正常对照组比较,模型组大鼠肺组织中TGF-β1表达水平显著升高(P<0.05);与模型组比较,BLC 组和inhibitor NC 组大鼠肺组织中TGF-β1表达水平显著降低(P<0.05);与inhibitor NC 组比较,inhibitor组大鼠肺组织中TGF-β1表达水平显著升高(P<0.05)。详见图6 A。与空白对照比较,5%CSE条件下细胞中TGF-β1表达水平显著升高(P<0.05);与5%CSE 条件比较,5%CSE+20%BLC-S条件下细胞TGF-β1表达水平显著降低(P<0.05);与5%CSE + 20%BLC -S+inhibitor NC 条件比较,同水平inhibitor 条件下细胞TGF - β1表达水平显著升高(P<0.05)。详见图6 B。
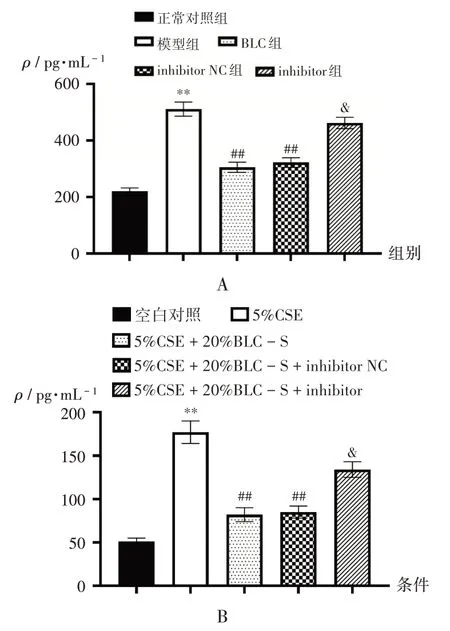
图6 TGF-β1的表达水平Fig.6 Expression level of TGF-β1
2.6 miR-145-5p mRNA 表达水平
与正常对照组比较,模型组大鼠肺组织中miR -145 - 5p mRNA 表达水平显著降低(P<0.05);与模型组比较,BLC 组及inhibitor NC 组大鼠肺组织中miR -145-5p mRNA表达水平显著升高(P<0.05)。与inhibitor NC 组比较,inhibitor 组大鼠肺组织中miR-145- 5p mRNA 表达水平显著降低(P<0.05)。详见图7 A。与空白对照比较,5%CSE 条件下细胞中miR - 145 - 5p mRNA 表达水平显著降低(P<0.05);与5%CSE 条件比较,5%CSE + 20%BLC - S 条件下细胞miR - 145 - 5p mRNA表达水平显著升高(P<0.05)。详见图7 B。
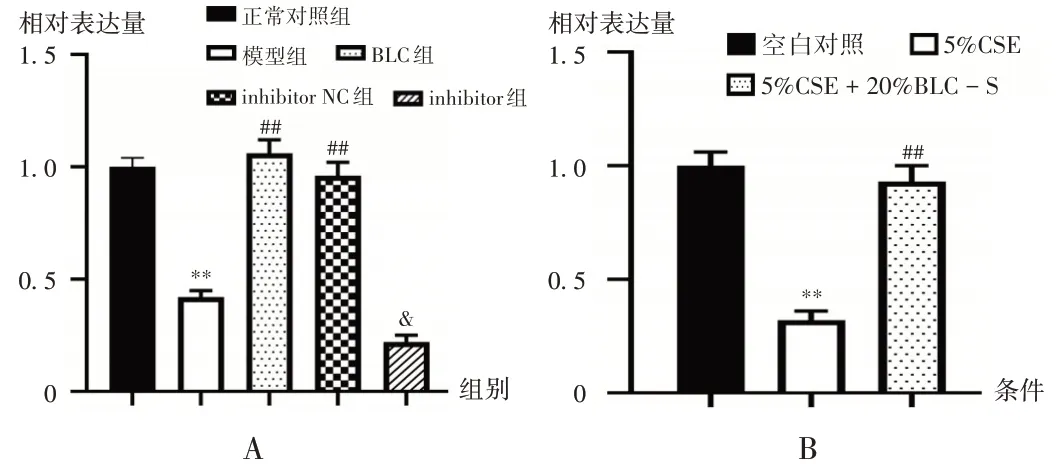
图7 miR-145-5p mRNA的表达水平Fig.7 Expression level of miR-145-5p mRNA
3 讨论
吸烟被认为是COPD 的主要风险因素[1]。长期暴露于烟雾会增加轻度稳定期COPD 模型小鼠肺组织纤维化[10]。有研究表明,COPD 患者在常规治疗基础上加用BLC 后,其肺通气换气功能、呼吸困难等不适症状有了显著改善[11]。本研究中证明了BLC 可抑制COPD 模型大鼠肺功能下降、病理改变和纤维化反应;此外,BLC能增强暴露于CSE 的BEAS-2B细胞活力,并阻断细胞中TGF-β1/Smad通路。
持续暴露于CSE 会导致肺部miRNA 的失调,这与各种呼吸系统疾病有关,如肺结核、哮喘、肺癌及COPD[12]。暴露于香烟的COPD 模型大鼠肺组织中miR - 145 下调,并且已提出miR - 145 表达水平与COPD 的诊断密切相关[13]。miR - 145 - 5p 水平降低与5~12 岁哮喘儿童人群的肺生长早期下降有关,并且基线miR-145-5p水平降低也与随访结束时(23~30岁)研究人群的COPD发生相关[6]。本研究中,在COPD模型大鼠肺组织及暴露于CSE 的BEAS - 2B 细胞中均发现miR-145-5p 水平显著下调,而BLC 显著逆转了该趋势。此外,miR - 145 - 5p inhibitor 的加入明显逆转了BLC 对COPD 模型大鼠的保护作用,体现在肺功能指标降低,平均肺泡数减少和平均线性截距增长。表明BLC可通过上调miR-145-5p水平发挥COPD保护作用。
有研究证实,miR - 145 - 5p 上调能减轻COPD 模型大鼠肺组织纤维化程度[9]。TGF-β1介导的Smad3 信号在与烟雾刺激、博来霉素激发和肿瘤进展/发展相关的上皮间质转化(EMT)中的关键作用已得到证实[14]。TGF-β1信号通过跨膜丝氨酸/苏氨酸激酶受体转导,将1 型受体内化到核内体中,用于受体激活的Smad 锚与Smad3 复合物的形成。之后Smad 在丝氨酸残基处磷酸化,促进Smad2/3 和Smad4 之间的相互作用,然后易位到细胞核,并通过与Smad 结合元件相互作用来调节EMT 相关基因的转录[15-16]。基于Smad3 在TGF- β1介导的EMT 过程中发挥更关键作用,本研究中重点关注BLC对TGF-β1/Smad通路的影响。结果证实,在COPD模型大鼠肺组织和暴露于CSE 的BEAS - 2B 细胞中TGF-β1/Smad 信号通路激活,BLC 显著抑制了该通路激活。进一步分析显示,miR-145-5p inhibitor的加入阻断了BLC对TGF-β1/Smad信号通路的抑制作用。但本研究还存在一定局限性,除TGF-β1/Smad 外,还应研究与纤维化进展相关的其他信号,包括PI3K/Akt 和ERK。
综上所述,BLC在体内和体外均显示出对香烟诱导COPD的保护作用,其机制可能与上调miR-145-5p水平逆转暴露香烟激活的TGF-β1/Smad3信号通路有关。
