静脉用药调配中心洁净间超净配药器应用实践*
2023-08-29胡珊珊付静静刘建军朱仲珍杨彩蝶徐孟宁
蒋 磊,胡珊珊,许 琼,付静静,刘建军,姚 钰,朱仲珍,杨彩蝶,徐孟宁,丁 琪
(1. 安徽省第二人民医院,安徽 合肥 230041; 2. 国药中铁精神病医院,安徽 合肥 230041)
输液的微粒污染是影响输液安全的重要因素[1]。静脉输液不溶性微粒为肉眼不可见、具有不溶性及非代谢性的颗粒杂质(粒径<50µm),可对人体微循环产生潜在的严重危害,引起静脉炎、热原反应、肉芽肿、血管栓塞、过敏,甚至导致肿瘤[2-3]。因此,对成品输液不溶性微粒污染的控制,是保障输液质量安全、减少输液反应的重要措施[4]。静脉用药调配中心(PIVAS)对静脉用药调配全过程科学管理的加强及对配置环境的改善,一定程度上减少了输液反应的发生风险。然而,PIVAS洁净间并非均能达到洁净度要求,尤其是使用传统注射器进行手工配药时会增加微粒污染药液的风险,影响输液安全。且PIVAS 医嘱量及工作强度的日益增大也影响了传统手工配药的调配质量,降低了工作效率[5]。近年来,我国开始尝试和推广自动化配药设备,以保证输液配置的同质化、标准化及输液安全。已有医院探索性使用超净配药器,在降低静脉炎发生率方面有积极作用[6]。本研究中比较了传统手工和超净配药器配药对成品输液的不溶性微粒数、药液残留量及调配效率的影响,现报道如下。
1 材料与方法
1.1 仪器与试药
仪器:SW-CJ-1CU型洁净工作台(苏州安泰空气技术有限公司);DM - 100 型超净配药器(哈尔滨鼓润生物技术有限公司);GWF-8JA型微粒分析仪(天津天河分析仪器有限公司);一次性使用20 mL 无菌注射器(稳健平安医疗科技有限公司,批号为20221005);一次性使用1 mL无菌注射器(湖南平安医械科技有限公司,批号为20210509);
试药:注射用奥美拉唑钠(江苏奥赛康药业股份有限公司,批号为L2106061,规格为每支20 mg),药品自带专用溶剂(批号为C200708,规格为每支10 mL);0.9%氯化钠注射液(安徽丰原药业股份有限公司,批号为220210115,规格为每瓶100 mL)。
1.2 方法
溶液配置方式与分组:选取安徽省第二人民医院PIVAS工作年限为3~6年的药学专业技术人员6名,随机分为对照组和观察组,各3名。对照组采用传统手工配药方式,观察组使用超净配药器,两组配置人员的性别、学历、工作时间、职称比较,差异无统计学意义(P>0.05),具有可比性。输液配置在PIVAS 万级洁净间、百级水平层流台内严格按无菌操作技术规范完成。
溶液制备:取注射用奥美拉唑钠专用溶剂10 mL,加入0.9%氯化钠注射液100 mL 稀释,得空白对照溶液。按注射用奥美拉唑钠药品说明书建议和临床常用剂量,每支注射用奥美拉唑钠冻干粉注入5 mL 专用溶剂,充分溶解后,取40 mg(2 支),加入100 mL 0.9%氯化钠注射液稀释。摇匀,即得奥美拉唑钠成品输液。每组配置6份,室温静置备用。
不溶性微粒数检测:按2020 年版《中国药典(四部)》通则0903 不溶性微粒检查法的光阻法,使用微粒分析仪,在百级净化条件下,分别于放置0,2,4,6,8 h时取空白对照溶液和成品输液各适量,测定每毫升中微粒(粒径≥10µm 及≥25µm)数。按2020 年版《中国药典》规定,标示装量≥100 mL 的静脉输液,除另有规定外,粒径≥10 µm 的微粒数不得超过25 个/ mL,粒径≥25µm 的微粒数不得超过3 个/mL。检测前以部分待测溶液冲洗取样杯,再将待测液倒入取样杯中,并置微粒分析仪的升降台,静置2 min 脱气泡,每次抽取5 mL溶液,连续测定3次,取平均值。以空白对照溶液作为空白对照组,下同。
调配效率与药液残留量:分别记录第1,2,3小时内完成成品输液的袋数,并比较两组的调配效率。从两组配置完毕的整支药品中各随机抽取40 支(每次各8 支,连续5 d),检测整支药液残留量。将空西林瓶瓶口向上直立静置1 h 后,开启胶塞,以1 mL 注射器抽取残余药液,并记录体积。
1.3 统计学处理
2 结果
2.1 成品输液不溶性微粒数
观察组粒径≥10 µm 及≥25 µm 的不溶性微粒数在8 h 内均未超出规定限度,且除0 h 外均显著少于对照组(P<0.05)。详见图1。
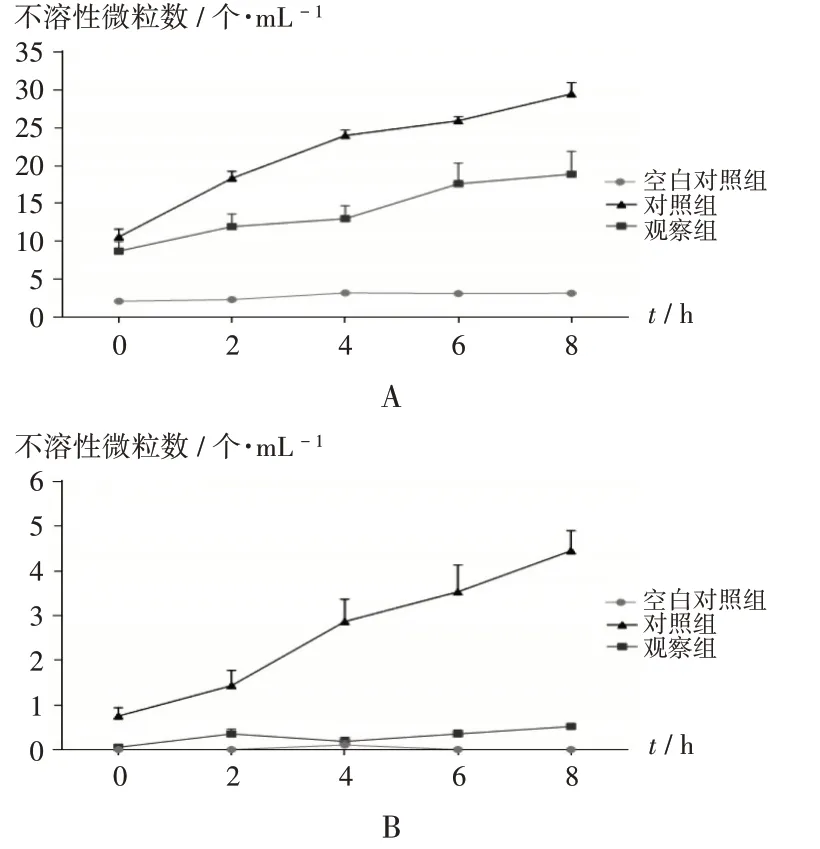
图1 两组成品输液不溶性微粒数比较Fig.1 Comparison of the number of insoluble particles in finished infusion between the two groups
2.2 药液残留量
观察组的药液残留量均值为(0.20±0.005)mL,显著少于对照组的(0.24±0.009)mL(P<0.05),且相较于对照组,观察组的药液残留量差异较小。详见图2。
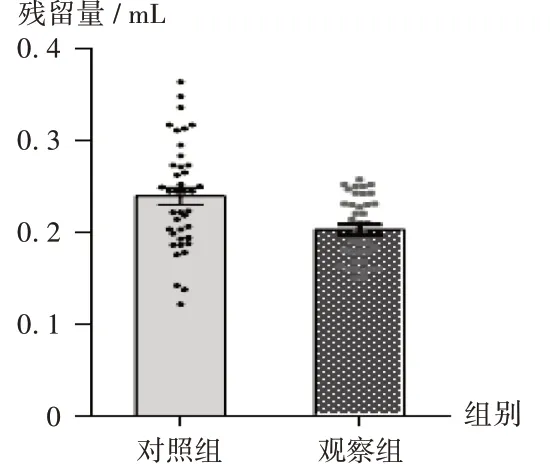
图2 两组药液残留量比较Fig.2 Comparison of the residual amount of drug solution between the two groups
2.3 调配效率
对照组的调配效率随着时间的延长呈降低趋势,而观察组在3 h 内的调配效率相对稳定,受调配时长的影响较小。详见图3。
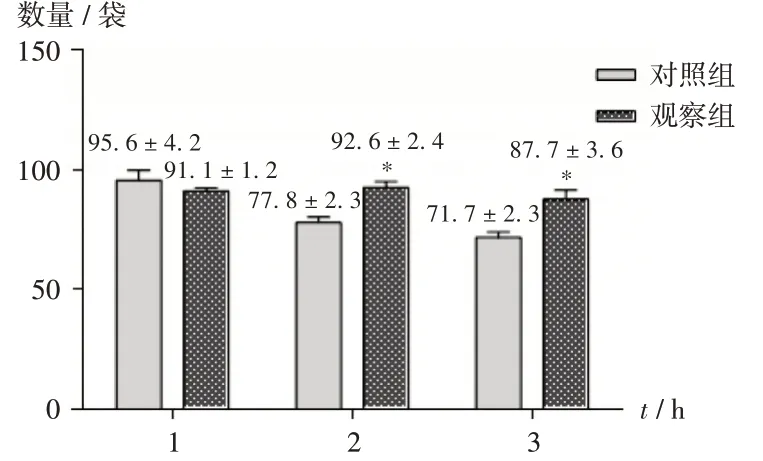
图3 两组调配效率比较Fig.3 Comparison of dispensing efficiency between the two groups
3 讨论
静脉输液微粒污染为注射剂质量控制的重要方面,多国药典对注射剂中的不溶性微粒数进行了严格限制[7]。临床一般使用加装滤膜的输液器过滤微粒,然而受滤膜孔径及微粒数量影响,滤过功能有限,因此仍要控制输液中的不溶性微粒数[6,8]。输液中微粒污染的产生因素包括胶塞、药品溶解度等,配置操作及配药环境的影响也越来越受关注[9]。PIVAS的广泛建立将输液的配置环境由医院Ⅲ类提高到Ⅰ类,减少了环境中不溶性微粒及病原微生物对成品输液的污染[10]。然而超净工作台为半开放式,PIVAS 洁净间的人员走动、物品流动及操作台内药品摆放较多均会影响超净工作台的工作效率,增加其空气的微粒含量。传统手工配药方式下,注射器内壁与外界空气相通,配药人员手部可频繁接触芯杆,空气及手部污染物可随活塞的推拉进入药液,有研究显示,注射器污染的细菌种类与治疗室空气、物体表面及操作者的手部微生物组成基本一致[6]。
本研究中采用超净配药器,内置0.22µm聚四氟乙烯滤膜,可除去99.99%的微粒及微生物,通过持续正压气流,阻挡非洁净空气进入,创建局部密闭的静态百级洁净配药环境;另外其配备的专用溶药器为无芯杆设计,以洁净气体为动力源替代手工推拉芯杆,避免了注射器内壁暴露及手部触碰,可大幅降低配药环境和配置操作对药液质量的影响,达到配药过程中的动态局部百级洁净环境。
本研究结果表明,观察组的2 种不溶性微粒(粒径≥10µm及≥25µm)数量在各时间点均少于对照组;且观察组成品输液在8 h 内的不溶性微粒数均符合药典规定,提示超净配药器在降低不溶性微粒方面具有一定优势,更能保障成品输液质量稳定且相对安全。
目前,我国静脉用药调配残留量尚无限度标准,但药液残留率的降低为剂量准确性的重要保证[11]。根据2020 年版《中国药典(四部)》规定的注射用无菌粉末残留量限度标准:药品标示装量≤0.05 g,残留量限度≤装量的15%;标示装量>0.05~0.15 g,残留量限度≤10%;标示装量>0.15~0.5 g,残留量限度≤7%;标示装量>0.5 g,残留量限度≤5%。然而在实际工作中,大范围运用容积测量法及减重称量法判定药液残留量,耗时较长,难以保证成品输液及时配送,故我院PIVAS 以药液残留量≤溶剂量的5% 作为内控标准[11-12]。传统手工方式的调配质量受配药人员的操作习惯、精神状态、劳累程度等主观因素影响较大[5]。而超净配药器采用手持式、点按按钮的加药方式产生持续动力替代人工抽拉的动作,以减少配药人员的劳动强度和手部肌肉损伤。本研究结果显示,对照组的药液残留量显著多于观察组,且观察组(40支药品)药液残留量差异较小,表明超净配药器在保证输液调配的标准化、同质化方面有一定优势,能较好地控制药液残留量。
我院PIVAS 每天的平均调配时长约为5 h,传统手工长时间高强度、高频率的加药动作易导致工作人员疲劳、手关节疼痛等现象,工作效率也会随时间的延长而降低[5,13]。本研究结果表明,在第1 小时,对照组的调配效率略高于观察组,可能与工作人员在使用超净配药器前,需进行清洁、消毒及更换安装针筒等耗费时间有关;在第2,3小时,对照组的调配效率均低于观察组,且3 h 内对照组的调配效率逐渐下降,而观察组相对稳定,提示超净配药器由于自动化结构,即使长时间调配也不易疲劳,调配速率受调配时长的影响较小。相关研究表明,医院药品调剂的自动化有助于提高工作效率,而我国PIVAS的自动化药物调配设备仅占12.4%[14-15]。表明超净配药器在长时间调配时的工作效率有明显优势,值得各医疗机构PIVAS 推广应用。然而本研究中未针对不溶性微粒的性质进行分析,这将是下一步的研究重点,本团队还将纳入微生物等影响因素展开长期观察,并不断优化配药方式。
综上所述,超净配药器通过在静态及动态环境中均能达到百级洁净度要求,在静脉用药调配过程中能减少不溶性微粒的污染,减少药液残留量,保证成品输液的质量,同时能提高长时间批量调配的工作效率,满足PIVAS的实际工作需要,有较好的临床应用前景。
