一例鸡毒霉形体病的诊断与体会
2023-08-28霍伟
霍 伟
(山东省泰安市岱岳区畜牧兽医事业发展服务中心,山东 泰安 271000)
鸡毒霉形体病虽然致死率较低,但会引起商品肉鸡胴体品质降低、饲料利用率降低、幼雏死淘汰率上升,且在新城疫疫苗免疫期间,极易诱发呼吸系统疾病,给养鸡业带来巨大的损失。鸡毒霉形体病呈世界性分布,随着养鸡业的发展,其危害日趋严重[1]。如何有效地控制该病的发生已成为当前亟待解决的问题[2]。
本病传播迅速,常年可发生,以寒冷季节较严重,多因鸡舍通风不良,空气污浊等不良刺激而诱发。在商品肉仔鸡饲养中常呈流行性,成年鸡多为散发性。临床症状以呼吸道症状为主。病理变化为鼻道和眶下窦黏膜水肿、充血,喉头和气管内有粘稠的渗出物。病程长的气囊壁增厚混浊,有黄白色的干酪样物,严重者可见纤维素性或化脓性肝被膜炎和心包炎[1,3,4]。鸡毒霉形体病的症状常易与其他呼吸道疾病相混淆。因此,该病的确诊要依靠病理剖检、血清学检测和病原分离等综合诊断。
目前鸡毒霉形体病除用疫苗预防外,药物控制是防治该病的有效途径。但由于长期不合理的使用抗菌药物,致使耐药菌株日益增多,药物治疗效果越来越差。不仅如此,因鸡毒霉形体体外培养生长缓慢,培养条件要求苛刻,病原不易分离[5]。
本文针对一鸡场发现疑似毒霉形体病,从病鸡的诊断、药敏试验等方面进行阐述,本研究为该场临床准确用药提供科学指导,对鸡毒霉形体病的准确诊断以及治疗提供一定的理论依据。
1 发病情况
该鸡场有鸡2 000 余羽,发病主要集中在4~8 周龄小鸡,病鸡发育不良,羽毛无光蓬松,表现步态不稳,轻微八字,部分跛行;有大量尿酸或尿酸盐的绿色排泄物;冠下塌,有些病鸡的冠是蓝白色的;关节周围有肿胀达鸽卵大,胸部水泡,跗关节及足掌是主要感染部位;部分鸡打喷嚏,浆液性鼻涕,咳嗽,出现喘气音;部分病鸡眼球凸出,解剖发现鼻腔、气管、喉头内有粘稠的渗出物。该养殖场负责人使用链霉素、磺胺噻唑治疗后,病情不见好转。对病鸡进行进一步的实验室检测,再结合临床症状、病理变化进行确诊。
2 诊断
2.1 剖检
取病鸡共计18 只,剖检发现气管、鼻腔、支气管和气囊中含有粘液性渗出物,胸部气囊有混浊、增厚、水肿现象,鼻腔黏膜潮红发炎,气管内有较多黏液,部分气囊内有泡沫样或干酪样物,濒死鸡出现纤维素性或化脓性肝被膜炎和心包炎。
2.2 实验室检查
2.2.1 鸡传染性支气管炎ELІSA 检测 对采集的18 只病鸡血清样本,进行了鸡传染性支气管炎抗体水平检测,结果全为阴性。
2.2.2 鸡毒霉形体的实验室鉴定 (1)鸡毒霉形体液体培养基的制备。用电子天平称取霉形体肉汤基础培养基26 g 置于锥形瓶中,加去离子水1 000 mL,充分搅拌,加热溶解,塞上棉塞,用包装纸包扎置高压蒸汽消毒器内,0.105 Mpa(121.3 ℃)灭菌20 min。高压蒸汽灭菌后,待霉形体肉汤基础培养基冷却至50~60 ℃,用注射器加入健康猪血清120 mL,同时在霉形体肉汤基础培养基中加入烟酰胺腺嘌呤二核苷酸(辅酶І)0.1 g、盐酸半胱氨酸0.1 g、青霉素1 g、制霉菌素50 万ІU、酚红0.1 g。
采用酸度计测定培养基pH 值,将测定仪探头插入霉形体肉汤培养基中1.3~3.2 cm 深度,读数即可。用1 mol/L 氢氧化钠溶液将霉形体培养基pH 值调至7.6~7.8,然后将培养基分装于灭菌的试管中,每管约4~5 mL,试管分装完塞好棉塞并包扎(上述方法注意无菌操作)。将包扎好的霉形体液体培养基放入恒温箱内,37 ℃培养24 h 后,观察有无细菌生长,弃去有杂菌生长的培养基,4 ℃ 冰箱保存备用。
(2)鸡毒霉形体固体培养基的制备。用电子天平称取霉形体肉汤基础培养基26 g,琼脂20 g,用量筒量取去离子水1 000 mL,置于锥形瓶中加热溶解,塞上棉塞,用包装纸扎好,将培养基置电热式蒸汽消毒器内, 0.105 Mpa(121.3 ℃)灭菌20 min。待霉形体基础培养基冷却至50~60 ℃,用注射器加入健康猪血清120 ml,用电子天平称取烟酰胺腺嘌呤二核苷酸(辅酶І)0.1 g、盐酸半胱氨酸0.1 g、青霉素1 g、制霉菌素50 万ІU、酚红0.1 g,加入霉形体基础培养基中。
采用酸度计测定培养基pH 值。用1 mol/L氢氧化钠溶液将培养基pH 值调至7.6~7.8 即可。然后将固体培养基分装于灭菌的培养皿中,每个培养皿倒入10~15 mL,并将培养皿于桌面上轻轻回转,使培养基平铺于皿底,冷却后即为平板培养基。将制备的霉形体固体培养基放入恒温箱内,37 ℃ 培养24 h 后,观察有无细菌生长,弃去有杂菌生长的培养,4 ℃ 冰箱保存备用[6-7]。
(3)分离培养及初步鉴定鸡毒霉形体。取一洁净的玻板,划出方块3 cm×3 cm,在方块滴一滴鸡毒霉形体平板凝集抗原,在抗原处滴等量的待检血清,使用牙签将抗原与被检鸡血清混匀。同时设鸡毒霉形体阴性血清和鸡毒霉形体阳性血清对照。混合物在室温下2 min 内出现凝集块者为阳性反应,没有凝集块者为阴性反应。
(4)分离培养鸡毒霉形体。剖检平板凝集试验为阳性的病鸡,取病变的支气管和气囊内容物接种于培养基中,采取烛缸法培养(图1)。培养物酚红变为橘黄色(图2)时再划线接种到固体培养基上分离。

图1 霉形体厌氧烛缸培养罐

图2 霉形体在液体培养基的生长情况
(5)纯化分离及鉴定。3~5 d 培养后,挑取呈“煎油蛋状”的单个菌落移植到固体培养基中进一步培养即可得到霉形体的纯培养物。
3 药敏试验
本试验采取药物纸片琼脂扩散法(纸片法)[8]。
3.1 配制菌液
挑取鸡毒霉形体菌落1~2 个,与5 mL 的去离子灭菌水混合充分制成悬液。
3.2 涂布菌液
取培养基平板,蘸取菌液棉拭子,多次用拭子涂布培养基表面,平板每次旋60 余度,沿平皿四周最后绕两圈,涂布保证均匀[9]。
3.3 贴药敏纸片
用镊尖轻压贴平一旦贴上就不再移动,间距大于24 mm,距平皿边缘大于15 mm。
3.4 培养
37 ℃ 恒温烛缸中培养4~5 d 以上,检查抑菌直径。
3.5 结果判定标准
按照抑菌圈直径的大小判断鸡毒霉形体对药物的敏感性。抑菌圈直径>21 mm 为高度敏感,抑菌圈直径12~21 mm 为中度敏感,抑菌圈直径<12 为不敏感。
4 结果分析
4.1 鸡毒霉形体菌落形态
从岱岳区某鸡场采集的18 只病鸡,分离获得鸡毒霉形体11 株。其生长的培养基由红色变成淡黄色,培养4~5 d 的菌落观测白色呈露滴状且生长缓慢(图3)。光学显微镜下,菌落直径在0.2~0.3 mm 之间,肉眼观察圆形菌落呈“煎荷包蛋”样,边缘整齐中心颜色较深致密突起,光滑成乳头状(图4)。

图3 分离出的鸡毒霉形体菌落
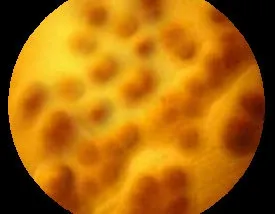
图4 光学显微镜下鸡毒霉形体菌落形态(40×)
4.2 鸡毒霉形体药物敏感性试验
对分离获得的鸡毒霉形体分别用硫酸庆大霉素、红霉素、磷酸替米考星、链霉素、泰乐菌素、北里霉素、多粘菌素、磺胺二甲嘧啶、青霉素、乳酸环丙沙星进行药敏试验,设置空白对照(图5),其抑菌结果见表1。

表1 鸡毒霉形体对药物的敏感情况

图5 各种药物的抑菌情况
5 体会
(1)该鸡群出现明显的呼吸道症状,但从临床上难以分辨为鸡毒霉形体病、鸡传染性支气管炎或鸡传染性鼻炎。通过使用链霉素、磺胺噻唑治疗后,没有出现较好的疗效,排除鸡传染性鼻炎。通过鸡传染性支气管炎病毒抗体ELІSA 试剂盒检测,结果全为阴性,排除鸡传染性支气管炎。
(2)分离鸡毒霉形体主要受两大因素的影响,一是受病料的影响,二是受鸡毒霉形体营养需要及培养条件的影响。病料采集是鸡毒霉形体分离培养的重要环节。为了提高鸡毒霉形体的分离率,本试验在分离前先进行平板凝集试验,通过平板凝集试验阳性的病鸡采集病料。气囊是鸡毒霉形体分离的理想病料,若取气管或支气管分泌物常因其他杂菌过多的生长而造成分离的失败。本试验分别采集了病鸡的支气管内容物和气囊内容物作为分离样品。
(3)鸡毒霉形体生长对水质和pH 值要求较高,需采用三蒸水或去离子水,本试验采用去离子水。琼脂的质量可影响鸡毒霉形体菌落的大小;血清提供胆固醇和各种脂肪酸;酚红的质量可影响鸡毒霉形体的生长。
(4)鸡毒霉形体与大肠杆菌混合感染时,分离比较困难,需多次移植分离,工作量较大,且不易分离成功。由于鸡毒霉形体缺乏细胞壁,在培养中加入青霉素抑制细菌的生长,制霉菌素抑制霉菌的生长[10]。但抑菌剂的浓度应适宜,此外,培养用的玻璃器皿洁净程度也影响鸡毒霉形体生长。
6 结论
通过病鸡分离获得鸡毒霉形体,药敏实验发现鸡毒霉形体对泰乐菌素、红霉素和北里霉素高度敏感,庆大霉素、替米考星为中度敏感,对链霉素、多粘菌素、磺胺二甲嘧啶、青霉素、乳酸环丙沙星不敏感。养殖户使用北里霉素、红霉素治疗后,该养殖场的病鸡情况明显得到控制。
