菜豆黄花叶病毒RPA-LFD技术快速检测方法的建立与应用
2023-08-27朱宇翔秦嘉超季英华陈新陈学好崔晓艳
朱宇翔 秦嘉超 季英华 陈新 陈学好 崔晓艳
摘要:根据菜豆黄花叶病毒(bean yellow mosaic virus,简称BYMV)外壳蛋白基因序列的保守区设计特异性引物和探针,建立蚕豆中BYMV的重组酶聚合酶扩增(recombinase polymerase amplification,简称RPA)检测方法。同时,将该方法与侧向流动试纸条(LFD)检测方法相结合,建立RPA-LFD快速检测方法,并进行特异性和灵敏度验证。结果表明,该方法可在 37~42 ℃等温条件下进行,30 min即可完成检测。灵敏度试验表明,采用 RPA-LFD方法检测BYMV的灵敏性是PCR方法的 100 倍。在特异性試验方面,与同属于马铃薯Y病毒属亲缘关系较近的大豆花叶病毒(soybean mosaic virus,简称SMV)、菜豆普通花叶病毒(bean common mosaic virus,简称BCMV)和芜菁花叶病毒(turnip mosaic virus,简称TuMV)无交叉反应。因此,本研究建立的菜豆黄花叶病毒RPA-LFD技术检测快速、灵敏且高效,有望成为我国菜豆黄花叶病毒田间诊断与防控的实用性技术手段。
关键词:菜豆黄花叶病毒;重组酶聚合酶扩增;侧向流动试纸条;病毒检测
中图分类号:S436.43 文献标志码:A
文章编号:1002-1302(2023)14-0070-06
菜豆黄花叶病毒(bean yellow mosaic virus,简称BYMV)是马铃薯Y病毒属的成员,属于正义单链RNA病毒,全长9.5 kb,基因组编码一条多聚蛋白,该多聚蛋白裂解成11个编码蛋白:P1、HC-Pro、P3、P3N-PIPO、6K1、CI、6K2、NIa、NIb、VPg和CP[1-2]。研究人员常用外壳蛋白(CP)作为株系划分的一个标准,它作为重要的结构蛋白,主要参与病毒的运动和介体传播[3-9]。BYMV首次在1925年被报道,随后在世界各个国家广泛传播[10]。寄主范围特别广泛,主要侵染豌豆和蚕豆[11-12]。通常以种子带毒和蚜虫非持久性传播为主,也可通过汁液摩擦接种的方式传毒。蚕豆受病的叶片一般会表现出系统花叶、斑驳等症状,严重时会造成植株畸形,严重影响作物的产量及品质[13]。目前菜豆黄花叶病毒已经成为世界范围内的流行性植物病毒,造成豆科植物以及其他多种田间作物的大面积减产。关于菜豆黄花叶病毒的防治方法以选育优良的抗病品种为主,田间管理时应注意蚜虫的防治并结合合理的药剂防治,防止病毒病相互传染,加重病情。因此,快速且高效的检测方法对防控菜豆黄花叶病毒至关重要。
目前已报道的菜豆黄花叶病毒的检测方法主要有酶联免疫吸附(ELISA)法[14],包括直接抗原包被ELISA和双抗体夹心ELISA[15]。然而,该方法检测灵敏度低,且需要高质量的抗体[16];聚合酶链式反应(PCR)及RT-PCR法包括RT-PCR[17]、一步实时定量RT-PCR[16]、免疫捕捉RT-PCR[18]。该方法具有较高的灵敏度和特异性,被广泛使用,但PCR对菜豆黄花叶病毒的检测需要提取RNA、反转录、扩增、琼脂糖凝胶电泳及成像检查扩增子等[19]。步骤繁琐、耗时长、需要大型昂贵仪器,不适合野外现场的快速检测[20]。
重组酶聚合酶扩增(RPA)作为一种新型的等温分析法,能够对植物病原体内的DNA或RNA进行高度特异和有效的检测。RPA已经广泛应用于细菌、真菌和病毒的分子检测。Ghosh等基于柑橘黄龙病病原菌(Candidatus Liberiabacter asiaticus)保守的16S RNA基因设计特异性引物对和探针,结合侧向流动试纸条建立了RPA检测体系[21];Lei等利用便携式实时荧光检测仪完成了对甘蓝型油菜茎基溃疡病(Lep tosphaeria maculans)的快速检测[22];Zhang等首次应用 RPA 检测李痘病毒 (plum pox virus,简称PPV)后,RPA逐渐应用在植物病毒的检测上[23],比如番茄黄化曲叶病毒(tomato yellow leaf curl virus,简称简称TYLCV)[24]、菜豆荚斑驳病毒 (bean pod mottle virus,简称BPMV)[25]、樱桃病毒(cherry virus A,简称CVA)[26]、紫云英矮缩病毒(milk vetch dwarf virus,简称MVDV)[27]、黄瓜花叶病毒(cucumber mosaic virus,简称CMV)[28],显示了其可应用于检测菜豆黄花叶病毒的潜力。RPA利用链置换聚合酶、重组酶和单链DNA结合蛋白(SSB)进行DNA变性[29],通过包括凝胶电泳、基于探针的荧光监测或简单的非仪器“夹心分析”,如侧向流动试纸条等方法进行检测,该方法无需大型昂贵仪器进行扩增、电泳等繁琐步骤,恒温的条件下,短时间内即可观察结果。该方法简单、快速、高效,非技术人员也可直接操作,对现场菜豆黄花叶病毒病株快速检测具有良好的应用潜力。
在本研究中,建立了基于RPA-LFD检测BYMV的方法,开发引物和探针,不仅测试了对BYMV的特异性,而且可对RPA-LFD和PCR灵敏度进行比较。同时,RPA-LFD检测技术可以快速且有效地检测出田间病样中的BYMV。
1 材料与方法
1.1 材料
2020年,从江苏和云南不同地区收集9份表现出花叶症状的蚕豆病样。所有样本均PCR检测和序列测定后储存在江苏省农业科学院经济作物研究所实验室-80 ℃冰箱。大豆花叶病毒(SMV)、菜豆普通花叶病毒(BCMV)和芜菁花叶病毒(TuMV)样本均储存在笔者所在课题组实验室。本试验于2022年3—4月于江苏省农业科学院经济作物研究所完成。
1.2 RNA提取,cDNA合成
使用天根生化科技(北京)有限公司的植物总RNA提取试剂盒提取蚕豆叶片的总RNA,采用NanoDrop 2000C微体积紫外可见分光光度计测定RNA提取物的纯度和浓度。使用北京擎科生物科技有限公司的Glodenstar RT6cDNA合成试剂盒,利用 1 μg 总RNA以20 μL体积合成第1链cDNA。cDNA-20 ℃保存备用。
1.3 RPA-LFD检测BYMV
本研究中RPA的引物设计是按照制造商的引物设计说明(英国剑桥TwistDx)靶向部分菜豆黄花叶病毒CP基因(来自不同NCBI参考序列菌株CP的比对)。RPA使用来自TwistAmpnfo工具包的材料和方案(英国剑桥TwistDx)进行。RPA反应含有1 μL BYMV感染的蚕豆植株cDNA、29.5 μL Rehydration Buffer、2.1 μL 10 mmol/L正向引物(BYMV-RPA-F:5′-TTATTTGGACTTGATGGCAATGTTGGAACAGAC-3′) 和2.1 μL 10 mmol/L反向引物(BYMV-RPA-R:[5′BIOTIN]ACATAGTATTAAGTAATGTAACGCCAAATTATA-3′)、0.6 μL 10 mmol/L 探针(BYMV--probe:[5′FAM]GCAGGAGATGTCAATCGTGATATGCACACCAT[THF]CTTGGTGTTCGTATTT[3′BLOCK])、12.2 μL ddH2O和2.5 μL 280 mmol/L醋酸镁的50 μL反应体积, 37 ℃ 扩增20 min。对于侧向流动分析,参考试剂盒操作(德国Milenia Genline HybriDetect试纸),将5 μL RPA扩增产物与100 μL分析缓冲液(HybriDetect分析缓冲液)在新反应管中混合。然后将侧向流动试纸条(LFD)浸入混合物中,并在室温下培养5 min。在控制区有1条可见线的条带被视为阴性,在控制区和测试区都有2条可见线的条带被视为阳性。
1.4 PCR检测BYMV
PCR反应使用10 μL 2×Taq Master Mix ll (with Dye)[天根生化科技(北京)有限公司],0.5 μmol/L 正向引物 [BYMV-CP-F:5′-CCAACATTC(T)CGCCAA(G)ATAATGT-3′]和反向引物 (BYMV-CP-R:5′-TAGAGAGAATGATACACATACTG-3′),1 μL cDNA和8 μL ddH2O。所有样品在95 ℃下预变性5 min,然后进行35个循环(95 ℃ 30 s,58 ℃ 30 s和72 ℃ 30 s),最后72 ℃延伸 10 min。获得的PCR产物在1.5%琼脂糖凝胶上分离。溴化乙锭染色,Bio-Rad分子成像仪凝胶DOCXR系统(Bio-Rad,Hercules,CA,美国)观察图像。
2 结果与分析
2.1 RPA-LFD检测BYMV方法的建立
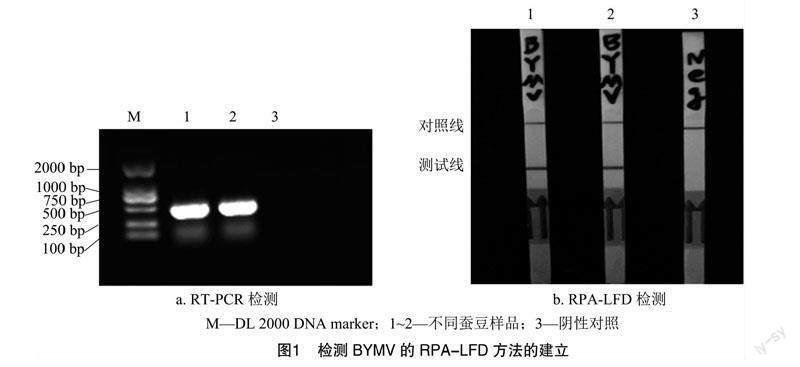
以2份感染菜豆黄花叶病毒的蚕豆样品的cDNA作为模板分别进行PCR和RPA-LFD的扩增,用健康蚕豆植株的cDNA作为阴性对照。PCR扩增之后,通过琼脂糖凝胶电泳检测出400 bp的目标条带,RPA-LFD试验使用特异性引物和探针成功地在感染植株中检测到菜豆黄花叶病毒(图1),阴性对照无条带,表明RPA-LFD可用于菜豆黄花叶病毒的快速检测。
2.2 RPA-LFD与PCR的灵敏度比较
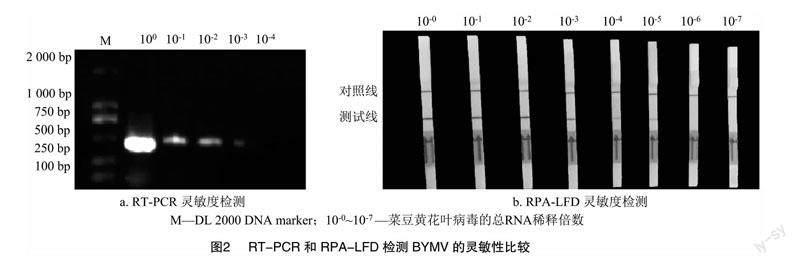
为评估RPA-LFD的灵敏度,以菜豆黄花叶病毒检测为阳性的蚕豆叶片总RNA为模板,以 10 倍浓度梯度进行稀释,反转录之后得到cDNA进行 RPA-LFD 和PCR检测的灵敏度比较。结果表明,RPA-LFD可以检测到总RNA稀释到10-5的样品,而PCR仅能检测到总RNA稀释到10-3的样品(图2)。因此,本研究建立RPA-LFD的检测方法比PCR灵敏100倍。
2.3 RPA-LFD特异性分析
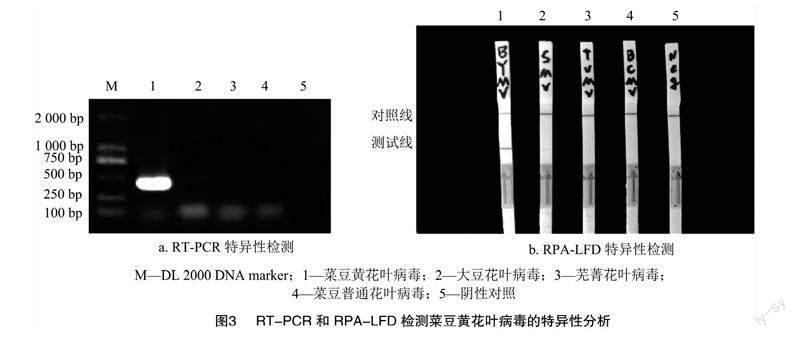
BYMV属于马铃薯Y病毒属,分别以该属侵染豆科作物的其他病毒(SMV、BCMV、TuMV)阳性样品的cDNA和BYMV阳性样品的cDNA为模板进行RPA[CM(19*2/3]扩增,同时以PCR进行验证,对所建立的RPA-LFD 的方法特异性进行分析。结果显示,该引物和探针只能从含菜豆黄花叶病毒的cDNA中扩增出条带,大豆花叶病毒、芜菁花叶病毒和菜豆普通花叶病毒的样品均未检测出条带(图3)。因此,所建立的RPA-LFD检测技术具有良好的特异性,可以有效地检测菜豆黄花叶病毒。
2.4 RPA-LFD田间样品的检测
2020年从江苏和云南不同地区采集了9份疑似菜豆黄花叶病毒感染的蚕豆样品叶片。通过RPA-LFD的方法检测BYMV,同时用PCR进一步验证。结果表明,9份样品中有6个阳性植株,RPA-LFD 检测结果与PCR结果一致(图4)。因此,所建立的菜豆黄花叶病毒的RPA-LFD检测技术可以快速且有效地检测出田间病样中的BYMV(表1)。
3 讨论
1985年濮祖芹等利用血清學的方法曾在江苏菜豆中检测到菜豆黄花叶病毒[30],之后在浙江[31]、云南[32]等地均有报道。 笔者所在实验室在2019—2021这3年间,从江苏、安徽、云南、广西、重庆、四川等地收集了200多份蚕豆疑似病样,经PCR检测出的病毒,菜豆黄花叶病毒的占比接近30%,说明该病毒已经对全国各地蚕豆的生产造成了严重威胁。病毒病的准确检测和诊断是有效防控作物病害的重要步骤,所以建立一套快捷、高效的检测方法对有效地防止病害的流行起到至关重要的作用。
本研究建立的RPA-LFD检测蚕豆植株中菜豆黄花叶病毒的方法操作简单,反应迅速而且具有较高的特异性。RPA-LFD可在37~42 ℃的常温条件下进行扩增,因为引物的退火和延伸是由酶介导的,不是靠温度驱动,从而不需要昂贵的热循环仪,仅需在恒温的水浴锅中即可完成,甚至有学者通过RPA可常温扩增的特点设计出了仅用人体体温就能完成DNA扩增的检测方法[33]。在田间样品检测到的阳性病样均经PCR检测得以验证,RPA-LFD最短可在20 min内完成扩增,通过侧向流动试纸条5 min即可读出结果,相比于PCR扩增一般需要90 min左右,而且如果操作不当,电泳条带易不清晰或弥散,本研究建立侧向流动试纸条的检测方法耗时短,操作更简易,结果直观且易于辨识,非常适合用于野外病样的快速诊断;同时,RPA-LFD检测的灵敏度也是其优势之一,本研究中RPA-LFD检测菜豆黄花叶病毒的灵敏度是PCR的100倍;本试验开发的引物和探针对菜豆黄花叶病毒具有特异性,而对其他3种马铃薯Y病毒属的病毒无交叉反应。
2006年RPA技術首次被报道,因其检测快速、灵敏且高效等优点,近年来在植物病毒检测领域被广泛使用。RPA-LFD技术可直接以粗提物为模板,操作简便,避免了样品制备的繁琐过程,减少时间成本,可以直接在田间完成检测[34]。不过,RPA技术还存在一些不足之处可供完善,比如其检测成本较高于PCR,缺乏专门的引物和探针设计软件,而且在检测过程中容易受其他因素的影响,尤其是气溶胶污染而产生假阳性,所以检测应在无污染且通风良好的环境中进行。随着RPA技术的不断完善,该技术有望成为我国菜豆黄花叶病毒田间诊断与防控的实用性技术手段。相比于传统的分子检测技术,RPA技术在植物快速诊断领域具有更为广泛的应用前景。
参考文献:
[1]Chen J,Chen J,Adams M J.A universal PCR primer to detect members of the Potyviridae and its use to examine the taxonomic status of several members of the family[J]. Archives of Virology,2001,146(4):757-766.
[2]Chung B Y W,Miller W A,Atkins J F,et al. An overlapping essential gene in the Potyviridae[J]. Proceedings of the National Academy of Sciences of the United States of America,2008,105(15):5897-5902.
[3]Wada Y,Iwai H,Ogawa Y,et al. Comparison of Pathogenicity and Nucleotide sequences of 3′-terminal regions of bean yellow mosaic virus isolates from Gladiolus[J]. Journal of General Plant Pathology,2000,66(4):345-352.
[4]Wylie S J,Coutts B A,Jones M G K,et al. Phylogenetic analysis of bean yellow mosaic virus isolates from four continents:relationship between the seven groups found and their hosts and origins[J]. Plant Disease,2008,92(12):1596-1603.
[5]Kumar Y,Hallan V,Zaidi A A.Identification and Characterization of bean yellow mosaic virus Infecting Freesia[J]. Journal of Plant Biochemistry and Biotechnology,2009,18(2):253-255.
[6]Parrella G,Lanave C. Identification of a new pathotype of bean yellow mosaic virus (BYMV) infecting blue passion flower and some evolutionary characteristics of BYMV[J]. Archives of Virology,2009,154(10):1689-1694.
[7]Wylie S J,Luo H,Li H,et al. Multiple polyadenylated RNA viruses detected in pooled cultivated and wild plant samples[J]. Archives Of Virology,2012,157(2):271-284.
[8]Sharma P,Sahu A K,Verma R K,et al. Current status of potyvirus in India[J]. Archives of Phytopathology and Plant Protection,2014,47(8):906-918.
[9]Zakubanskiy A V,Mitrofanova I V,Chirkov S N.Molecular characterization of viruses infecting canna in Russia[J]. European Journal of Plant Pathology,2017,149(4):923-931.
[10]Murashige T,Skoog F.A revised medium for rapid growth and bio assays with tobacco tissue cultures[J]. Physiologia Plantarum,1962,15(3):473-497.
[11]Bos L.The identification of three new viruses isolated from Wisteria and Pisum in The Netherlands,and the problem of variation within the potato virus Y group[J]. Netherlands Journal of Plant Pathology,1970,76(1):8-46.
[12]夏明忠. 蠶豆病害研究简介[J]. 园艺与种苗,1990(3):45-46.
[13]涂丽琴,吴淑华,干射香,等. 江苏省蚕豆上菜豆黄花叶病毒的分子鉴定[J]. 江苏农业学报,2019,35(4):804-810.
[14]Prabowo D B,Hadiastono T,Himawan T,et al. Detection disease of sugarcane streak mosaic virus (SCSMV) via serological test on sugarcane (Saccharum officinarum L.),weed and insect vector[J]. International Journal of Science and Research,2014,3(1):88-92.
[15]Hema M,Savithri H S,Sreenivasulu P. Antibody and nucleic acid probe-based techniques for detection of sugarcane streak mosaic virus causing mosaic disease of sugarcane in India[J]. Current Science,2001,81(8):1105-1108.
[16]Fu W L,Sun S R,Fu H Y,et al. A one-step real-time RT-PCR assay for the detection and quantitation of sugarcane streak mosaic virus[J]. BioMed Research International,2015,2015:569131.
[17]Chandran V,Gajjeraman P. A simple precipitation approach for isolation and enrichment of sugarcane streak mosaic virus[J]. Sugar Tech,2013,15(4):417-419.
[18]Hema M,Kirthi N,Sreenivasulu P,et al. Development of recombinant coat protein antibody based IC-RT-PCR for detection and discrimination of sugarcane streak mosaic virus isolates from Southern India[J]. Archives of Virology,2003,148(6):1185-1193.
[19]Vincelli P,Tisserat N. Nucleic acid-based pathogen detection in applied plant pathology[J]. Plant Disease,2008,92(5):660-669.
[20]Babu B,Washburn B K,Miller S H,et al. A rapid assay for detection of rose rosette virus using reverse transcription-recombinase polymerase amplification using multiple gene targets[J]. Journal of Virological Methods,2017,240:78-84.
[21]Ghosh D K,Kokane S B,Kokane A D,et al. Development of a recombinase polymerase based isothermal amplification combined with lateral flow assay (HLB-RPA-LFA) for rapid detection of Candidatus Liberibacter asiaticus[J]. PLoS One,2018,13(12):e0208530.
[22]Lei R,Kong J,Qiu Y H,et al. Rapid detection of the pathogenic fungi causing blackleg of Brassica napus using a portable real-time fluorescence detector[J]. Food Chemistry,2019,288:57-67.
[23]Zhang S L,Ravelonandro M,Russell P,et al. Rapid diagnostic detection of plum pox virus in Prunus plants by isothermal AmplifyRP? using reverse transcription-recombinase polymerase amplification[J]. Journal of Virological Methods,2014,207:114-120.
[24]Wang T M,Yang J T.Visual DNA diagnosis of tomato yellow leaf curl virus with integrated recombinase polymerase amplification and a gold-nanoparticle probe[J]. Scientific Reports,2019,9(1):1-8.
[25]张永江,魏 霜,袁俊杰,等. 一步法逆转录重组酶聚合酶常温扩增(RT-RPA) 技术检测菜豆荚斑驳病毒[J]. 江苏农业科学,2018,46(21):96-98.
[26]陈 玲,段续伟,张开春,等. 基于重组酶聚合酶扩增 (RPA) 技术的樱桃病毒 A(CVA) 的检测方法[J]. 园艺学报,2020,47(2):390-398.
[27]Cao Y H,Yan D K,Wu X Y,et al. Rapid and visual detection of milk vetch dwarf virus using recombinase polymerase amplification combined with lateral flow strips[J]. Virology Journal,2020,17(1):102.
[28]Srivastava N,Kapoor R,Kumar R,et al. Rapid diagnosis of cucumber mosaic virus in banana plants using a fluorescence-based real-time isothermal reverse transcription-recombinase polymerase amplification assay[J]. Journal of Virological Methods,2019,270:52-58.
[29]Piepenburg O,Williams C H,Stemple D L,et al. DNA detection using recombination proteins[J]. PLoS Biology,2006,4(7):e204.
[30]濮祖芹,周益军. 从菜豆上分离的菜豆黄花叶病毒鉴定[J]. 南京农业大学学报,1985,8(2):130.
[31]郑 滔,陈 炯,陈剑平. 杭州郊区菜豆花叶病病原的分子鉴定[J]. 浙江农业学报,2002,14(3):178-181.
[32]Qi P,Wang X M,He Q Y,et al. Sequence analysis of the coat protein gene of bean yellow mosaic virus isolates from faba bean in Yunnan,China and Syria[J]. Acta Phytopathologica Sinica,2007,37(4):368-376.
[33]Crannell Z A,Rohrman B,Richards-Kortum R.Equipment-free incubation of recombinase polymerase amplification reactions using body heat[J]. PLoS One,2014,9(11):e112146.
[34]Kappagantu M,Villamor D E V,Bullock J M,et al. A rapid isothermal assay for the detection of Hop stunt viroid in hop plants (Humulus lupulus)and its application in disease surveys[J]. Journal of Virological Methods,2017,245:81-85.
收稿日期:2022-10-08
基金項目:国家食用豆产业技术体系建设专项(编号:CARS-08-G15);江苏现代农业(特粮特经)产业技术体系集成创新中心项目(编号:JATS[2019]399)。
作者简介:朱宇翔(1996—),男,江苏南通人,硕士研究生,从事豆类作物病毒病的研究。E-mail:1017980413@qq.com。
通信作者:崔晓艳,博士,研究员,从事大豆花叶病毒及豆类作物抗病遗传育种研究,E-mail:cxy@jaas.ac.cn;陈学好,博士,教授,从事黄瓜品质性状和抗逆性状研究,E-mail:xhchen@yzu.edu.cn。
