具有抗真菌活性的海洋天然产物研究进展
2023-08-25张颖张诗宁耀东徐尧卢小玲马增岭
张颖?张诗?宁耀东?徐尧?卢小玲?马增岭
摘要:海洋是世界上最大的生物资源宝库。由于海洋生态系统的特殊性(高压、高盐、低氧)给海洋生物之间的生存带来了非常激烈的竞争,导致很多海洋生物在其生命活动中产生了具有大量特殊结构和生物活性的次生代谢产物。本文总结了2016—2021年从海洋来源的微生物、动物、植物中提取的93個天然的抗真菌活性物质,并对它们的应用前景进行了展望。同时,还总结了这些海洋天然产物的抗真菌作用。
关键词:海洋微生物;次级代谢产物;抗真菌
中图分类号:R987.1文献标志码:A
Antifungal effect of marine natural products
Zhang Ying1,2, Zhang Shi1,2, Ning Yao-dong2, Xu Yao2, Lu Xiao-ling2, and Ma Zeng-ling1
(1 College of Life and Environmental Sciences, Wenzhou University, Wenzhou 325035; 2 Department of Biochemistry and Molecular Biology, School of Basic Medical Sciences, Naval Medical University, Shanghai 200433)
Abstract The ocean is the largest biological resource in the world. The special characteristics of marine ecological environment (high pressure, high salt, and low oxygen) make the competition for survival among marine organisms very fierce, resulting in many marine organisms producing a large number of secondary metabolites with special structures and biological activities during their life activities. In this paper, we summarized 93 natural antifungal active substances isolated from microorganisms, animals, and plants of marine sources from 2016 to 2021, and provided an outlook on their application prospects. In addition, the antifungal effects of marine natural products are reviewed.
Key words Marine microorganism; Secondary metabolites; Antifungal activity
在自然界中,真菌是一种具有潜在致病性的微生物,并且新的致病真菌不断涌现,近年来,由于免疫抑制剂、化学治疗药物和抗生素的广泛应用,造成临床耐药现象日益严重以及深部真菌感染发生率逐步上升。
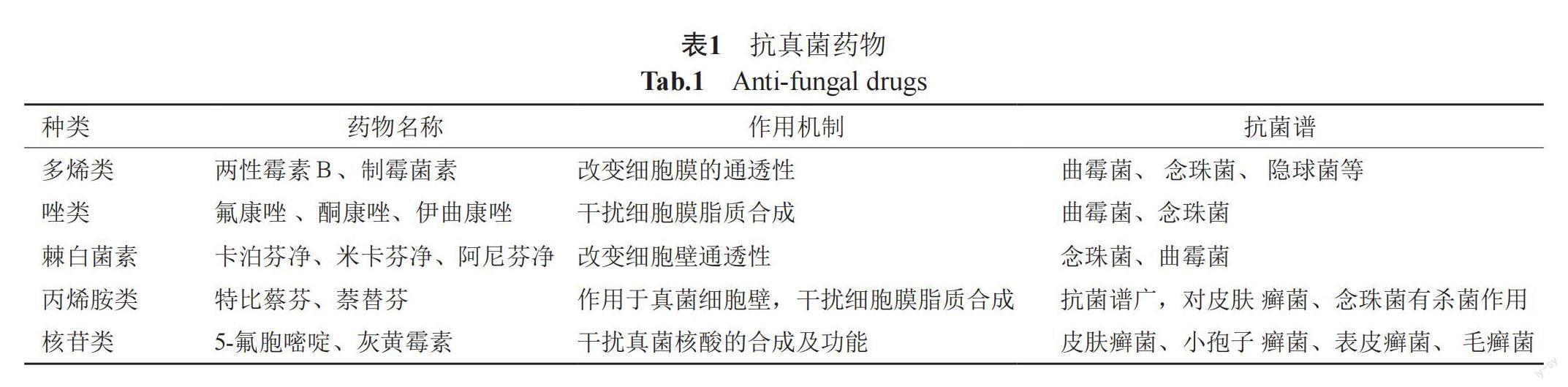
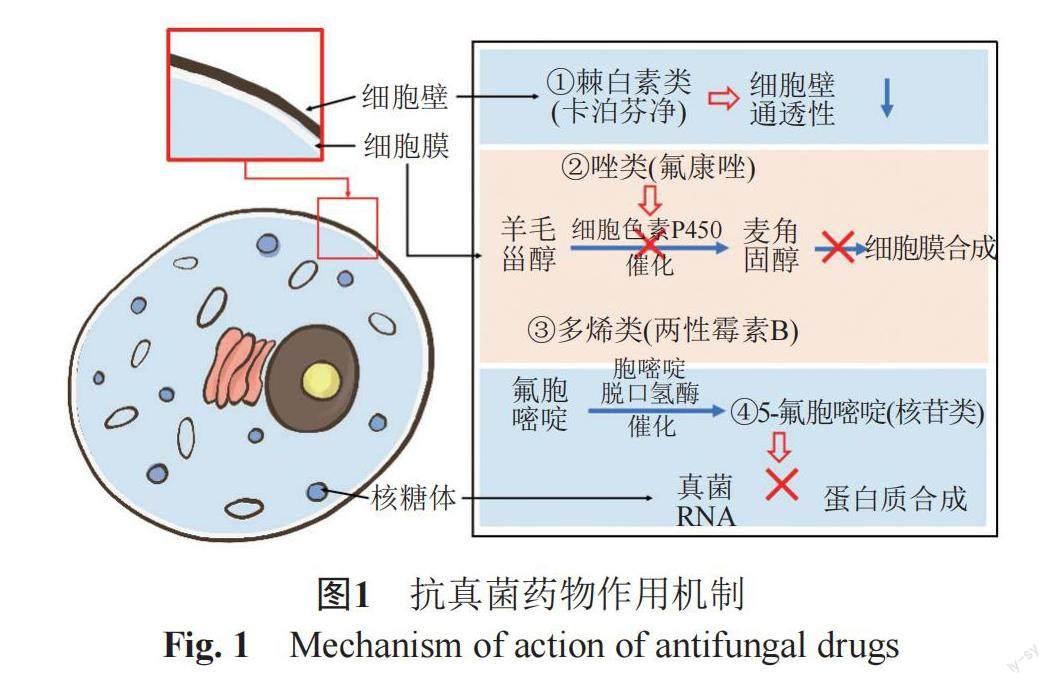
目前,应用于临床的抗真菌药物主要有多烯类、唑类、棘白菌素类、丙烯胺类、核苷类等[4](表1和图1),但有一定的局限性,如对肾脏有损伤、抗菌谱窄和复发率高等,因此急需寻找一些高效、低毒的抗真菌药物先导化合物。这些药物大多来源于天然产物(NPs),如在灰黄青霉(Penicillium griseofulvin)培养液中获取的灰黄霉素(griseofulvin),是一种含氯代谢产物[1],棘球白素类化合物是由真菌产生的一类脂肽,在此基础上又半合成了卡泊芬净,米卡芬净等上市使用[2],唑类药物的原形为放线菌的代谢产物氮霉素。因此,继续从自然界中寻找新的天然抗真菌药物是可行的。海洋因高盐、高压、缺氧和光照不足而形成的独特生存环境,造就了海洋天然产物独特的化学结构和显著的生物学活性,使得它们成为天然产物库的重要组成部分,从海洋天然产物中发现新型有效的抗真菌药物也成为一个热门课题[3]。
本文按照海洋天然产物的来源,综述了2016—2021年来发表的具有抗真菌活性的天然产物的结构和相关活性。
1 海洋微生物来源的抗真菌化合物
1.1 来源于海洋细菌的化合物(图2)
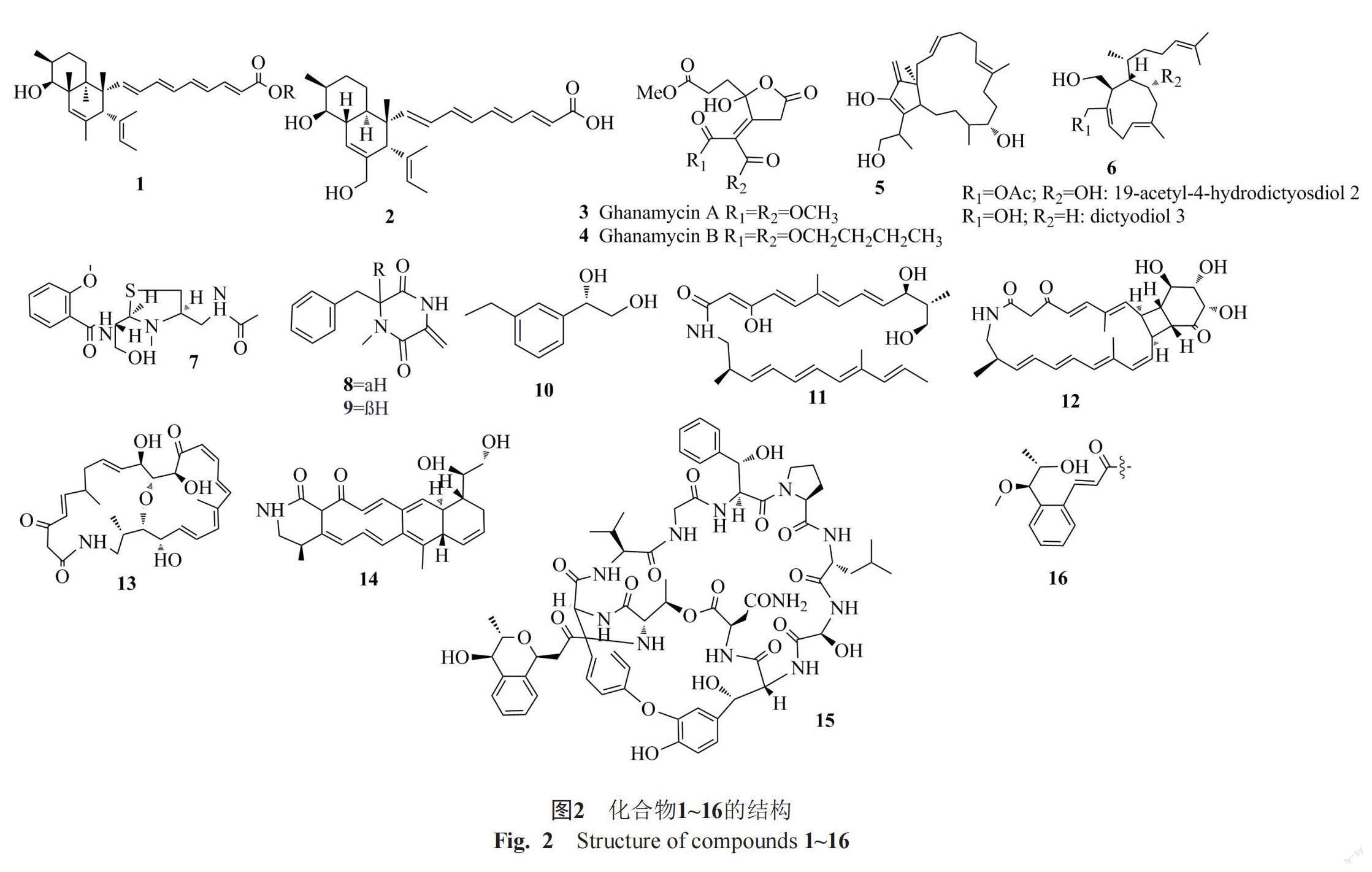
Anjum等[5]从两种海洋土壤样品来源的细菌Janthinobacterium spp.45和ZZ148的共培养物中分离得到两种罕见的聚酮化合物,分别为janthinopolyenemycins A(1)和B(2),它们对白念珠菌MIC值分别为15.6和31.25 μg/mL,都表现出抑制作用。Xu等[6]从海洋来源的链霉菌TXC6-16发酵液中分离得到两种新型γ-丁内酯ghanamycin A(3)和B(4),它们对植物病原菌和真菌都表现出相应抗菌活性,化合物(4)对植物病原菌(如丁香假单胞菌和欧文菌)有良好的抗菌活性,MIC值为50 μg/mL。在海洋菌株IG100中分离到两种活性萜类化合物terperstacin(5)和19-乙酰基-4-羟基二元醇(6),它们对黄曲霉的MIC值分别为7.9和31.3 μg/mL,对灰黄青霉的MIC值分别为25和100 μg/mL,具有较好的抑菌效果,其中化合物6首次在真菌中分离得到,具有重要的生态学意义[7]。从泰国红树林土壤中分离到的链霉菌AMA49菌株及其亚组分AMA49F1的乙酸乙酯提取物对稻瘟病菌的MIC值为8~16 μg/mL,进一步研究发现该系列提取物能破坏真菌膜和细胞器,对分生孢子萌发及附着胞形成完全抑制,表明AMA49菌株提取物是潜在的稻瘟病生物防治剂,这也是第一次报道含寡霉素A及其衍生物的海洋链霉菌提取物对菌丝生长、分生孢子萌发以及附着胞形成有抑制作用,这也可作为稻瘟病生防菌剂药源进行深入研究[8]。曹雪梅等[9]发现海洋细菌GM-1-1发酵液能显著抑制白念珠菌的生长和增殖,抑菌圈直径达39.5 mm,对孢子萌发具有强烈的抑制作用,GM-1-1菌株发酵液处理5 h时孢子萌发率仅为34.22%;能够破坏白念珠菌的细胞形态;抑制白念珠菌生物被膜的形成;破坏了细胞的通透性。海底沉积物来源的放线菌Streptomyces sp.中发现了一种新型水杨酰胺类似物链霉素噻唑烷A(7),其具有独特的含噻唑烷侧链;此外分离到链霉素二酮哌嗪A(8)和B(9)以及(S)-1-(3-ethylphenyl)-1,2-ethanediol(10),显示出对白念珠菌具有较好的抗真菌活性,MIC值分别为47、42和42 μg/mL[10]。在深海沉积物来源的链霉菌发酵液中分离出4种内酰胺,包括3种新的链球菌内酰胺A-C(11~13)和已知的nizalactam C(14),化合物(11)和(13)对白念珠菌均具有良好的抗真菌活性,其MIC值分别为10.4和16.1 μg/mL[11]。来自日本深海的链霉菌N11-34提取物中发现了两种双环肽,分别为尼龙烯酰胺A(15)和B(16),可选择性抑制丝状真菌的生长。化合物15对植物病原菌Cgreella cingulata NBRC5907和炭疽病菌NBRC5467的MIC值分为3.1和6.3 μg/mL,均表现出良好的抗菌活性,化合物16对上述真菌的MIC值为25 μg/mL[12]。
1.2 来源于海洋真菌的化合物 (图3)
彭书海等从海洋来源的真菌Cochliobolus lunatus中分离获得了环十酯肽化合物cyclopeptolide(17),对白念珠菌的MIC为16 μg/mL,并与临床药物氟胞嘧啶在抗真菌实验中显示出协同效应,在联合体外抗真菌实验中,氟胞嘧啶和化合物(17)的FICI(浓度指数)为0.9375,有望成为重要的抗真菌药物的先导化合物[13]。从海洋真菌Trichoderma brevicompactum A-DL-9-2中发现了8个新的木霉烯衍生物trichocene G-N(18~25)和2个新的酮芳烃衍生物trichocuparins A(26)和B(27),以及6个已知的单端孢霉烯(28~33),首次发现化合物(26)以氨基糖单元键与三烯骨架结合为特征,化合物(26)和(27)为首次在木霉菌中发现的酮芳烃倍半萜,此外,单端孢霉烯(32)的抗白念珠菌活性最高,其MIC值为4.0 μg/mL[14]。从海洋来源的毛癣菌培养液中分离得到两个新的毛癣菌烯倍半萜毛癣菌醇D(34)和E(35)。其中化合物(34)对两种酵母样真菌白念珠菌和新生隐球菌的生长有明显的抑制作用,其MIC值均为6.3 μg/mL;而(35)对两种真菌的MIC值也分别达到12.5和25 μg/mL,显示出良好的活性[15]。2种新的硫代二酮哌嗪emestrins L(36)和M(37),5种已知的类似物(38~42)和5种已知的二氢异香豆素(43~47)从海洋衍生真菌Spergillus terreus RA2905中分离获得,其中化合物(38)能有效抑制白念珠菌,MIC值为32 μg/mL,显示了较好的活性[16]。Yu等[17]从海洋真菌长枝木霉中寻找拮抗代谢产物时获得了两类化合物,分别为倍半萜(48~53)和环二肽(54~56),其中(48)是一种罕见的倍半萜,为首次发现的三环-6/5/5-[4.3.1.01,6]-癸烷骨, (48~50)对炭疽菌具有显著的抗真菌活性,其MIC值分别为8、16和16 μg/mL。Yang等[18]从一株海洋来源的真菌菌株中分离鉴定出3个新的dolabellane型二萜(57~59)和3种新的atranone(60~62),其中化合物(61)是无色晶体,代表具有2-甲基四氢呋喃-3-羧酸盐的C24atranone的第一个实例,化合物(58)對鲍曼不动杆菌和粪肠球菌的MIC值为16和32 μg/mL,化合物(60)对白念珠菌的MIC值为8 μg/mL。从海洋来源真菌Pleosporales sp.CF09-1中分离得到6种新的氮唑酮衍生物pleosporalones B和C(63~64)及pleosporalones E-H(66~69),同时得到一个已知类似物(65)。抗菌实验结果表明pleosporalones B(63)对甘蓝链格孢霉(Alternaria brassicola)和镰刀孢霉(Fusarium oxysporum)有很好的抑制作用,MIC值为1.6 μg/mL,比酮康唑阳性对照的MIC值更低[19]。从红树林土壤真菌Penicillium sp. HK1-22分离得到3种新的单体萘-γ-吡酮化合物peninaphones A-C(70~72)和两种已知的双萘-γ-吡酮化合物(73~74),其中化合物74对水稻纹枯病病原菌和立枯丝核菌均有明显的拮抗活性,MIC值分别为50和10 μg/mL[20]。Kim等[21]从海藻内生真菌产黄青霉XNM-12中分离得到一个新的亚萜类生物碱草酸C(75)和4个已知的亚萜类化合物(76~79),以及2个新的赤藓糖醇衍生物penicierythritols A和B(80~81),其中草酰胆碱C(75)代表了具有裂解结构的α-吡喃酮环的草酰胆碱生物碱的第一个实例,化合物(75)和(80)对植物病原菌青枯病菌具有中等抑菌作用,MIC值分别为8和4 μg/mL。化合物(80)对植物病原赤星病菌也表现出中等程度的抗真菌作用,MIC值为8 μg/mL。从地中海海绵Cymbaxinella damicornis中分离到一株东方木霉霉株LSBA1,该菌株对白念珠菌具有一定的杀菌活性,MIC大约为2.49~19.66 μg/mL[22]。Ding等[23]从杂色曲霉菌中鉴定和分离出两种新的呋喃二酮衍生物,分别为asperfurandiones A和B(82~83),对新生隐球菌和白念珠菌均显示出中等抗菌活性,MIC值为64 μg/mL。Yang等[24]从真菌Aspergillus sp. LS78中分离出两种新的四氢呋喃衍生物aspericacids A和B(84~85),化合物83对白念珠菌具有中等抑制活性,MIC值为50 μg/mL,化合物84表现出较弱抗菌活性,MIC值为128 μg/mL。
2 海洋植物来源的抗真菌化合物
海洋微藻中提取的胞外多糖(EPS)在抗菌和抗菌膜活性方面表现出较好的效果,其MIC大约在62.5~1000 μg/mL。对于抗白念珠菌,仅使用31.3 μg/mL提取物浓度,可减少约90%的生物膜形成[25]。从褐藻Eiseniabicyclis中分离的间苯三酚具有很强的抗菌活性,其中岩藻红素A70表现出很强的抗真菌活性,对白念珠菌的MIC为512 μg/mL[26]。木榄的粗提物对木霉的最佳抑菌圈(ZOI)为(22.31±0.36) mm,对产黄青霉的MIC值为7.26 μg/mL[27]。Choi等[28]从褐藻的乙酸乙酯提取物中得到eckolE.cava对金黄色葡萄球菌有抗菌作用,其MIC值为125~259 μg/mL,eckol组分与氨苄西林组合的抑制浓度指数范围是0.31~0.5, 这一结果表明其对金黄色葡萄球菌具有显著的协同作用。Amphidinol(86)是从甲藻中分离和鉴定的一种新化合物,对白念珠菌和烟曲霉的MIC值为64 μg/mL,具有一定的抑制作用[29](图4)。
3 海洋动物来源的抗真菌化合物
Kevin等[30]在对地中海深海海绵的第一次化学研究中发现了7种新的甾体皂苷,命名为poecillastrosides A-G(87~93),研究发现poecillastrosides A-G在C-18共享一个氧化甲基,它们是第一个显示这一特征的皂苷类化合物,其中poecillastrosides D和E均能抑制烟曲霉的生长,MIC值分别为6和24 μg/mL(图4)。
4 结论与展望
从2016—2021年,人们从海洋中分离出93个具有抗真菌活性的海洋天然产物,包括聚酮类、萜类、环肽类等结构(图5),其中16个来源于海洋微生物中的细菌,67个来源于海洋微生物中的真菌,而来源于海洋动物和植物的抗真菌化合物研究较少(图6),分别有7个和3个。海洋微生物凭借其多样的种属、特殊的生存环境、独特的代谢途径,成为了海洋天然产物的重要来源,海洋微生物产生了许多结构特殊并且活性较好的次级代谢产物。
在抗真菌活性的检测中,虽然指示菌种类多样(图7),但目前主要集中于对白念珠菌的测试,因为其是人类身体中很常见的一类真菌,会引起常见的真菌性疾病;它易于培养,在干燥或炎热等条件下时仍能存活,便于实验室操作。除此之外,有很多植物病原菌也可作为指示菌,它们在生物农药研发、环境保护等方面有一定的应用价值,在后续的抗真菌研究中,可适当扩大指示菌的种类,扩大抗真菌化合物的筛选规模,提高获得特异性和作用广泛的抗真菌天然产物的命中率。
同时还发现,对于抗真菌代谢产物的研究,大多集中于实验室发现阶段和活性测试的表型研究,缺少深入的作用机制及后续的成药性研究,进一步开发应用较少[31],这很大程度上受制于活性产物的产量,因此在今后的实验中,需要拓展海洋天然产物发现环节,应用组学技术,分子网络技术,排重技术等提高海洋天然产物的出新率,在此基础上优化海洋天然产物半合成、全合成和发酵工艺,提高天然产物的产量[32],可对活性好的产物进行抗真菌机制的探讨。尽管近年来抗真菌药物的研究有了长足的进步,但是发现了高效、广谱、低毒的抗真菌药物依然是需要加强的方向。
参 考 文 献
朱育菁, 于晓杰, 潘志针, 等. 灰黄霉素的研究进展[J]. 厦门大学学报(自然科学版), 2010, 49(3): 435-439.
陈海. 新型棘白菌素类环六脂肽抗真菌剂的设计, 全合成和活性研究[D]. 第二军医大学, 2013.
吴泽宏, 马民, 陈建良, 等. 海洋真菌活性次级代谢产物研究进展[J]. 广东药学院学报, 2017, 33(5): 687-699.
谢海伟, 杨贤松, 吕超田, 等. 抗真菌药物及其作用机制研究[J]. 中国微生态学杂志, 2015, 27(12): 1477-1479.
Anjum K, Sadiq I, Chen L, et al. Novel antifungal janthinopolyenemycins A and B from a co-culture of marine-associated Janthinobacterium spp. ZZ154 and ZZ148[J]. Tetrahedron Lett, 2018, 59(38): 3490-3494.
Xu J H, Gu K, Zhang D J, et al. Ghanamycins A and B, two novel γ-butyrolactones from marine-derived Streptomyces ghanaensis TXC6-16[J]. J Antibiot (Tokyo), 2017, 70(6): 733-736.
Botta L, Saladino R, Barghini P, et al. Production and identification of two antifungal terpenoids from the posidonia oceanica epiphytic ascomycota mariannaea humicola IG100[J]. Microb Cell Fact, 2020, 19(1): 184-184.
Buatong J, Rukachaisirikul V, Sangkanu S, et al. Antifungal metabolites from marine-derived Streptomyces sp. AMA49 against pyricularia oryzae[J]. J Pure Appl Microbiol, 2019, 13(2): 653-665.
曹雪梅, 李歡, 陈茹, 等. 海洋细菌GM-1-1菌株对白念珠菌的抗菌作用机理初步研究[J]. 食品工业科技, 2019, 40(19): 99-103.
Yi W, Qin L, Lian X Y, et al. New antifungal metabolites from the mariana trench sediment-associated actinomycete Streptomyces sp. SY1965[J]. Marine Drugs, 2020, 18(8): 385.
Wang P, Wang D, Zhang R, et al. Novel macrolactams from a deep-sea-derived Streptomyces species[J]. Mar Drugs, 2020, 19(1): 13.
Karim M R U, In Y, Zhou T, et al. Oku N, Igarashi Y. Nyuzenamides A and B: Bicyclic peptides with antifungal and cytotoxic activity from a marine-derived Streptomyces sp[J]. Org Lett, 2021, 23(6): 2109-2113.
彭書海, 卢余盛, 姚光山. 海洋真菌Cochliobolus lunatus中环十酯肽化合物cyclopeptolide 1的发现及其抗真菌活性研究[J]. 中国海洋药物, 2020, 39(3): 21-25.
Shi Z Z, Liu X H, Li X N, et al. Antifungal and antimicroalgal trichothecene sesquiterpenes from the marine algicolous fungus Trichoderma brevicompactum A-DL-9-2[J]. J Agric Food Chem, 2020, 68(52): 15440-15448.
Yamazaki H, Yagi A, Takahashi O, et al. Antifungal trichothecene sesquiterpenes obtained from the culture broth of marine-derived Trichoderma cf. brevicompactum and their structure-activity relationship[J]. Bioorg Med Chem Lett, 2020, 30(17): 127375.
Wu J S, Shi X H, Yao G S, et al. New thiodiketopiperazine and 3, 4-dihydroisocoumarin derivatives from the marine-derived fungus Aspergillus terreus[J]. Mar Drugs, 2020, 18(3): 1-10.
Du F Y, Ju G L, Xiao L, et al. Sesquiterpenes and cyclodepsipeptides from marine-derived fungus Trichoderma longibrachiatum and their antagonistic activities against soil-borne pathogens[J]. Mar Drugs, 2020, 18(3): 165.
Yang B, He Y, Lin S, et al. Antimicrobial dolabellanes and atranones from a marine-derived strain of the toxigenic fungus Stachybotrys chartarum[J]. J Nat Prod, 2019, 82(7): 1923-1929.
Cao F, Meng Z H, Mu X, et al. Absolute configuration of bioactive azaphilones from the marine-derived fungus Pleosporales sp. CF09-1[J]. J Nat Prod, 2019, 82(2): 386-392.
Zheng Y Y, Liang Z Y, Shen N X, et al. New naphtho-γ-pyrones isolated from marine-derived fungus Penicillium sp. HK1-22 and their antimicrobial activities[J]. Mar Drugs, 2019, 17(6): 322.
Xu K, Wei X L, Xue L, et al. Antimicrobial meroterpenoids and erythritol derivatives isolated from the marine-algal-derived endophytic fungus Penicillium chrysogenum XNM-12[J]. Mar Drugs, 2020, 18(11): 578.
Touati I, Ruiz N, Thomas O, et al. Hyporientalin A, an anti-candida peptaibol from a marine Trichoderma orientale[J]. World J Microbiol Biotechnol, 2018, 34(7): 98.
Ding L, Xu P, Li T, et al. Asperfurandiones A and B, two antifungal furandione analogs from a marine-derived fungus Aspergillus versicolor[J]. Nat Prod Res, 2019, 33(23): 3404.
Liu Y, Ding L, Zhang Z, et al. New antifungal tetrahydrofuran derivatives from a marine sponge-associated fungus Aspergillus sp. LS78[J]. Fitoterapia, 2020, 146: 104677.
Gargouch N, Elleuch F, Karkouch I, et al. Potential of exopolysaccharide from Porphyridium marinum to contend with bacterial proliferation, biofilm formation, and breast cancer[J]. Mar Drugs, 2021, 19(2): 66.
Kim K H, Yu D, Eom S H, et al. Fucofuroeckol-A from edible marine alga Eisenia bicyclis to restore antifungal activity of fluconazole against fluconazole-resistant Candida albicans[J]. J Appl Phycol, 2018, 30(1): 605-609.
Acharya S, Patra D K, Pradhan C, et al. Anti-bacterial, anti-fungal and anti-oxidative properties of different extracts of Bruguiera gymnorrhiza L. (Mangrove)[J]. Eur J Integr Med, 2020, 36: 1-8.
Oliver S P. Foodborne pathogens and disease special issue on the national and international pulsenet network[J]. Foodborne Pathog Dis, 2019, 6(7): 439-440.
Martínez K A, Lauritano C, Druka D, et al. Amphidinol 22, a new cytotoxic and antifungal amphidinol from the dinoflagellate amphidinium carterae[J]. Mar Drugs, 2019, 17(7): 385.
Calabro K, Kalahroodi E L, Rodrigues D, et al. Poecillastrosides, steroidal saponins from the mediterranean deep-sea sponge poecillastra compressa (Bowerbank, 1866)[J]. Mar Drugs, 2017, 15(7): 199.
尚卓, 王斌贵. 海洋真菌来源的抗菌活性物质研究: 方法与进展[J]. 生命科学, 2012, 24(9): 997-1011.
金黎明, 金鑫浩, 侯熙彦, 等. 具有抗菌活性的海洋真菌天然產物研究进展[J]. 中国海洋药物, 2017, 36(4): 66-74.
