银杏肽锌螯合物的制备、体外消化及抗氧化活性分析
2023-08-25李诗颖周小芮陈亚楠张秀芸张银雨
郑 义,李诗颖,李 闯,周小芮,陈亚楠,张秀芸,张银雨
(1.徐州工程学院食品与生物工程学院,江苏徐州 221018;2.江苏省食品资源开发与质量安全重点建设实验室,江苏徐州 221018)
银杏(Ginkgo biloba)种仁(白果)为卫健委公布的药食同源物质,《本草纲目》记载其具有化痰、止咳、敛肺、平喘等功效。银杏干制品中蛋白含量13.2%[1],氨基酸组成合理,属于优质植物蛋白[2]。目前我国对银杏资源开发利用还处于初级阶段,由于银杏产量大,价格低,大量资源被浪费,迫切需要开发银杏精深加工产品[3]。银杏肽(Ginkgo bilobapeptides,GBP)为银杏蛋白经过蛋白酶水解得到的肽类混合物,所选蛋白酶通常为风味蛋白酶、碱性蛋白酶、木瓜蛋白酶、胃蛋白酶等单一或复合蛋白酶;具有抗氧化[4-6]、降血压[7]、降血糖[8]、降血脂[9]和肝保护[10]等作用,且易被吸收利用,具有广泛的应用前景。
锌是人体必需的微量元素之一,在蛋白质与核酸合成、生长发育、免疫调节、伤口愈合、维持正常味觉和食欲等方面具有重要作用[11]。近年来,我国人群锌膳食摄入量显著改善,但各年龄段仍存在不同程度的缺锌,尤其老年人尤为严重[12]。传统的无机锌和有机酸锌补充剂易与食物中的草酸、植酸等生成沉淀,锌的生物利用率较低,且有一定的副作用[13]。因此亟待开发高效安全且生物利用度率高的锌补充剂。研究表明,生物活性肽可通过羧基、氨基、亚氨基等基团与锌离子配位形成稳定的可溶性肽锌螯合物,一方面通过与锌离子的协同作用提高生物活性肽的原有活性,另一方面肽锌螯合物以肽的形式被消化吸收,可提高锌的生物利用率[14]。国内外已有不少以动植物蛋白源生物活性肽与锌金属离子反应制备肽锌螯合物的研究报道。Wang 等制备了一种用于补锌的酪蛋白源肽锌螯合物纳米颗粒,经体外模拟胃肠消化吸收后仍然有40%的锌离子以肽锌螯合物的形式存在[15]。Liu 等采用菠萝蛋白酶和风味蛋白酶分步水解法制备低分子量鸡皮胶原蛋白肽,进一步将鸡皮胶原蛋白肽与硫酸锌螯合制备了新型肽锌螯合物,研究发现肽锌螯合物的生物利用度高于硫酸锌,可通过减少肿瘤细胞和微环境中的自噬而抑制肿瘤生长[16]。郑英敏等通过Alcalase 酶水解大豆分离蛋白制备大豆多肽,并将大豆多肽与氯化锌进行螯合反应制备肽锌螯合物,结构分析表明锌离子可以与多肽中的羧基、氨基和肽键结合,从而形成大豆多肽锌螯合物[17]。现有研究报道存在锌离子与肽的螯合率偏低、肽锌螯合物在人体内的生物利用率不高等问题,因此亟需制备和鉴定新型肽锌螯合物。我国银杏资源丰富,银杏肽具有广泛的生物活性,以银杏肽为原料制备银杏肽锌螯合物(Ginkgo bilobapeptides-zinc chelate, Zn-GBP)具有重要研究意义与应用前景,目前有关Zn-GBP 的研究未见报道。
本研究采用复合风味蛋白酶水解银杏蛋白制备银杏肽,将银杏肽与硫酸锌进行螯合反应制备Zn-GBP,采用响应面法优化Zn-GBP 的制备工艺,通过体外模拟胃肠道消化分析Zn-GBP 中锌离子的生物利用率,以清除DPPH 和ABTS+自由基清除能力、还原能力为指标,评价了Zn-GBP 的体外抗氧化活性,旨在为银杏资源的开发利用,为Zn-GBP 的开发提供科学依据。
1 材料与方法
1.1 材料与仪器
银杏 2021 年10 月采收于江苏省邳州市;复合风味蛋白酶(1.5×104U/g) 丹麦诺维信公司;胃蛋白酶(EC 3.4.23.1, 1.2×104U/g)、胰蛋白酶(EC 3.4.21.4, 5.0×104U/g) 国药集团化学试剂有限公司;还原型谷胱甘肽(glutathione, GSH)、DPPH 和ABTS 美国Sigma-Aldrich 公司;其他试剂均为国产分析纯。
DCTZ-1000 多用途恒温超声提取机 北京弘祥隆生物技术开发有限公司;Labscale 小型切向流超滤系统 美国Millipore 公司;723C 可见分光光度计上海欣茂仪器有限公司;Alpha 1-2 LD plus 冷冻干燥机 德国Christ 公司;3K30 冷冻离心机 德国Sigma 公司。
1.2 实验方法
1.2.1 GBP 的制备 采用超声辅助碱提酸沉法制备银杏蛋白[18],考马斯亮蓝法测得纯度为84.35%。采用复合风味蛋白酶水解银杏蛋白制备银杏肽[9],酶解工艺流程为:银杏蛋白→酶解→灭酶→离心分离→超滤膜分离→冷冻干燥→GBP 粉。
1.2.2 Zn-GBP 的制备 取GBP 粉,加适量去离子水溶解,接着加入适量七水硫酸锌,超声波混匀(超声功率100 W,时间3 min),在一定的pH 和温度条件下螯合一定时间。冷却至室温,4500 r/min 离心15 min,取上清液,加入5 倍体积预冷的95%乙醇,4 ℃下醇沉12 h。4500 r/min 离心15 min,收集沉淀,用无水乙醇洗涤沉淀2~3 次,冻干,得到Zn-GBP。
1.2.3 螯合率与螯合物得率的测定 采用《GB 5009.14-2017 食品安全国家标准 食品中锌的测定》中的二硫腙比色法,测定样品中锌的质量。根据锌的质量,计算螯合率和螯合物得率。
式中:m1为Zn-GBP 中锌的质量,mg;m2为GBP 中锌的质量,mg;m3为反应体系锌的总质量,mg。
式中:m4为生成的螯合物质量,mg;m5为反应物的总质量,mg。
1.2.4 单因素实验 采用单因素实验考察肽锌比(银杏肽与锌质量比)、螯合pH、螯合温度和螯合时间对螯合率及螯合物得率的影响,试验因素水平如表1所示。每组试验重复3 次。
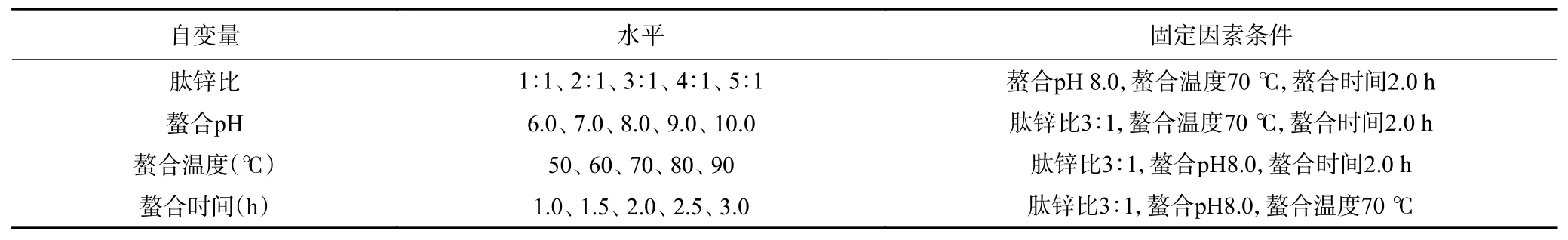
表1 单因素实验因素水平设计Table 1 Factors and levels of single factor experiment
1.2.5 响应面法优化试验 在单因素实验的基础上,采用响应面法中的Box-Behnken 试验设计,以螯合率为响应值,设计四因素三水平试验,因素水平如表2所示。
1.2.6 体外模拟胃肠道消化 采用Sun 等[19]报道的方法,略作修改。参照2015 版《中国药典》二部附录中的方法配制人工胃液与人工肠液。人工胃液:取4 mol/L 盐酸16.4 mL,加双蒸水约800 mL、胃蛋白酶10 g,混匀,加双蒸水定容至1000 mL,4 mol/L 盐酸调pH 至1.2。人工肠液:取0.68 g 磷酸二氢钾,加50 mL 双蒸水、7.7 mL 0.2 mol/L 氢氧化钠,再加入1 g 胰蛋白酶,双蒸水定容至100 mL,0.2 mol/L氢氧化钠调pH 至7.2。取50 mg Zn-GBP,加入10 mL人工胃液,混匀后,37 ℃下振荡水浴2 h。人工胃液消化后,调pH 至7.2 灭活胃蛋白酶,加入10 mL 人工肠液,移入到透析袋(2000 Da)中,37 ℃下振荡水浴2 h。人工肠液消化后,沸水浴10 min 灭酶。将Zn-GBP 替换为相同质量的硫酸锌作为阳性对照。
溶解率测定:分别取人工胃液和人工肠液消化后的消化液,10000 r/min 离心15 min。采用《GB 5009.14-2017 食品安全国家标准 食品中锌的测定》中的二硫腙比色法分别测定上清液中锌离子和消化液中总锌质量。根据锌的质量,计算溶解率。
式中:m6为上清液中锌离子的质量,mg;m7为消化液中总锌质量,mg。
渗透率测定:人工肠液消化后,分别取透析袋内外的溶液,采用二硫腙比色法分别测定内外溶液中锌离子质量。根据锌离子的质量,计算溶解率。
式中:m8为透析袋外液中锌离子的质量,mg;m9为透析袋内液中锌离子的质量,mg。
1.2.7 体外抗氧化活性测定 以DPPH 自由基清除能力、ABTS+自由基清除能力和还原能力为指标,评价Zn-GBP 的体外抗氧化活性。以GBP 作为组间对照,GSH 作为阳性对照。
1.2.7.1 DPPH 和ABTS+自由基清除能力测定 参照《GB/T 39100-2020 多肽抗氧化性测定 DPPH 和ABTS 法》。
式中:A1为样品溶液与DPPH 溶液混合液的吸光度;A2为样品溶液与乙醇溶液混合液的吸光度;A3为DPPH 溶液与样品试剂溶液混合液的吸光度。
式中:A4为ABTS+溶液与样品试剂溶液混合液的吸光度;A5为样品溶液与ABTS+溶液混合液的吸光度。
采用Origin 软件中的log3p1 模型,对数据进行非线性拟合,得到回归方程,计算半数有效浓度(half maximal effective concentration, EC50)。
1.2.7.2 还原能力测定 采用Oraiza 报道的铁氰化钾法[20]。将2 mL 样品溶液、2 mL 磷酸盐缓冲溶液(0.2 mol/L,pH 6.6)与2 mL 1% (m/V)铁氰化钾溶液混合。样品溶液50 ℃下孵育20 min 后,在上述反应体系中加入2 mL 10% (m/V)三氯乙酸,混匀,3500 r/min 离心8 min。离心后,取2 mL 上清液依次与0.4 mL 0.1% (m/V)氯化铁和2 mL 去离子水混合,50 ℃孵育10 min,测定700 nm 处的吸光度。将样品溶液替换为相同体积的去离子水作为空白对照。
1.3 数据处理
采用SPSS 24.0 软件进行数据统计与分析;试验重复三次,结果以平均值±标准差表示。采用新复极差法进行多重比较分析,P<0.05 表示统计学差异显著,P<0.01 表示统计学差异极显著。
2 结果与分析
2.1 单因素实验结果
2.1.1 肽锌比对螯合率及螯合物得率的影响 如图1所示,当肽锌比值由1:1 提高到3:1 时,螯合率及螯合物得率均随着肽锌比值的增加而升高,当肽锌比值高于3:1 时,螯合率及螯合物得率均随着肽锌比值的增加而下降。当肽锌比值较低时,大量锌离子未参加螯合反应;当肽锌比值较高时,溶液中产生聚集现象,银杏肽的利用率不高,螯合物得率下降[21]。综合考虑螯合率及螯合物得率,选择较优肽锌比为3:1。
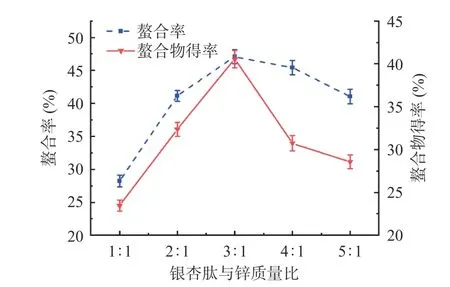
图1 银杏肽与锌质量比对螯合率及螯合物得率的影响Fig.1 Effect of mass ratio of Ginkgo biloba peptides to zinc on the chelation rate and chelate yield
2.1.2 螯合pH 对螯合率及螯合物得率的影响 图2为不同螯合pH 对螯合率及螯合物得率的影响。在螯合pH 为6.0~8.0 时,螯合率及螯合物得率均随螯合pH 的升高而增加,并在螯合pH 为8.0 时达到最大值。在螯合pH 为8.0~10.0 时,螯合率及螯合物得率均随螯合pH 的升高而降低。螯合pH 过低时,H+与锌离子争夺供电子基团,不利于螯合反应的进行;螯合pH 过高时,大量锌离子与OH-反应生成氢氧化锌沉淀,导致参与螯合反应的锌离子减少[21-22]。综合考虑螯合率及螯合物得率,选择较优螯合pH为8.0。
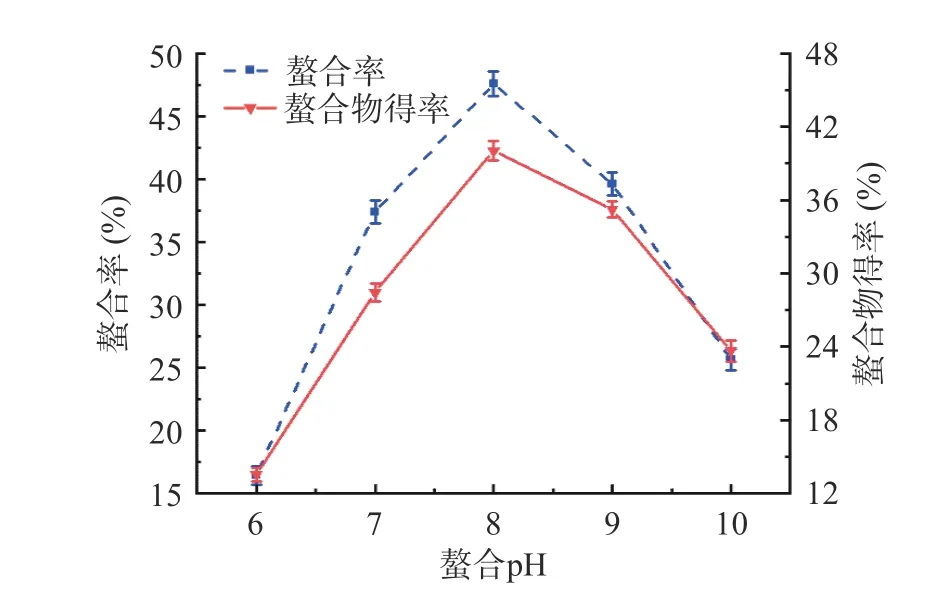
图2 螯合pH 对螯合率及螯合物得率的影响Fig.2 Effect of chelating pH on the chelation rate and chelate yield
2.1.3 螯合温度对螯合率及螯合物得率的影响 图3为不同螯合温度对螯合率及螯合物得率的影响。螯合率及螯合物均随螯合温度的升高而先增加后降低,并在螯合温度为70 ℃时达到最大值。螯合温度较低时,随着螯合温度的升高,反应体系的分子运动加快,增加了银杏肽与锌离子的碰撞几率,螯合率及螯合物得率上升;螯合温度较高时,随着螯合温度的升高,银杏肽结构可能被破坏,减少了螯合位点,或者生成的肽锌螯合物结构不稳定[23]。综合考虑螯合率及螯合物得率,选择较优螯合温度为70 ℃。
(52)合叶裂齿苔Odontoschisma denudatum(Dumort.)Dumort. 李粉霞等(2011)
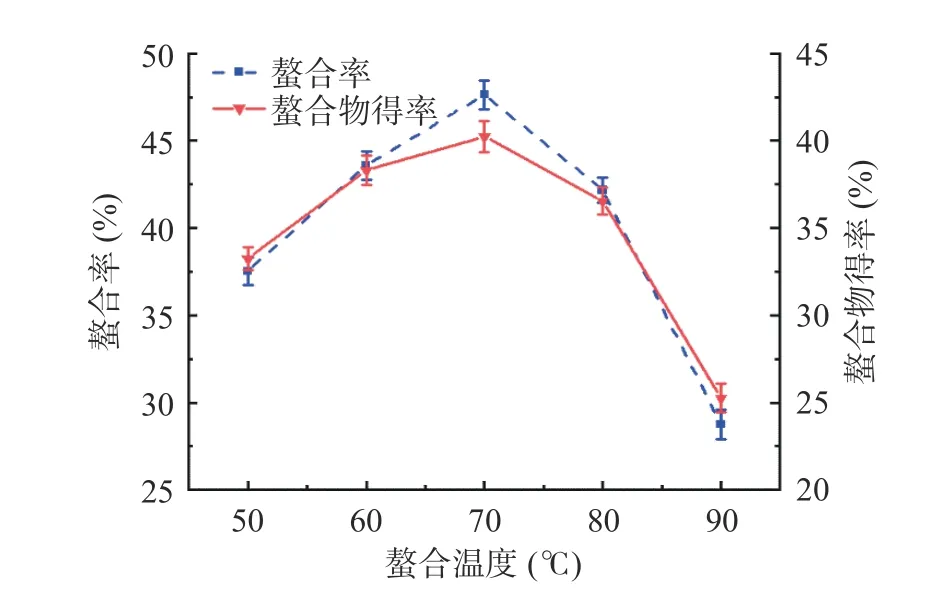
图3 螯合温度对螯合率及螯合物得率的影响Fig.3 Effect of chelating temperature on the chelation rate and chelate yield
2.1.4 螯合时间对螯合率及螯合物得率的影响 如图4 所示,当螯合时间在1.0~2.0 h 时,螯合率及螯合物得率均随着螯合时间的延长而升高,当螯合时间超过2.0 h 后,螯合率及螯合物得率的增幅均趋于平缓。螯合时间从2.0 h 延长至3.0 h 时,螯合率及螯合物得率增幅趋于平缓。综合考虑螯合率及螯合物得率,选择较优螯合时间为2.0 h。
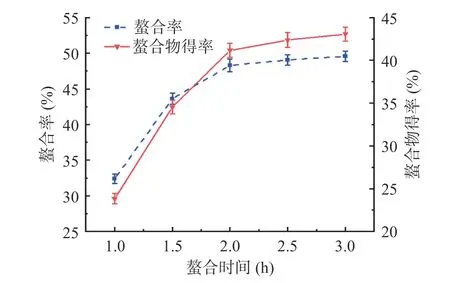
图4 螯合时间对螯合率及螯合物得率的影响Fig.4 Effect of chelating time on the chelation rate and chelate yield
2.2 响应面法优化结果
以螯合率为响应值,采用Box-Behnken 试验设计,优化Zn-GBP 的制备工艺参数。Box-Behnken试验设计及结果如下表3 所示。
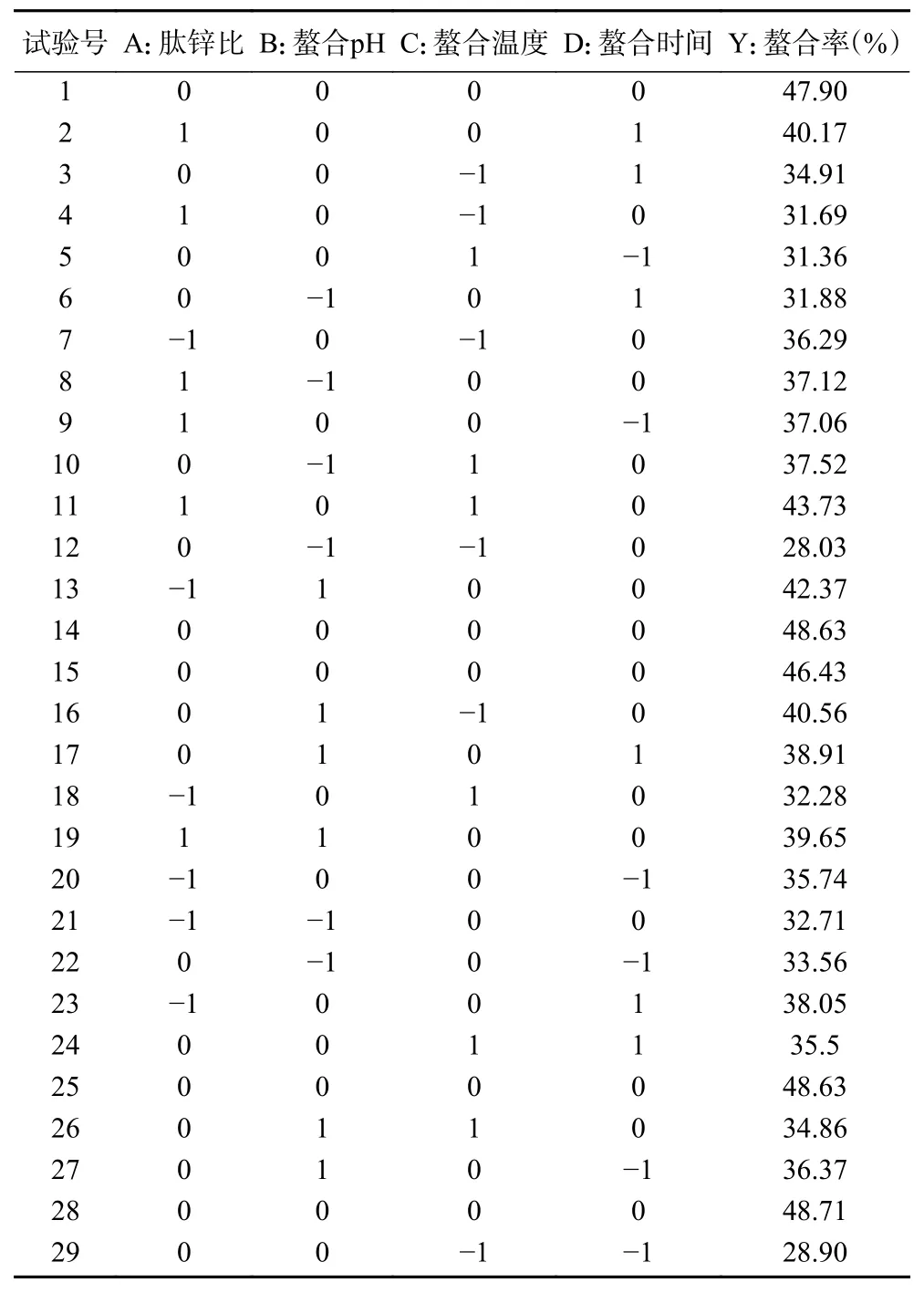
表3 Box-Behnken 试验设计及结果Table 3 Design and results of Box-Behnken experiment
2.2.1 回归模型的建立与检验 利用Design Expert软件对表3 数据进行多元非线性回归分析,得到螯合率(Y)与肽锌比(A)、螯合pH(B)、螯合温度(C)和螯合时间(D)的二次多项回归方程:Y=48.06+1.00A+2.66B+1.24C+1.37D-1.78AB+4.01AC+0.20AD-3.80BC+1.06BD-0.47CD-3.97A2-5.64B2-7.88C2-7.03D2。对该回归方程进行方差分析,结果见表4。
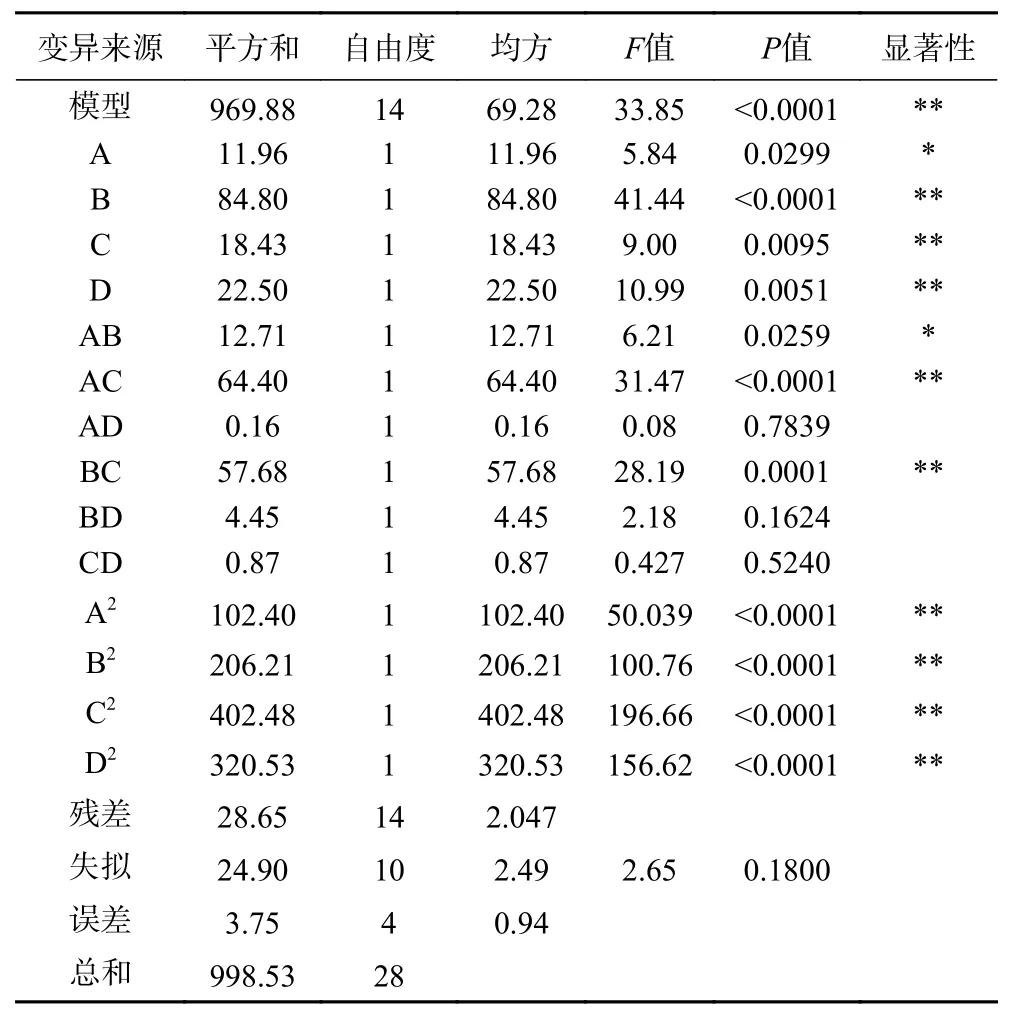
表4 回归模型方差分析Table 4 Analysis of variance with regression model
由表4 可知,该模型达极显著水平(P<0.01),失拟项不显著(P>0.05),校正决定系数R2Adj为0.94,表明该回归方程具有较高的拟合度和可信度,误差较小,可用于分析和预测Zn-GBP 的制备工艺。
一次项中,A 的回归系数显著(P<0.05),B、C、D 的回归系数极显著(P<0.01);二次项的回归系数均极显著(P<0.01);交互项中,AB 的回归系数显著(P<0.05),AC、BC 的回归系数极显著(P<0.01),表明肽锌比与螯合温度、肽锌比与螯合pH、螯合温度与螯合pH 等因素间的交互效应对螯合率有显著影响。
2.2.2 交互效应分析 响应面坡度越陡峭,表明两因素间的交互效应对螯合率的影响越大。图5A 为肽锌比与螯合pH 的交互效应对螯合率的影响。当肽锌比从2:1 上升到3:1 时,螯合率随之增加;肽锌比超过3:1 后,螯合率随之下降。螯合pH 从7.0 提高到8.0 时,螯合率随之增加;螯合pH 超过8.0 后,螯合率逐渐下降。图5B 为肽锌比与螯合温度的交互效应对螯合率的影响。当肽锌比为3:1 左右,螯合温度为70 ℃左右时,螯合率较高。图5C 为螯合pH 与螯合温度的交互作用对螯合率的影响。当螯合pH 处于较低水平时,随着螯合温度的增大,螯合率先急剧增加后缓慢降低;当螯合pH 处于较高水平时,随着螯合温度的增大,螯合率先缓慢增加后急剧降低。
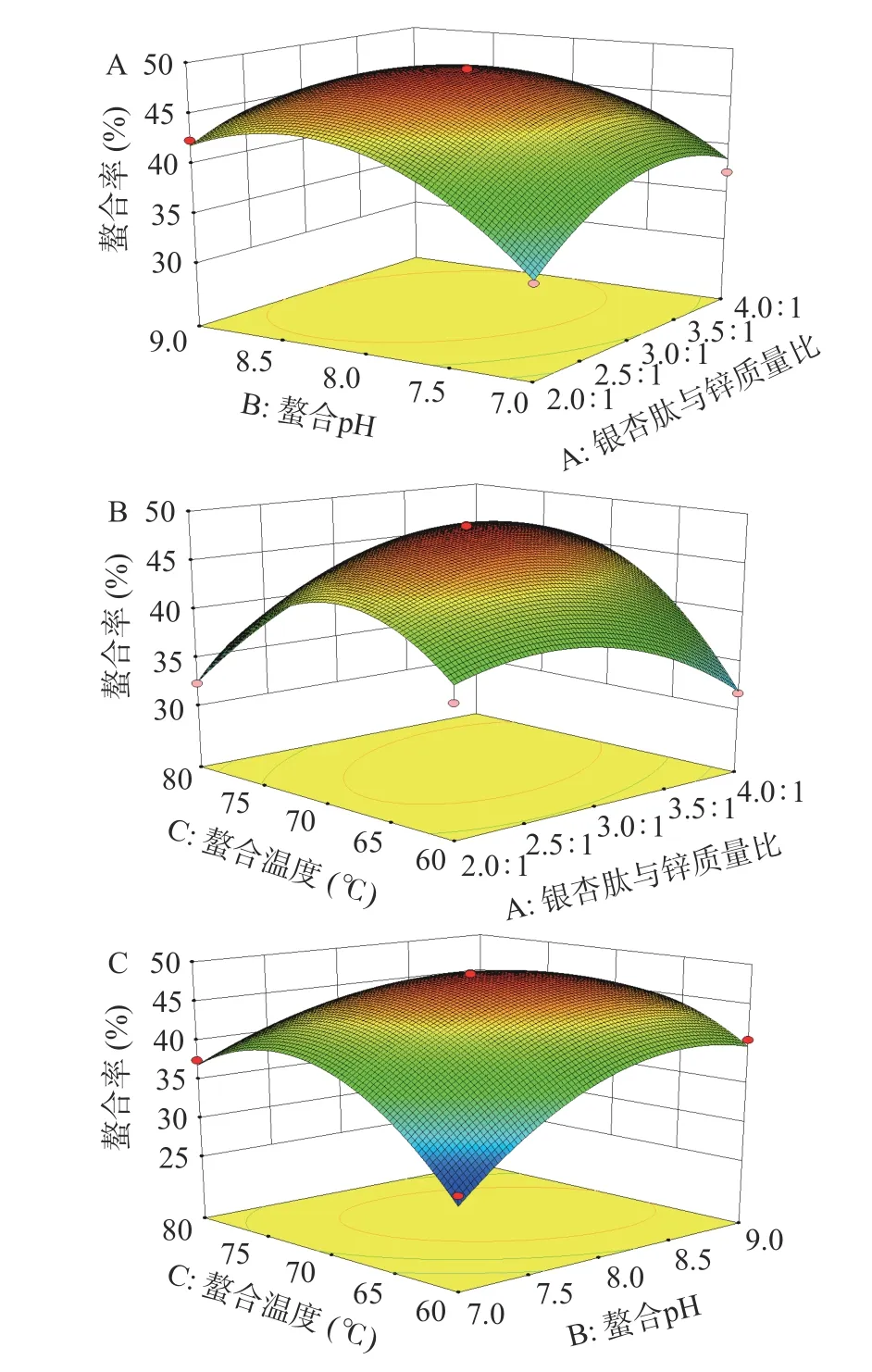
图5 交互效应对银杏肽锌螯合率的影响Fig.5 Interactive effect on the chelation rate of Ginkgo biloba peptides-zinc
2.2.3 最优提取工艺优化以及验证试验 对上述回归方程求二阶偏导,得到Zn-GBP 的最佳制备工艺参数为:肽锌比3.11:1、螯合pH 8.21、螯合温度70.51 ℃、螯合时间2.06 h,在此条件下螯合率的理论值为49.50%。为便于实际操作,将最佳工艺参数调整为肽锌比3:1、螯合pH 8.2、螯合温度70 ℃、螯合时间2 h。在此修正条件下,实测螯合率为49.23%±0.35%(n=3),与理论值较一致,表明此模型可用于指导生产实践;在此工艺条件下,螯合物得率为42.34%±0.45%(n=3)。
2.3 体外模拟胃肠道消化分析
图6为Zn-GBP 与ZnSO4分别经模拟胃肠道消化后的锌离子溶解率。Zn-GBP 与ZnSO4经人工胃液消化后的锌离子溶解率分别为99.23%±2.4%和90.86%±2.3%,存在显著差异(P<0.05);经人工肠液消化后的锌离子溶解率分别为69.47%±2.3%和45.83%±2.1%,亦存在显著差异(P<0.05)。Zn-GBP 经人工胃液消化后表现出良好的锌离子溶解率,原因可能是Zn-GBP 具有良好的稳定性,在胃蛋白酶水解过程中环状螯合结构未被破坏[24]。Zn-GBP 经人工肠液消化后锌离子溶解率有一定的降低,可能是因为Zn-GBP 的螯合结构被胰蛋白酶部分水解,游离出的锌离子在肠液环境中生成氢氧化锌沉淀[25]。ZnSO4经人工肠液消化后的锌离子溶解率大幅降低,是因为大量的锌离子形成了沉淀。
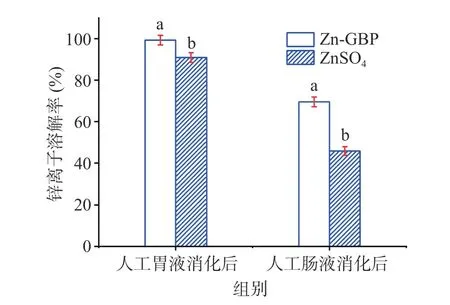
图6 银杏肽锌螯合物与ZnSO4 经模拟胃肠道消化后锌离子溶解率的比较Fig.6 Comparison of dissolution rates of zinc ions from Zn-GBP and zinc sulfate after in vitro simulated gastrointestinal digestion
图7为Zn-GBP 与ZnSO4分别经人工肠道消化后的渗透率。Zn-GBP 与ZnSO4经人工肠液消化后的渗透率分别为47.57%±1.8%和23.42%±1.3%,二者存在显著差异(P<0.05)。Zn-GBP 的渗透率高于ZnSO4的原因是Zn-GBP 经胃肠道消化后只有部分被降解,可通过透析袋;大多数锌离子形成了沉淀,无法通过透析袋[21]。综上,锌离子溶解率和渗透率结果表明,Zn-GBP 在胃肠道消化过程中具有良好的稳定性,避免了无机锌盐在肠道环境中因形成沉淀而导致生物利用率的问题。
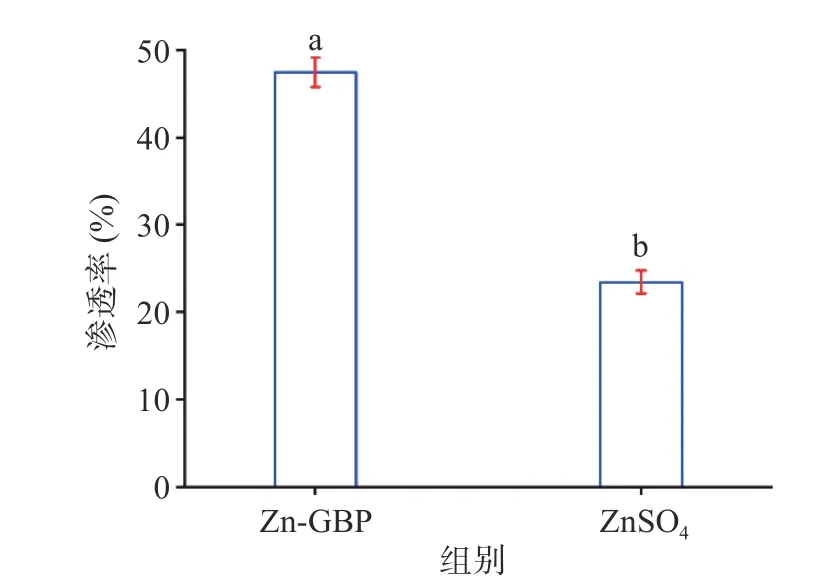
图7 银杏肽锌螯合物与ZnSO4 经模拟肠道消化后渗透率的比较Fig.7 Comparison of permeabilities of zinc ions from Zn-GBP and zinc sulfate after in vitro simulated intestinal digestion
2.4 体外抗氧化活性分析
2.4.1 DPPH 自由基清除能力 受试物对DPPH 自由基清除能力主要依赖于其供氢能力,当DPPH 自由基接受供体提供的氢原子时,奇数电子的氮原子减少,进而导致反应体系的吸光度降低[26]。Zn-GBP和GBP 对DPPH 自由基的清除能力如图8 所示。由图可知,在20~1000 mg/L 的质量浓度下,Zn-GBP和GBP 对DPPH 自由基的清除率均随质量浓度增加而增大;Zn-GBP 对DPPH 自由基的清除率始终高于GBP。在低质量浓度下,Zn-GBP 清除DPPH 自由基能力低于GSH;而当质量浓度高于800 mg/L时,Zn-GBP 对DPPH 自由基的清除能力与GSH 相当。
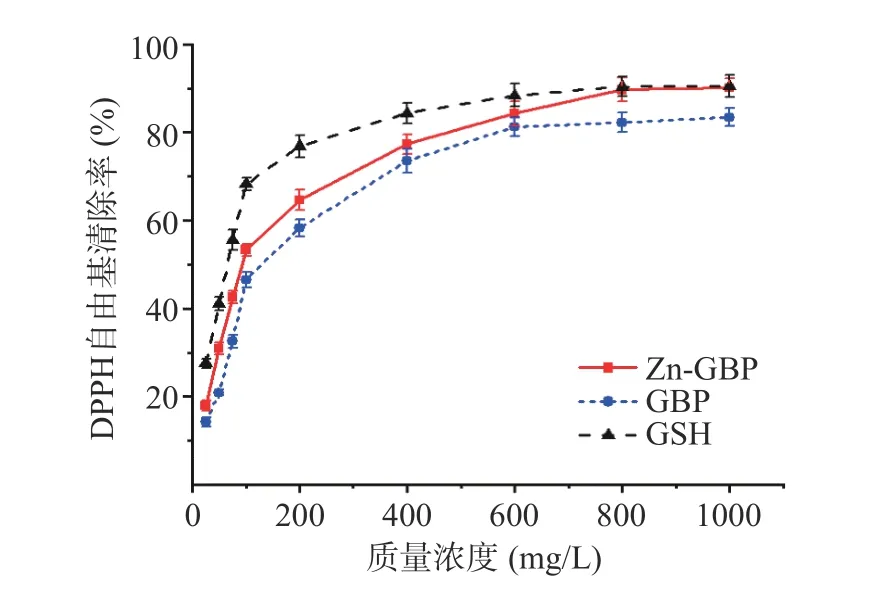
图8 银杏肽锌螯合物和银杏肽对DPPH 自由基的清除能力Fig.8 Scavenging effects of Zn-GBP and GBP against DPPH radicals
EC50是评价抗氧化能力的重要指标,EC50越小表明受试样品的抗氧化能力越强。Zn-GBP、GBP和GSH 清除DPPH 自由基的非线性回归方程分别为y=-31.12+18.01ln(x-10.65),R2=0.9921;y=-48.28+19.77ln( x -4.24) ,R2=0.9778; y=3.79+13.20ln( x -19.38),R2=0.9646。计算得到,Zn-GBP、GBP 和GSH 清除DPPH 自由基的EC50分别为101、148 和52.5 mg/L。由EC50可知,Zn-GBP 清除DPPH 自由基能力高于GBP,但低于GSH。
2.4.2 ABTS+自由基清除能力 ABTS+自由基在734 nm 处有最大吸收峰,加入受试样品后,如果734 nm 的吸光度降低,则表明受试物具有清除ABTS+自由基能力。图9 为Zn-GBP 和GBP 对ABTS+自由基的清除能力。由图可知,在测定的质量浓度下,Zn-GBP 和GBP 对ABTS+自由基的清除率均随质量浓度增加而增大;Zn-GBP 对ABTS+自由基的清除率始终高于GBP。质量浓度在25~100 mg/L范围内,Zn-GBP 清除ABTS+自由基能力低于GSH;而当质量浓度高于100 mg/L 时,Zn-GBP 对ABTS+自由基的清除能力始终高于GSH。
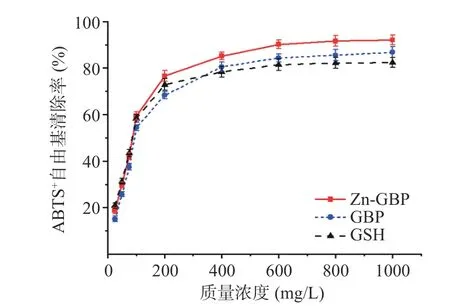
图9 银杏肽锌螯合物和银杏肽对ABTS+自由基的清除能力Fig.9 Scavenging effects of Zn-GBP and GBP against ABTS+radicals
Zn-GBP、GBP 和GSH 清除ABTS+自由基的非线性回归方程分别为y=-27.08+18.16ln(x-13.97),R2=0.9587;y=-31.79+17.99ln(x-12.93),R2=0.9644;y=10.27+14.26ln(x-17.09),R2=0. 0.9550。计算得到,Zn-GBP、GBP 和GSH 清除DPPH 自由基的EC50分别为83.6、107 和85.5 mg/L。由EC50可知,Zn-GBP 清除ABTS+自由基能力高于GBP 和GSH。
2.4.3 还原能力 采用铁氰化钾法测定受试物的还原能力时,如果受试物具有还原能力,则铁氰化钾被受试物还原为亚铁氰化钾,亚铁氰化钾进一步与三氯化铁反应生成亚铁氰化铁,后者在700 nm 处有最大吸收峰,利用吸光度评价受试物还原能力的强弱。铁氰化钾法测定的Zn-GBP 和GBP 的还原能力如图10 所示。在测定的质量浓度下,Zn-GBP、GBP和GSH 的还原能力均随着质量浓度的增加而提高。当质量浓度为1 g/L 时,Zn-GBP、GBP 和GSH的还原能力分别为0.386、0.353、0.426;质量浓度为3 g/L 时,Zn-GBP、GBP 和GSH 的还原能力分别为0.971、0.892、1.037。由此可知,Zn-GBP、GBP 和GSH 的还原能力强弱顺序为GSH>Zn-GBP>GBP。对分光光度法而言,当吸光度大于1.0 时,测量误差较大,故不再进一步提高待测样液的质量浓度。
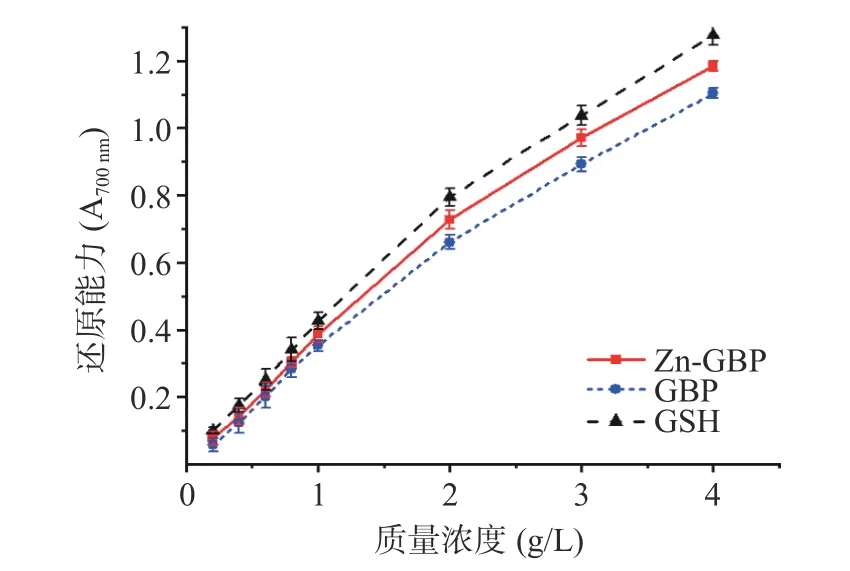
图10 铁氰化钾法测定的银杏肽锌螯合物和银杏肽的还原能力Fig.10 Reduction power of Zn-GBP and GBP determined by potassium ferricyanide method
3 结论
通过单因素试验及Box-Behnken 试验设计,获得了Zn-GBP 的最佳制备工艺参数为银杏肽与锌质量比3:1、螯合pH 8.2、螯合温度70 ℃、螯合时间2 h;在此条件下,螯合率为49.23%±0.35%(n=3),螯合物得率为42.34%±0.45%(n=3)。与无机锌盐相比,Zn-GBP 经人工胃液消化后表现出良好的锌离子溶解率和渗透率,具有较好的生物利用率。Zn-GBP 具有较好的清除DPPH 自由基、清除ABTS+自由基能力和还原能力,且较GBP 有所提高,TOP-2 清除DPPH 和ABTS+自由基的EC50值分别为101 和83.6 mg/L。本研究得到了一种具有良好抗氧化活性且生物利用率较高的Zn-GBP,获得了该肽锌螯合物的最佳制备工艺参数,后续将进一步筛选并表征高抗氧化活性的肽段、分析抗氧化作用机制及构效关系。
