枸杞叶多糖对小鼠代谢、抗氧化、免疫功能及肠道微生物的影响
2023-08-25李泉积金亚婷赵嘉庆
白 敏,张 颖,李泉积,姬 锦,金亚婷,王 琦, ,赵嘉庆,3,4,5,
(1.宁夏医科大学基础医学院,宁夏银川 750004;2.宁夏医科大学公共卫生与管理学院,宁夏银川 750004;3.宁夏医科大学医学科学技术研究中心,宁夏银川 750004;4.宁夏常见传染病防控重点实验室,宁夏银川 750004;5.宁夏回族自治区医学科学研究所,宁夏银川 750004)
枸杞是中国传统的中草药,也是一种食品补充剂。随着研究的深入,已证明枸杞是一种能够增强免疫力[1-2]、缓解炎症[3],抗肿瘤[4]、降糖调脂[5]、保肝护肝[6]功效的药食两用植物。在发展食用枸杞果的同时,作为副产业的枸杞叶在市场上创造的效益也相当可观[7],不仅因其含有枸杞多糖和特殊的营养成分,更由于其既可作茶饮又可作为药材食用,因此人们对枸杞叶的需求量呈逐年递增的趋势[8]。研究表明枸杞叶的化学成分,无论在活性成分、营养成分还是微量元素方面,与果实基本一致,而且在量上某些成分甚至超过果实[9]。增加对枸杞叶的研究开发可以变废为宝,扩大资源并有效利用资源。
枸杞多糖作为枸杞叶中的主要有效成分,关于其提取工艺及食用疗效的研究也在逐渐增加。目前的研究表明枸杞叶多糖对糖尿病[10]、过敏性哮喘[11]、阿尔茨海默症[12]等多种疾病表现出有益作用。但关于枸杞叶多糖的使用剂量与功效仍不明确,对机体健康水平的评估如生物代谢、抗氧化能力及免疫功能等方面的研究鲜有报道,因此本工作主要研究不同剂量的枸杞叶多糖对小鼠肠粘膜的变化、抗氧化能力、免疫功能指标、生物代谢及肠道菌群的影响,从而评估枸杞叶多糖对机体的健康水平是否具有促进作用,为枸杞叶多糖的功效研究和产品开发提供理论依据。
1 材料与方法
1.1 材料与仪器
6~8 周C57BL/6 雌性小鼠 40 只,平均体重18~22 g,购买于北京维通利华实验动物技术有限公司(合格证号:SCXK 京 2016-0006,伦理审查批准号:2019-121)。 随机分为4 组分别为正常对照组、枸杞叶多糖低、中、高剂量组,每组10 只。喂养于湿度为50%~60%,温度20~26 ℃明暗交替12 h 的SPF 级的动物房内,用高压灭菌处理的饮用水和饲料进行饲养。
枸杞叶多糖(含量为60%) 由宁夏森淼科技集团股份有限公司提供;小鼠饲料 购自江苏省协同医药生物有限公司;流式抗体抗小鼠CD3-APC、APC Rat IgG2bκ(CD3 同型对照)标记T 细胞、抗小鼠CD19-PE、PE Rat IgG2aκ(CD19 同型对照)标记B细胞、抗小鼠CD11c-FITC、FITC Armenian Hamster IgG(CD11c 同型对照)标记树突状细胞(DC)细胞美国Biolegend 公司;小鼠脾脏淋巴试剂盒、胎牛血清、磷酸盐缓冲液(pH7.2~7.4)、培养基1640、红细胞裂解液 中国索莱宝公司;总超氧化物歧化酶(SOD)测定试剂盒、丙二醛(MDA)测定试剂盒、谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒 南京建成生物工程研究所;文库定量试剂盒 美国Kapa Illumina 公司。
BD Accuri C6 型流式细胞仪 美国BD Biosciences;THZ-98 型气浴恒温振荡器 上海博讯实业有限公司;Z326k 型台式冷冻离心机 德国Hermle公司;S-3400N 型扫描电镜 日本日立公司;2100 型生物分析仪 美国Agilent 公司;AU400 型全自动生化分析仪 日本Olympus。
1.2 实验方法
1.2.1 枸杞叶多糖干预小鼠 正常对照组灌服生理盐水200 μL。枸杞叶多糖低、中、高剂量组每日灌服等体积纯枸杞叶多糖的剂量为50、100、150 mg/kg 枸杞叶多糖。以上操作1 次/d,连续7 周。灌胃剂量的选择参考之前的报道[13],其实验结果表明在小鼠模型中灌服枸杞多糖在17.5~140 mg/kg区间,免疫量效关系呈现上升趋势。因此设置将50、100、150 mg/kg 三个剂量作为本次枸杞叶多糖低、中、高剂量的研究对象,从而探究枸杞叶多糖对机体的影响。
1.2.2 扫描电镜观察 7 周灌胃结束后,麻醉小鼠,从距Treitz 韧带约10 cm 处取下一段空肠,纵行切开肠管,用生理盐水充分冲洗肠内容物,冲洗干净后浸入2.5%戊二醛固定液中4 ℃固定2 h,0.1 mol/L磷酸缓冲液清洗三次,每次10 min;加入1%锇酸,4 ℃,固定1 h,0.1 mol/L 磷酸缓冲液清洗两次;梯度乙醇脱水:30%、50%、70%、80%、90%、100%乙醇室温各10 min。75%、100%的叔丁醇中干燥两次,每次15 min,置于-20 ℃冰箱冰冻10 min。真空干燥后,进行真空镀膜喷涂,使用S-3400N 扫描式电子显微镜观察[14]。
1.2.3 小鼠血清抗氧化能力的测定 7 周灌胃结束后麻醉小鼠,眼球取血于1.5 mL 高压灭菌后的EP管中,4 ℃、2000 r/min、离心15 min,分离出血清。进行T-SOD、GSH-Px 活性及MDA 含量的检测,其检测均采用南京建成生物工程研究所试剂盒,操作步骤按照说明书进行。
1.2.4 脾脏组织单细胞悬液的制备 采血取眼球血后,处死小鼠,打开小鼠腹腔,分离脾脏,将其浸浴在预冷的完全培养基中。将脾脏放在两层300 目尼龙网膜中间,浸浴在完全培养基中,用5 mL 注射器活塞沿同一方向侧向研磨脾脏,使脾细胞游离出来。用300 目尼龙网膜过滤研磨好的脾细胞悬液,15 mL离心管收集滤液。4 ℃、400×g、5 min 离心,弃上清,留沉淀。向沉淀中加入5 mL 1×红细胞裂解液,混匀,冰上孵育5 min。用适量的磷酸盐缓冲液重悬细胞沉淀,显微镜下计数,调整细胞浓度至1×107个/mL。
1.2.5 流式细胞术检测脾脏免疫细胞数量 取出100 μL 制备好的脾脏组织单细胞悬液,其细胞数量为1×106个/mL,各加入2 μL CD3-APC 标记T 细胞、CD19-PE 标记B 细胞、CD11c-FITC 标记DC 细胞。同时设置同型对照组,分别加入同型抗体APC Rat IgG2bκ、PE Rat IgG2aκ、FITC Armenian Hamster IgG。冰上孵育30 min,染色缓冲液洗涤两次,流式细胞仪BD Accuri C6 上机检测。
1.2.6 小鼠血清生化指标的测定 取各组小鼠全血于抗凝管中,将全部全血样本置于高速离心机3000×g离心15 min 分离血清,进行生化指标的测定。测定指标包括血糖、胆红素、谷草转氨酶、谷丙转氨酶、甘油三酯、胆固醇、总蛋白、白蛋白、球蛋白、肌酐、尿酸、尿素氮等18 项生化指标的检测,所有生化检测指标均由宁夏医科大学科技中心医学分析检测中心OlympusAU400 全自动生化分析仪检测。
1.2.7 小鼠粪便16S RNA 测序 收集连续灌胃7 周后,正常对照组及高剂量枸杞叶多糖组小鼠粪便。十六烷基三甲基溴化铵法提取各组粪便样本中的总DNA,采用紫外分光光度计对DNA 进行定量。用引物341F(5'-CCTACGGGNGGCWGCAG-3') 805R(5'-GACTACHVGGGTATCTAATCC-3')PCR 扩增16S rRNA 基因的V3-V4 区。PCR 扩增产物通过2%琼脂糖凝胶电泳检测,对纯化后的PCR 产物使用Agilent 2100 生物分析仪和Illumina 的文库定量试剂盒进行评估。根据测序所到的样本中的序列信息与Silva 和NT-16S 数据库进行比对作物种分类及后续分析。
1.3 数据处理
使用Graphpad Prism 6.0 软件进行统计学分析,各组实验数据用均数±标准差(x¯±s)表示,枸杞叶低、中、高剂量组分别同正常对照组进行两样本t检验,P<0.05 为差异有统计学意义。
2 结果与分析
2.1 枸杞叶多糖干预后对小鼠肠粘膜的影响
根据1.2.2 节的方法,结果发现小鼠肠绒毛呈比较宽厚的叶片状,排列整齐、规则,表面有纵横交错,深浅不一的裂隙,不同剂量的枸杞叶多糖干预后同正常对照组相比无明显变化(见图1)。表明不同剂量的枸杞叶多糖不会对小鼠肠粘膜造成损伤。
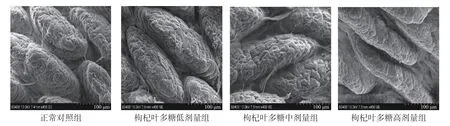
图1 枸杞叶多糖干预后对肠粘膜的影响Fig.1 The effect of Lycium barbarum leaves polysaccharides intervention on intestinal mucosa
2.2 枸杞叶多糖干预后对小鼠抗氧化能力的影响
大多数植物多糖都有抗氧化功能[15-16],谭连杰[17]在评估多糖对机体产生的影响时,对实验动物抗氧化能力、免疫功能及生物代谢等方面的作用进行了评估,因此进行了参考。为了进一步验证枸杞叶多糖对小鼠机体抗氧化能力的影响,通过口服不同剂量枸杞叶多糖后,检测小鼠血清中丙二醛(MDA),谷胱甘肽过氧化物酶(GSH-Px),总超氧化物歧化酶(T-SOD)指标。T-SOD 具有抗氧化能力,且消除代谢过程中产生的氧自由基,保护细胞免受损伤。MDA 是膜脂过氧化最重要的产物之一,其浓度与细胞损伤程度呈正相关性,其浓度可间接反映膜脂过氧化程度[18]。GSH-Px 是机体内广泛存在的一种重要的过氧化物分解酶,通过将脂质过氧化氢还原为相应的醇,并将H2O2还原为水来保护机体免受氧化损伤[19]。由表1可知,与正常对照组比较,中、高剂量枸杞叶多糖组均可以升高血清中T-SOD 水平,差异有统计学意义(P<0.05);高剂量枸杞叶多糖组可以降低血清中MDA 水平,差异有统计学意义(P<0.05);中、高剂量枸杞叶多糖可升高GSH-Px 的活性,差异有统计学意义(P<0.01)。目前的研究中许多植物多糖均有抗氧化的能力[20],在一些动物如,虾[21]、鲤鱼[22]、鸡[23]、小鼠[24]等动物的饲料中添加多糖或以口服的方式灌胃多糖类食品均可起到抗氧化的能力,同时起到提高免疫力的作用。研究结果表明,来源于枸杞叶中的多糖同样具有一定的抗氧化作用。
2.3 枸杞叶多糖干预后对小鼠免疫应答能力的影响
T 细胞具有直接杀伤靶细胞、辅助和抑制B 细胞产生抗体、分泌细胞因子等作用,可以抵御疾病的感染和肿瘤的形成。B 细胞受到抗原刺激后就会转变成浆细胞,浆细胞可以合成和分泌各种抗体,发挥体液免疫的功能。树突状细胞是机体免疫系统中功能最强大、最有效的抗原递呈细胞,能高效地摄取、加工处理和递呈抗原[25]。一些植物多糖已经表现出对免疫细胞的调节能力[26-28]。为了评价枸杞叶多糖对小鼠免疫功能的影响,采用1.2.4 与1.2.5 节的方法,口服不同剂量的枸叶多糖后,同正常对照组相比,脾脏淋巴细胞流式结果横坐标表示抗体类型,纵坐标表示相对细胞数,发现枸杞叶多糖低、中、高剂量组的T 细胞水平显著提升,具有统计学差异(P<0.05)(见图2)。同正常对照组相比,低、中、高剂量枸杞叶多糖组B 细胞数量无明显变化(见图3)。同正常对照组相比,枸杞叶多糖低、中、高剂量组DC 细胞数量显著上升(P<0.05)(见图4)。不同种类免疫细胞数量的统计结果见图5,纵坐标为细胞在脾脏总细胞中所占比例。实验通过检测小鼠脾脏的淋巴细胞数量变化探究枸杞叶多糖对免疫细胞的作用可知,枸杞叶多糖可增强机体特异性免疫中的T 细胞免疫,但对B 细胞数量产生无明显变化。有报道显示,DC 细胞是机体免疫系统中重要的抗原提呈细胞,功能强大,可活化初始T 细胞从而调控天然免疫和获得性免疫[29],因此枸杞叶多糖可提高天然免疫与特异性免疫功能。这对提高机体免疫力具有重要意义。
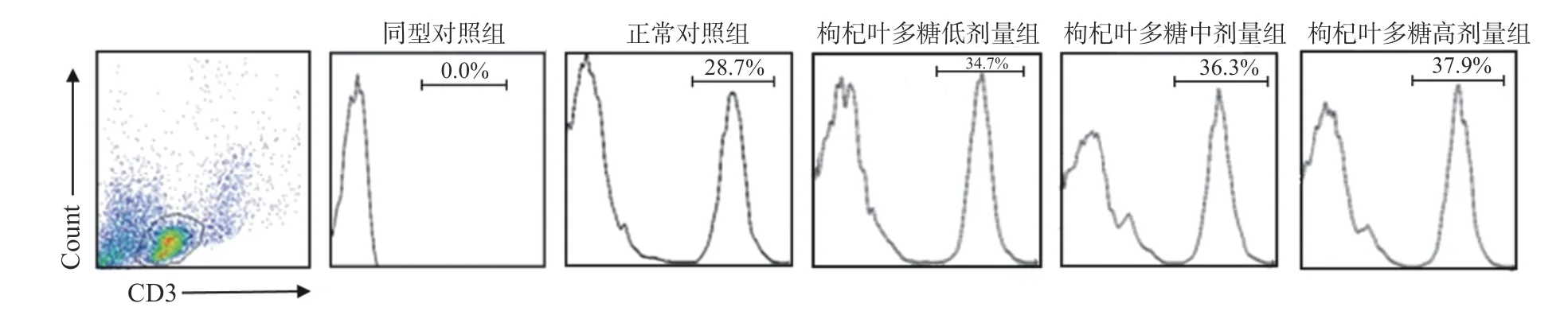
图2 枸杞叶多糖干预对小鼠T 细胞的影响Fig.2 Effect of Lycium barbarum leaves polysaccharides intervention on T cells in mice
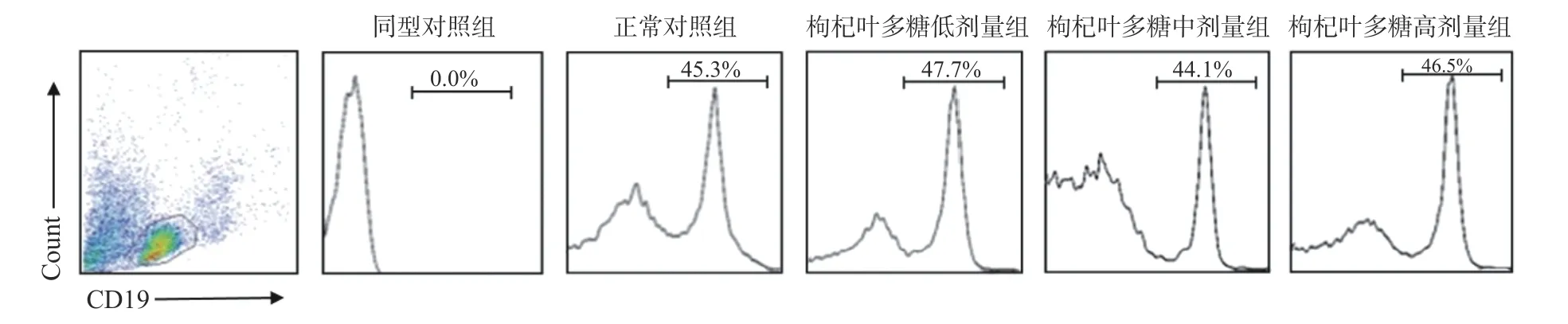
图3 枸杞叶多糖干预对小鼠B 细胞的影响Fig.3 Effect of Lycium barbarum leaves polysaccharides intervention on B cells in mice
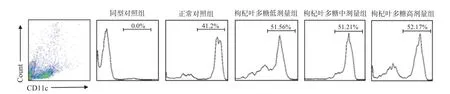
图4 枸杞叶多糖干预对小鼠DC 细胞的影响Fig.4 Effect of Lycium barbarum leaves polysaccharides intervention on DC cells in mice
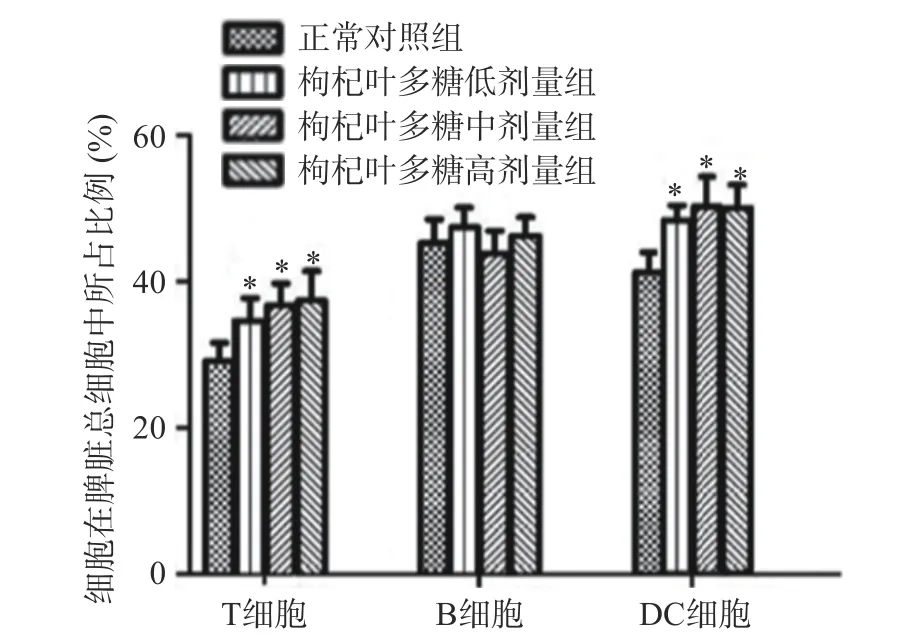
图5 枸杞叶多糖干预后对小鼠脾脏淋巴细胞数量的影响Fig.5 Effect of Lycium barbarum leaves polysaccharides intervention on the number of spleen lymphocytes in mice
2.4 枸杞叶多糖干预后对小鼠机体生物代谢的影响
通过不同剂量枸杞叶多糖对小鼠肠粘膜的影响结果可知,高剂量的枸杞叶多糖对小肠粘膜无损害。其次,根据枸杞叶多糖对小鼠的抗氧化能力和免疫功能的研究结果发现,高剂量的枸杞叶多糖对小鼠的促进作用最佳。因此,检测高剂量枸杞叶多糖组对小鼠生物代谢的改变。结果显示,同正常对照组相比较,枸杞叶多糖高剂量组甘油三脂、谷草转氨酶水平显著低于正常对照组(P<0.05),有统计学意义(见表2)。其它生化指标无显著差异。甘油三酯来自于脂肪物质的分解,甘油三酯过多会导致皮下脂肪的堆积,引起肥胖[30],表明服用高剂量的枸杞叶多糖可在一定程度上帮助机体分解脂肪。谷草转氨酶存在于肝细胞中,当肝功能受到损伤时谷草转氨酶会升高[31],口服高剂量的枸杞叶多糖可降低谷草转氨酶的含量,表明高剂量枸杞叶多糖的摄入对正常小鼠肝脏的保护具有一定的促进作用。其次其它生化指标没有影响,表明高剂量的枸杞叶多糖不会对机体的基本生物代谢产生损害。
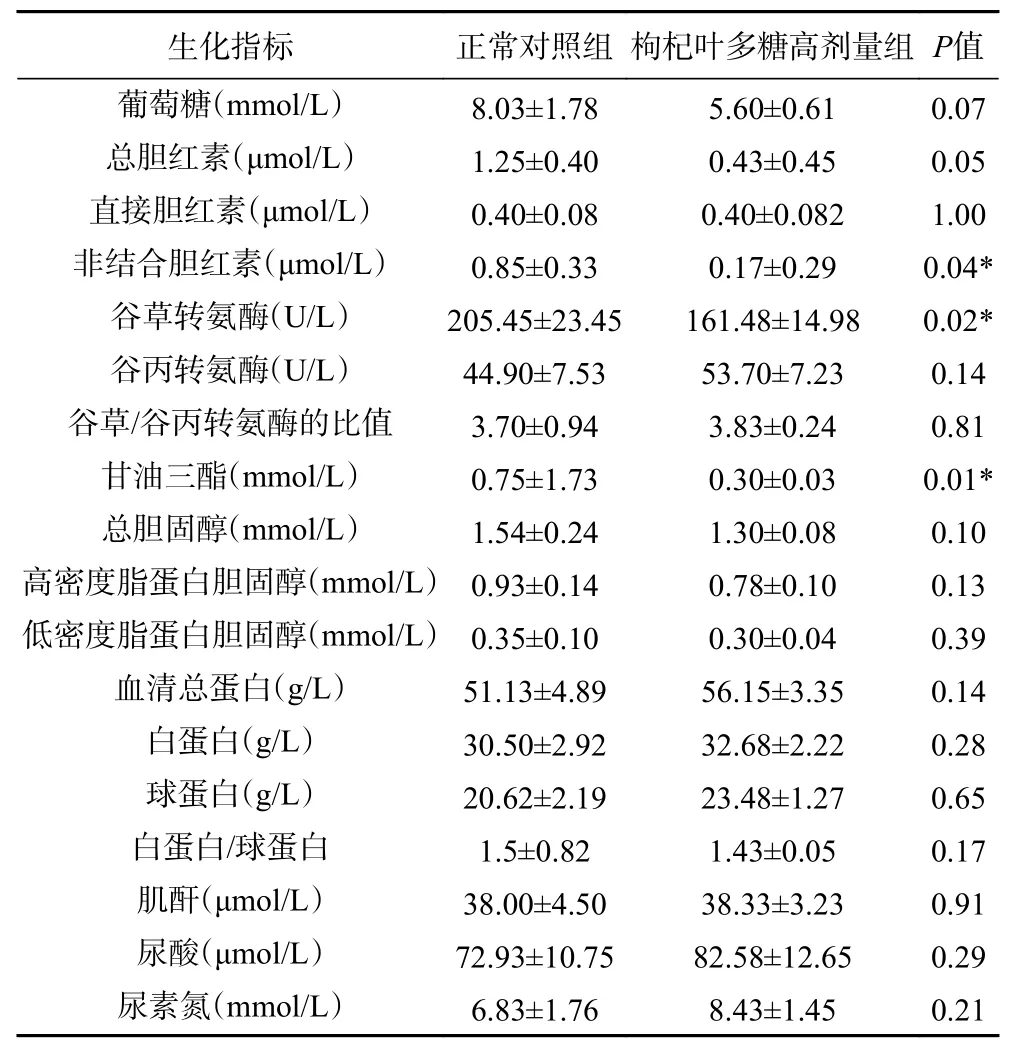
表2 枸杞叶多糖干预后对小鼠血清生化指标的影响(x¯±s,n=10)Table 2 Effect of Lycium barbarum leaves polysaccharides intervention on serum biochemical indexes (x¯±s,n=10)
2.5 枸杞叶多糖干预后小鼠体内肠道菌群的变化
为了确定灌胃枸杞叶多糖后,小鼠肠道微生物区系是否发生变化,使用16S RNA 测序技术检测正常对照组及高剂量枸杞叶多糖组小鼠粪便菌种的RNA,并进行差异性分析,筛选P值小于0.05 的物种绘制柱状图。图中横坐标为分组,纵坐标为物种相对丰度。枸杞叶多糖高剂量组与对照组相比(图6),在门水平上,灌胃高剂量枸杞叶多糖的小鼠疣微菌门显著增加(P<0.05)。在属水平上,灌胃了高剂量枸杞多糖的小鼠肠道菌群中杜氏杆菌(Dubosiella)、粪杆菌属(Faecalibaculum) 、 乳杆菌 HT002(LactobacillaceaeHT002)、乳杆菌属(Lactobacillus)、瘤胃球菌属(Ruminococcus)、嗜黏蛋白阿克曼菌(Akkermansia)这些有益菌均增加。这些菌参与调节代谢途径,例如参与碳水化合物代谢、氨基酸代谢、短链脂肪酸代谢和信号转导途径等[32-34]。疣微菌门的代表菌属——嗜黏蛋白阿克曼菌,它利用肠道粘蛋白作为能量来源,保护肠道免受病原体的侵袭,是一种潜在的益生菌[35];乳杆菌和瘤胃球菌属通过产生抑制病原体增殖和减少肠道炎症的短链脂肪酸来减少细菌感染[36]。这一研究表明服用枸杞叶多糖能够改善肠道菌群,增加益生菌的丰度,能够抵抗和预防更多疾病。
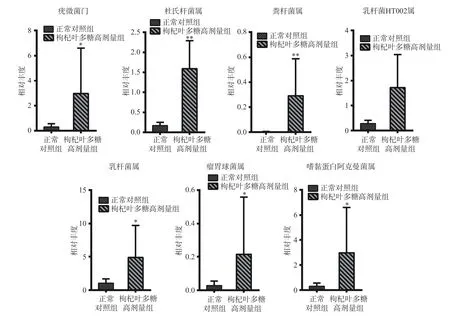
图6 枸杞叶多糖干预后对小鼠体内肠道菌群的影响Fig.6 Effect of Lycium barbarum leaves polysaccharides intervention on intestinal flora in mice
3 结论
本研究着重于枸杞叶多糖对机体的功效,通过服用不同剂量的枸杞叶多糖,表明服用高剂量(150 mg/kg)枸杞叶多糖对肠粘膜的结构及生物代谢无任何损伤,且有助于甘油三酯的分解及肝脏的保护。同时,增加机体的抗氧化能力、调节免疫功能、改善肠道菌群,使机体抵御病原体的侵害,从而达到预防疾病的目的。而低、中剂量枸杞叶多糖与正常对照组相比有较小差异或无差异,造成此现象最大的原因是由于动物实验中灌胃的时间有限,低、中剂量的效果发挥可能需要更长的时间。其次通过不同剂量的比较时发现,枸杞叶多糖高剂量(150 mg/kg)服用时效果最佳,为枸杞叶多糖剂量的选择提供参考。同时,为枸杞叶的开发利用提供了理论支撑,提高枸杞叶的利用率,具有创新和实用性。
