西洋参低聚糖的制备及其体外功能活性分析
2023-08-25张蕙竹熊博宇
张蕙竹,陶 立,刘 睿,熊博宇,于 雷,2,
(1.吉林农业大学食品科学与工程学院,吉林长春 130118;2.吉林农业大学小麦和玉米深加工国家工程实验室,吉林长春 130118)
西洋参多糖(American ginseng polysaccharides,AGP)是一类大分子多糖,相对分子质量范围为2×104~7×104,主要由葡萄糖、半乳糖、木糖、阿拉伯糖和鼠李糖组成[1],主要糖苷键类型为β-(1,4)[2]。其作为西洋参主要的功能成分之一,具有抗氧化、降血糖和抗肿瘤等功能活性[3],但其相对分子质量大,难以有效地跨膜来发挥生物效应[4],限制了西洋参多糖在生物体内的应用[5]。而低聚糖不仅具有低热量、稳定性高和安全无毒等理化特性,还具有调节肠道功能、调节血糖和抗氧化等功能活性,并且其相对分子质量较低,更容易被人体吸收利用[6]。
酶的特异性、高效性、温和性以及可调性使其在实验中得到广泛应用,酶能够作用于糖苷键使其断裂从而达到水解多糖的目的。按照酶促反应的性质,可将酶进行分类,纤维素酶、淀粉酶和壳聚糖酶等催化底物发生水解反应的酶归类于水解酶类[7]。目前关于酶解多糖的研究中,利用纤维素酶作用于β-(1,4)糖苷键水解阿拉伯木聚糖,其水解产物具有更好的益生活性[8],通过α-淀粉酶水解牡蛎多糖的α-(1,4)糖苷键,可以成功制备牡蛎寡糖[9],利用壳聚糖酶制备得到的甲壳低聚糖可以克服壳聚糖在中性溶液中难溶的缺点[10],利用纤维素酶和果胶酶复合酶解苹果多糖,对酶解前后的抗氧化活性进行评估,其酶解产物具有更强的抗氧化活性[11],通过纤维素酶降解得到的黑木耳低聚糖具有更强的DPPH、OH-和O2-自由基清除能力[12]。相对于淀粉酶和壳聚糖酶而言,纤维素酶是一种复合酶,研究认为纤维素酶可以将纤维素转化为葡萄糖是其各组分协同作用的结果,这种协同作用机制,更加适合作用于复杂的多糖结构[13]。李立新等[5]利用纤维素酶将西洋参多糖进行酶解,并研究了酶解产物的初级结构,吴宪玲等[14]通过响应面法优化了酶解西洋参多糖的工艺条件,但目前尚未报道关于西洋参多糖酶解产物及西洋参低聚糖的生物活性研究。
吉林省长白山地区西洋参资源丰富,在人参皂苷加工产业中,提取完皂苷后的西洋参残渣中仍存在大量的多糖类物质,常作为废物被丢弃,造成资源浪费和环境污染。因此本研究充分利用西洋参残渣中的多糖,利用生物酶法对西洋参多糖进行转化具有重要的研究价值。将酶解产物进行超滤得到西洋参低聚糖,对其体外功能活性进行研究,弥补研究空缺,为深入研究西洋参低聚糖奠定理论基础,同时提高西洋参资源的综合利用,减少浪费,创造更高的经济效益。
1 材料与方法
1.1 材料与仪器
西洋参多糖 吉林省宏久生物科技股份有限公司提供(多糖含量:75%,将西洋参提取皂苷后过滤得到的残渣,采用水提浓缩法将得到的组分喷雾干燥制得);纤维素酶(50 U/mg)、葡萄糖、纤维二糖、α-葡萄糖苷酶(50 U/mg)、α-淀粉酶(50 U/mg)、脂肪酶(30 U/mg)、抗坏血酸、p-NPG、阿卡波糖、DPPH、ABTS 上海源叶生物技术有限公司;邻苯二甲醛、3,5-二硝基水杨酸 天津市光复精细化工研究所,所有试剂均为分析纯。
Y-PL300 型实验型喷雾干燥机 上海宇砚机械设备有限公司;MSC-300 超滤杯、500 Da 超滤膜、2 kDa 超滤膜 上海摩速科学器材有限公司;硅胶板G 青岛海洋化工有限公司;R3 旋转蒸发仪 上海沃珑仪器有限公司;UV-2600I 紫外可见分光光度计 岛津仪器有限公司。
1.2 实验方法
1.2.1 西洋参多糖的制备 西洋参与75%乙醇以1:8(w/w)的比例混合,在70 ℃下反应3 h。将反应结束过滤得到的料渣与蒸馏水以1:15(w/w)的比例混合,在100 ℃下充分反应3 h。将反应结束后过滤得到的滤液进行浓缩后喷雾干燥得到西洋参多糖(American ginseng polysaccharides,AGP)。
1.2.2 西洋参多糖酶解单因素实验
1.2.2.1 西洋参多糖酶解的影响因素 以pH5.0 的柠檬酸-磷酸氢二钠缓冲液配制西洋参多糖溶液,分别考察反应温度、底物浓度、加酶量、酶解时间对西洋参多糖酶解的影响。各因素设置如下:反应温度40、45、50、55、60、65 ℃,设定底物浓度20 mg/mL,加酶量100 U/mg,酶解时间60 min;底物浓度10、20、30、40、50、60 mg/mL,设定反应温度55 ℃,加酶量100 U/mg,酶解时间60 min;加酶量20、50、100、150、200、250 U/mg,设定反应温度55 ℃,底物浓度20 mg/mL,酶解时间60 min;酶解时间30、60、90、120、150、180 min,设定反应温度55 ℃,加酶量100 U/mg,底物浓度20 mg/mL。反应结束后沸水浴灭酶10 min,冷却后4800 r/min 离心10 min,取上清液进行薄层色谱(TLC)分析并测定平均聚合度。
1.2.2.2 薄层色谱分析 将硅胶板G 在105 ℃条件下活化30 min,葡萄糖和纤维二糖标准品为对照,稀释酶解液,点样量为5 μL。使用展开剂为乙酸乙酯:乙酸:异丙醇:甲酸:水=25:10:5:1:15,在4 ℃条件下重复展开3 次,85 ℃烘干后使用显色剂显色,显色剂为10%硫酸乙醇[15]。
1.2.2.3 平均聚合度的测定 参照杨书艳[16]的方法,采用苯酚-硫酸法测定总糖含量,配制0.1 mg/mL 葡萄糖标准溶液,分别吸取0.0、0.2、0.4、0.6、0.8、1.0 mL,加入蒸馏水补至2.0 mL;加入6%苯酚溶液1.0 mL,缓慢加入浓硫酸5.0 mL,摇匀后静置30 min,冷却至室温。用紫外分光光度计在490 nm 处测量吸光值,绘制标准曲线。得到葡萄糖标准曲线回归方程为y=13.473x+0.0076,R2=0.990。样品的测定:配制0.1 mg/mL 西洋参多糖溶液,吸取1.0 mL,按照上述步骤操作,根据葡萄糖标准曲线进行计算。
采用DNS 法测定还原糖含量,配制0.1 mg/mL葡萄糖标准液,分别吸取0.0、0.2、0.4、0.6、0.8、1.0 mL,加入蒸馏水补至1.0 mL,加入DNS 溶液2.0 mL,沸水浴加热5 min,加入蒸馏水补至10.0 mL,冷却至室温,用紫外分光光度计在540 nm 处测定吸光值,绘制标准曲线。得到葡萄糖标准曲线回归方程为y=13.259x-0.1907,R2=0.999。样品的测定:配制0.1 mg/mL 西洋参多糖溶液,吸取1.0 mL,按照上述步骤操作,根据葡萄糖标准曲线进行计算。
平均聚合度(DP)的计算公式如下:
1.2.3 西洋参低聚糖的分离制备 室温下,以钢瓶氮气为加压气体,控制压力为0.15±0.02 MPa,配制西洋参多糖酶解产物溶液浓度为20 mg/mL,在4800 r/min 下离心10 min,收集上清液。首先将上清液经过2 kDa 超滤膜过滤,收集滤液,将收集的滤液经过500 Da 超滤膜过滤,收集截留液,超滤至10 min内无过滤液滴下为终点[17]。将截留液冷冻干燥后得到西洋参低聚糖(American ginseng oligosaccharides,AGOS)。
1.2.4 西洋参低聚糖和西洋参多糖抗氧化活性的测定
1.2.4.1 ABTS+自由基清除能力的测定 参考刘昊等[18]的方法并修改,按体积比为1:1,将2.45 mmol/L过硫酸钾水溶液与7 mmol/L ABTS 溶液混合,于黑暗处避光反应12 h,稀释使ABTS 储备液在734 nm波长处吸光值为0.7±0.05。取100 μL 不同浓度的样品溶液,再加入170 μL ABTS 储备液,摇匀后置于黑暗处反应6 min,以抗坏血酸作为对照,在波长734 nm处测定吸光值。
ABTS+自由基清除率计算公式如下:
式中:C:ABTS+自由基清除率,%;A0:空白组测试值;A1:样品组测试值;A2:背景组测试值。
1.2.4.2 DPPH 自由基清除能力的测定 参考王鑫等[19]的方法并修改,配制DPPH 标准储备液(0.2 mmol/L),再分别取1.0 mL 不同浓度的样品溶液,依次加入1.0 mL DPPH 溶液,振荡摇匀后避光反应30 min,以抗坏血酸作为对照,在波长517 nm 处测定吸光度。
DPPH 自由基清除率计算公式如下:
式中:C:DPPH 自由基清除率,%;A0:空白组测试值;A1:样品组测试值;A2:背景组测试值。
1.2.4.3 OH 自由基清除能力的测定 参考Zhao 等[20]的方法并修改,吸取1.0 mL 不同浓度的样品溶液,依次加入各为1.0 mL 的FeSO4溶液和水杨酸溶液(浓度均为9 mmol/L),振荡混匀后静置15 min,再加入1.0 mL 8.8 mmol/L 的H2O2,置于37 ℃的恒温振荡箱中1 h,以抗坏血酸作对照,在波长510 nm 处测定吸光度。
OH 自由基清除率计算公式如下:
式中:C:OH 自由基清除率,%;A0:空白组测试值;A1:样品组测试值;A2:背景组测试值。
1.2.4.4 O2-离子清除能力的测定 参考计艳艳[21]的方法并修改,吸取1.0 mL 不同浓度的样品溶液,依次加入9.0 mL Tris-HCL 缓冲液(50 mmol/L;pH8.2),摇匀,37 ℃条件下预热20 min,然后加入2.5 mL 在37 ℃条件下预热过的邻苯二酚(3 mmol/L)溶液,以HCl(10 mmol/L)作空白对照,抗坏血酸为阳性对照,在325 nm 波长下测定吸光值。
O2-离子清除率计算公式如下:
式中:C:O2-阴离子清除率,%;A0:空白组测试值;A1:样品组测试值;
1.2.4.5 Fe2+螯合能力的测定 参考Gülçin[22]的方法并修改,吸取2.0 mL 不同浓度的样品溶液,依次加入100 μL 氯化亚铁溶液(2 mmol/L)、500 μL 菲洛嗪溶液(5 mmol/L)和5.5 mL 去离子水,混匀后室温反应10 min,在562 nm 波长下测定吸光度。
Fe2+螯合能力计算公式如下:
式中:C:Fe2+螯合能力,%;A0:空白组测试值;A1:样品组测试值;A2:背景组测试值。
1.2.4.6 总还原力的测定 参考Zhao 等[23]的方法并修改,吸取1.0 mL 不同浓度的样品溶液,依次加入2.0 mL 铁氰化钾溶液(1% w/v)、2.0 mL PBS 缓冲液(0.2 mmol/L;pH6.6),在50 ℃条件下反应20 min,加入2.0 mL 三氯乙酸溶液(10% w/v),混匀后离心10 min(3000 r/min),取上清液2.0 mL,加入2.0 mL去离子水和100 μL 三氯化铁溶液,室温反应10 min后在700 nm 波长下测定吸光值。吸光值即为样品的总还原力。
1.2.5 西洋参低聚糖和西洋参多糖降血糖能力的测定
1.2.5.1α-葡萄糖苷酶抑制能力的测定 参照羡荣华等[24]的方法稍作修改,将1.0 mL 不同浓度样品溶液与2.0 mLα-葡萄糖苷酶(2 U/mL)充分混合,于37 ℃温育20 min 后加入4.5 mLp-NPG(20 mmol/L)。在37 ℃继续温育30 min 后,加入7.0 mL 2 mol/L碳酸钠溶液,终止反应。在对照管中,使用相同量的缓冲液代替样品,于405 nm 处测量的吸光度来测定α-葡萄糖苷酶抑制能力,阿卡波糖为阳性对照。
α-葡萄糖苷酶抑制率计算公式如下:
式中:C:α-葡萄糖苷酶抑制率,%;A0:空白组测试值;A1:样品组测试值;A2表示背景组测试值。
1.2.5.2α-淀粉酶抑制能力的测定 参照李洁等[25]的方法稍作修改,分别准确称取100 μLα-淀粉酶,与200 μL 不同浓度样品溶液,于37 ℃反应15 min,加入5.0 mL 1%淀粉溶液反应10 min,再加入6.0 mL DNS 溶液,混合均匀后沸水加热15 min,冷却后于540 nm 测定样品的α-淀粉酶抑制能力,阿卡波糖为阳性对照。
α-淀粉酶抑制率计算公式如下:
式中:C:α-淀粉酶抑制率,%;A0:空白组测试值;A1:样品组测试值;A2:背景组测试值。
1.2.6 西洋参低聚糖和西洋参多糖降血脂能力的测定
1.2.6.1 胆固醇结合能力的测定 参照张婷婷[26]的方法稍作修改,将新鲜的鸡蛋黄与9 倍体积的蒸馏水混合搅拌成均一状态的乳浊液,将pH 调为2.0 和7.0,分别称取AGOS 和AGP 加入调好pH 的25 mL蛋黄稀释液中,在37 ℃水浴振荡2 h 后,4000 r/min离心20 min,取上清液,采用邻苯二甲醛法于550 nm处测定吸光值。
胆固醇结合能力计算公式如下:
式中:M:恒重样品质量,g;M1:离心后上清液中胆固醇含量,mg;M2:吸附前蛋黄乳液胆固醇含量,mg。
1.2.6.2 胆酸钠结合能力的测定 参照Qian 等[27]的方法稍作修改,准确称取0.2 g 和0.3 g 胆酸钠溶于100 mL 浓度为0.15 mol/L 的NaCl 溶液中,调节溶液pH 为7.0,分别加入0.2 g AGOS 和AGP 样品,于37 ℃震荡反应2 h,于4200 r/min 离心20 min,于620 nm 下测定吸光值。
胆酸钠吸附能力计算公式如下:
式中:M:恒重样品质量,g;M1:吸附后上清液中胆酸钠含量,mg;M2:吸附前胆酸钠含量,mg。
1.2.6.3 脂肪酶抑制能力的测定 参照牛梦宪等[28]的方法稍作修改,取40 μL 100 mg/mL 脂肪酶溶液,与100 μL 不同浓度样品溶液混合均匀,加入3.0 mL磷酸钾缓冲液(100 mmol/L;pH7.0),于30 ℃反应3 min,加入20 μL 乙酸对硝基苯酯-二甲基亚砜溶液,反应10 min 后于405 nm 处测定吸光值。
脂肪酶抑制率计算公式如下:
式中:C:脂肪酶抑制率,%;A1:对照组测试值;A2:样品组测试值。
1.3 数据处理
所有实验均重复3 次,数据结果用均值±标准差表示。采用单因素方差分析和多重比较法检验评估数据的统计学意义,所有统计分析均采用SPSS 26.0 软件进行,使用GraphPad Prism 8.0.2 作图。
2 结果与分析
2.1 西洋参多糖酶解单因素实验
2.1.1 反应温度对西洋参多糖酶解的影响 由图1所示,根据薄层色谱原理,寡糖聚合度越小,其迁移速度越快,位移越大。二糖的聚合度为2,因此将单糖和二糖部分划分为A 区,而聚合度大于2 的部分划分为B 区。AGP 中单糖和二糖区域(下文简称为A 区)显示出斑点,聚合度大于2 区域(下文简称为B 区)并未有明显斑点显色。由图2 所示,随着温度的升高,A 区颜色逐渐加深,B 区颜色逐渐变深后变浅,可能是由于随着温度的升高,西洋参多糖分子和纤维素酶分子间的运动速度增大[29],互相之间的接触也增多,因此随着降解速率的增加,寡糖的生成量也随之增加。但是当温度高于45 ℃时,纤维素酶分子由于吸收了过多的热量,导致自身次级键不稳定从而发生断裂,其空间结构被破坏,最终使纤维素酶的活性减弱甚至丧失[30]。显色情况表明,B 区颜色随着温度的升高逐渐加深后变淡,说明纤维素酶活力的丧失导致酶解能力减弱,寡糖生成量也随之减少。当温度为45 ℃时,分离效果最好且斑点颜色最明显,因此45 ℃为较优值,如表1 所示,此时平均聚合度为2.65。

表1 不同反应温度下酶解液的平均聚合度Table 1 DP of the enzymatic digest at different reaction temperatures

图1 西洋参多糖的薄层色谱结果Fig.1 TLC results of AGP
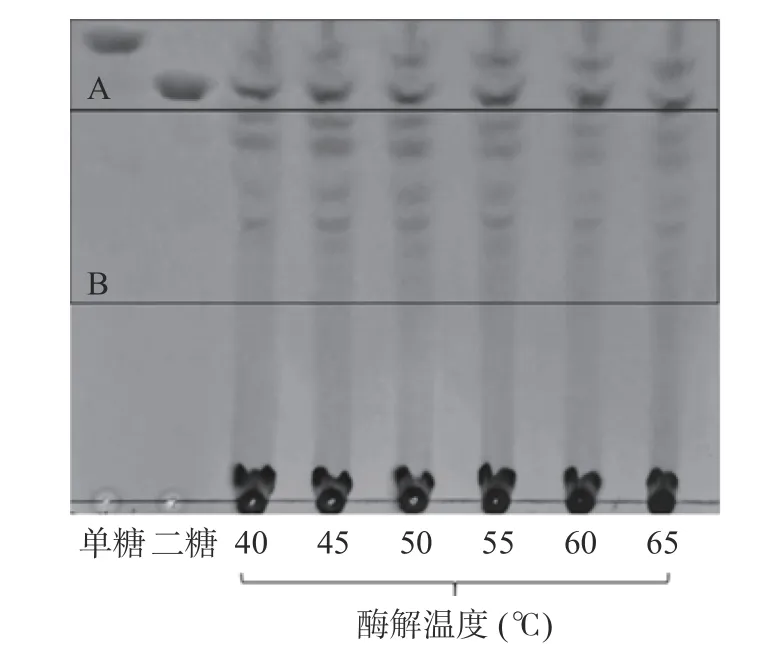
图2 反应温度对西洋参多糖酶解的影响薄层色谱结果Fig.2 TLC results of the effect of reaction temperature on enzymatic hydrolysis of AGP
2.1.2 底物浓度对西洋参多糖酶解的影响 由图3所示,随着底物浓度的增加A 区颜色逐渐加深,分析其原因为可被酶利用的底物不断增多,因此更多的糖苷键被不断破坏,暴露出具有还原性的羟基[31],单糖和二糖的生成量也不断增加。此时,随着底物浓度的增加,B 区斑点数量经历了先增加后减少的过程,这是由于这些聚合度相对较大的寡糖随着底物浓度的增加逐渐积累,随着反应继续进行又降解为更小分子的糖而使含量减少[32]。因此为了得到聚合度分布相对均匀的寡糖,选择20 mg/mL 为较优值,如表2 所示,此时平均聚合度为2.73。

表2 不同底物浓度下酶解液的平均聚合度Table 2 DP of the enzymatic digest at different substrate concentration

图3 底物浓度对西洋参多糖酶解的影响薄层色谱结果Fig.3 TLC results of the effect of substrate concentration on enzymatic hydrolysis of AGP
2.1.3 加酶量对西洋参多糖酶解的影响 由图4 可知,随着加酶量的不断增加,A 区和B 区颜色逐渐变深,当加酶量大于100 U/mg 时,B 区逐渐分离不均且斑点数量减少。随着加酶量的增加,酶解效率升高[33]。但当加酶量达到一定程度,部分寡糖也会被降解生成单糖和二糖。因此为了避免寡糖被过度水解和经济成本的问题,选择加酶量100 U/mg 为较优值,如表3 所示,此时平均聚合度为3.31。
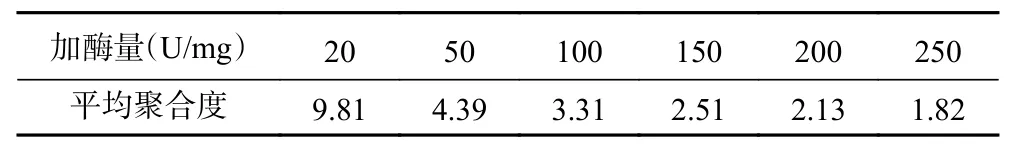
表3 不同加酶量下酶解液的平均聚合度Table 3 DP of the enzymatic digest at different cellulase dosage

图4 加酶量对西洋参多糖酶解的影响薄层色谱结果Fig.4 TLC results of the effect of cellulase dosage on enzymatic hydrolysis of AGP
2.1.4 时间对西洋参多糖酶解的影响 由图5 所示,显色情况表明,随着时间的不断增加,A 区颜色逐渐变深,B 区颜色逐渐变深后变浅。当反应时间大于90 min 时,B 区颜色逐渐变浅,且分离效果更加不明显,可能的原因是寡糖发生降解,产生了更多的单糖和二糖[34]。因此为了避免寡糖被过度水解,选择90 min 为较优值,如表4 所示,此时平均聚合度为2.76。
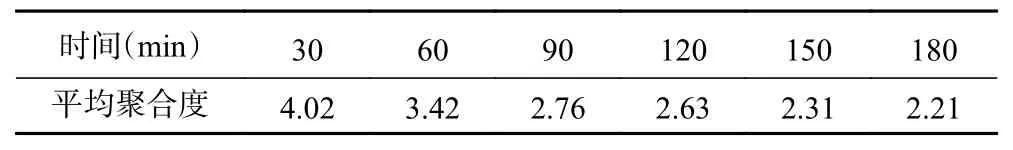
表4 不同时间下酶解液的平均聚合度Table 4 DP of the enzymatic digest at different enzymolysis time
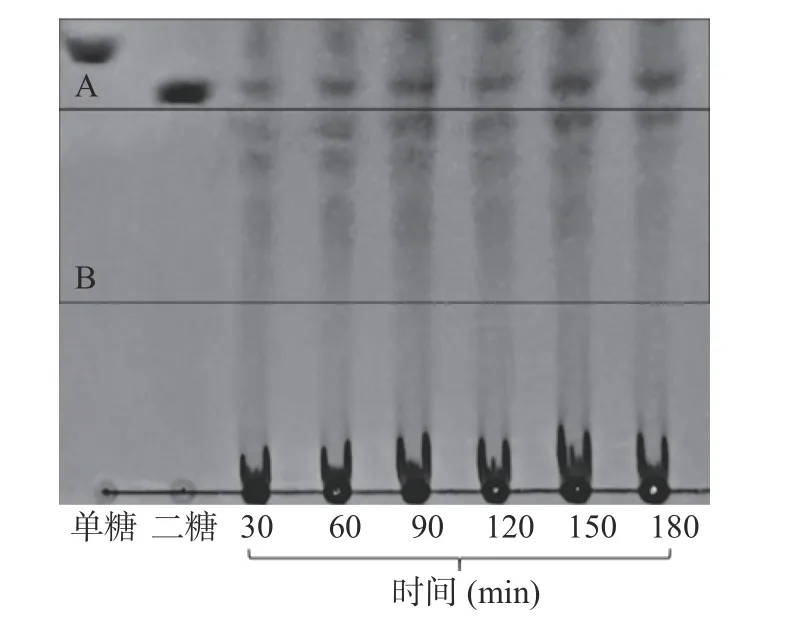
图5 时间对西洋参多糖酶解的影响薄层色谱结果Fig.5 TLC results of the effect of enzymolysis time on enzymatic hydrolysis of AGP
2.2 西洋参低聚糖和西洋参多糖抗氧化活性的测定
如图6A~图6C 所示,在0.025~2.000 mg/mL浓度范围内,所有样品的ABTS+、DPPH 和OH 自由基清除活性均呈剂量依赖性增加[35]。AGOS 的自由基清除率普遍高于AGP,当质量浓度为2 mg/mL时,AGOS 的的ABTS+、DPPH 和OH 自由基清除率分别为74.63%、79.98%、99.94%,而AGP 的ABTS+、DPPH 和OH 自由基清除率分别为35.07%、68.98%、55.18%。可能是因为低聚糖具有更多的游离羟基和更好的水溶性,有更多的机会与自由基相互作用[36]。因此,AGOS 可有效提高了自由基清除能力。
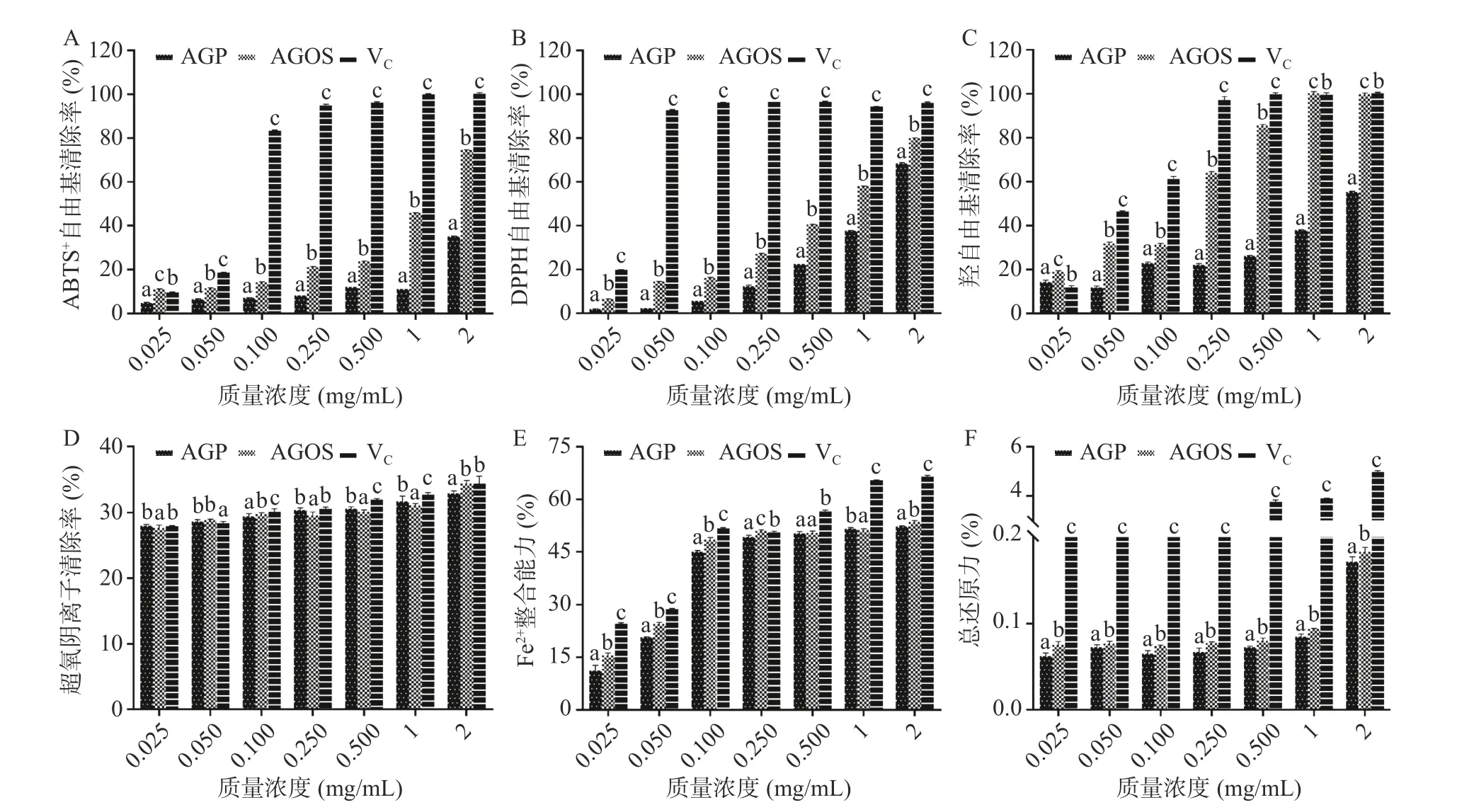
图6 西洋参低聚糖和西洋参多糖抗氧化活性的测定Fig.6 Antioxidant activity results of AGOS and AGP
如图6D~图6E 所示,在0.025~2.000 mg/mL 浓度范围内,AGOS 具有一定的O2-自由基清除能力和Fe2+螯合能力[37],并且其O2-自由基清除能力与VC接近,O2-是一种两性离子自由基,可以与游离羟基发生反应而被消除[38],Fe2+螯合能力与其中的官能团类型有关[39],而酶解使低聚糖暴露出更多的游离羟基基团,因此AGOS 的O2-清除能力和Fe2+螯合能力要强于AGP。
如图6F 所示,在0.025~2.000 mg/mL 浓度范围内,AGOS 的总还原力具有浓度依赖性,还原能力与还原糖的存在有关,因为其具有供氢能力[40],而AGOS中的还原糖含量要高于AGP,所以AGOS 具有更好的总还原力。
2.3 西洋参低聚糖和西洋参多糖降血糖能力的测定
α-葡萄糖苷酶抑制剂可抑制淀粉、糖原等水解成葡萄糖,延缓淀粉、糖原等在小肠中的吸收,α-淀粉酶抑制率的增加,能够有效延缓葡萄糖的释放,降低餐后血糖水平。如图7A~图7B 所示,AGOS 和AGP的α-葡萄糖苷酶抑制率和α-淀粉酶抑制率随着浓度的升高而不断增加,呈现浓度依赖性。AGOS 比AGP 对α-葡萄糖苷酶和α-淀粉酶的抑制能力显著增强(P<0.05),当质量浓度为10 mg/mL 时,AGOS的α-葡萄糖苷酶抑制率和α-淀粉酶抑制率分别为35.76%和62.45%,AGP 的α-葡萄糖苷酶抑制率和α-淀粉酶抑制率分别为29.92%和57.00%,原因是酶解可以促进多糖糖苷键断裂,暴露出更多羟基基团,与消化酶中的氨基酸残基相结合,起到抑制酶活性的作用[41]。而AGOS 羟基基团的暴露增大了其与氨基酸残基相互作用的机会,因此AGOS 具有较强的α-葡萄糖苷酶和α-淀粉酶抑制能力。
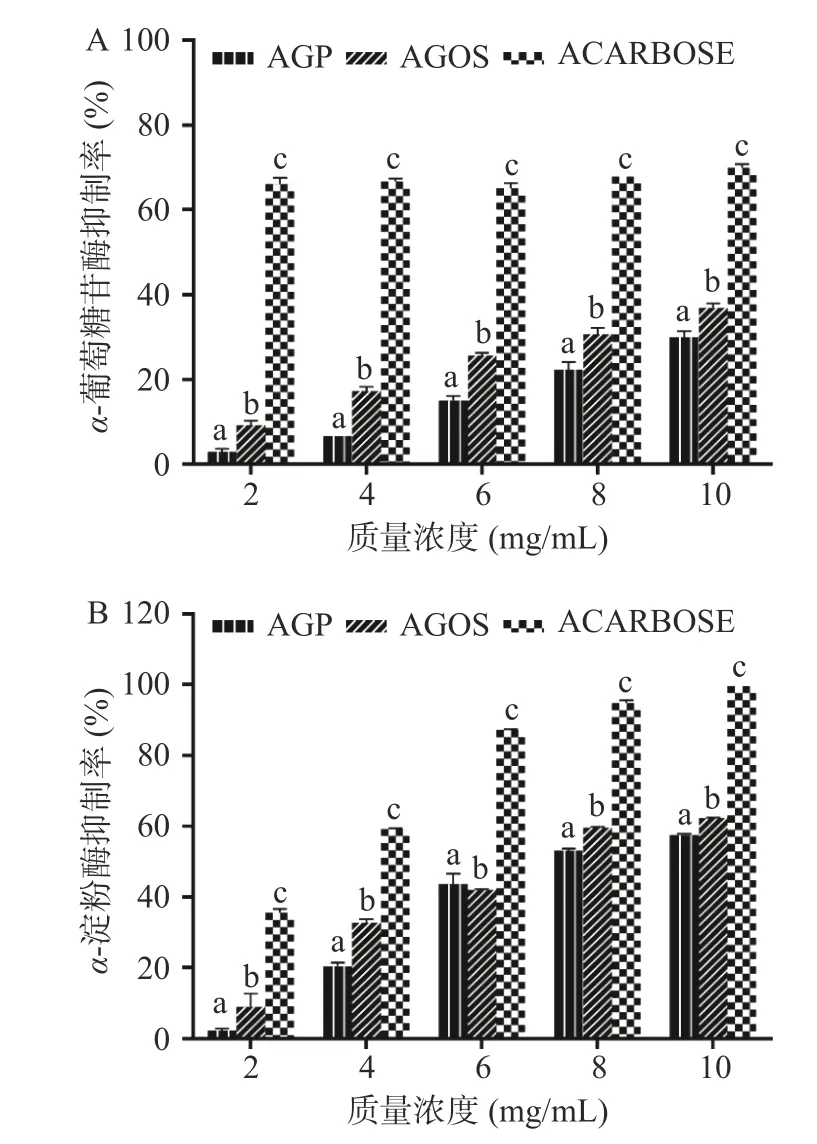
图7 西洋参低聚糖和西洋参多糖降血糖能力的测定Fig.7 Hypoglycemic results of AGOS and AGP
2.4 西洋参低聚糖和西洋参多糖降血脂能力的测定
胆固醇结合能力是评价降胆固醇能力的重要指标,胆汁酸为胆固醇代谢提供了一条重要的排泄途径,如图8A 为AGOS 和AGP 在模拟胃肠道环境下对胆固醇的结合能力,在胃和小肠的环境下,AGOS的胆固醇结合能力要显著高于AGP(P<0.05)。图8B为AGOS 和AGP 在不同的胆酸钠浓度下对其展现出不同的结合能力,AGOS 的胆酸钠结合能力高于AGP。这是由于酶解使AGP 的微观结构和分子大小发生了变化,AGOS 具有较大的表面积和多孔结构,可以结合更多的胆酸钠和胆固醇[42],达到降脂的目的。因此AGOS 具有更好的胆固醇结合能力。
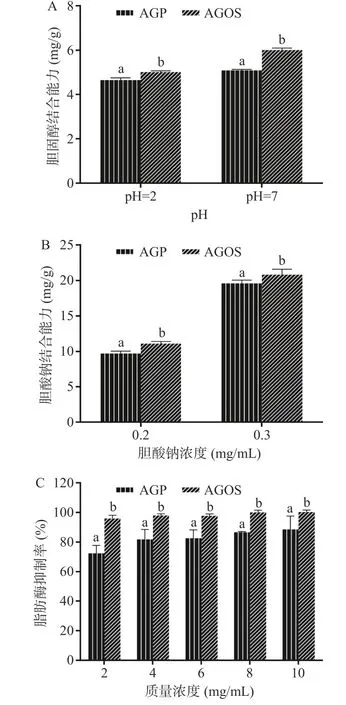
图8 西洋参低聚糖和西洋参多糖降血脂能力的测定Fig.8 Hypolipidemic results of AGOS and AGP
如图8C 所示,AGOS 和AGP 对脂肪酶的抑制率随着浓度的升高逐渐增大,呈现浓度依赖性。脂肪酶可以将脂肪水解成游离脂肪酸和单酰甘油酯,通过抑制脂肪酶的活性,可以减少机体对脂肪的吸收,从而达到降脂的目的[43]。当质量浓度为10 mg/mL 时,AGOS 的脂肪酶抑制率为98.55%,高于AGP,是因为低分子量的AGOS 更容易被人体吸收,从而抑制了脂肪细胞脂质积累[44]。
3 结论
本研究采用酶解法水解AGP,通过超滤分离得到AGOS。纤维素酶酶解AGP 最佳条件为:反应温度45 ℃、底物浓度20 mg/mL、加酶量100 U/mg、酶解时间90 min,此条件下AGP 酶解产物的平均聚合度为2.74。AGOS 具有更强的抗氧化活性,其ABTS+自由基清除能力比AGP 高39.56%、DPPH 自由基清除能力比AGP 高11.00%、OH 自由基清除能力比AGP 高44.76%;AGOS 具有更强的酶抑制能力,其α-葡萄糖苷酶抑制率比AGP 高5.84%、α-淀粉酶抑制率比AGP 高5.45%、脂肪酶抑制率比AGP 高10.46%。本研究结果说明了AGOS 具有更强的抗氧化活性、体外降血糖能力和体外降血脂能力,证实了AGOS 作为功能性食品的潜在应用价值,为西洋参残渣中低聚糖资源的开发利用提供理论依据。
