超声波-微波辅助提取杜仲叶多糖工艺优化及其体外抗凝血活性分析
2023-08-25陈艳萍贺菊萍杨万根
陈艳萍,贺菊萍,刘 意,杨万根,,
(1.吉首大学林产化工工程湖南省重点实验室,湖南张家界 427000;2.徐州工程学院江苏省食品资源开发与质量安全重点建设实验室,江苏徐州 221018;3.吉首大学食药两用资源研究与高值化利用湖南省重点实验室,湖南吉首 416000)
杜仲树是我国的特有树种,其叶在2018 年被列为我国的新食品原料。目前,我国的杜仲树栽植面积已达35 万hm2,在国内27 个省(区、市)均有栽植,杜仲叶资源非常丰富[1];但我国对杜仲叶开发研究的时间还不长,目前主要产品是杜仲叶茶、动物饲料添加剂等初级加工产品,亟需对其开展深入研究,开发高附加值产品。现代研究发现,植物多糖往往具有抗肿瘤[2-3]、抗氧化[4]、抗凝血[5]、调节肠道菌群[6]等生物活性,而多糖也是杜仲叶的主要成分之一,因此开发杜仲叶多糖的研究正变得日益广泛。
杜仲叶多糖开发面对的问题之一是如何快速提取。常用的植物多糖提取技术有热水提取、超声波、微波、酶辅助提取等。热水提取以水为提取溶剂,耗时长、效率低。超声波辅助提取是利用频率大于20 kHz 的超声波产生强大压力、剪切力破坏细胞结构,加速多糖向水中扩散,提高提取效果。微波辅助提取是高频电磁波使植物细胞内外的温度快速上升,植物细胞内压力超过细胞壁承受能力,细胞壁遭到破坏,其内的有效成分流出[7]。超声波提取有强烈的物理破碎和混合传质作用,但为提取溶液体系快速加热的能力弱,而微波提取则相反,因此超声波、微波辅助提取之间的互补性很强。近年出现了将两种技术结合的超声波-微波辅助提取技术,该技术呈现出高效、绿色等诸多优势,如HU 等[8]将此技术应用于提取虎果仁油,提取率达到85.23%,JIANG 等[9]采用该技术从玉米麸皮中提取阿拉伯木聚糖,提取率达27.7%。目前还没有发现超声波-微波辅助提取技术在杜仲叶多糖提取中的应用研究。
因此,本文以杜仲叶多糖为研究对象,开展超声波-微波辅助提取杜仲叶多糖工艺条件优化研究,并对所得精制多糖的单糖组成、分子量、体外抗凝血活性进行分析,旨在为我国丰富的杜仲叶资源的高值化利用提供理论依据和技术参考。
1 材料与方法
1.1 材料与仪器
杜仲叶 采摘于吉首大学林产化工工程湖南省重点实验室杜仲基地;血浆 由湘西州人民医院提供;石油醚(沸程30~60 ℃)、苯酚、浓硫酸、醋酸钠、三氟乙酸、氯化钠、氢氧化钠、无水乙醇 国药集团化学试剂有限公司;溴化钾 Sigma-Aldrich 公司;葡萄糖标准品、肝素钠 北京索莱宝科技有限公司;APTT、PT、TT 试剂盒 武汉中太生物技术有限公司;葡萄糖、甘露糖、鼠李糖、半乳糖醛酸、半乳糖、葡萄糖醛酸、阿拉伯糖、木糖、岩藻糖、盐酸氨基葡萄糖、N-乙酰-D-氨基葡萄糖、D-果糖、D-核糖、氨基半乳糖盐酸盐、L-古洛糖醛酸、D-甘露糖醛酸 博睿糖生物公司;所有分离用有机溶剂均为国产分析纯。
XH-300PE 超声波高压微波协同组合工作站北京祥鹄科技发展有限公司;XN06-Ⅱ半自动凝血分析仪 武汉景川诊断技术股份有限公司;Evolution 201 紫外可见光光度计、ICS5000 离子色谱仪(IC)、D-37520 离心机 ThermoFisher 公司;UGC-24M 干式氮吹仪 力辰科技公司;LC-10A 高效液相色谱仪Shimadzu 公司;TENSOR 27 傅里叶红外光谱仪Bruker 公司。
1.2 实验方法
1.2.1 杜仲叶预处理 杜仲叶于60 ℃干燥至恒重,粉碎后,过60 目筛。用5 倍体积的石油醚于80 ℃水浴除去杜仲胶和脂类,再用5 倍体积的80%乙醇于80 ℃水浴除去单糖、双糖、寡糖等物质[10],过滤,滤渣晾干后装入塑封袋,4 ℃下保存备用。
1.2.2 杜仲叶多糖提取工艺 称取3.0 g 处理后的杜仲叶粉,以一定的料液比加入蒸馏水,置于超声波微波协同组合工作站中在常压下以一定的超声波功率、微波功率和提取温度提取一定的时间。提取结束后,4000 r/min 离心10 min,上清液即为多糖提取液,重复提取三次,将提取液合并。多糖提取液于55 ℃减压浓缩,在浓缩溶液中慢慢加入乙醇,4 ℃静置12 h 后,4000 r/min 离心10 min,弃去上清液,沉淀用无水乙醇洗2 次,再将沉淀分散在少量蒸馏水中并冻干,得到杜仲叶粗多糖。
1.2.3 杜仲叶多糖含量测定及提取得率计算 采用苯酚-硫酸法[11]测多糖含量。以蒸馏水为空白对照,标准葡萄糖质量浓度C(mg/mL)为横坐标,吸光度A 为纵坐标,绘制标准曲线,得其回归方程A=14.595C+0.00727,R2=0.999。将1.2.2 提取三次合并的多糖提取液定容于250 mL 容量瓶中,精密吸取1.0 mL,加蒸馏水补足至2 mL,测吸光度A,根据回归方程计算多糖的质量浓度C。按下式计算杜仲叶多糖得率Y(%)。
式中:C:待测液中的多糖质量浓度,mg/mL;V:待测样品液的体积,mL;n:样品液的稀释倍数;m:杜仲叶粉的质量,g。
1.2.4 单因素实验 单因素实验常规量设为:超声波功率110 W,提取温度50 ℃,微波功率250 W,料液比1:20(g:mL),提取时间20 min。依次考察超声波功率(50、70、90、110、130、150 W)、提取温度(40、45、50、55、60、65 ℃)、微波功率(100、150、200、250、300、350 W)、料液比(1:10、1:15、1:20 、1:25、1:30、1:35(g:mL))、提取时间(15、20、25、30、35、40 min)对多糖得率的影响。
1.2.5 Plackett-Burman 试验 在单因素实验基础上,利用Plackett-Burman 试验筛选出关键因素,因素与水平设计见表1。
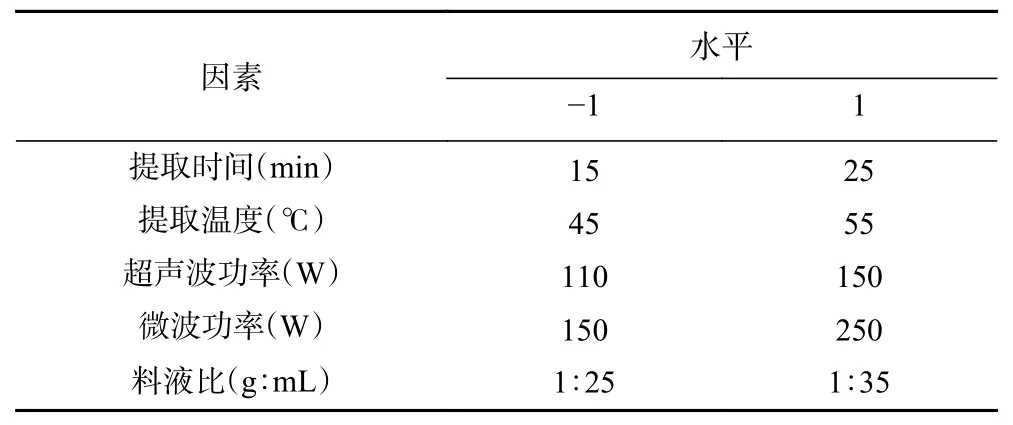
表1 Plackett-Burman 试验设计Table 1 Design of the Plackett-Burman experiment
1.2.6 响应面法优化提取工艺 根据Plackett-Burman 试验,对筛选出的3 个关键因素采用Box-Behnken设计对工艺参数进行优化,因素与水平设计见表2。
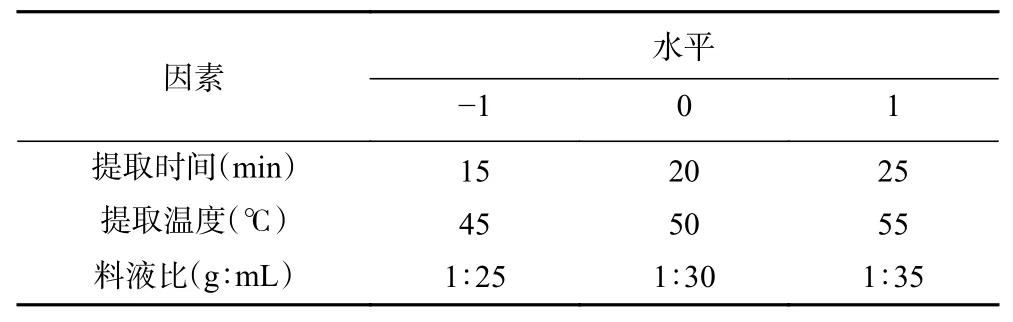
表2 Box-Behnken 响应面试验设计Table 2 Design of the Box-Behnken experiment
1.2.7 粗多糖的精制方法 Sevage 法[12]去蛋白:粗多糖溶液与Sevage 试剂(三氯甲烷:正丁醇=4:1,v/v)混合,去除游离蛋白,重复操作5 次,收集脱蛋白水相。
脱色:用1%活性炭进行脱色。60 ℃条件下于摇床上120 r/min 振荡30 min,过滤。
透析:用截留分子量3500 Da 的透析袋蒸馏水透析72 h,中间换水多次。
醇沉:将透析后的多糖溶液用95%乙醇调节至80%,4 ℃条件下静置12 h,4000 r/min 离心10 min,用无水乙醇洗涤沉淀2 遍,冻干。
离子层析:称取约100 mg 透析后多糖溶解在少量蒸馏水中,4000 r/min 离心10 min,取上清液加入DEAE-52 纤维素离子交换色谱柱(2.6×40 cm)中,先后用蒸馏水、1 mol/L NaCl 溶液洗脱,洗脱液流速5 mL/min。收集NaCl 溶液的洗脱液,经截留分子量3500 Da 透析除去盐离子,再60 ℃减压浓缩至原体积1/10,冻干后得到杜仲叶精制多糖。
1.2.8 精制多糖的分子量分布分析 采用高效凝胶渗透色谱法[13]测定杜仲叶精制多糖分子量。色谱条件:色谱柱:BRT105-104-102 串联凝胶柱(8×300 mm);流动相:0.05 mol/L NaCl 溶液;流速:0.6 mL/min;柱温:40 ℃;进样量:20 μL;检测器:RI-10A 示差检测器。样品配制成5 mg/mL 溶液,12000 r/min 离心10 min,上清液用0.22 μm 的微孔滤膜过滤,然后将样品转置于1.8 mL 进样瓶中测样。
1.2.9 精制多糖的单糖组成分析 精密称量5.0 mg样品置于安瓿瓶中,加入3 mol/L 三氟乙酸2 mL,120 ℃水解3 h。准确吸取酸水解溶液转移至玻璃管中用氮气吹干,加入5 mL 去离子水涡旋混匀,吸取100 μL 加入900 μL 去离子水,12000 r/min 离心5 min。取上清进IC 分析。
色谱条件:色谱柱Dionex CarbopacTMPA20(3×150 mm) ;流动相:A:H2O;B:15 mmol/L NaOH;C:15 mmol/L NaOH & 100 mmol/L NaOAc;流速:0.3 mL/min;进样量:5 μL;柱温:30 ℃;检测器:电化学检测器[13]。
1.2.10 精制多糖的光谱分析 取适量杜仲叶精制多糖溶液于石英比色皿中,用紫外分光光度计进行扫描,扫描波长200~400 nm,扫描频率为2 nm/s。
称量1.0 mg 杜仲叶精制多糖样品和100.0 mg溴化钾于玛瑙研钵中,研磨混匀成细粉后,压制成透明薄片,用傅里叶红外光谱仪扫描,扫描范围4000~500 cm-1,分辨率为4 cm-1,累积扫描64 次。
1.2.11 精制多糖的体外抗凝血活性测定 参照文献[14]测定。将杜仲叶精制多糖溶于生理盐水,分别配成2、4、8 mg/mL,再将待测多糖与血浆以1:4 体积比混合均匀。分别以生理盐水、肝素钠溶液(2 μg/mL)做阴性和阳性对照,然后测定活化部分凝血酶原时间(APTT)、凝血酶原时间(PT)、凝血酶时间(TT)三个指标评价其抗凝血活性。
a. APTT 的测定:取100 μL 预热的37 ℃待测混合血浆,加入100 μL 的APTT,预热 3 min,再加100 μL 预热的氯化钙溶液(0.025 mol/L)并混合均匀,仪器计时。
b. PT 的测定:取100 μL 预热的37 ℃待测混合血浆,加入200 μL 预热的PT,混合均匀,仪器计时。
c. TT 的测定:取100 μL 预热的37 ℃待测混合血浆,加入100 μL 预热的TT,混合均勾,仪器计时。
1.3 数据处理
所有试验重复三次操作,结果用平均值±标准偏差表示。Design-Expert 8.0.6 软件分析响应面试验结果,SPSS Statistics 22.0 软件进行ANOVA 分析,Origin 2019b 软件作图。
2 结果与分析
2.1 单因素实验结果
2.1.1 超声波功率对杜仲叶多糖得率的影响 图1显示,随着超声波功率由50 W 增大到70 W,杜仲叶多糖得率呈增长趋势,这是因为超声波空化效应产生的微射流和冲击波有利于植物材料中多糖的溶解和扩散[15];但继续增大超声波功率,多糖降解,多糖得率比之前降低;但是超声波功率继续增大到130 W 时,由于超声波的空化作用更大,植物材料结构受到更大的影响,多糖更易从植物组织里溶出,这时多糖得率达到最大值3.45%±0.12%。然而,继续增大超声波功率,多糖得率下降,这是因为过高的超声波功率会产生大量的微小气泡,使空化效应下降[16]。超声波功率130 与110、150 W 之间的多糖得率差异显著(P<0.05),因此后续试验中超声波功率取值范围为110~150 W。
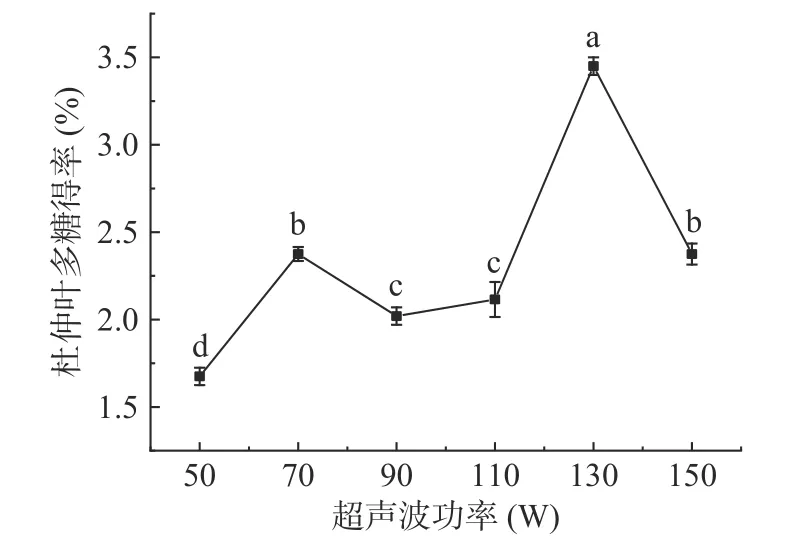
图1 超声波功率对杜仲叶多糖得率的影响Fig.1 Effect of ultrasonic power on the yield of polysaccharides from Eucommia ulmoides leaves
2.1.2 提取温度对杜仲叶多糖得率的影响 图2 显示,当提取温度从40 ℃升高到50 ℃时,杜仲叶多糖得率逐渐增大,在50 ℃时达到最大值3.54%±0.05%,但进一步升高温度至55 ℃,杜仲叶多糖得率反而下降。这可能是由于温度在一定范围内的升高有利于多糖从细胞中溶出,但随着系统温度的升高,超声空化气泡的温度和压力也会降低,过高的系统温度会降低空化效应,从而导致多糖得率下降[17]。而温度升至60 ℃时,使空化气泡压力有所上升,多糖得率呈小幅增大,继续升至65 ℃后,空化气泡变得细密,空化效应下降,多糖得率下降。提取温度50 ℃与45、55 ℃之间的多糖得率差异显著(P<0.05),因此后续试验中提取温度取值范围为45~55 ℃。
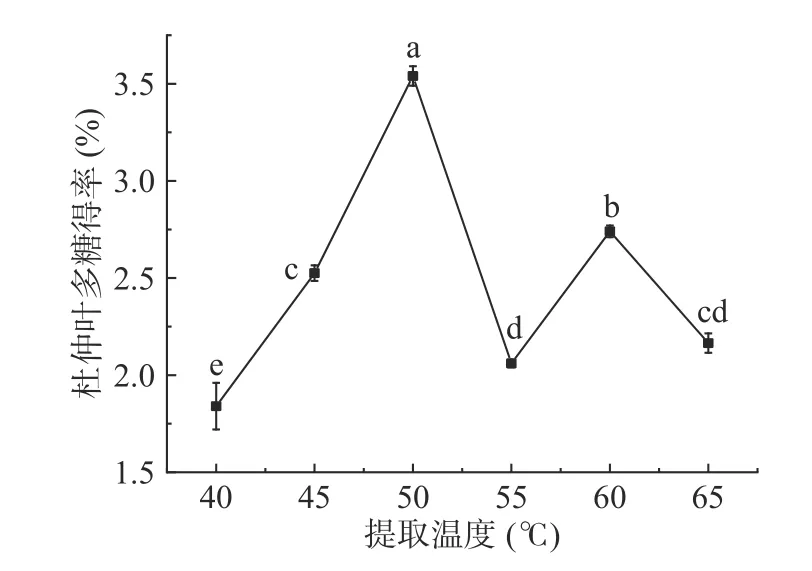
图2 提取温度对杜仲叶多糖得率的影响Fig.2 Effect of extraction temperature on the yield of polysaccharides from Eucommia ulmoides leaves
2.1.3 微波功率对杜仲叶多糖得率的影响 图3 显示,微波功率由100 W 增大至150 W 时,多糖得率有小幅下降,但微波功率升至200 W 时,多糖得率大幅上升,达到最大值3.76%±0.04%。多糖得率的增加是由于微波使植物细胞内受热膨胀并导致细胞壁破裂,多糖溶出增加,但是微波功率过高,多糖被降解,导致多糖得率下降[18]。在微波功率200 W 与150、250 W 之间,多糖得率差异显著(P<0.05),因此后续试验中微波功率取值范围为150~250 W。
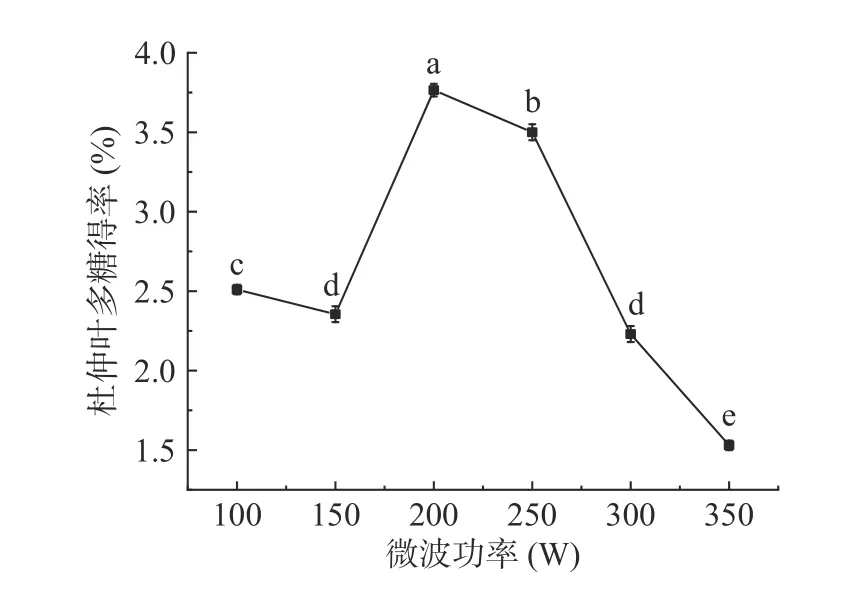
图3 微波功率对杜仲叶多糖得率的影响Fig.3 Effect of microwave power on the yield of polysaccharides from Eucommia ulmoides leaves
2.1.4 料液比对杜仲叶多糖得率的影响 图4 显示,在料液比为1:10、1:15(g:mL)时,多糖得率较低;但当料液比增大到达到1:20(g:mL)时,多糖得率有大幅增加,在料液比1:30(g:mL)时有最大值3.94%±0.02%。这是因为溶剂比例较低时,杂质的析出量增多,抑制了杜仲叶多糖的析出;继续增大溶剂比例,杂质基本溶出,此时多糖溶出不受抑制,得率增大[19]。因此后续试验中料液比取值范围为1:25~1:35(g:mL)。
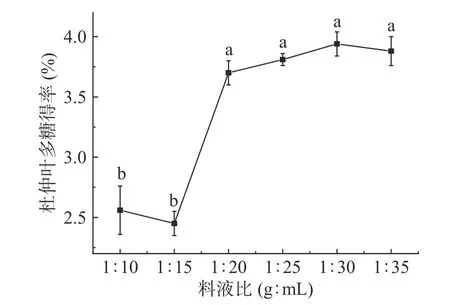
图4 料液比对杜仲叶多糖得率的影响Fig.4 Effect of ratio of solid to liquid on the yield of polysaccharides from Eucommia ulmoides leaves
2.1.5 提取时间对杜仲叶多糖得率的影响 图5 显示,提取时间从15 min 增加至20 min 时,杜仲叶多糖的得率上升并达到最大值3.94%±0.1%,之后继续增加提取时间,杜仲叶多糖得率下降。这是由于多糖的溶出需要一定时间,但提取时间过长,超声会破坏多糖的分子结构引起多糖降解,导致多糖得率下降[20]。在提取时间20 min 与15、30 min 之间,多糖得率差异显著(P<0.05),在20 与25 min 之间,多糖得率差异不显著(P>0.05),考虑后续试验中提取时间取值范围为15~25 min。
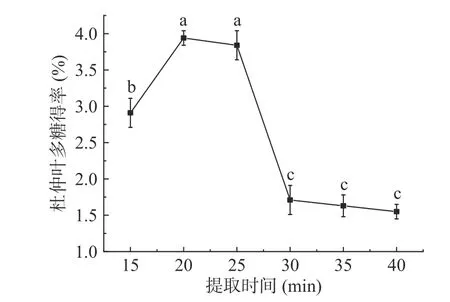
图5 提取时间对杜仲叶多糖得率的影响Fig.5 Effect of extraction time on the yield of polysaccharides from Eucommia ulmoides leaves
2.2 Plackett-Burman 试验结果
Plackett-Burman 试验结果见表3,方差分析结果见表4。
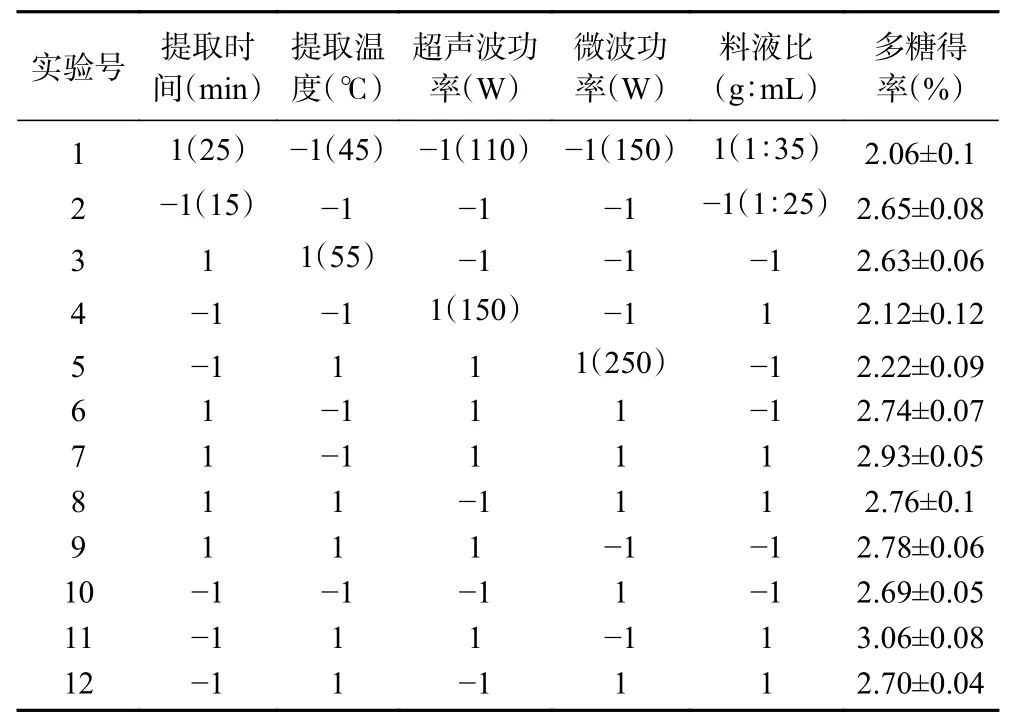
表3 Plackett-Burman 试验设计及结果Table 3 The design and results of the Plackett-Burman experiment
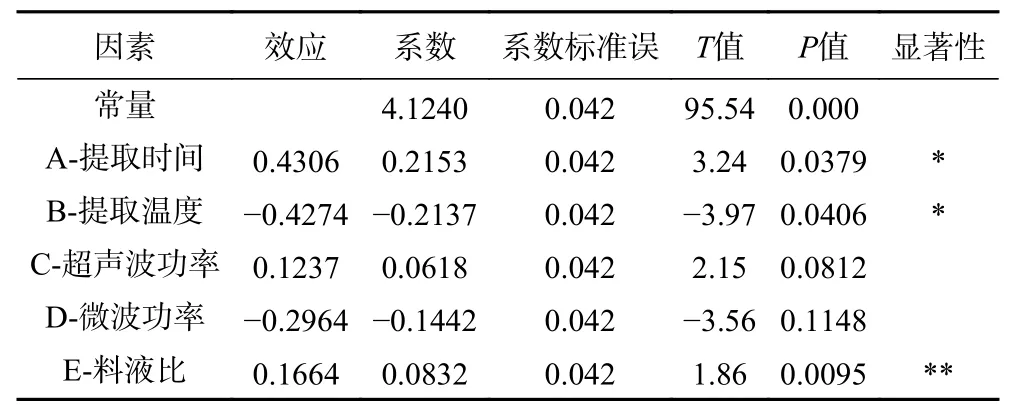
表4 Plackett-Burman 试验各因素效应评价Table 4 Effect evaluation of the factors of Plackett-Burman experiment
由表4 可知,提取时间、提取温度和料液比对杜仲叶多糖得率的影响均达到显著水平(P<0.05),其中料液比为达到极显著水平(P<0.01)。超声波功率和微波功率为非显著影响因素,故选择提取时间、提取温度和料液比进行响应面优化试验,而超声波功率、微波功率则分别固定为130 和200 W。
2.3 Box-Behnken 响应面试验结果
Box-Behnken 响应面试验结果见表5。
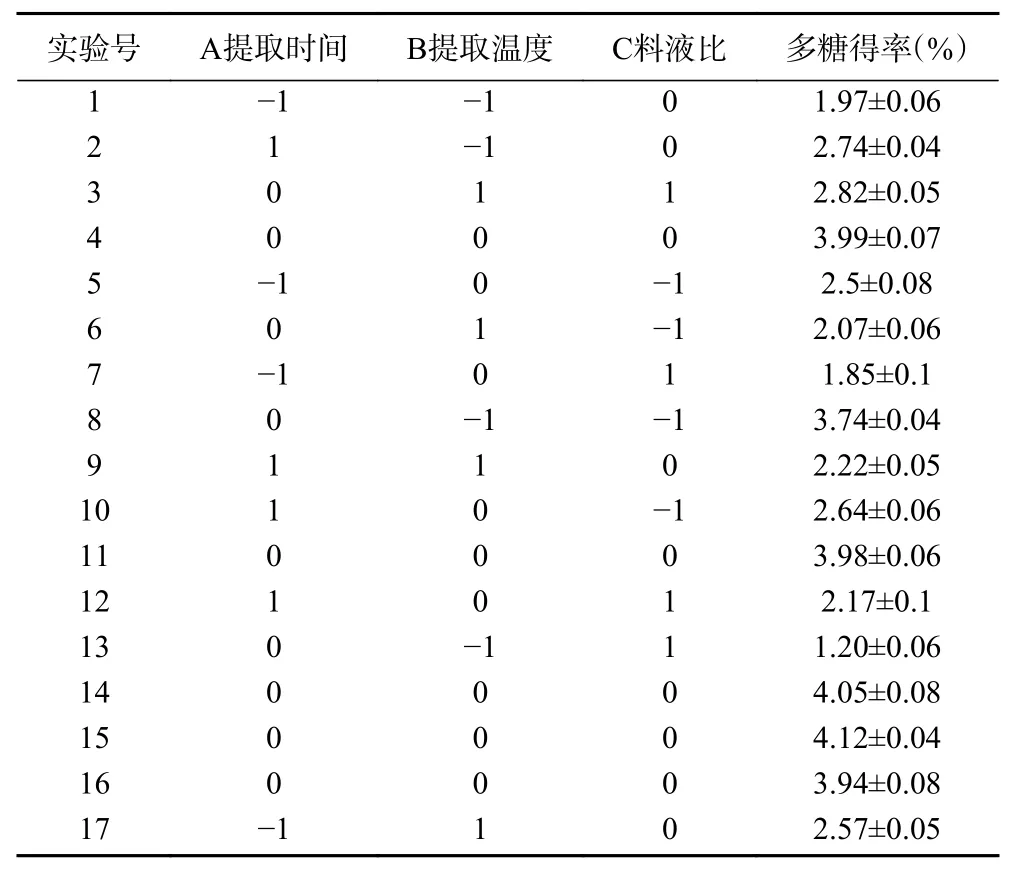
表5 Box-Behnken 响应面试验设计及结果Table 5 Design and results of the Box-Behnken experiment
对实验结果进行回归拟合,得到显著影响杜仲叶多糖得率(Y)因素的多元二次回归方程:Y=4.02+0.11A+3.750×10-3B-0.36C-0.282AB+0.045A C+0.82BC-0.90A2-0.74B2-0.82C2。表6 为回归模型的方差分析结果。结果显示,在该模型中一次项A 具有显著影响(P<0.05),一次项C 和二次项A2、B2、C2以及交互项AB、BC 具有极显著影响(P<0.01)。此外,该回归模型P<0.01,说明该模型可靠。R2=0.9944,说明模型拟合程度良好,模型的校正相关系数(R2Adj=0.9871)说明自变量之间的相关性良好。
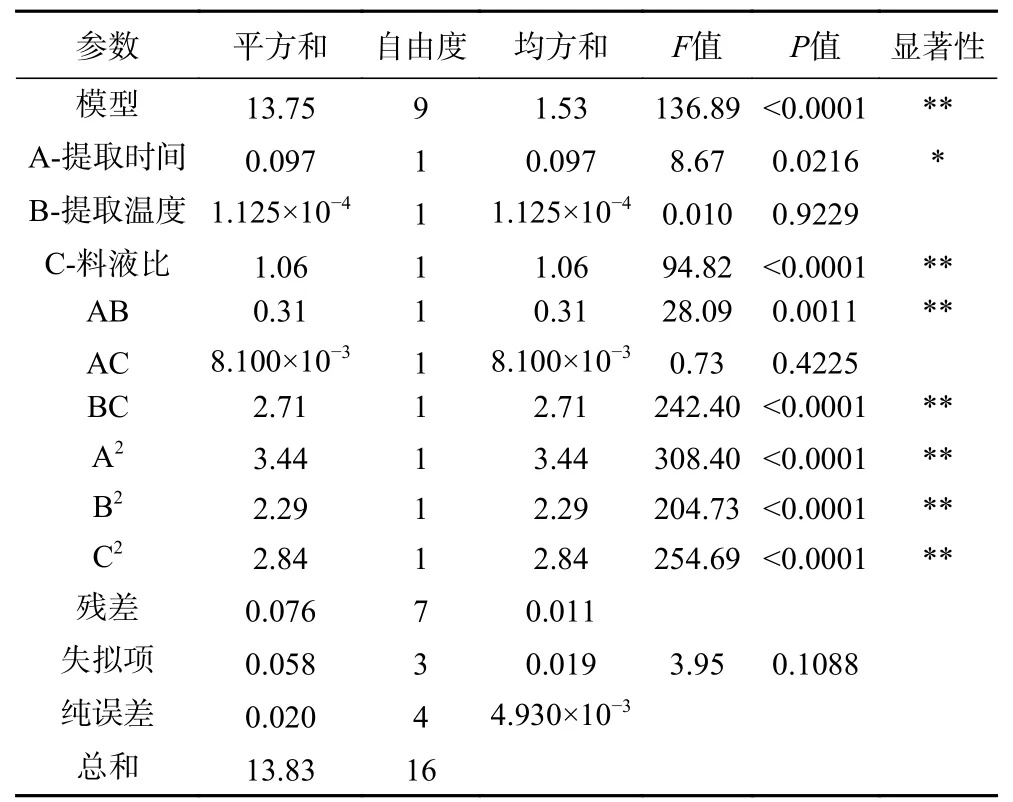
表6 回归模型方差分析结果Table 6 Results of variance analysis of response surface quadratic model
由模型分析得出,杜仲叶多糖的超声波-微波辅助提取最优工艺条件为提取温度49.06 ℃、料液比1:28.44(g:mL)、提取时间20.41 min。此条件下预测的杜仲叶多糖得率为4.08%。为了在实际中具有可操作性,将最优工艺参数确定为提取温度49 ℃、料液比1:30(g:mL)、提取时间20 min。为了验证模型的可靠性,在此最佳条件下进行了验证实验,测出多糖得率为4.02%±0.03%,该值与预测值十分接近。表明响应面优化试验可以合理优化杜仲叶多糖的超声波-微波辅助提取工艺条件。
宫本红[21]采用热水提取杜仲叶多糖,最优提取工艺条件为:料液比1:20,提取温度100 ℃,浸提时间120 min,在此条件下粗多糖的提取率有3.7%。刘晓河等[22]研究了酶对杜仲多糖提取率的影响,发现酶的添加对多糖的提取有显著作用,其中果胶酶效果最为显著。陈雪花[10]采用的超声波协同酶法提取杜仲叶多糖,最佳提取工艺条件为复合酶添加量3.7%、pH4.0、超声波功率100 W、提取温度45 ℃、料液比1:20(g:mL)和提取时间15 min,多糖得率达4.79%±0.02%。虽然本研究的多糖得率与超声波协同酶法的得率相比较低,但本文所采用的超声波-微波辅助提取方法因减少了用酶成本和灭酶的能耗成本,经济上更具优势。
图6为两因素间交互作用响应面图。可以直观地观察到杜仲叶多糖得率较高分布区域范围以及两者之间的交互作用。交互作用对杜仲叶多糖得率的影响大小顺序为:BC>AB>AC。
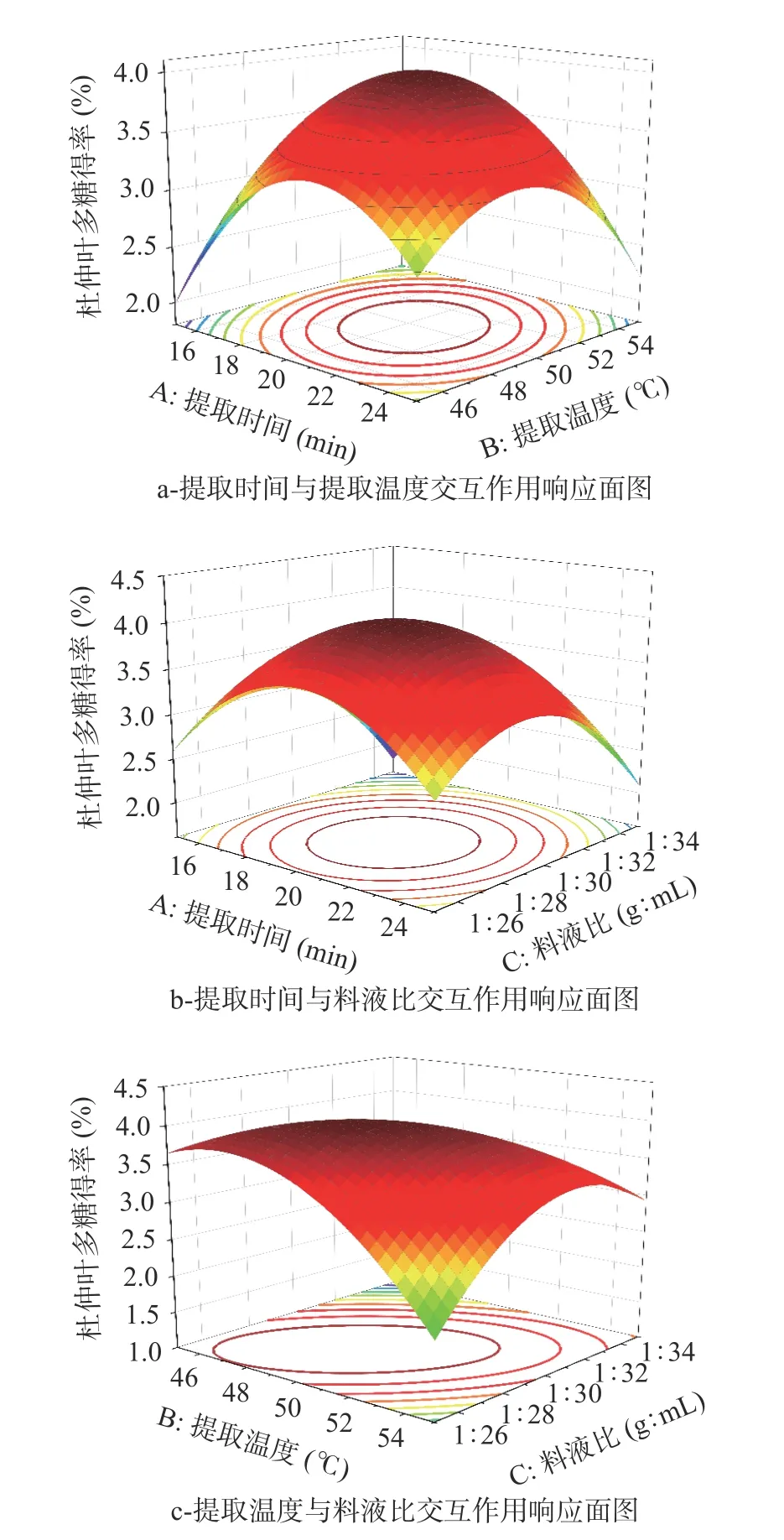
图6 两因素间交互作用响应面图Fig.6 Response surface plots of interaction between two factors
2.4 杜仲叶多糖的DEAE-52 纤维素离子交换层析柱纯化
以管号为横坐标,吸光度(A)为纵坐标绘制杜仲叶多糖经离子交换层析纯化的洗脱曲线,如图7 所示。收集5 号管至11 号管的洗脱液,透析冻干后多糖得率为26.16%,精制多糖的糖含量为50%(以葡萄糖计)。不同单糖标准品在相同浓度下的吸收值相差较大,而葡萄糖是单糖中显色较强的一种[23]。杜仲叶多糖为杂多糖,此研究中用葡萄糖制作标准曲线,因杜仲叶多糖中的其他单糖显色不如葡萄糖而使多糖的糖含量测定结果偏低。
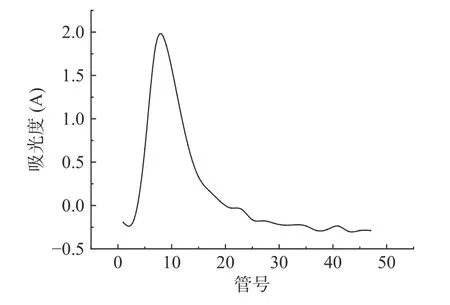
图7 杜仲叶多糖的的DEAE-52 洗脱曲线Fig.7 DEAE-52 elution curve of Polysaccharides from Eucommia ulmoides leaves
2.5 分子量测定结果
图8显示,杜仲叶精制多糖的主要洗脱峰单一且较对称,说明多糖纯度较高,其重均分子质量Mw为1653 kDa,数均分子质量Mn为1431 kDa,峰值分子质量Mp为1647 kDa,分子量分布系数Mw/Mn为1.16。FENG 等[24]从杜仲茎皮部提取的杜仲多糖平均分子量为1146 kDa,ZHU 等[25]从杜仲茎皮部提取的杜仲多糖平均分子量为1000~2000 kDa。结果说明杜仲叶与皮中多糖的分子量相近。陈雪花[10]采用超声波辅助酶法提取的杜仲叶多糖时,其分子量仅为180 kDa,其值偏小,是与该提取方法中使用纤维素酶有关。
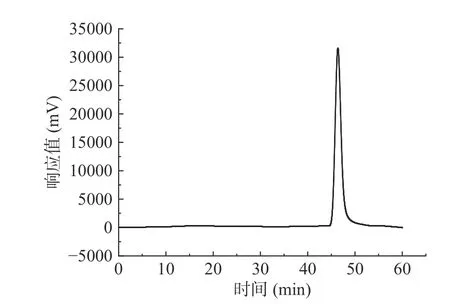
图8 杜仲叶精制多糖的分子质量色谱图Fig.8 Chromatogram of molecular weight of refined polysaccharides from Eucommia ulmoides leaves
2.6 单糖组成测定结果
图9显示,杜仲叶精制多糖中含有果糖、葡萄糖、N-乙酰-D 氨基葡萄糖、半乳糖、阿拉伯糖等5 种单糖。各单糖摩尔百分含量为:果糖37.3%、葡萄糖35%、N-乙酰-D 氨基葡萄糖14.6%、半乳糖8.6%、阿拉伯糖4.4%,表明果糖与葡萄糖是杜仲叶多糖的主要成分。陈雪花[10]采用超声波-酶法得到的杜仲叶多糖主要成分是甘露糖、半乳糖和阿拉伯糖,与本研究结果产生差异,是因为提取工艺不同以及本研究所测定多糖是精制多糖而致。
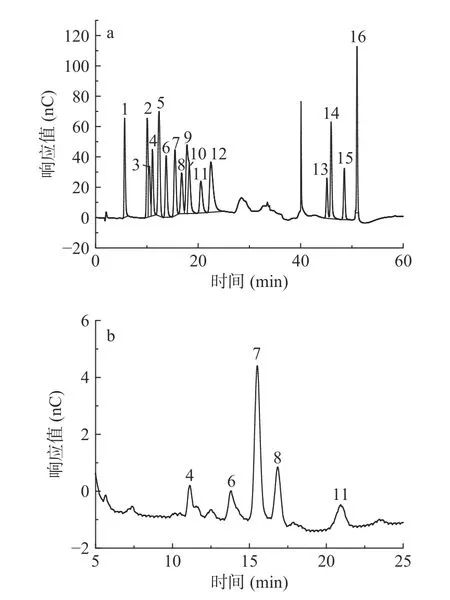
图9 杜仲叶精制多糖的单糖组成色谱图Fig.9 Chromatogram of monosaccharide composition of polysaccharides from Eucommia ulmoides leaves
2.7 光谱分析结果
图10为杜仲叶精制多糖溶液在200~400 nm 紫外波长范围的吸收曲线。可以看出,在280 nm 和260 nm 处未有明显的蛋白和核酸吸收峰,说明为较纯的多糖。图11 为杜仲叶精制多糖的红外光谱图,具有多糖的特征吸收峰,在3419 cm-1为O-H 伸缩振动,2925 cm-1处为CH3、CH2、CH 等的C-H 伸缩振动、1126 cm-1处为C-N 伸缩振动[26],1603 cm-1处为糖醛酸COO-伸缩振动,1389 cm-1处为甲基的变形吸收峰[27],1261 cm-1处为C-O 伸缩振动,证明了乙酰基的存在[28]。1075 cm-1处为吡喃糖的糖环伸缩振动[29]。此外,在760 cm-1处的吸收峰显示糖单元的β构型[28],而815 cm-1处的吸收峰表示端基碳为β型[10]。综上表明,本研究得到的杜仲叶多糖为β型酸性多糖。
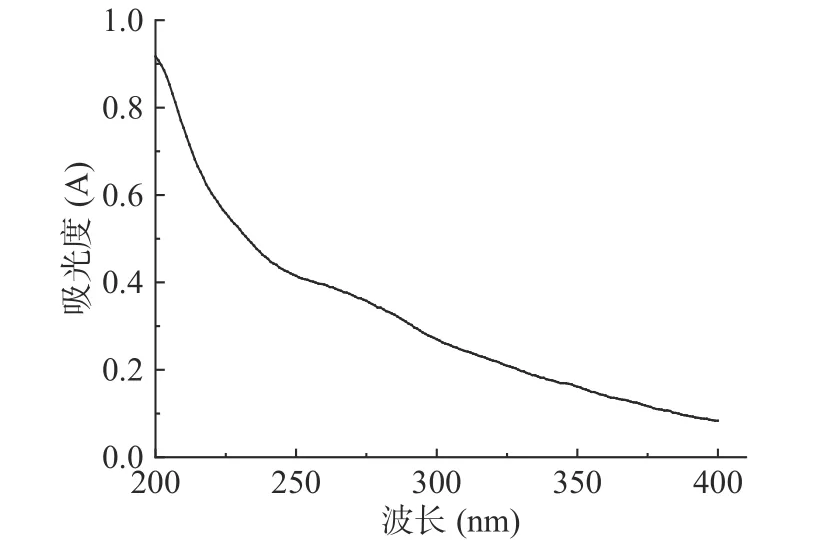
图10 杜仲叶精制多糖紫外光谱图Fig.10 UV spectrum of refined polysaccharides fromEucommia ulmoides leaves
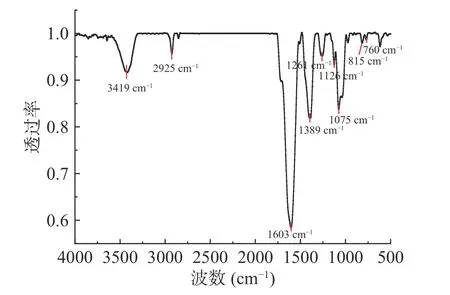
图11 杜仲叶精制多糖红外光谱图Fig.11 IR spectra of refined polysaccharides from Eucommia ulmoides leaves
2.8 体外抗凝血活性结果
2.8.1 杜仲叶精制多糖对APTT 的影响 肝素是一种硫酸化多糖,在临床上常被用作抗凝剂和抗血栓剂,但有严重的出血和血小板减少等副作用,且肝素来源于动物肠组织,存在机体感染病毒的风险[14]。因此,从天然产物中提取抗凝剂具有重要意义。目前已经发现多种植物多糖具有抗凝血活性,如黑木耳多糖[30],香椿子多糖[14],红枣多糖[31]等。虽然杜仲叶多糖已经被证实具有抗氧化[32]、降血糖[33]、抗结肠癌[10]等活性,但其抗凝血活性还未见研究报道。
表7显示,与阴性对照相比,在杜仲叶多糖浓度2 mg/mL 时,APTT 即增大,说明有抗凝效果;且随多糖浓度增大,APTT 延长(P<0.01);当多糖浓度达到8 mg/mL 时,APTT 超过120 s(P<0.01)。闻志莹[14]研究香椿子多糖抗凝血活性时发现,当多糖浓度为4 mg/mL 时,对APTT 的延长到36.6 s,而本研究杜仲叶精制多糖浓度为4 mg/mL 时,APTT 的延长时间为73.05 s,表明杜仲叶精制多糖对APTT 有显著影响,实验结果表明杜仲叶多糖是通过参与内源性凝血途径来起到抗凝血作用。

表7 杜仲叶精制多糖对APTT 的影响Table 7 Effect of refined polysaccharides from Eucommia ulmoides leaves on APTT
2.8.2 杜仲叶精制多糖对PT 的影响 表8 显示,与阴性对照相比,当多糖浓度在2~8 mg/mL 范围内,杜仲叶多糖对PT 有一定的延长作用,表明杜仲叶多糖也可以通过参与外源性凝血途径起到抗凝血作用。当杜仲叶多糖浓度为8 mg/mL 时,对PT 的影响达到极显著水平(P<0.01),延长到42.30 s。
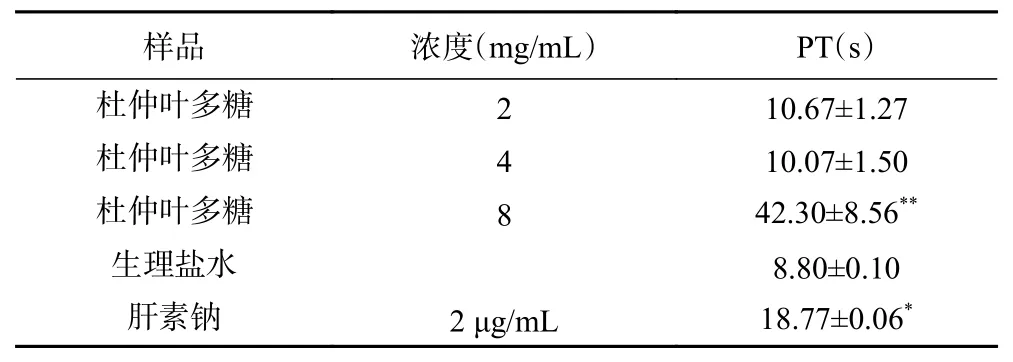
表8 杜仲叶精制多糖对PT 的影响Table 8 Effect of refined polysaccharides from Eucommia ulmoides leaves on PT
2.8.3 杜仲叶精制多糖对TT 的影响 表9 显示,与阴性对照相比,当杜仲叶多糖为2 mg/mL 时,延长时间为14.4 s,当杜仲叶多糖浓度为8 mg/mL 时,延长时间超过了120 s,且影响达到极显著水平(P<0.01),说明杜仲叶多糖对TT 有显著影响作用,进而说明杜仲叶多糖也可以通过参与共同途径来影响凝血过程。闻志莹[14]研究的香椿子多糖浓度为2 mg/mL时,延长时间仅为12.63 s,说明杜仲叶多糖对TT 作用的影响比香椿子多糖大。本文发现杜仲叶多糖的单糖组成主要是果糖、葡萄糖、N-乙酰-D 氨基葡萄糖、半乳糖、阿拉伯糖。宋苗苗[34]报道,抗凝血榴莲皮多糖组成有大量的鼠李糖、半乳糖酸存在,而Martinichen-Herrero 等[35]报道,具有半乳糖-甘露聚糖结构的地衣多糖有抗凝血和抗血栓活性。因此初步推测杜仲叶多糖的抗凝血活性可能与半乳糖糖基的存在有关。
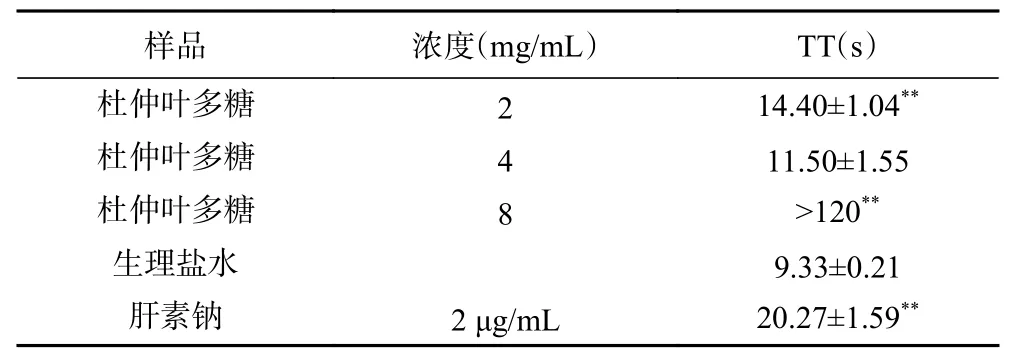
表9 杜仲叶精制多糖对TT 的影响Table 9 Effect of refined polysaccharides from Eucommia ulmoides leaves on TT
3 结论
本研究采用超声波-微波辅助法提取杜仲叶多糖,经单因素实验和BBD 试验,得到最优提取工艺条件为:超声波功率130 W、微波功率200 W、提取温度49.06 ℃、料液比1:28.44(g:mL)、提取时间20.41 min,得率4.08%。在此条件下实际多糖得率为4.02%±0.03%。经DEAE-52 离子层析纯化后,精制多糖的重均分子质量(Mw)为1653 kDa,单糖组成及摩尔比为:果糖37.3%、葡萄糖35%、N-乙酰-D 氨基葡萄糖14.6%、半乳糖8.6%、阿拉伯糖4.4%,并确定其为β型酸性多糖。与阴性对照相比,杜仲叶多糖能极显著延长APTT(P<0.01),对PT、TT 有一定的延长作用,且当多糖浓度为8 mg/mL 时,对PT、TT 有极显著影响(P<0.01),说明其可以通过内源性、外源性、共同途径来影响凝血过程,其中是以内源性途径为主。本研究结果表明,与传统水浸提法和单一的超声波、微波法相比,超声波-微波辅助提取法能高效提取杜仲叶多糖,与酶法相比,超声波-微波辅助提取法有利于降低生产成本,并且发现杜仲叶多糖具有较强的体外抗凝血活性。本研究对我国丰富的杜仲叶资源开发具有一定的理论和技术参考价值。
