纳米淀粉的疏水改性及其对叶黄素的吸附研究
2023-08-25史永桂姚先超焦思宇陆晓娜杨麦秋林日辉
史永桂,姚先超,焦思宇,陆晓娜,杨麦秋,林日辉
(广西民族大学化学化工学院,广西多糖材料与改性重点实验室,林产化学与工程国家民委重点实验室,广西林产化学与工程重点实验室/协同创新中心,广西南宁 530006)
叶黄素具有多种生物活性功能,是天然的食品着色剂和添加剂,在预防神经性损伤、延缓衰老等方面具有重要的作用[1]。马晓雨[2]研究发现,叶黄素的每日摄入量为18 mg 时,不会产生任何不良反应和毒副作用,这为叶黄素在食品和医药领域提供了可靠的参考。但是,叶黄素分子中具有多个共轭双键和两个酮环,使其水溶性较差、稳定性差、易被氧化破坏等[3]。为进一步提高叶黄素在食品和医药等领域的应用,研究开发使用适宜载体对叶黄素进行负载是有效的技术途径,特别是使用生物相容性好、可降解的纳米级天然产物材料作为载体,以达到最好的药物递送效果[4-5]。纳米淀粉(Nanometer Starch,SNPs)作为天然的生物大分子,具有良好的生物兼容性和可降解性,且能表现出较好的药物结合能力而受到广泛的关注[6]。但是,SNPs 颗粒外部有大量裸漏的羟基,使其亲水性较高,对疏水性药物的负载效果不理想[7]。为改善其亲水的特性,对淀粉颗粒表面接支疏水性基团是增强其疏水性的一种有效方法。
酯化改性是通过疏水性基团取代淀粉分子上亲水羟基的一种改性方法,这种改性不仅减弱了淀粉分子之间的氢键作用力,还提高了淀粉的疏水性能。近年来,研究学者多以金属氯化物和酶作为催化剂,二甲基亚砜和离子液体等作为溶剂,虽然可以制备出一定疏水性的改性淀粉,但是都存在反应成本较高,反应溶剂有毒有害且很难处理等问题[8]。由于松香酸基团的强疏水性能和脂肪酶催化效率高、反应条件温和以及无重金属离子残留优点,本课题组研发了木薯淀粉和松香酸在脂肪酶催化下,制备出具有一定疏水性的松香淀粉酯(Rosin Starch Ester,RAS)[9]。改性后的RAS 颗粒表面的部分羟基被松香酸基团取代,使淀粉颗粒的疏水性增加,提高了对疏水性物质的亲和力。巫佳[10]在RAS 对苯酚和多环芳香烃苯并芘吸附研究中发现,RAS 相对木薯淀粉在水溶液中分散性得到了增强,提高了对疏水性的多苯环结构物质吸附能力。但是,目前对SNPs 进行疏水改性并应用于药物负载领域的研究鲜有报道[11]。
因此,本文在采用沉降法制备SNPs 的基础上,采用松香酸为改性剂,脂肪酶为催化剂,在两相体系中对SNPs 颗粒表面接枝松香酸基团,进行疏水改性,旨在利用SNPs 颗粒表面裸漏的羟基,和松香酸基团上的羧基发生酯化反应,制备出一种纳米级的疏水性淀粉颗粒。同时以长链疏水性药物叶黄素作为模型药物,研究了SNPs 和RENPS 在不同吸附条件下对叶黄素的吸附效果,并探讨了SNPs 和RENPS对其的吸附机理,为改性淀粉作为疏水性药物载体方面提供一种新的思路。
1 材料与方法
1.1 材料与仪器
木薯淀粉(纯度95%以上、直链淀粉含量10%)
市售;松香(AR) 上海源叶生物有限公司;无水乙醇(AR) 成都市科隆化学品有限公司;叶黄素(纯度80%) 阿拉丁试剂有限公司;脂肪酶(酶活≥100000 U/g) 绵阳禾本生物科技有限公司;二甲基亚砜(AR) 阿拉丁试剂有限公司。
JY92-IIN 超声波细胞粉碎机 宁波新芝生物科技股份有限公司;FD-A10N-50 冷冻干燥机 上海皓庄仪器有限公司;UV23II 紫外可见分光光度计 上海天美科学仪器有限公司;SUPRA 55 Sapphire 场发射扫描电子显微镜 德国卡尔蔡司公司;Nicomp380ZLS纳米激光粒度及电位分析仪 美国PSS 粒度仪公司;SDS350 整体倾斜接触角测量仪 东莞市晟鼎精密仪器有限公司。
1.2 实验方法
1.2.1 纳米淀粉(SNPs)的制备 参考Hu 等[12]的方法并稍作改进,配制质量分数为5%的乳液,置于恒温磁力搅拌器中以冷凝器进行回流,在90 ℃恒温1 h 至淀粉完全糊化。将淀粉糊置于超声波细胞粉碎机中,室温下,600 W 下超声处理10 min 之后,将低黏度淀粉糊在8000 r/min 下离心5 min,取上清液,在600 W 超声条件下,将10 mL 清液以10 mL/min的流速,通入100 mL 乙醇中(冰浴),得纳米淀粉颗粒混合液[13]。在8000 r/min 下对混合液离心5 min,取沉淀。将沉淀再次与乙醇溶液混合,置于磁力搅拌器上,在100 r/min 下搅拌15 min,离心,取沉淀,重复步骤2 次,即得SNPs。
1.2.2 松香酯纳米淀粉(RENPS)的制备 参考杨慧等[9]的方法制备RENPS,并加以改进。直接称取3 g离心后的SNPs,并将其加入50 mL 的氯仿中,将氯仿与SNPs 在600 W 超声条件下(冰浴)分散30 s。将6 g松香加入分散液,置于55 ℃、180 r/min 培养箱中振荡5 min,使松香完全溶解。移取脂肪酶、水、乙醇各200 μL 加入混合物中,于55 ℃、180 r/min 的培养箱中振荡,分别反应5、10、15、20 h。反应结束后,离心取沉淀,用无水乙醇对沉淀清洗4 次。对清洗后的沉淀物,通过冷冻干燥至恒重,即得不同取代度RENPS。
1.2.3 取代度(DS)测定 采用酸碱滴定法测定酯化淀粉的取代度[14]。分别称取2 g 的RENPS 和SNPs(冷冻干燥至恒重),加入50 mL 的0.1 mol/L 的氢氧化钠溶液,在磁力搅拌器上55 ℃皂化3 h。将皂化后的溶液冷却至室温,加入0.5 mol/L 的盐酸溶液8.5 mL 搅拌均匀,滴加2~3 滴酚酞作为指示剂再用0.025 mol/L 的盐酸进行滴定至终点。取代度计算公式如下:
式中:W 为松香基团的质量分数,%;C 为滴定盐酸的标准浓度,0.025 mol/L;V1为SNPs 滴定消耗盐酸的体积,L;V2为样品淀粉滴定消耗盐酸的体积,L;m 为样品的质量,g;285 为松香基团的平均相对分子质量;DS 为取代度;162 为淀粉分子上葡萄糖单元平均分子量。
1.2.4 场地发射扫描电镜(SEM)观察 用毛细管取少量木薯淀粉,将1.2.1 制备的SNPs 和1.2.2 制备的RENPS 样品均匀地撒到双面导电胶上,置于真空镀膜仪下喷镀钯金,扫描电镜下用500 倍和20000倍拍照观察。
1.2.5 粒度分布测定 取适量1.2.1 制备的SNPs和1.2.2 制备的RENPS 样品溶于冷超纯水中制得混合悬浊液,并在冰浴条件下,超声波分散2 min。取适量分散液放入比色皿中,用激光纳米粒度仪测定样品粒度分布[15]。测定条件:温度25 ℃、水折射率1.33、淀粉折射率1.53。
1.2.6 接触角测定 参考姚先超等[16]方法并稍作改进,采用液滴法测定静态接触角。取淀粉样品0.1 g于60 ℃下溶解在10 mL 的二甲基亚砜中,将溶解后溶液均匀滴加在载玻片上,于80 ℃真空干燥箱中干燥成膜。利用接触角自动进样装置在膜表面滴加2 μL 去离子水,在30 s 水滴稳定后,测量接触角并拍照。再将水滴分别静置5、10、20、30 min 拍照,采用仪器自动法测量,每个样品在不同位置测量5 次,取其平均值。
1.2.7 叶黄素吸附量测定 采用紫外分光光度计法在445 nm 处计算吸附量[17]。以叶黄素浓度为横坐标X(mg/mL),吸光度为纵坐标Y,标准曲线为:Y=1.13X-0.037(R2=0.9985)。参考史永桂等[7]的方法,取0.1 g 的样品放入2 mL 的离心管中作为吸附剂,加入1 mL 的2 mg/mL 的叶黄素醇溶液,将离心管放在混合血液混凝器上,在5~120 min 内间隔取点,以不加淀粉的叶黄素溶液作为对照。将吸附完成后的混合液,在8000 r/min 离心5 min,取上清液0.5 mL,加入4.5 mL 的乙醇,稀释10 倍,测量吸光度,叶黄素的吸附量计算公式(3)为:
式中: q为吸附量,mg/g;C1为叶黄素溶液浓度,mg/mL;C2为吸附后的叶黄素溶液浓度,mg/mL;V 为叶黄素溶液体积,mL;10 为稀释倍数;m 为用于吸附叶黄素的样品干重,g。
1.2.8 不同叶黄素浓度下吸附量测定 称取0.1 g的不同DS 的RENPS 和SNPs 为吸附剂,放入2 mL的离心管中,分别加入1 mL 浓度为0.5、1、2、3 mg/mL的叶黄素溶液,在室温(25 ℃),避光下,于血液混凝器上吸附1 h,按1.2.7 公式计算吸附量。
1.2.9 SNPs 和RENPS(DS=0.0287)对叶黄素吸附动力学 按1.2.7 的方法,以0.5、1 、2 mg/mL 的叶黄素浓度在5~120 min 内间隔取点,计算吸附量。
1.2.10 贮藏稳定性测定 将吸附后的样品,室温(25 ℃)、升温条件下(50 ℃)分别避光储存0~30 d。定时取0.5 g 不同贮藏条件下的样品,并参考Fu 等[18]的方法用乙酸乙酯将叶黄素萃取出来,按1.2.7 方法,在紫外分光光度计测量吸光度,并以公式(4)计算叶黄素保留率(%)。
式中:A1为初始样品中叶黄素吸光度;A2为贮藏后间隔时间取的样品中叶黄素吸光度。
1.3 数据处理
所有实验均重复3 次,使用Microsoft Excel 2010对数据统计、标准偏差计算和线性相关分析。采用Origin 2018 对实验参数和结果绘图,Photoshop 对图片进行排版。
2 结果与分析
2.1 反应时间对松香酯纳米淀粉取代度的影响
反应时间对RENPS 取代度的影响如表1 所示。从表1 可以发现,随着反应时间的增加,DS 逐渐升高,在初始反应时间0~10 h 时,反应的速率较慢,DS增加较缓慢,这归结于松香酸的分子量较大,在溶液中与SNPs 表面的羟基结合较困难,使发生反应的程度较低。在10~15 h 时,反应速率提高,这是因为随着反应的进行,淀粉颗粒表面形成了酯化斑点[19],溶剂中的松香酸与酯化斑点上的松香基团具有相亲性,使溶剂中的松香酸在酯化斑点周围发生聚集,增加了淀粉颗粒上的羟基与松香酸之间的接触概率,提高了化学反应速率。

表1 反应时间对RENPS 取代度的影响Table 1 Effect of reaction time on the degree of substitution of RENPS
此外,淀粉颗粒的颗粒尺寸也是影响其在改性反应中活性变化的重要原因,SNPs 具有较小的纳米级颗粒尺寸和较大的比表面积,使淀粉颗粒中更多的羟基裸露在颗粒表面,可明显增加反应的程度。史永桂等[7]在对原木薯淀粉进行酶催化修饰改性中,原淀粉的DS 仅为0.0165,而SNPs 的DS 相对其可提高73.94%。
2.2 SEM 分析
根据Zhao 等[20]的报道,木薯淀粉颗粒主要为圆形和少许不规则形,颗粒的尺寸在2~10 μm。由图1可知,通过沉降法制备的SNPs 相对木薯淀粉,颗粒尺寸改变明显,形貌为圆形或椭圆形。这与史永桂等[21]采用醇沉法制备出的颗粒尺寸为纳米级的研究结果相同。经酯化后的RENPS 相对SNPs 颗粒尺寸与形貌无明显变化,均能保持圆形或椭圆形形貌,表明SNPs 在酯化过程中形貌未被明显破坏。韩墨等[22]在辛烯基琥珀酸酐对玉米淀粉纳米颗粒进行酯化修饰研究中,也发现修饰改性后的淀粉酯形貌无明显改变,粒径仍能分布在40~202 nm 之间。由于SNPs 和RENPS 的粒径小,都具有较大的比表面积,表面能较大,颗粒之间会发生聚集,以此从高能态降低至低能态形成稳定的结构。

图1 木薯淀粉、SNPs 和RENPS 的SEM 图Fig.1 SEM images of cassava starch, SNPs and RENPS
2.3 取代度对松香酯纳米淀粉粒度分布的影响
通过淀粉颗粒的粒径分布分析,可进一步说明颗粒尺寸分布结果。由图2 可知,SNPs 主峰在480 nm附近,RENPS 颗粒尺寸主峰也均分布在100~450 nm之间,表明通过沉降法成功制备了纳米级的淀粉颗粒,也进一步印证了SEM 结果。从主峰分布分析可知,相对SNPs,RENPS 的主峰随DS 的增大,主峰逐渐左移,并出现了减小趋势。这归结于SNPs 中淀粉分子链的氢键较强,在粒径测量水溶液条件下,颗粒之间相互吸引发生了一定的聚集。Chang 等[23]使用原淀粉乙酰酯化改性后,再对其纳米化处理,也发现所得颗粒形貌之间出现黏连。RENPS 峰出现左移可能是与Zeta 电位相关,姚先超等[16]研究表明,经酯化修饰的淀粉纳米颗粒电位可由-12.2 mV 提高至-19.4 mV,而Zeta 电位的增加会使淀粉颗粒对水的稳定性得到提高,减弱在水中的聚集程度。因此,在RENPS 表面接枝了大量松香基团后,其Zeta 电位可能提高,减弱了RENPS 在水中的聚集,使测得粒径主峰发生了左移。同时,表面电荷因静电斥力能在溶液环境中保持分散状态,这种能力是纳米颗粒能维持较好的分散性和对天然药物产生更好吸附能力中起着至关重要的作用[24]。

图2 取代度对RENPS 粒度分布的影响Fig.2 Effect of degree of substitution on size distribution of RENPS
2.4 取代度对松香酯纳米淀粉接触角的影响
图3和表2 为一滴去离子水滴加在SNPs 和RENPS表面上接触角的状态。由表2 可知,SNPs 表面接触角最小,为51.69°±2.15°,这是因为淀粉中富含羟基基团,可与水分子之间建立氢键[25],有利于水在表面的润湿,这也与杨慧[26]对木薯原淀粉测量的接触角结果相近。改性后的RENPS 接触角随DS 的增大而提高,其中RENPS(DS=0.0287)的接触角可达93.32°±1.15°,相对SNPs 可提高80.54%,表明通过酯化修改性引入的松香基团可有效增加其疏水性能力。这归结于SNPs 表面的羟基被松香酸取代后,松香酸的三元菲环结构[27],可有效增加其疏水性能力。

图3 SNPs 与RENPS 在滴下水滴30 s 时接触角照片Fig.3 Photos of contact angle of SNPs and RENPS after a drop of water dropping for 30 s

表2 SNPs 与RENPS 在滴下水滴30 s 时接触角Table 2 Contact angles of SNPs and RENPS after a drop of water dropping for 30 s
图4和表3 为SNPs 和RENPS(DS=0.0287)在水滴滴下后接触角随时间的变化情况。由表3 可知,随时间的增加,接触角都出现减小的趋势,这是因为液滴在表面发生了渗透和扩散[28]。接触角随时间延长降低的幅度与DS 有一定相关性,SNPs 和RENPS在30 min 内分别降低了12.38%和9.12%,表明RENPS 样品的接触角降低幅度较小,能维持稳定的状态时间较长,说明经过改性的处理的RENPS 不仅能增加其疏水性,也能增加其稳定性。

图4 SNPs 与RENPS(DS=0.0287)在水滴滴下后接触角随时间的变化图Fig.4 The change of contact angle of SNPs and RENPS (DS=0.0287) with time after a drop of water dropping
2.5 取代度对松香酯纳米淀粉吸附叶黄素的影响
为确定SNPs 和RENPS 对叶黄素的吸附平衡时间,研究了吸附时间对淀粉样品吸附叶黄素的影响,其吸附结果如图5 所示。在叶黄素溶液初始为2 mg/mL 时,SNPs 在0~60 min 内吸附量缓慢增加,吸附时间60 min 时,基本达到吸附平衡,吸附量为7.35 mg/g。相对SNPs,RENPS 的吸附速度较快,随DS 的增加,达到吸附平衡的时间逐渐减小。RENPS(DS=0.0287)在30 min 已基本达到吸附平衡,30~120 min 吸附量仅增加6.25%,其饱和吸附量可达22.89 mg/g,相对SNPs 的饱和吸附量可提高211.42%。这与史永桂等[7]在木薯淀粉表面疏水改性后,对原花青素的吸附平衡时间提前的研究结果相似。RENPS相对SNPs 可达到较快的吸附平衡和较高的吸附量,这可能与RENPS 在叶黄素溶液中的颗粒分散性相关,疏水性基团的存在减弱了淀粉分子链之间的羟基缔合,从而改善在溶液中的分散性[29],使RENPS 在叶黄素溶液中分散性增加,颗粒能更好的接触吸附质,以此达到较快的吸附平衡和较高的吸附量,这也印证了粒度分布的检测结果。同时,经表面疏水改性,可增强了淀粉颗粒对疏水性物质的亲和力,使RAS 对叶黄素的吸附量得到明显增加。
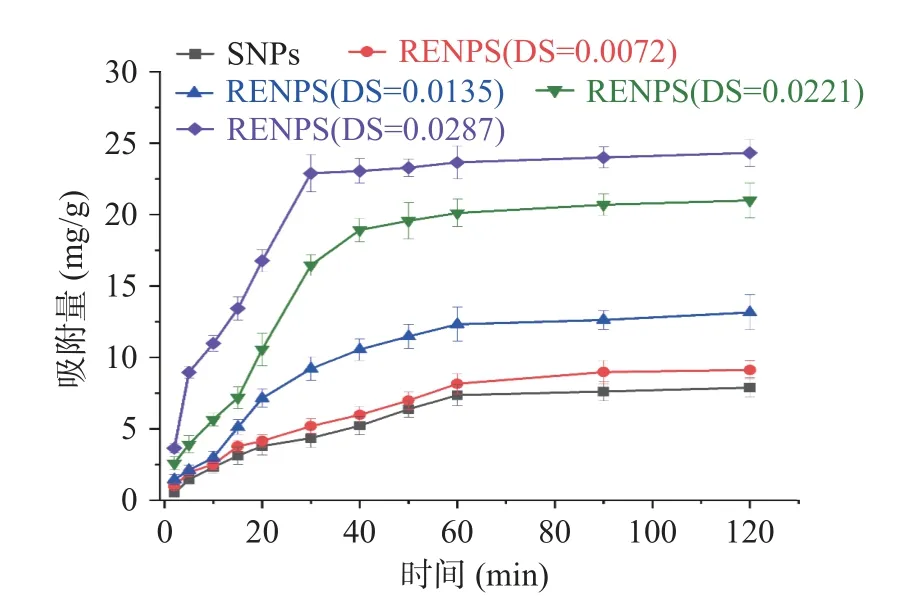
图5 取代度对松香酯纳米淀粉吸附叶黄素的影响Fig.5 The effect of DS on lutein adsorbed by RENPS
2.6 叶黄素浓度对松香酯纳米淀粉吸附叶黄素的影响
表4为SNPs 和RENPS 在温度为25 ℃、吸附时间60 min 下,不同叶黄素浓度对RENPS 吸附的影响。SNPs 和RENPS 对叶黄素的吸附量随着叶黄素浓度(0.5~3.0 mg/mL)的增加而增加,这是因为随叶黄素初始浓度的增加,提高了溶液中的叶黄素分子与淀粉颗粒表面的接触概率,使更多的叶黄素被吸附在了淀粉颗粒表面。当叶黄素浓度高于2 mg/mL 时,吸附量增加不再明显,这归结于淀粉颗粒表面与叶黄素的结合位点趋于饱和,使吸附能力下降。此外,RENPS对叶黄素的吸附量均高于SNPs,且与DS 成正比,表明经疏水改性后,在不同浓度的叶黄素溶液中均能显著增加叶黄素的吸附量,这也印证了在不同DS 下对叶黄素的吸附结果。

表4 不同叶黄素浓度对RENPS 吸附量的影响(mg/g)Table 4 Effect of lutein concentration on adsorption of RENPS(mg/g)
2.7 吸附动力学分析
为进一步明确吸附机理,采用拟一级动力学和拟二级动力学对SNPs 和RENPS(DS=0.0287)进行吸附机理分析[30]。拟一级吸附动力学模型的方程表达式为:
式中:qe和qt分别为平衡时和t 时刻对叶黄素的吸附量,mg/g;K1为拟一级吸附动力学速率常数,h-1。通过对ln(qe-qt)和t 关系线性拟合,可以得到K1、qe、R2。
拟二级吸附动力学模型的方程表达式为:
式中:qe和qt分别为平衡时和t 时刻对叶黄素的吸附量,mg/g;K2为拟二级吸附动力学速率常数,g/mg/h。通过对和t 关系线性拟合,可以得到K2、qe、R2。
表5为SNPs 对叶黄素吸附动力学结果。从表5和图6 可知,一级动力学模型拟合结果R2在(0.9562~0.9852)大于二级动力学R2值(0.9073~0.9622);且一级动力学拟合出理论吸附值qe,cal更接近实验值qe,exp,所以一级动力学模型更适用于描述SNPs 对叶黄素的吸附过程。表明SNPs 是通过物理吸附作用将叶黄素吸附在颗粒表面,这是归结于其颗粒粒径较小,具有较大的比表面积,表面能较大,可将叶黄素吸附在颗粒表面[31]。

图6 25 ℃时吸附时间对SNPs 吸附叶黄素的影响(a)及相应的拟一级动力学模型线性拟合(b)Fig.6 Effect of adsorption time on lutein adsorbed by SNPs at 25 ℃ (a) and linear fitting of corresponding pseudo first-order kinetic model (b)
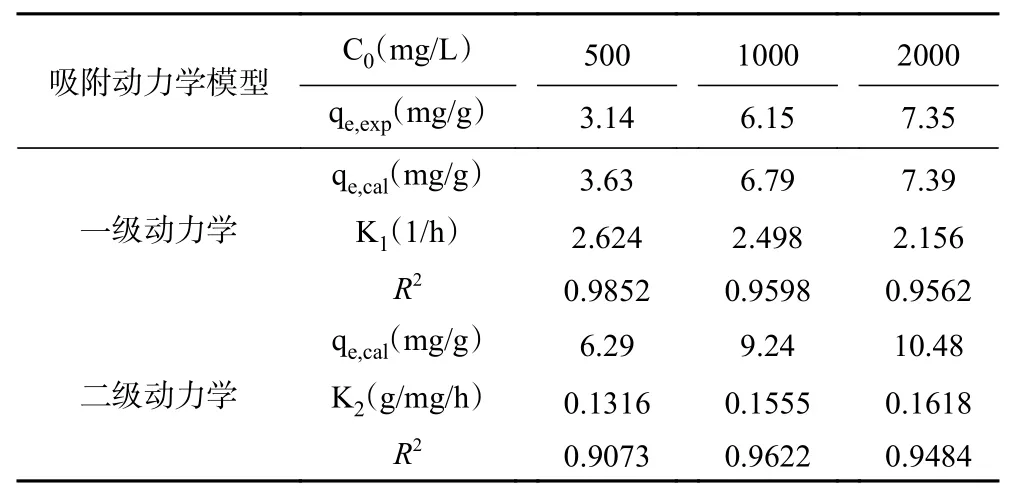
表5 SNPs 吸附动力学参数Table 5 Adsorption kinetic parameters of SNPs
相对SNPs,RENPS 对叶黄素得吸附机理发生了改变。由表6 和图7 可知,二级动力学模型拟合结果R2>0.99,大于一级动力学R2值,且二级动力学拟合出得理论计算值也更加接近实验值。所以二级动力学模型更适用于描述RENPS 对叶黄素的吸附过程。因此,RENPS 对叶黄素得吸附不仅是物理吸附,还发生了化学吸附作用力的产生。这可能是因为SNPs 表面引入了松香基团,松香基团与叶黄素分子之间产生了氢键的相互作用力[32],影响了吸附过程,也进一步证明了,经改性后的RENPS 相对SNPs可有效改善对叶黄素的吸附效果。
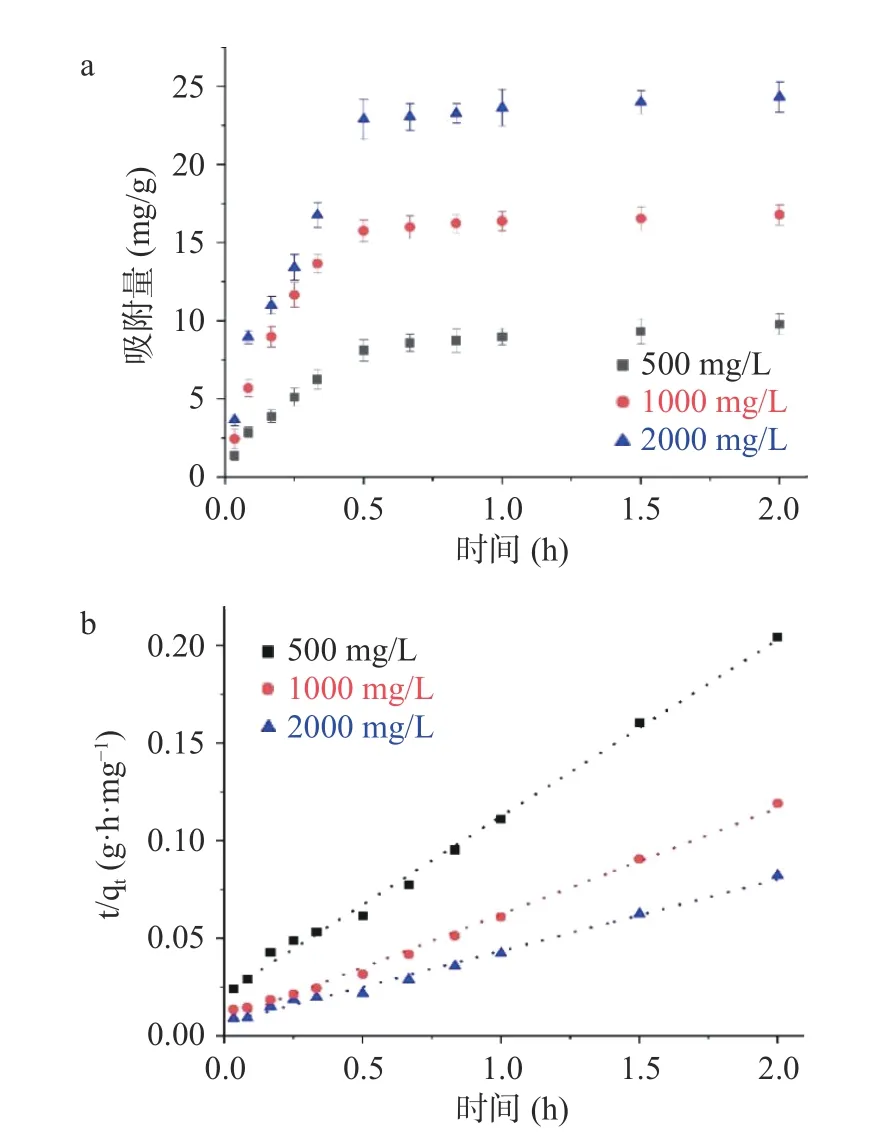
图7 25 ℃时吸附时间对RENPS(DS=0.0287)吸附叶黄素的影响(a)及相应的拟二级动力学模型线性拟合(b)Fig.7 Effect of adsorption time on lutein adsorbed by RENPS(DS=0.0287) at 25 ℃ (a) and linear fitting of corresponding pseudo second-order kinetic model (b)
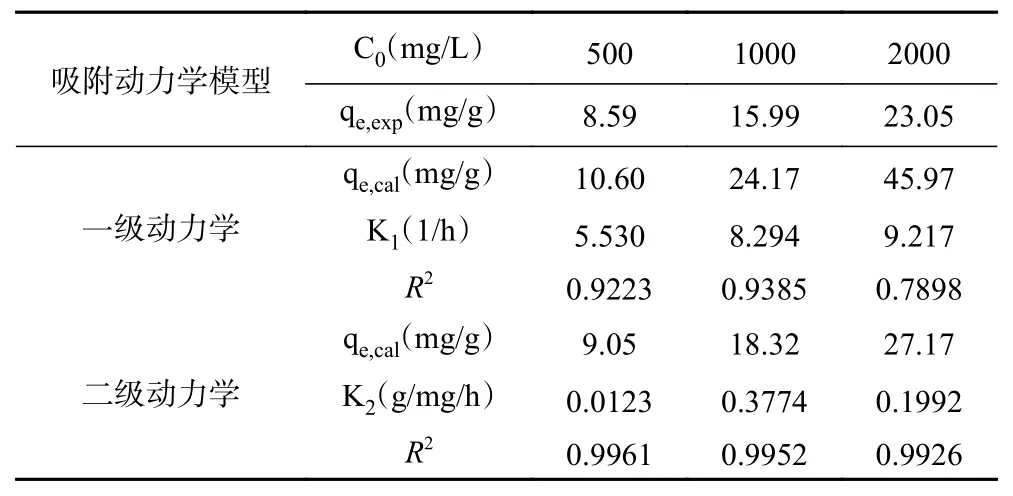
表6 RENPS(DS=0.0287)吸附动力学参数Table 6 Adsorption kinetic parameters of RENPS (DS=0.0287)
2.8 松香酯纳米淀粉对叶黄素贮藏稳定性的影响
叶黄素是一种长脂链、含两个酮环的分子,且分子中具有多个共轭双键,由于这种不饱和结构的存在,使其化学稳定性较差,在温度、光照和氧气等因素下容易发生降解,颜色逐渐变浅,吸光值降低,通过记录吸光值的变化可以计算出叶黄素的保留率[33]。由图8 可知,在常温条件下贮藏30 d,叶黄素与RENPS上的叶黄素保留率分别为64.91%和78.94%,表明RENPS 不会破坏叶黄素稳定性,并且可保护叶黄素的生物活性。这归结于淀粉为天然的高分子材料,具有良好的生物兼容性[34],并且淀粉颗粒可阻隔氧气进入淀粉颗粒内部,使叶黄素处于淀粉颗粒的保护下,进而不被氧气氧化[35]。此外,在升温条件下贮藏30 d,RENPS 相对叶黄素保留率仍可提高14.54%。寇宗亮等[35]在淀粉纳米颗粒对姜黄素(疏水性药物)的吸附研究中也发现,在相同贮藏条件下,经淀粉纳米颗粒负载后的姜黄素相对姜黄素原料药,其稳定性也明显提高,这与本文的研究结果类似。

图8 松香酯纳米淀粉对叶黄素贮藏稳定性的影响Fig.8 Effect of RENPS on storage stability of lutein
3 结论
本研究在醇沉法制备SNPs 的基础上,通过廉价的脂肪酶作为催化剂,在两相体系对SNPs 催化接枝了松香酸基团,成功制备了纳米级(粒度范围在100~450 nm)的疏水改性淀粉。相对原木薯淀粉的接枝改性,具有较大比表面积的SNPs 的取代度得到明显提升。与SNPs 相比,RENPS 的疏水性明显增加,且疏水性和DS 呈现正相关。同时,RENPS 对叶黄素的饱和吸附量也随DS 的增加而增加,且平衡吸附时间随DS 的增加而减少,表明疏水改性后淀粉可明显增加其对疏水性药物的吸附作用。SNPs 对叶黄素的吸附为一级动力学,而RENPS 对叶黄素的吸附为二级动力学。以上研究表明,利用淀粉颗粒表面的羟基,通过酯化反应是获得改性淀粉的一种方法,并且降低其淀粉的粒径,可以有效增加其反应程度。疏水改性淀粉可有效解决原淀粉对疏水性药物的负载难题,增加了淀粉在食源性方面的应用。但是,目前改性淀粉的取代度仍然很低,需要继续改进提升其取代度,并且RENPS 作为纳米级的输送体系,在细胞层面具有一定的潜在应用。
