高产EPS 乳酸片球菌的航天育种及其EPS 性能研究
2023-08-25张孟雨彭嘉屹陈禹豪曾凤婷钟青萍
张孟雨,李 尧,彭嘉屹,陈禹豪,曾凤婷,钟青萍
(华南农业大学食品学院,广东广州 510642)
乳酸菌(lactic acid bacteria,LAB)是一种公认安全(generally recognized as safe,GRAS)微生物[1],在自然界分布广泛。大多数乳酸菌能够耐受胃肠液环境,具有抗菌作用,还能产生胞外多糖(exopolysaccharide, EPS) 、γ-氨基丁酸( 4-aminobutanoic acid,GABA)等活性物质,是重要的益生菌[2]。乳酸菌产生的胞外多糖具有安全性高、生物活性好等性质[3],分为同多糖(homopolysaccharides,HoPS)和杂多糖(heteropolysaccharides,HePS)两种[4],主要是由葡萄糖、果糖、甘露糖、半乳糖、鼠李糖、阿拉伯糖等糖单元按不同比例组成,本质上是一种高分子量水溶性的长链天然聚合物[5]。乳酸菌所产胞外多糖因其持水、抗菌和其他益生性能等在食品工业、制药、化妆品及环境工业中应用广泛[6],不仅可以作为食品生产加工中的增粘剂、稳定剂、乳化剂等,还可以用作生物絮凝剂、生物吸收剂、离子交换树脂和重金属去除剂等,具有广泛的应用前景[7]。
航空诱变技术是指将菌株通过卫星、飞船等返回式航天器带入宇宙空间中,使其在各种太空诱变因子的作用下遗传性状发生改变的技术,从而提高微生物突变率以期获得性状优良的菌株[8-9]。近年来,航天诱变技术在微生物育种方面发展迅速,Wang 等[10]发现经航天诱变的白假丝酵母生长速率、生物被膜形成能力和抗氧化能力均有所提高;Bai 等[11]对经航天诱变的沃式葡萄杆菌进行研究,发现其生物被膜形成能力增强。航空航天技术获得的突变微生物具有较好的研究价值和应用前景[12],但目前航天诱变乳酸菌的研究较少,如王莹等[13]从航天诱变的嗜热链球菌中筛选出两株产酸速率快,黏度和胞外多糖含量均有所提高的菌株;隋馨瑶[14]将副干酪乳杆菌进行航天诱变,经筛选得到一株高产酸的副干酪乳杆菌A-4-2,说明航天诱变对乳酸菌的性能可能产生积极作用。微生物空间育种正在成为微生物科学的一个新兴和有前途的领域,并有利于推动发酵技术的发展[15]。
本研究将乳酸片球菌L21 进行航天诱变处理,对诱变菌株进行EPS 产量及遗传稳定性分析,比较原始菌株及突变菌株对酸、胆盐及人工模拟胃、肠液的耐受性,筛选出一株性能稳定并高产EPS 的乳酸片球菌株,探明其EPS 的抗生物被膜、抗氧化、抑制α-淀粉酶和α-葡萄糖苷酶的能力,以期获得具有优良益生特性的突变菌株,为航天育种乳酸菌及其所产胞外多糖的综合利用提供理论依据,以及为航天诱变微生物的研究和应用提供借鉴。
1 材料与方法
1.1 材料与仪器
乳酸片球菌L21 菌株 由本实验室分离鉴定和保藏;金黄色葡萄球菌ATCC 25923、单增生李斯特菌ATCC 19155、大肠埃希氏菌ATCC 25922、铜绿假单胞菌ATCC 9027 均为实验室保藏菌株;胰蛋白胨、牛肉膏、酵母粉 广东环凯生物技术有限公司;葡萄糖、吐温、磷酸氢二钾、乙酸钠、柠檬酸三胺、硫酸镁、硫酸锰、琼脂、甘油 广州化学试剂厂;Tris 北京索莱宝科技有限公司;DPPH 试剂、ABTS试剂 美国Sigma 公司;胰蛋白酶(1:250)、胃蛋白酶(1:3000)、牛胆盐 上海源叶生物科技有限公司;α-淀粉酶(1 U/mL)、α-葡萄糖苷酶(1 U/mL) 上海吉至生化科技有限公司;其他试剂均为分析纯。
Scientz-12N 冷冻干燥机 宁波新芝生物科技股份有限公司;AvantiJ-E 落地式高速大容量离心机美国贝克曼库尔特有有限公司;SpectraMax i3x 连续波长多功能微孔板检测平台 美国Molecular Devices 公司;5417R 超高速离心机 德国Eppendorf 公司;VersaMax 光栅型酶标仪 美国Melecular Devices 公司;Evolution 300 紫外可见分光光度计 美国ThermoFIsher Scientific 公司;LC-20AD 高效液相色谱仪 日本岛津公司;TP600PCR 仪 日本TaKaRa公司;R1001-VN 旋转蒸发仪 郑州长城科工贸有限公司;Agilent1260 凝胶渗透色谱 美国Agilent 公司。
1.2 实验方法
1.2.1 培养基及试剂配制 MRS 培养基:胰蛋白胨10.0 g/L,牛肉膏5.0 g/L,酵母粉4.0 g/L,葡萄糖20.0 g/L,吐温-80 1.0 mL/L,磷酸氢二钾(K2HPO4·7H2O)2.0 g/L,乙酸钠(CH3COONa·3H2O)5.0 g/L,柠檬酸三胺 2.0 g/L,硫酸镁(MgSO4·7H2O)0.2 g/L,硫酸锰(MnSO4·4H2O)0.05 g/L。pH 为6.0,121 ℃灭菌20 min。配固体培养基需加入15~20 g 琼脂。
LB 培养基:胰蛋白胨10 g,酵母粉5 g,NaCl 10 g,去离子水1 L。pH 为7.0,121 ℃灭菌20 min。
人工模拟胃液:125 mmol/L NaCl、7 mmol/L KCl、45 mmol/L NaHCO3、3 g/L 胃蛋白酶,pH 调至3.0,0.22 μm 微孔滤膜过滤除菌。
人工模拟肠液:1 g/L 胰蛋白酶、3 g/L 牛胆盐,pH 调至7.5,0.22 μm 微孔滤膜过滤除菌。
0.1 mol/L PBS 溶液(pH6.86):A 液(0.2 mol/L Na2HPO4):称取71.6 g Na2HPO4·12H2O 溶于1 L 水中;B 液(0.2 mol/L NaH2PO4):称取31.2 g NaH2PO4·2H2O 溶于1 L 水中。取49 mL A 液和51 mL B 液混合配成pH7.4 的缓冲液,然后取500 mL 加超纯水稀释至1000 mL。
ABTS+工作液:7.4 mmol/L ABTS 与2.6 mmo/L K2S2O8等体积混合,避光静置12 h,用pH7.4 的PBS 溶液稀释至其OD734nm为0.7±0.2 后使用。
α-淀粉酶溶液(1 U/mL):α-淀粉酶溶液与PBS 缓冲盐溶液混合,配制成1 U/mL 的α-淀粉酶溶液,-20 ℃条件下避光储存,40 ℃水浴锅中预热30 min 后使用。
α-葡萄糖苷酶溶液(1 U/mL):α-葡萄糖苷酶溶液与PBS 缓冲盐溶液混合,配制成1 U/mL 的α-葡萄糖苷酶溶液,-20 ℃条件下避光储存,40 ℃水浴锅中预热30 min 后使用。
1%淀粉溶液:将1 g 淀粉置于100 g 沸水中充分溶解并常温储存。
1.2.2 菌株诱变条件及活化 基础数据(由中国航天科技集团有限公司提供):在轨飞行67 h;大椭圆轨道,高度范围324~7970 km,穿越范爱伦辐射带;倾角42.5°;舱内压力常压下;在轨舱壁测温点实测温度:最低点 0.8 ℃,最高 37 ℃;舱内搭载物位置温度范围:20±5 ℃;对于舱内和设备内部的应用的元器件和材料,试验船遭受的总剂量处于几krad 至几十krad 量级(与所处位置屏蔽厚度相关,具体量值随屏蔽厚度增加衰降很快),但均高于当前载人飞船的水平。
从搭载菌株的返地固体培养物中取2 g 接入10 mL MRS 液体培养基中37 ℃恒温培养48 h。
1.2.3 菌株纯化及保存 将活化培养的菌液梯度稀释,取合适稀释梯度菌液在MRS 固体培养基上涂布,37 ℃恒温培养48 h。挑选菌落较大、拉丝较长的单菌落在MRS 固体培养基连续划线纯化2 代,挑选单菌落于MRS 液体培养基中培养,20%甘油保菌,-80 ℃冰箱存放。
1.2.4 航天诱变乳酸菌EPS 的提取 参考卢承蓉等[16]的方法并略作修改。按3%接种量将菌株接种于MRS 培养基中,37 ℃培养箱中培养24 h,连续活化3 次后,在4 ℃,10000 r/min 条件下离心10 min,将浓度为800 g/L 的三氯乙酸溶液加入上清液中,使体系中三氯乙酸终浓度为4 g/L,在4 ℃冰箱中静置6~8 h,离心15 min(10000 r/min,4 ℃),取上清液加入其3 倍体积的95%乙醇,在4 ℃冰箱中静置12~15 h 后,在4 ℃,10000 r/min 条件下离心15 min,取多糖沉淀,加入去离子水溶解,转移至截留分子量为8000~14000 Da 的透析袋中,3 h 后换第一次水,之后每隔8 h 换一次水,持续2 d,收集透析液内液体,经真空冷冻干燥后即得到EPS 提取物,以此EPS 提取物进行后续实验。
1.2.5 葡萄糖标准曲线的绘制和乳酸菌EPS 含量测定 采用王彦平等[17]的方法并略作修改。在试管中加系列浓度葡萄糖稀释液200 μL,加入现配的浓度为6%的苯酚溶液200 μL,摇匀,加入1 mL 浓硫酸后混匀,静置20 min 后于冰水中冷却,吸取200 μL至96 孔酶标板孔中,在连续波长多功能微孔板检测平台中测定490 nm 处的吸光度。以葡萄糖质量浓度(mg/L)为横坐标,OD490nm为纵坐标,绘制标准曲线。将乳酸菌EPS 样品按同样条件进行反应,测其OD490nm,代入标准曲线得EPS 产量,并计算其提高率:
式中,Am为突变菌株EPS 产量;Aw为原始菌株EPS 产量。
1.2.6 高产EPS 突变菌株遗传稳定性测试 选EPS产量提高的突变菌株连续培养10 代,每隔两代测定其EPS 产量,分析其产EPS 的遗传稳定性。
1.2.7 航天诱变菌株的性能分析
1.2.7.1 菌体自聚性 参考彭嘉屹等[18]的方法并略作修改,乳酸菌菌株活化两代,4 ℃,10000 r/min 离心5 min,弃去上清液,用PBS 缓冲液(0.1 mol/L,pH6.86)反复两次洗涤菌体,离心取沉淀,PBS 缓冲液重悬并调整菌液浓度为108CFU/mL,取4 mL 混匀后菌液于室温下静置10 h,每隔2 h 吸取水相液体200 μL,测其OD595nm值,并计算自凝聚率:
式中,A0为0 h 时的OD595nm;At分别为2、4、6、8、10 h 时的OD595nm。
1.2.7.2 菌体表面疏水性 乳酸菌菌株活化两代后,菌液前处理见1.2.7.1,调整菌液浓度为108CFU/mL。取6 mL 菌液分别依次与2 mL 二甲苯(中性溶剂)、三氯甲烷(酸性溶剂)和乙酸乙酯(碱性溶剂)涡旋振荡混合5 min,室温放置30 min,吸取水相液体200 μL,测其OD595nm值,并计算表面疏水率[18]:
式中,A0为0 h 时的OD595nm;At为不同溶剂处理30 min 后的水相OD595nm。
1.2.7.3 菌株对酸的耐受性 参考焦时阳等[19]的方法并略作修改,乳酸菌菌株活化两代后,4 ℃,10000 r/min 离心5 min,弃去上清,用PBS 缓冲液(0.1 mol/L,pH6.86)重悬后取500 μL 分别接种到pH 为2.0、3.0、4.0 的9.5 mL 的MRS 液体培养基中,37 ℃恒温培养4 h 后进行浓度梯度稀释,37 ℃倒置培养48 h 后测定活菌数。
1.2.7.4 菌株对胆盐的耐受性 乳酸菌菌株活化两代,4 ℃、10000 r/min 离心5 min,弃上清,用PBS 缓冲液(0.1 mol/L,pH6.86)重悬后吸取500 μL 分别接种到含2.0、3.0、4.0 g/L 牛胆盐的5 mL MRS 液体培养基中,37 ℃静置培养24 h 后进行浓度梯度稀释,于37 ℃条件下恒温倒置培养48 h 后测定活菌数[19]。
1.2.7.5 菌株对人工模拟胃液的耐受性 参考向宬屹[20]的方法并加以修改,乳酸菌菌株活化两代,取1 mL 菌液于4 ℃,10000 r/min 条件下离心5 min,弃上清,用PBS 缓冲液(0.1 mol/L,pH6.86)洗涤菌体两次,接种于9 mL 人工模拟胃液中,以PBS 缓冲液作为对照,37 ℃恒温培养2 h 后进行浓度梯度稀释,于37 ℃条件下恒温倒置培养48 h 后测定活菌数。
1.2.7.6 菌株对人工模拟肠液的耐受性 另取1 mL经人工模拟胃液处理的菌液于9 mL 人工模拟肠液中处理8 h,每隔2 h 取样测定其活菌数[20]。
1.2.8 航天育种乳酸菌EPS 的抗致病菌生物被膜活性的测定 致病菌的活化:以2%的接种量将金黄色葡萄球菌、单增生李斯特菌、大肠杆菌和铜绿假单胞菌分别接种在LB 液体培养基中,37 ℃,150 r/min 活化两代备用。
根据Wang 等[21]的方法稍作修改。用新鲜的LB培养基活化致病菌菌株并梯度稀释至106CFU/mL,取100 μL 细菌培养物加入到96 孔板中,从1、2、4、8 mg/mL 的EPS 溶液中各取100 μL 加入到96 孔板中,37 ℃恒温静置培养24 h,以无菌水作为对照。24 h 后取浓度为0.9%的无菌生理盐水200 μL 冲洗两次除去培养基成分和浮游菌,将96 孔板放置于65 ℃恒温干燥箱中干燥固定,然后每孔加入200 μL浓度为0.1%结晶紫溶液对附着细胞进行染色5 min,用无菌水冲洗三次,在恒温干燥箱中彻底干燥,最后用200 μL 浓度为33%(v/v)的冰醋酸将与贴壁细胞结合的染料重新溶解10 min,并在595 nm 处测量每个孔的OD 值。按以下公式计算EPS 对致病菌生物被膜的抑制率:
式中,A0为无菌水作为对照的OD595nm值;At为不同浓度EPS 处理的OD595nm值。
1.2.9 乳酸菌EPS 的抗氧化活性的测定 用超纯水溶解EPS,分别配制不同浓度的EPS 溶液备用(0.5、1.0、2.0、4.0、8.0 mg/mL),以相同浓度的抗坏血酸(ascorbic acid,Vc)作为阳性对照。参照文献方法分别测定其对DPPH 自由基、羟自由基(·OH)、ABTS+自由基、超氧阴离子(O2-·)的清除能力和总还原力[22-25]。
1.2.10 EPS 对α-淀粉酶的抑制活性 用PBS 溶液将EPS 配制成一系列不同浓度的溶液(0.5、1.0、2.0、4.0、8.0 mg/mL)、α-淀粉酶溶液(1 U/mL)和1%(m/v)淀粉溶液。取不同浓度EPS 溶液与α-淀粉酶各100 μL 混合均匀,37 ℃加热5 min,加入100 μL淀粉溶液,37 ℃反应20 min,加入2 mL DNS 溶液终止反应,置于100 ℃沸水中5 min 显色,冷却后加2 mL 蒸馏水,测其OD540nm。以和样品相同浓度的阿卡波糖作为阳性对照。按下列公式计算EPS 对α-淀粉酶的抑制活性[26]:
式中A1:100 μL 淀粉酶+100 μL 淀粉溶液+2 mL DNS 试剂;A2:100 μL 淀粉溶液+2 mL DNS 试剂;A3:100 μL 淀粉酶+100 μL EPS 溶液+100 μL 淀粉溶液+2 mL DNS 试剂;A4:100 μL EPS 溶液+100 μL淀粉溶液+2 mL DNS 试剂。
1.2.11 EPS 对α-葡萄糖苷酶的抑制活性 用PBS 缓冲液将EPS 配制成一系列不同浓度的溶液(0.5、1.0、2.0、4.0、8.0 mg/mL)、pNPG 溶液(10 mmol/L)和α-葡萄糖苷酶溶液(1 U/mL),使用蒸馏水配制1 mol/L Na2CO3溶液。A1:90 μL PBS 溶液+20 μLα-葡萄糖苷酶溶液;A2:110 μL PBS 溶液;A3:80 μL PBS 溶液+20 μLα-葡萄糖苷酶溶液+10 μL EPS 溶液;A4:100 μL PBS 溶液+10 μL EPS 溶液。在96 孔板中分别加入200 μL 上述各溶液,37 ℃预热30 min 后加入pNPG 50 μL,置于37 ℃恒温箱,反应60 min 后,加入100 μL Na2CO3溶液终止反应,测其OD405nm。以和样品相同浓度的阿卡波糖作为阳性对照。按以下公式计算EPS 对α-葡萄糖苷酶的抑制活性[26]:
式中,A1为空白组吸光度;A2为空白对照组吸光度;A3为样品组吸光度;A4为样品对照组吸光度。
1.3 数据处理
每组实验重复三次,实验结果以均值±标准差(Means±SD)表示。表格利用Excel 软件绘制,其余图表使用Graphpad prism 8.0 绘制,数据采用IBM SPSS Statistics 25.0 软件进行统计学分析,P<0.05 表示差异具有统计学意义。
2 结果与分析
2.1 诱变菌株产EPS 含量测定
以无水葡萄糖制作标准曲线,得标准曲线方程y=0.00069x+0.0845,R2=0.9992。分别测定了100 株诱变菌株的EPS 产量,部分菌株的产量见表1,其中诱变菌株L21-50、L21-1、L21-42、L21-37、L21-49、L21-47、L21-41、L21-44 的EPS 产量较原始菌株提高较明显。
表1 L21 的部分诱变菌株的EPS 产量(±SD,n=4)Table 1 EPS productions of some mutant strains of L21(±SD, n=4)
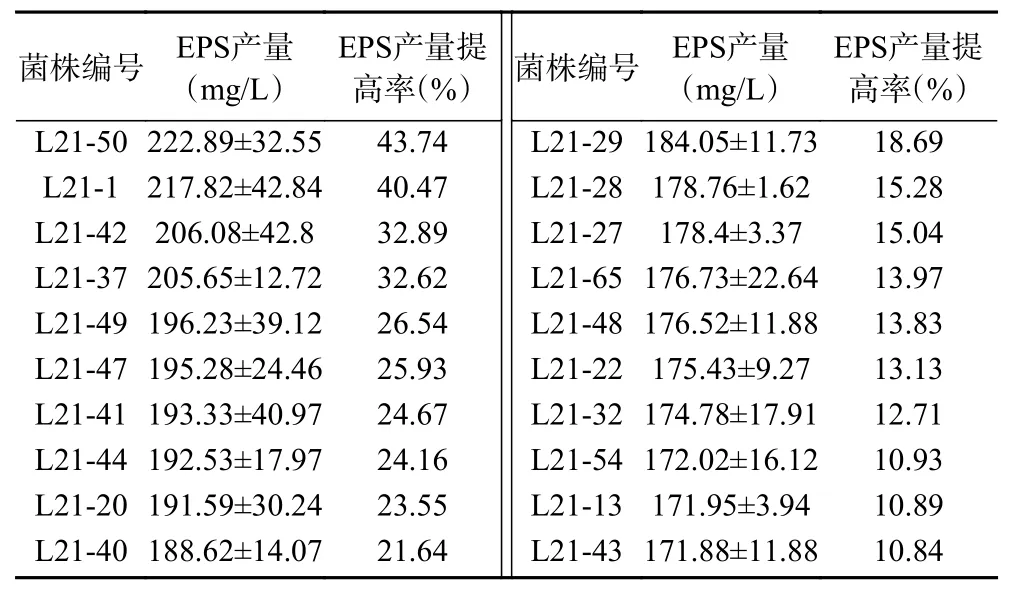
表1 L21 的部分诱变菌株的EPS 产量(±SD,n=4)Table 1 EPS productions of some mutant strains of L21(±SD, n=4)
?
2.2 诱变菌株的遗传稳定性
如图1 所示,在产量较高的诱变菌株中,L21-49在传代过程中EPS 产量稳定且无显著性差异(P>0.05),故选取L21-49 诱变菌株进行后续实验。
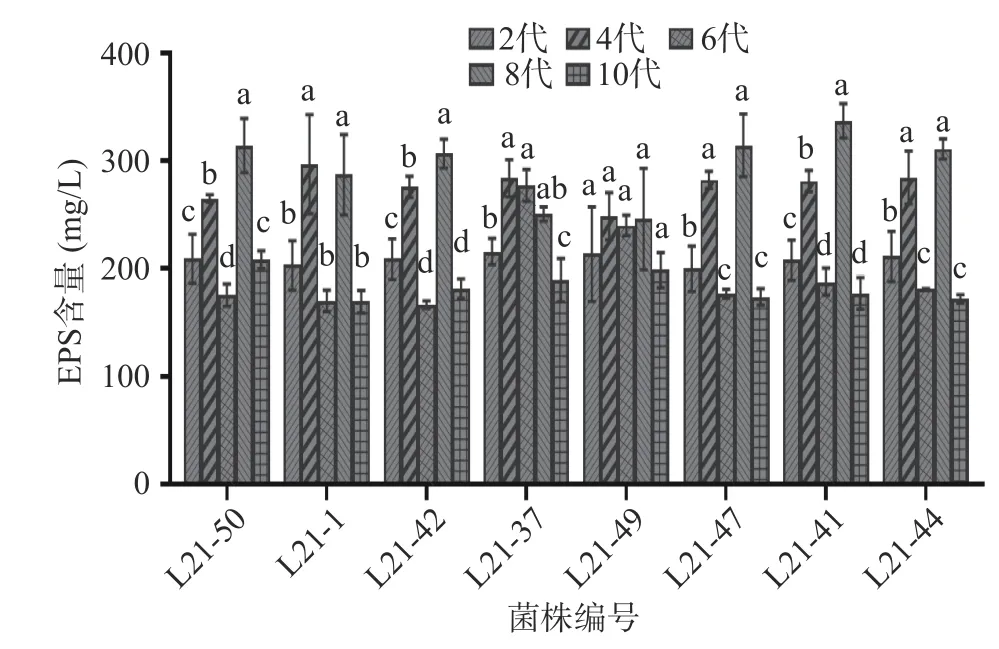
图1 突变菌株产EPS 的稳定性Fig.1 Stabilities of EPS productions of the mutant strains
2.3 高产胞外多糖航天诱变菌株的性能分析
2.3.1 菌体自凝聚性、表面疏水性 乳酸菌能否成为优势菌在肠道中定植并充分发挥益生功能关键取决于其黏附性[27]。自凝聚力能使菌株定植于宿主肠道,确保益生菌在肠道中达到高细胞密度,有助于粘附,使得乳酸菌黏附在肠道细胞实现定植和免疫调节。图2A 可知,乳酸菌的自凝聚率会随着时间的推移逐步提高,6 h 时两菌株的自聚率显著提高(P<0.05);在10 h 时,L21-49 自聚率最高,为29.36%,L21自聚率为24.04%。结果表明,航天诱变提高了乳酸菌的自凝聚力,更有利于菌株在人体肠道中黏附。此结果与张俊[28]的研究结果一致,他将从甘南传统牦牛奶中分离筛选出来的副干酪乳杆菌M5 经重离子束诱变后,所得的突变菌株与原始菌株相比,自凝聚力提高了20.1%,疏水性则无明显差异。
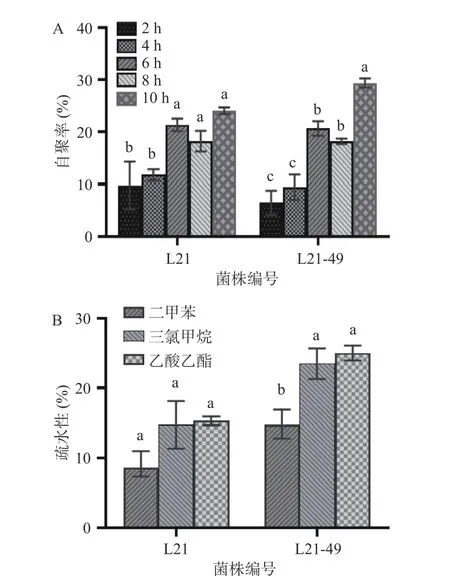
图2 乳酸菌菌体自聚性(A)和表面疏水性(B)Fig.2 Self coagulation (A) and surface hydrophobicity (B) of the LAB strains
细胞表面疏水性可以改善微生物和人类上皮细胞之间的相互作用[29]。疏水率>50%时为高疏水性菌株;20%<疏水率<50%时为中疏水菌株;疏水率<20%为低疏水性菌株[30]。从图2B 可以看出,L21为低疏水性菌株,但L21-49 的疏水性有所提高,对于中性溶剂二甲苯仍为低疏水性菌株,对于酸性溶剂三氯甲烷和碱性溶剂乙酸乙酯,则成为了中疏水性菌株。说明航天育种提高了原始菌株的疏水性。但文鹏程等[31]研究航天诱变副干酪乳杆菌A-4-2 时发现,突变菌株与野生菌株相比,表面疏水性显著降低(P<0.05),考虑到有可能是因为菌株的差异以及复杂的太空环境导致的菌株突变方向有所不同所致。
2.3.2 乳酸菌耐受性 要想在肠道中发挥益生特性,益生菌必须经过胃肠环境,因此首先需要具有酸和胆汁耐受性才能在肠道中存活。如图3A 所示,pH 为4 时,L21 及突变菌株的活菌数在108CFU/mL,随pH 下降,活菌数减少,在pH 为2、3 时,均保持在107CFU/mL。原始菌株与变异株无明显差异,均具有较强耐酸性。
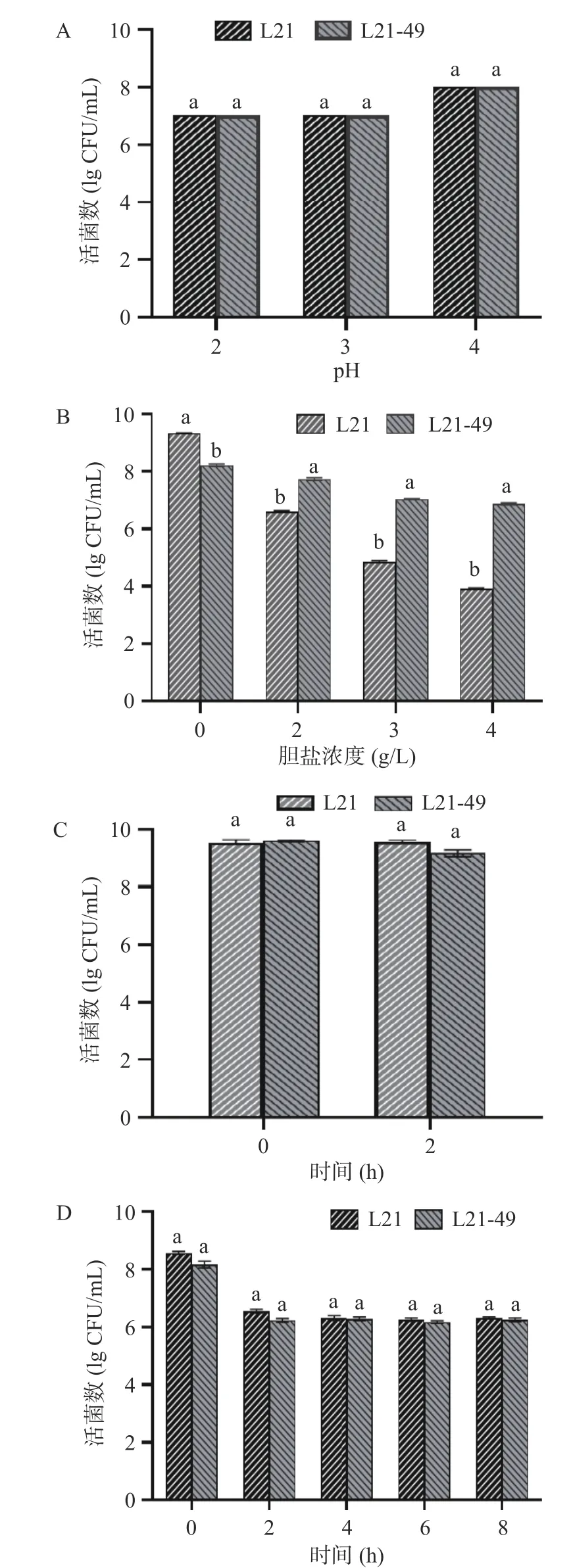
图3 乳酸菌耐受性Fig.3 Tolerances of the LAB strains
乳酸菌对于胆盐的耐受压力主要是来自于胆囊在十二指肠处分泌的胆汁。如图3B 所示,L21 在胆盐浓度为2.00、3.00、4.00 g/L 时,活菌数逐渐下降,而其突变株的活菌数均保持在107CFU/mL。可见诱变菌株的胆盐耐受性提升了。有研究表明,乳酸菌在高浓度胆盐刺激下,会更多地产生胞外多糖从而形成保护,使乳酸菌对胆盐更加具有耐受性[32]。
考虑到人体消化道的连续性,乳酸菌必须经过连续的胃液与肠液的考验。如图3C 和图3D 所示,2 株菌在经过人工模拟胃液处理2 h 后活菌数均保持在108~109CFU/mL。取经过胃液处理的菌液再经2 h 肠液处理后,L21 及其突变株的活菌数从108CFU/mL 下降到106CFU/mL,随着时间的延长,活菌数均维持在106CFU/mL。
由结果可知,突变菌株与原始菌株相比,耐酸及耐人工模拟胃肠液性能并未受到影响,耐胆盐性能有所提升。文鹏程等[31]研究发现,经航天诱变的副干酪乳杆菌与原始菌株相比,耐酸能力有所提高,耐胆盐和产胞外多糖能力与野生菌株均无显著差异(P>0.05)。卢承蓉等[16]对高产胞外多糖的乳酸菌进行紫外诱变,发现诱变菌株的耐酸性、耐胆盐、耐人工模拟胃肠液性能均稍优于原始菌株。这说明菌株突变存在不定向性和随机性,但就本文来说,航空诱变未影响菌株耐酸和耐人工模拟胃肠液等性能,还提高了菌株耐胆盐能力。
2.4 乳酸菌EPS 的抗致病菌生物被膜活性
分析2 株菌的EPS 对2 种革兰氏阳性致病菌(金黄色葡萄菌和单增生李斯特菌)和2 种革兰氏阴性致病菌(大肠杆菌和铜绿假单胞菌)的生物被膜的抑制作用,结果如图4 所示。L21 和L21-49 的EPS对4 种菌的生物被膜抑制率皆随着EPS 浓度的升高而升高,诱变菌株与原始菌株抑制率无显著差异。总的来说,乳酸菌菌株L21 与L21-49 的EPS 对单增李斯特菌生物被膜的抑制率高于其他致病菌。这与Bai 等[32]的研究结果部分一致,EPS 对革兰氏阳性菌和革兰氏阴性菌生物被膜的抑制能力呈剂量依赖增加,乳酸菌所产EPS 在2 mg/mL 时,对单增李斯特菌和肠链球菌生物被膜形成能力具有较强抑制作用,抑制率分别为55.28%和55.18%。Lakra 等[33]研究发现,魏斯氏乳酸菌所产EPS 对金黄色葡萄球菌、单增李斯特菌、肠沙门氏菌和伤寒沙门氏菌具有明显的抗生物被膜活性。
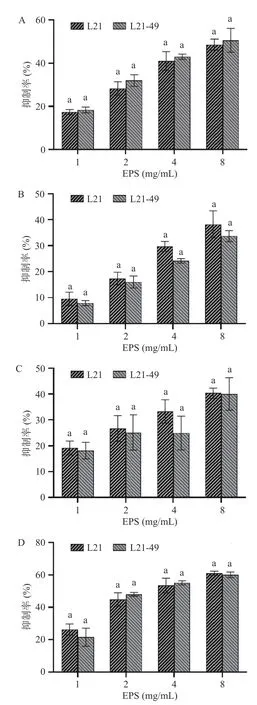
图4 乳酸菌EPS 抗生物被膜活性Fig.4 Anti-biofilm activities of the LAB EPS
2.5 乳酸菌EPS 的抗氧化活性
高氧水平会导致体内活性氧(ROS)的形成,包括超氧阴离子()、过氧化氢(H2O2)和高活性羟基自由基(·OH)[34]。ROS 积累后会引起氧化应激,从而导致蛋白质、DNA 和脂质受损,甚至导致细胞死亡[35]。在本研究中,分析了乳酸菌EPS 对DPPH、OH、ABTS+和自由基清除能力以及总还原能力,以VC作为阳性对照(图5)。
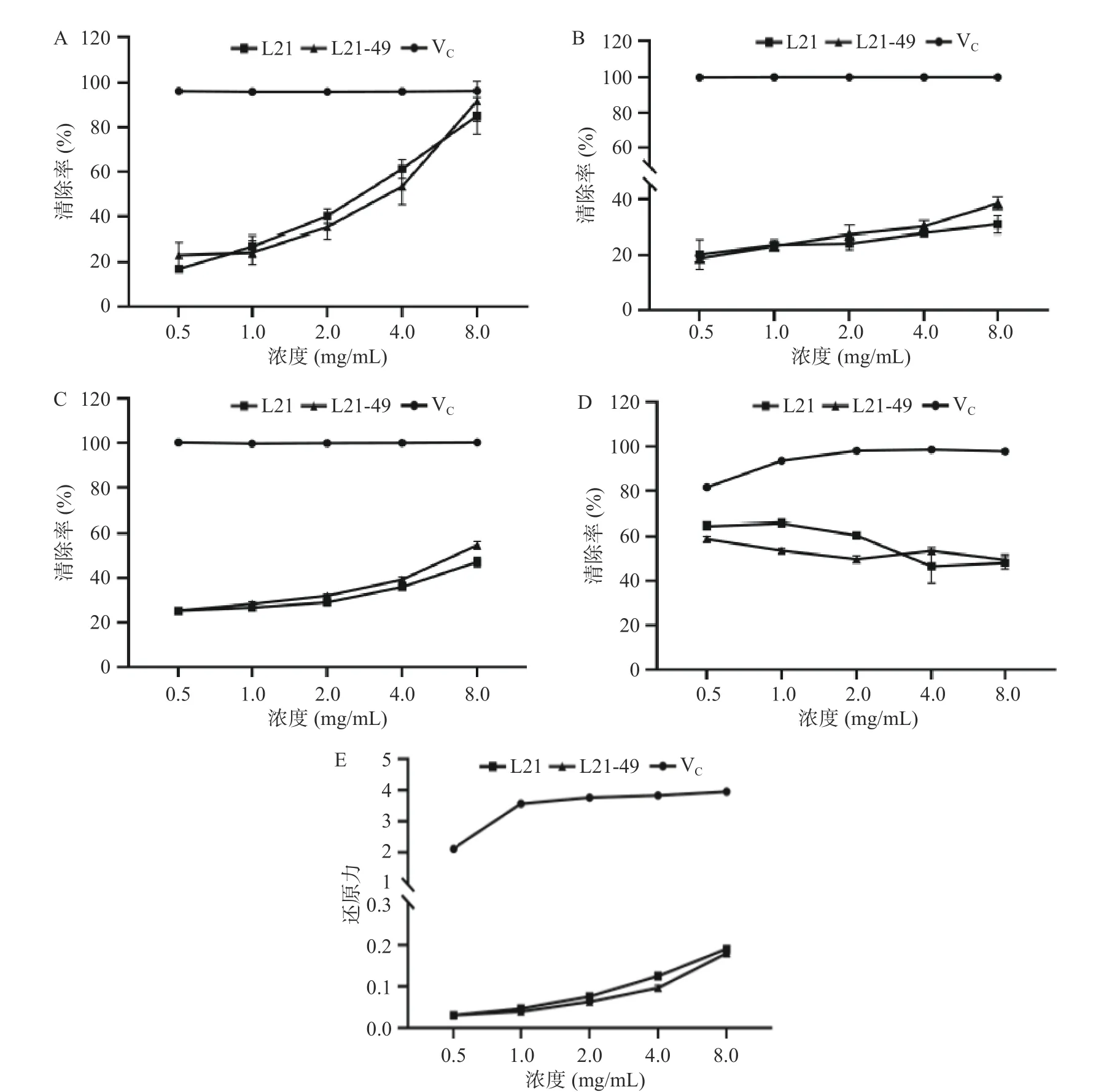
图5 乳酸菌EPS 的抗氧化活性Fig.5 Antioxidant activities of the LAB EPS
DPPH 自由基在有机溶剂中相对稳定,因此常常作为评价抗氧化剂对于体外抗氧化活性评价的模型。随着EPS 浓度的升高,其对DPPH 自由基的清除率有着明显的浓度依赖性。在EPS 浓度为0.5~8.0 mg/mL 时,L21 和L21-49 的EPS 对DPPH 清除率分别为16.99%~85.15%和23.20%~91.75%。赵丹等[36]报道假肠膜明串珠菌HDL-3 胞外多糖(5.0 mg/mL)对DPPH 自由基的清除率为36.58%±1.04%。方伟等[37]研究发现,发酵乳杆菌CECT 5716的EPS 的浓度为8.0 mg/mL 时,对DPPH 自由基的清除率为(84.17±1.30)%。本研究结果优于赵丹等[36],与方伟等[37]相似。航天诱变前后乳酸菌EPS 均展现了较好的DPPH 自由基清除能力,当浓度为8.0 mg/mL时,L21-49 清除DPPH 活性稍高一些,但总体上诱变菌株与原始菌株清除率之间没有显著差异。
·OH 在体内新陈代谢中活性最强毒性最大,会与体内细胞造成很严重的氧化损伤,因此·OH 也被用于评价抗氧化活性。EPS 对·OH 的清除率有着一定的浓度依赖性。在EPS 浓度为0.5~8.0 mg/mL 时,L21 和L21-49 的EPS 对·OH 清除率分别为20.20%~30.82%和18.74%~38.44%。EPS 最高浓度时L21-49 清除·OH 活性较优于L21,诱变菌株与原始菌株清除率之间没有显著差异。
ABTS+自由基清除模型也是评价体外抗氧化剂抗氧化活性的重要指标之一。随着EPS 浓度的升高,对ABTS+自由基的清除率也存在一定的浓度依赖性。在EPS 浓度为0.5~8.0 mg/mL 时,L21 和L21-49 的EPS 对ABTS+自由基清除率分别为25.21%~47.11%和25.32%~54.71%。EPS 浓度为8.00 mg/mL时,诱变菌株与原始菌株EPS 的清除率之间没有显著差异。卢承蓉等[16]发现副干酪乳杆菌L15、L15U2-26 产EPS 对ABTS+自由基的清除率分别为12.87%~71.79%、10.73%~76.25%。诱变前后菌株EPS 的清除率也无明显差异;方伟等[37]研究发现发酵乳杆菌CECT 5716 的EPS(8.0 mg/mL)对ABTS+自由基的清除率为(35.37±1.24)%。本研究结果优于其结果。
抗氧化剂的抗氧化能力是与总还原能力之间存在一定的相关性,因此可以把乳酸菌EPS 的总还原能力作为评价其抗氧化性活性的指标。随着EPS 浓度的升高,EPS 总还原力也存在浓度依赖性。L21-49 与L21 的EPS 的总还原力相差不大,但相同浓度下,乳酸菌EPS 的总还原能力显著低于VC,原因可能是EPS 作为大分子,还原末端比较少[39]。
总体来看,航天诱变并未影响菌株EPS 的抗氧化能力,两菌株EPS 对几种自由基的清除效果是:DPPH 自由基>O2-自由基>ABTS+自由基>OH 自由基。L21 与L21-49 的EPS 都具有良好的体外抗氧化活性,且两者抗氧化效果并未出现明显差异,考虑到航天诱变可能并未改变菌株EPS 结构,而只是提升其产EPS 的能力。
2.6 乳酸菌EPS 对α-淀粉酶和α-葡萄糖苷酶的抑制效果
人体食用的碳水化合物类物质通常最先在口腔中被α-淀粉酶分解成寡糖片段,随后在小肠内被α-葡萄糖苷酶分解,得到的葡萄糖进入血液中使得血糖水平上升[40]。本研究通过乳酸菌EPS 对α-淀粉酶和α-葡萄糖苷酶的抑制效果来评价其体外降血糖活性,结果如图6 所示。2 株乳酸菌EPS 对α-淀粉酶的抑制能力呈一定的浓度依赖性,L21 和L21-49 的EPS 在浓度为8.00 mg/mL 时的抑制率分别为22.97%和23.52%,但与阿卡波糖相比,乳酸菌EPS 的抑制活性较弱。有研究表明在8.0 mg/mL 浓度下,植物乳杆菌HY 和BR2 产EPS 对α-淀粉酶的抑制率分别为26.06%和21.88%[41-42],也远低于阿卡波糖降血糖活性。对于α-葡萄糖苷酶抑制率,2 株菌EPS也随着浓度的升高而增加,在浓度为8.0 mg/mL 时的抑制率分别为50.16%和51.15%,无显著差异。张宇[43]研究发现,副干酪乳杆菌胞外多糖对α-葡萄糖苷酶具有抑制作用,其LPP-2 组分在浓度为1.6 mg/mL时,抑制率最高,为57.36%,与本文结果相似。本研究证明乳酸片球菌L21 及诱变菌株具有一定的体外降血糖潜力,但对于其在体内的降血糖效果还需要进一步研究。
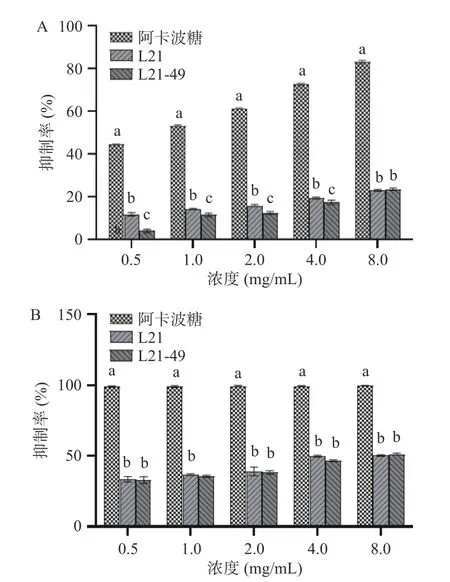
图6 乳酸菌EPS 的降血糖活性Fig.6 Hypoglycemic activities of the LAB EPS
3 结论
本研究对乳酸片球菌L21 的航天诱变菌株进行EPS 产量及遗传稳定性分析,筛选得到1 株高产EPS 且遗传稳定的突变菌株L21-49,其EPS 产量较出发菌株产量提高了26.54%。L21-49 具有较强的自聚性、疏水性、耐受酸及人工胃肠液的益生特性,并且在高浓度胆盐的环境下依然存活。L21-49 的EPS 对DPPH·、ABTS+·、·OH、O2-·均有一定的清除作用,总还原力较高,具有良好的体外抗氧化能力;对金黄色葡萄球菌、单增李斯特菌等致病菌的生物被膜具有抑制作用;具有一定的抑制α-淀粉酶、α-葡萄糖苷酶活力。
本文通过航天诱变技术对乳酸菌进行诱变,从中筛选高产 EPS 的乳酸片球菌并考察其益生性能,为扩大乳酸菌的综合利用,以及使其EPS 成为一种多功能活性物质提供参考依据。后续还需进一步分析诱变菌株的性能,并探究EPS 的结构以及其与功能活性的关系。
