长治地区清香型大曲理化特性与细菌类群的关联性分析
2023-08-25龙树瑺葛东颖蔡文超刘忠军宋子赟郭千璋
龙树瑺,葛东颖,蔡文超,刘忠军,宋子赟,郭千璋,郭 壮,
(1.湖北文理学院湖北省食品配料工程技术研究中心,湖北襄阳 441053;2.襄阳市酿酒生物技术与应用企校联合创新中心,湖北襄阳 441053;3.清香型白酒生物技术襄阳市重点实验室,湖北襄阳 441053;4.山西老雄山酒业有限公司,山西长治 047100)
由于酿造时使用的酒曲类型不同,清香型白酒通常分为大曲清香、小曲清香和麸曲清香,其中大曲清香型白酒选用以大麦和豌豆制成的大曲为糖化发酵剂,在3 类酒曲酿造的白酒中具有最佳的品质[1]。清香型大曲蕴含丰富的微生物类群和酶系,在白酒酿造过程中提供了酒体风味和风味的前体物质[2],大曲品质好坏对酒体的优劣具有较大影响,因而具有“曲乃酒之骨”的说法,如何提升清香型大曲的品质是酿酒行业科研人员比较关心的问题。具有丰富经验的科研人员,通常从外观、断面、曲皮厚和曲香等维度对大曲进行感官鉴评[3],结合大曲液化力、发酵力、酯化力、糖化力和酒化力的理化分析结果,对大曲品质进行综合评价[4]。清香型大曲的微生物类群亦与其品质存在较大的关联性,Hou 等[5]研究发现清香型大曲中糖多孢菌属(Saccharopolyspora)与糖化力呈显著负相关,而黄单胞菌属(Xanthomonas)与发酵力和酯化力呈显著正相关,可见解析不同微生物与理化性质的关联性对提升清香型大曲的品质具有一定积极作用。
Illumina Miseq 测序技术在清香型大曲细菌类群的解析中被广泛地应用[6]。周森等[7]对北京、山西、台湾、黑龙江和河北等地的清香型大曲微生物类群进行研究,结果发现不同地区出产的大曲中乳酸菌和芽孢杆菌数量之间存在较大差异且不具有规律性,因而对不同地区清香型大曲中特有微生物类群进行解析和甄别,对于清香型白酒品质的提升具有积极的作用。清香型白酒以汾酒为代表,长治市有许多企业从事清香型大曲和白酒的制作和酿造,然而目前关于长治地区清香型大曲理化特性与细菌类群关联性研究的报道尚少。
本研究对山西长治地区清香型大曲的理化指标进行测定,采用Illumina Miseq 测序技术对其细菌类群进行解析,在此基础上揭示清香型大曲理化指标与细菌类群的相关性,为清香型大曲微生物类群的解析和品质提升提供数据支持和理论支撑。
1 材料与方法
1.1 材料与仪器
清香型大曲 采集于山西省长治市长治县(东经113°02′19′′~113°09′51′,北纬35°52′45′~35°57′00′′之间),随机采取同一批次生产的11 个样品,记为LXS1~LXS11。样品采集时所有的大曲均在库房储藏了3 个月左右,以大麦和豌豆为原料制作而成,属于青茬清香型大曲,制曲温度为40~50 ℃;PCA 培养基 青岛海博生物技术有限公司;引物338F/806R 武汉天一辉远生物科技有限公司;Illumina MiSeq 测序配套试剂 美国Illumina 公司。
K9860 全自动凯氏定氮仪 中国海能公司;HE53 型水分测定仪 梅特勒-托利多国际贸易(上海)有限公司;VSA 动态水蒸汽吸附分析仪 美国AquaLAB 公司;MiSeq PE250 高通量测序平台 美国Illumina 公司;R930 机架式服务器 美国Dell 公司。
1.2 实验方法
1.2.1 清香型大曲理化指标的检测 清香型大曲的酸度、氨基酸态氮、灰分、水分、淀粉、液化力、发酵力、酯化力、糖化力和酒化力均参照轻工行业标准QB/T 4257-2011《酿酒大曲通用分析方法》进行测定;蛋白质含量参照GB/T 5009.5-2010《食品中蛋白质的测定》中的凯氏定氮法进行测定;水分活度采用水分活度仪进行测定。
1.2.2 清香型大曲细菌Illumina MiSeq 测序 使用试剂盒提取清香型大曲中微生物的基因组DNA[8],以338F/806R 为引物进行PCR 扩增[9],扩增产物由上海美吉生物医药科技有限公司完成高通量测序。
1.2.3 生物信息学分析 去除返回序列中的核苷酸标签与引物,参照王玉荣等[10]的方法对序列进行质控,使用QIIME(V1.9.1)分析平台[11]进行PyNAST校准并对齐序列[12],根据97%相似度进行分类操作单元(Operational taxonomic units,OTU)的划分[13]。使用ChimeraSlayer 检查剔除含嵌合体的OTU[14],通过与Greengenes 数据库比对明确各分类学地位[15]。
1.3 数据处理
使用Graph Pad Prism9 软件绘制样品各理化指标的小提琴图;使用R 软件(v4.1.2)的“reshape2”和“ggplot2”包绘制气泡图、“UpSetR”包绘制Upset 图和“waterfall”包绘制瀑布图;使用Cytoscape 软件(v3.7.2)绘制相关性网络图。
2 结果与分析
2.1 长治地区清香型大曲理化指标分析
大曲理化性质可以反映自身的属性和发酵特性。本研究采用理化分析方法,对长治地区11 个清香型大曲样品的水分活度、酸度、氨基酸态氮、灰分、水分、蛋白质和淀粉的含量进行分析,结果如图1所示。
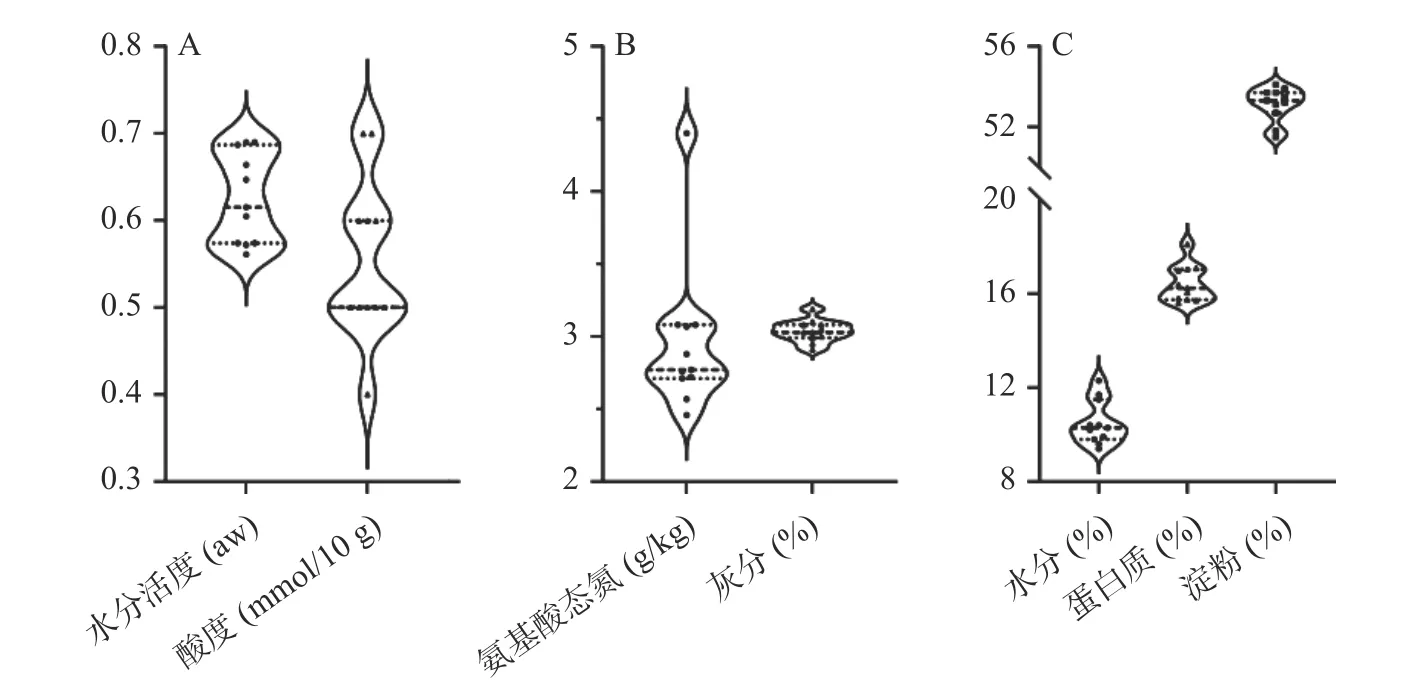
图1 清香型大曲的理化指标Fig.1 Physicochemical indexes of fen-flavor Daqu
由图1 可知,11 个清香型大曲水分活度的范围为0.561~0.690,变异系数为8.29%;酸度的范围在0.4~0.7 mmol/10 g,变异系数为13.09%;氨基酸态氮的含量范围为2.46~4.40 g/kg,变异系数为17.58%;灰分的含量范围为2.91%~3.19%,变异系数为2.54%;水分的含量范围为9.4%~12.3%,变异系数为8.83%;蛋白质的含量范围为15.601%~18.107%,变异系数为4.78%;淀粉的含量范围为51.5%~54.1%,变异系数为1.60%。由于氨基酸态氮的变异系数大于15%,表明纳入本研究的11 个清香型大曲在氨基酸态氮上存在较大的差异。氨基酸态氮是大曲生香力的重要指标,Zhao 等[16]的研究表明,Bacillus是参与白酒发酵的主要功能性细菌,该属的细菌可分泌淀粉酶和蛋白酶等水解酶,这些水解酶将淀粉和蛋白质等大分子转化为葡萄糖和氨基酸,进而产生各种风味前体物质,有助于白酒风味的形成,而酸度的形成主要来自产酸微生物的有机酸代谢以及脂肪、淀粉和蛋白质的降解[17]。由此推测,纳入本研究的清香型大曲在氨基酸态氮和酸度上存在明显差异的原因,可能与其蕴含的微生物类群有关。
大曲的酶活性亦是反映大曲品质的重要生化指标,进一步对清香型大曲的液化力、发酵力、酯化力、糖化力和酒化力进行了测定,结果如图2 所示。
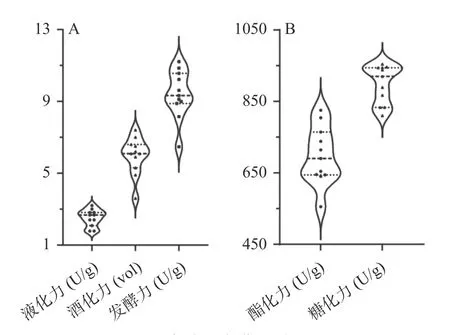
图2 清香型大曲的酶活性Fig.2 Enzymatic activity of fen-flavor Daqu
由图2 可知,纳入本研究的11 个清香型大曲样品的液化力范围在1.78~3.20 U/g,变异系数为18.84%;发酵力范围在6.47~11.21 U/g,变异系数为14.34%;酯化力范围在555~825 U/g,变异系数为11.55%;糖化力范围在810~954 U/g,变异系数为5.99%;酒化力范围在3.6~7.4 vol,变异系数为17.47%。虽然纳入本研究的11 个清香型大曲在液化力和酒化力上存在较为明显的差异,但其酶活均符合大曲的质量标准[18]。Wu 等[19]的研究表明随着大曲中芽孢杆菌含量的增加,其液化力显著提高,Tang 等[20]的研究发现除了酵母菌与大曲的酒化力密切相关外,Saccharopolyspora、高温放线菌属(Thermoactinomyces)和戊糖片球菌属(Pediococcus)等细菌与酒化力亦呈正相关。由此可见,清香型大曲的细菌菌群组成与其酶活力可能也存在一定的关联性。
2.2 长治地区清香型大曲的测序信息及α 多样性分析
对清香型大曲的细菌总数进行了计数,细菌总数的范围为7.06~7.46 lg CFU/g。采用Illumina MiSeq高通量测序技术对11 个清香型大曲的细菌类群结构进行了解析,整理测序结果如表1 所示。
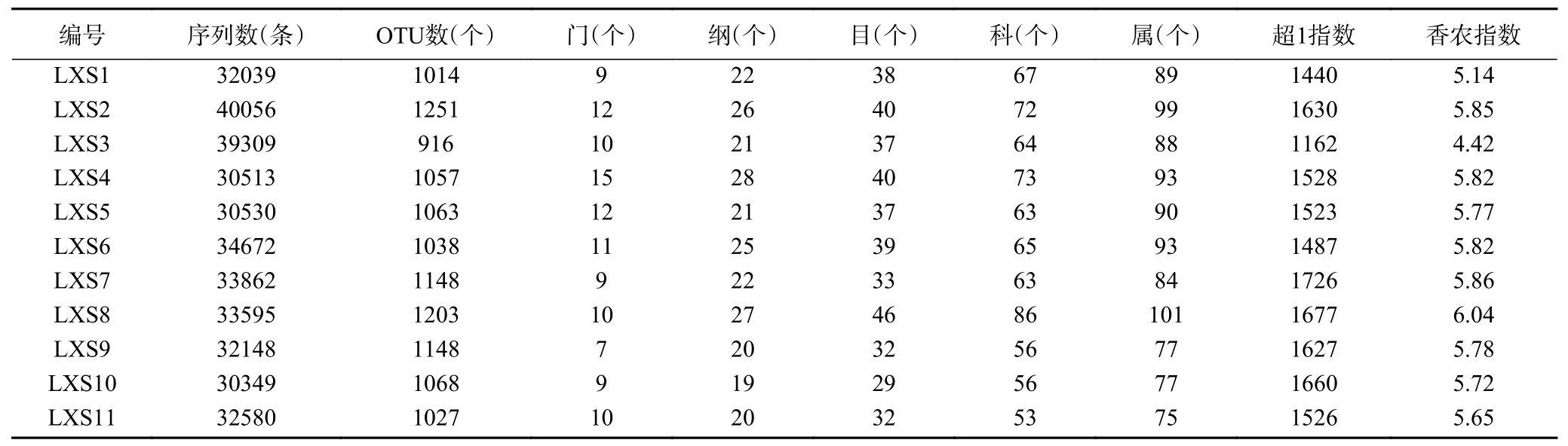
表1 清香型大曲测序结果及各分类地位数量Table 1 Sequencing results and the number of each taxonomic classification of fen-flavor Daqu
由表1 可知,通过质控后共获得369653 条高质量序列,平均每个样品33604 条序列,经97%的相似性划分后共获得11933 个OTU,比对所有序列后共划分为22 个门、48 个纲、85 个目、160 个科和277 个属,其中鉴定不到门和属的序列仅有0.22%和7.73%。通过α多样性分析可知,在11 个清香型大曲中样品LXS7 的超1 指数最大,而样品LXS8的香农指数最大,这表明样品LXS7 的细菌类群丰度更高,而样品LXS8 的细菌类群多样性更高,产生这种现象的原因可能是在踩曲等环节的人工接种或环境中微生物的自然接种等方面使得不同样品在微生物组成和含量上存在些许差异。
2.3 长治地区清香型大曲细菌类群的解析
将在11 个清香型大曲中均存在、平均相对含量大于1.0%的细菌门、属和OTU 定位为核心优势细菌门、属和OTU,绘制核心优势细菌门和属的气泡图如图3 所示。
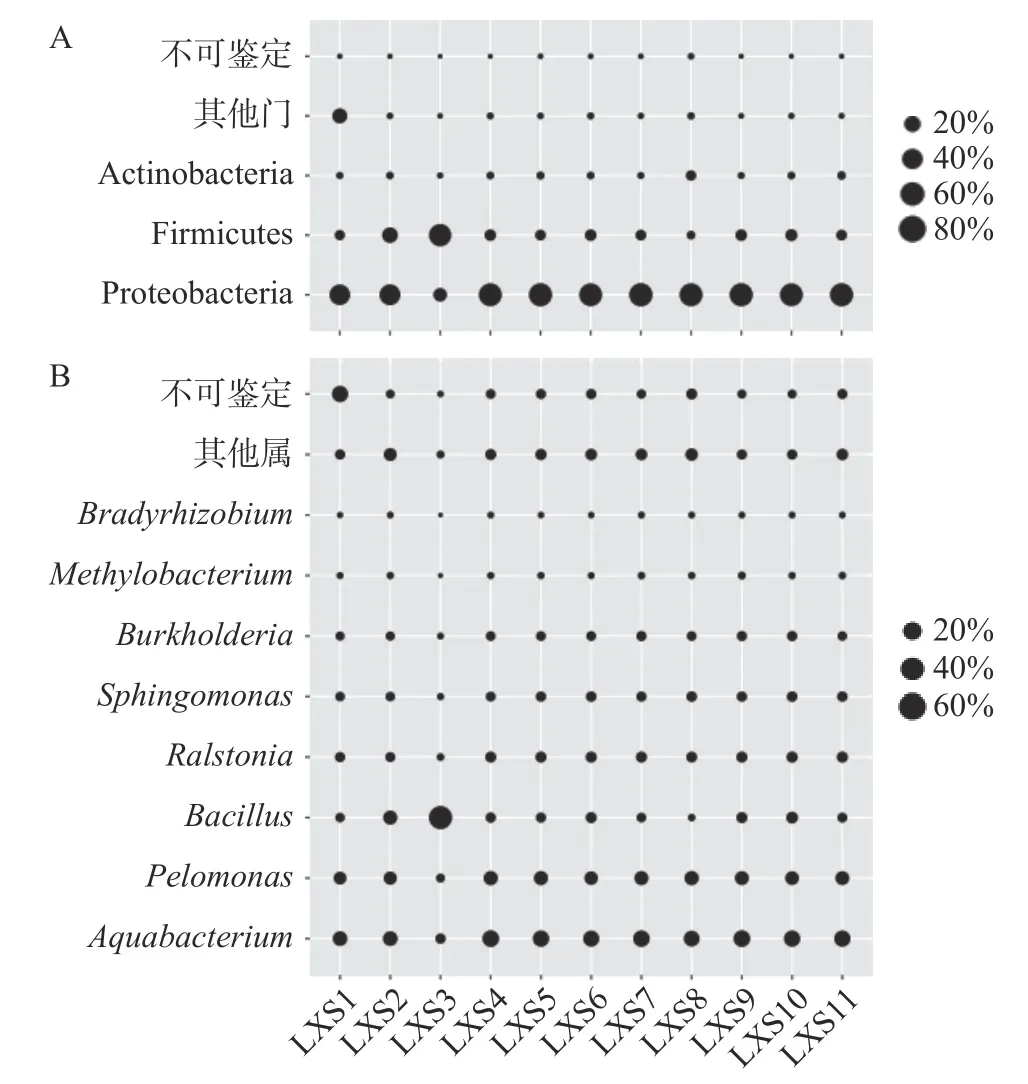
图3 清香型大曲中核心优势细菌门(A)和属(B)的气泡图Fig.3 Bubble diagram of core dominant bacteria phylum (A)and genus (B) in fen-flavor Daqu
由图3 可知,清香型大曲中3 个核心优势细菌门为变形菌门(Proteobacteria,76.07%)、厚壁菌门(Firmicutes,17.81%)和放线菌门(Actinobacteria,2.64%),8 个核心优势细菌属为水杆菌属(Aquabacterium,27.30%)、嗜糖假单胞菌属(Pelomonas,17.56%)、芽孢杆菌属(Bacillus,14.77%)、雷尔氏菌属(Ralstonia,8.20%)、鞘脂单胞菌属(Sphingomonas,6.52%)、伯克氏菌属(Burkholderia,5.47%)、甲基杆菌属(Methylobacterium,1.77%)和慢生根瘤菌属(Bradyrhizobium,1.14%)。Cai 等[21]亦采用高通量测序的方法对采集自湖北省襄阳市的30 个清香型大曲的细菌类群进行了解析,结果发现优势细菌属为Bacillus(54.26%)、链霉菌属(Streptomyces,11.47%)、Saccharopolyspora(11.34%)、乳酸杆菌属(Lactobacillus,6.56%)和Thermoactinomyces(1.53%)。虽然两个地区的清香型大曲微生物类群具有较大区别,但Bacillus均为两个地区的共有优势细菌属。因能产生芽胞且具有牢固的抗逆性和环境适应性,Bacillus在发酵过程中通过美拉德反应代谢产生的游离氨基酸增加了白酒独特的香味,是参与白酒酿造的主要功能性细菌[4]。清香型白酒品质讲究“一清到底”,然而本研究发现大曲中除含有Bacillus外,亦含有大量Aquabacterium和Pelomonas,复杂的细菌类群是否会对清香型白酒的“清”这一品质产生影响值得深入研究。Xia 等[22]的研究表明隶属于Aquabacterium的细菌可以产生葡聚糖分支酶并参与微生物的厌氧消化过程,这可能有助于白酒发酵系统中的碳循环,但其对白酒品质的影响尚需进一步研究揭示。He 等[23]的研究表明人工接种贝莱斯芽孢杆菌(Bacillus velezensis)和枯草芽孢杆菌(Bacillus subtilis)后增加了大曲中细菌特别是乳酸菌的含量,并且大曲的液化力、糖化力和酯化力亦有显著提高。在踩曲等环节人工强化接种Bacillus,对提高清香型大曲的品质可能具有积极意义。
进一步对OTU 在各样品中的分布及核心优势OTU 进行了分析,结果如图4 所示。
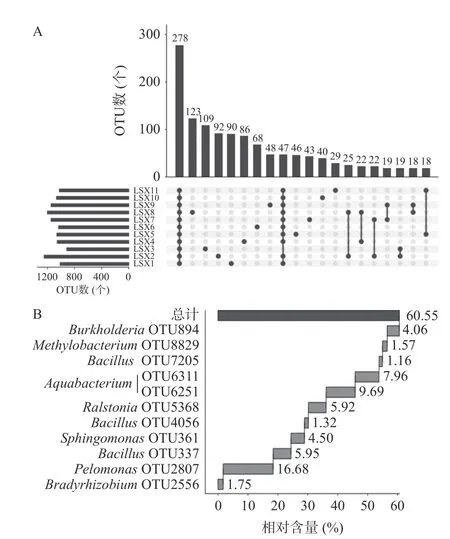
图4 基于OTU 的Upset 分析(A)与核心优势OTU 的瀑布图(B)Fig.4 Upset analysis based on OTU (A) and waterfall diagram of core advantage OTU (B)
由图4 可知,在11 个清香型大曲中均存在的OTU 有278 个,包含的序列数为297348 条,占质控合格序列的80.44%,而其中核心优势OTU 仅有11 个,分别为隶属于Bacillus的OTU337、OTU4056和OTU7205,隶属于Aquabacterium的OTU6251和OTU6311,隶属于Pelomonas的OTU2807,隶属于Ralstonia的OTU5368,隶属于Sphingomonas的OTU361,隶属于Burkholderia的OTU894,隶属于Bradyrhizobium的OTU2556 和隶属于Methylobacterium的OTU8829。由此可见,纳入本研究的样品中存在大量的共有细菌类群,且主要由Bacillus、Aqu-abacterium、Pelomonas、Ralstonia、Sphingomonas、Burkholderia、Bradyrhizobium和Methylobacterium组成。
2.4 长治地区清香型大曲理化特性和细菌类群的相关性分析
在对清香型大曲理化指标和微生物类群进行测定和解析的基础上,进一步对两者的相关性进行研究,两者相关性的网络图如图5 所示。
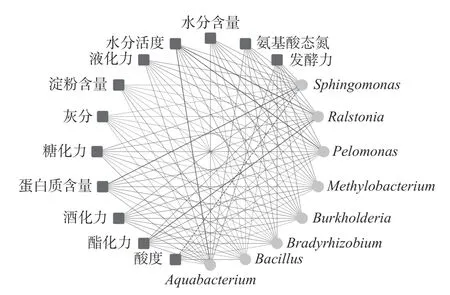
图5 清香型大曲中核心优势细菌属与理化性质的相关性网络图Fig.5 Correlation network diagram of core dominant bacterial genera and physicochemical properties in fen-flavor Daqu
由图5 可知,清香型大曲中核心优势细菌属与各理化指标之间存在63 个正相关和33 个负相关,但仅6 组指标间的相关性具有统计学意义(P<0.05),其中Sphingomonas与蛋白质含量呈显著正相关(P<0.05),而与酸度呈显著负相关(P<0.05),Ralstonia与水分活度和酯化力均呈显著正相关(P<0.05),Pelomonas和Aquabacterium与水分活度均呈显著正相关(P<0.05)。Sphingomonas作为白酒发酵过程中的稀有微生物,Zhang 等[24]的研究发现其通常来源于原料和酿造环境中的空气,与白酒中丁二酸二乙酯和己酸乙酯等香气物质呈正相关。Xu 等[25]的研究表明Ralstonia可以利用H2O、CO2和甲酸生成异丁醇,异丁醇等某些醇类是白酒中芳香和后味的过渡桥梁。
3 结论
虽然长治地区清香型大曲样品间存在大量隶属于Aquabacterium、Pelomonas、Bacillus、Ralstonia、Sphingomonas、Burkholderia、Methylobacterium和Bradyrhizobium等的共有细菌类群,但不同样品在氨基酸态氮、液化力和酒化力上存在较大的差异,并且Sphingomonas与蛋白质含量呈显著正相关且与酸度呈显著负相关(P<0.05),Ralstonia与水分活度和酯化力均呈显著正相关,Pelomonas和Aquabacterium与水分活度均呈显著正相关(P<0.05),后续研究中进一步揭示这些菌群与酒曲品质的共变性,对提升清香型大曲的品质可能具有积极意义。
