共存抗坏血酸下明胶对花色苷稳定性的影响及机理研究
2023-08-25由耀辉冯治平
马 静,李 丽,由耀辉,冯治平,
(1.四川轻化工大学生物工程学院,四川宜宾 644000;2.内江师范学院沱江流域特色农业资源四川省科技资源共享服务平台,四川内江 641000;3.内江师范学院果类废弃物资源化四川省高等学校重点实验室,四川内江 641000)
花色苷是果蔬饮料中重要的功能成分,在赋予饮料鲜艳色泽的同时,还具有抗炎、抗氧化、抗肿瘤等多种生物活性[1-2]。抗坏血酸(Vitamin C,VC)与花色苷常共存在果蔬饮料中,二者极易发生相互作用,加速花色苷的降解,导致果蔬饮料的色泽褪变,严重影响产品品质[3-4]。迄今,关于VC加速花色苷降解的原因尚未取得共识,被广泛接受的主流假说有两种:一是“氧化假说”,即VC的氧化产物促进花色苷降解[5];二是“缩合假说”,即VC直接与花色苷发生缩合反应[6]。
目前,提高花色苷结构稳定性的方法主要分为两大类:一是对花色苷分子结构进行修饰[7-8];二是通过大分子负载,使花色苷和大分子之间以氢键、疏水作用、静电作用等次级键结合[9-11]。其中,添加蛋白质是提高花色苷稳定性的有效方法之一,在提高花色苷稳定性的同时,还可以赋予食品额外的营养价值。Türkyılmaz 等[12]发现脯氨酸和花色苷之间的相互作用可以保护花色苷免受VC及其降解产物的降解。Ren 等[10]发现乳清蛋白的加入可以提高含VC饮料中花青素的稳定性,使紫玉米和葡萄花青素半衰期延长约2 倍,黑胡萝卜花青素半衰期延长约1.31 倍。Zang 等[11]发现在含VC的加速实验中,乳清蛋白分离物和牛血清白蛋白对花色苷都有不同程度的保护作用。Chung 等[13]发现L-色氨酸通过氢键和疏水作用与花色苷相互结合,使含VC模拟饮料中花色苷的半衰期从2 d 提高到6 d。目前的报道多为乳清蛋白、牛血清蛋白、酪蛋白与花色苷的研究[14-15],且这些蛋白质多数只溶于碱性环境下,而果汁饮料多为酸性环境,因此存在一定的局限性。明胶作为一类胶原蛋白衍生物,主要来源于动物骨、皮等结缔组织[16],具有成本低,来源广泛、易于加工、无毒性等特点,常用于食品、医药、包装[17-18]等领域。明胶在酸性环境下有较好的溶解性,有望通过氢键、疏水作用、静电作用等次级键与花色苷形成复合物,进而增强花色苷稳定性。然而,目前鲜有关于明胶对花色苷稳定性的研究,更无在VC-花色苷共存体系下的相关报道。
基于此,本文在含VC的模拟饮料条件下研究明胶对矢车菊-3-O-葡萄糖苷(Cyanidin-3-O-glucoside,C3G)贮存稳定性的影响,通过荧光光谱和分子对接等方法对明胶与VC及明胶与C3G 之间相互作用的结合能力、作用力及作用位点进行了研究,深入分析在VC存在下明胶对花色苷稳定性的保护机制,以期为提高果汁饮料中花色苷稳定性提供理论依据和技术支撑。
1 材料与方法
1.1 材料与仪器
矢车菊-3-O-葡萄糖苷标准品 中原植提标准品经销中心;明胶 国药集团;抗坏血酸、山梨酸钾 上海泰坦科技有限公司;其它常规试剂均为分析纯。
UV2000 紫外可见分光光度计 舜宇恒平;F-4600 荧光分光光度计 日立公司。
1.2 实验方法
1.2.1 模拟果汁饮料体系制备 模拟果汁饮料的制备参照Chung 等[13]的方法并略加修改。用去离子水配制0.1 g/L 的C3G 溶液(含0.3 g/L 的VC和0.1 g/L山梨酸钾)。用去离子水分别配制0、0.05、0.1、0.5、1、2 g/L 的明胶溶液,用磁力搅拌器在50 ℃的水浴中300 r/min 搅拌30 min,使明胶充分溶解。然后将C3G 溶液与明胶溶液按体积比1:1 比例混合,用0.1 mol/L,pH3.0 柠檬酸缓冲溶液调pH 为4,最终得到的模拟果汁饮料体系包含C3G 0.05 g/L、VC0.15 g/L、山梨酸钾0.05 g/L 以及不同质量浓度明胶(0、0.025、0.05、0.25、0.5、1 g/L)。无VC果汁饮料体系除不加VC外,其余配方比例参照上述方法。
1.2.2 贮存稳定性研究 贮存稳定性实验根据Jiang 等[19]的方法并进行适当修改。将上述溶液在30 ℃下避光保存,定期取样测量花色苷的含量,按公式(1)计算降解率,每组实验平行3 次。花色苷含量采用pH 示差法测定[20]:分别取2 mL 待测样,用pH1.0 氯化钾缓冲溶液和pH4.5 醋酸钠缓冲溶液将样品稀释至10 mL,平衡20 min,以纯水为空白,分别测定样液在波长512 nm 和700 nm 处吸光度,按公式(2)计算花色苷含量:
式中:C0表示C3G 的初始浓度,mg/L;Ct表示t d时样品中C3G 的浓度,mg/L;A 为样品的吸光度;M为矢车菊-3-O-葡萄糖苷相对分子质量,484.82 g/mol;DF 为稀释倍数;ε为矢车菊-3-O-葡萄糖苷的摩尔消光系数,26900 L/mol·cm;L 为光程,1.0 cm。
1.2.3 花色苷降解动力学分析 通常,花色苷的降解可运用一级反应动力学模型分析[21]。按公式(3)、(4)计算一级反应速率(k)和半衰期(t1/2)。
式中:C0表示C3G 的初始浓度,mg/L;Ct表示t d时样品中C3G 的浓度,mg/L;k 为降解速率,h-1;t1/2表示花色苷浓度下降一半所需的时间,h。
1.2.4 荧光光谱分析 荧光分析实验参照Li 等[1]方法并略加修改。固定明胶浓度为0.5 g/L,在300、310、320 K 条件下分别测定明胶在不同浓度C3G( 0、 1.03×10-5、 2.06×10-5、 3.09×10-5、 4.12×10-5、5.15×10-5、6.18×10-5mol/L)或是不同浓度VC(0、0.28×10-4、0.56×10-4、1.13×10-4、2.27×10-4、4.54×10-4、9.08×10-4mol/L)作用下的荧光光谱。设置激发波长为280 nm,发射波长为300~450 nm,激发和发射狭缝均为5 nm。
1.2.5 分子对接 采用AutoDock Vina1.1.2 进行分子对接。选择I 型胶原蛋白(PDB ID:5K31)作为明胶模型物,用Pymol2.3.0 去除蛋白结晶水、原始配体等,将蛋白结构导入AutoDocktools(v1.5.6)进行加氢、计算电荷、分配电荷、指定原子类型等处理。从PubChem 数据库下载C3G、VC的3D 结构,导入ChemBio3D Ultra 14.0 进行能量最小化,将优化好的小分子导入AutodockTools-1.5.6 进行加氢、计算电荷、分配电荷等处理。最后利用PyMOL2.3.0 对对接结果进行相互作用模式分析。
1.3 数据处理
所有试验均重复3 次,结果以平均值±标准差表示,采用Origin 8.5 绘制图表,使用SPSS 20.0 进行差异显著性分析,显著性水平P<0.05。
2 结果与分析
2.1 VC 存在下明胶对C3G 贮存稳定性的影响
由图1(a)、(b)可知,随着贮存时间的延长,每组中C3G 的降解率都在不断增加,但添加了明胶组的C3G 降解率均低于对照组,说明明胶的加入减缓了花色苷的降解,贮存7 d 后,明胶质量浓度为0.025、0.05 g/L 组的C3G 降解率与对照组无显著差异(P>0.05),随着明胶质量浓度的增加,与对照组相比,明胶显著降低了C3G 的降解率(P<0.05)。特别是明胶质量浓度为0.5 g/L 的体系中,在贮存7 d 后C3G 的降解率为55.95%,而相同条件下对照组C3G 的降解率为75.86%。这可能是明胶与C3G 形成了复合物,而复合物的形成能将C3G 吡咯环的C2 位置所遮蔽,防止了开环及查尔酮的形成,从而提高了C3G 的稳定性[22]。
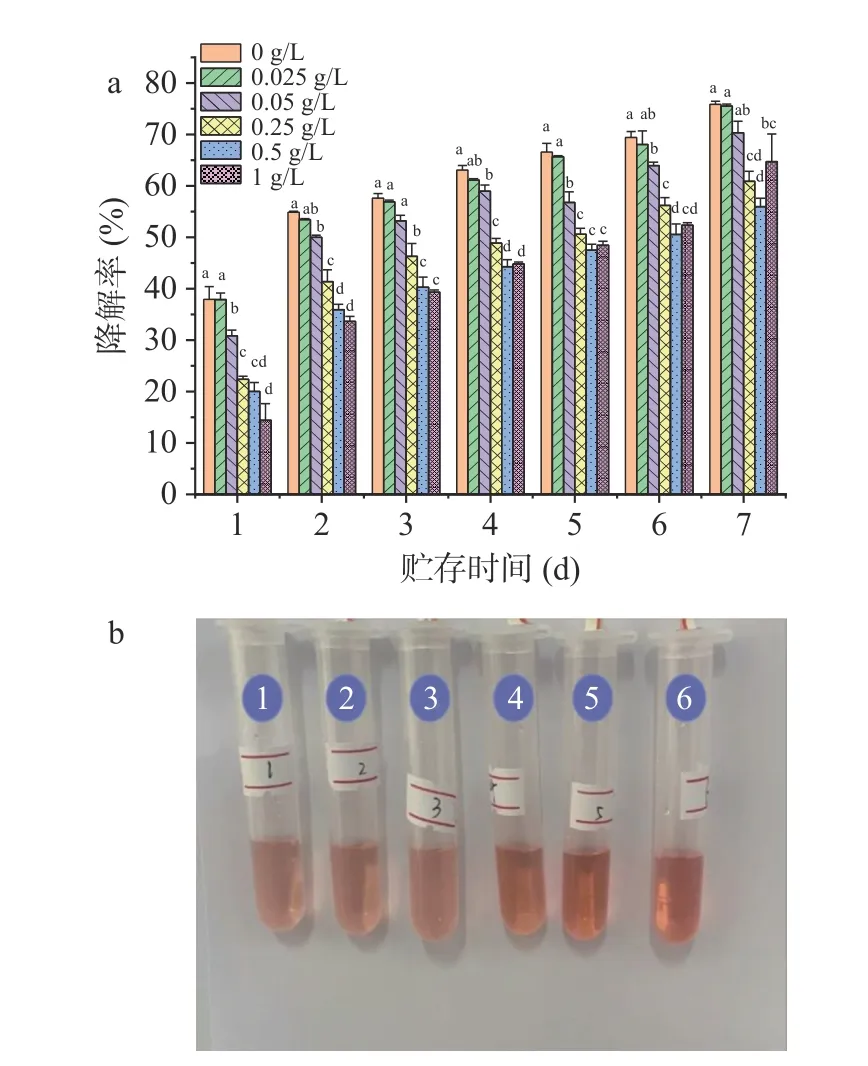
图1 含VC 模拟饮料中不同明胶浓度对C3G贮存稳定性的影响Fig.1 Effects of different gelatin concentrations in simulated beverages containing VC on the storage stability of C3G
2.2 无VC 条件下明胶对C3G 贮存稳定性的影响
在无VC的模拟饮料中,C3G 的降解率也随时间的延长而不断的增加,但在相同贮存时间内无VC中C3G 的降解率明显低于VC存在下C3G 的降解率,说明VC的存在促进了C3G 的降解。在贮存7 d 后,添加了明胶组的C3G 的降解率均高于对照组,说明在无VC存在下明胶不能提高C3G 的稳定性。明胶只在VC存在下对C3G 的降解具有保护作用,因此进一步推测明胶与VC竞争结合C3G 形成复合物,降低了VC对C3G 的可及性,从而提高了C3G 稳定性。之前的研究也有类似的报道,Chung 等[23]研究发现加热变性的乳清蛋白(WP)能显著提高紫胡萝卜花色苷(ACN)在VC存在下的稳定性,并且通过荧光猝灭研究发现ACN 与WP 通过氢键形成的相互作用强于VC与WP 的相互作用,WP 的加入增加了WP 与ACN 相互作用,从而降低了VC对ACN 的有效性。因此,在后面的实验中进一步研究了明胶与C3G 及明胶与VC之间的相互作用。
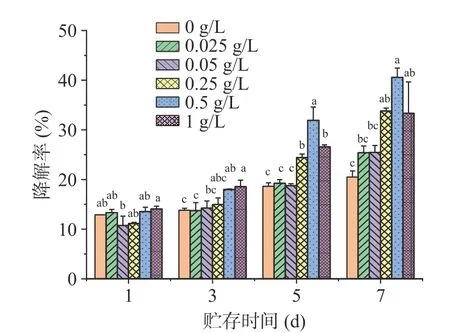
图2 无VC 条件下明胶对C3G 贮存稳定性的影响Fig.2 Effect of gelatin on storage stability of C3G in the absence of VC
2.3 VC 条件下C3G 降解动力学
由表1 可知,模拟饮料体系下,C3G 的降解符合一级动力学(R2>0.9),这与他人的研究结果一致[24-25]。添加了明胶体系中的C3G 的半衰期均有所提高,表明明胶对C3G 在贮存过程中具有一定的保护作用,当明胶质量浓度在0.025~0.5 g/L 范围内时,随着明胶质量浓度的增加C3G 降解速率随之降低,半衰期随之增加,其中明胶质量浓度为0.5 g/L 的体系中C3G 的半衰期相较于对照组提高了70 h。这可能是当明胶质量浓度较低时,由于VC浓度较高C3G 可能更容易与VC结合,但随着明胶质量浓度的增加,C3G 与明胶的作用力增强,从而降低了C3G 降解率,增加了C3G 的半衰期[10]。当明胶质量浓度增加到0.5 g/L 时,明胶与C3G 之间的相互作用可能达到了一种饱和状态,所以增加明胶的浓度对C3G 的降解不再起抑制作用。
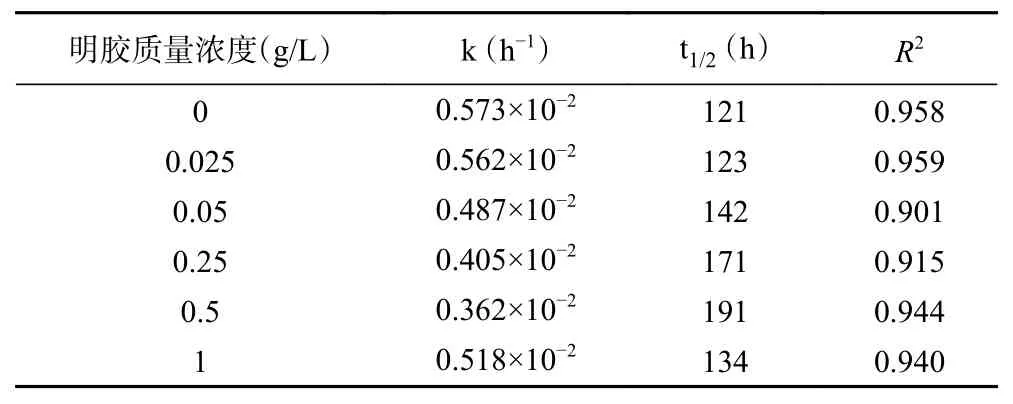
表1 不同浓度明胶处理下C3G 降解动力学参数Table 1 Degradation kinetic parameters of C3G under different concentrations of gelatin
2.4 C3G 或VC 对明胶荧光光谱的影响
蛋白质中的发色团为色氨酸、酪氨酸、苯丙氨酸,它们因为生色基团的不同分别在348、303、282 nm 波长处出现荧光峰[26],可用于研究蛋白质与小分子物质之间的相互作用。构成明胶的氨基酸有18 种,由于不存在色氨酸,且苯丙氨酸残基的荧光极弱且易被猝灭,所以明胶的内源荧光主要来自于酪氨酸[27]。
从图3 可以看出,明胶在313 nm 处有最大发射波长,随着C3G 或VC浓度的不断增加,明胶在313 nm处的荧光强度呈现有规律的降低,这一结果说明C3G 和 VC均与明胶之间发生了相互作用,且明胶的最大发射波长发生了不同程度的红移,这可能是C3G 或VC与明胶中亲水的侧链残基之间发生了相互作用,导致明胶分子中酪氨酸残基所处的微环境及分子构象行为发生变化,使所处环境的极性增强,疏水性降低,亲水性增强[28]。C3G 与VC是水溶性物质,可与蛋白质的亲水性侧链残基发生相互作用从而使得蛋白质的肽链变得更加伸展,从而使得蛋白质的构象发生变化[29]。
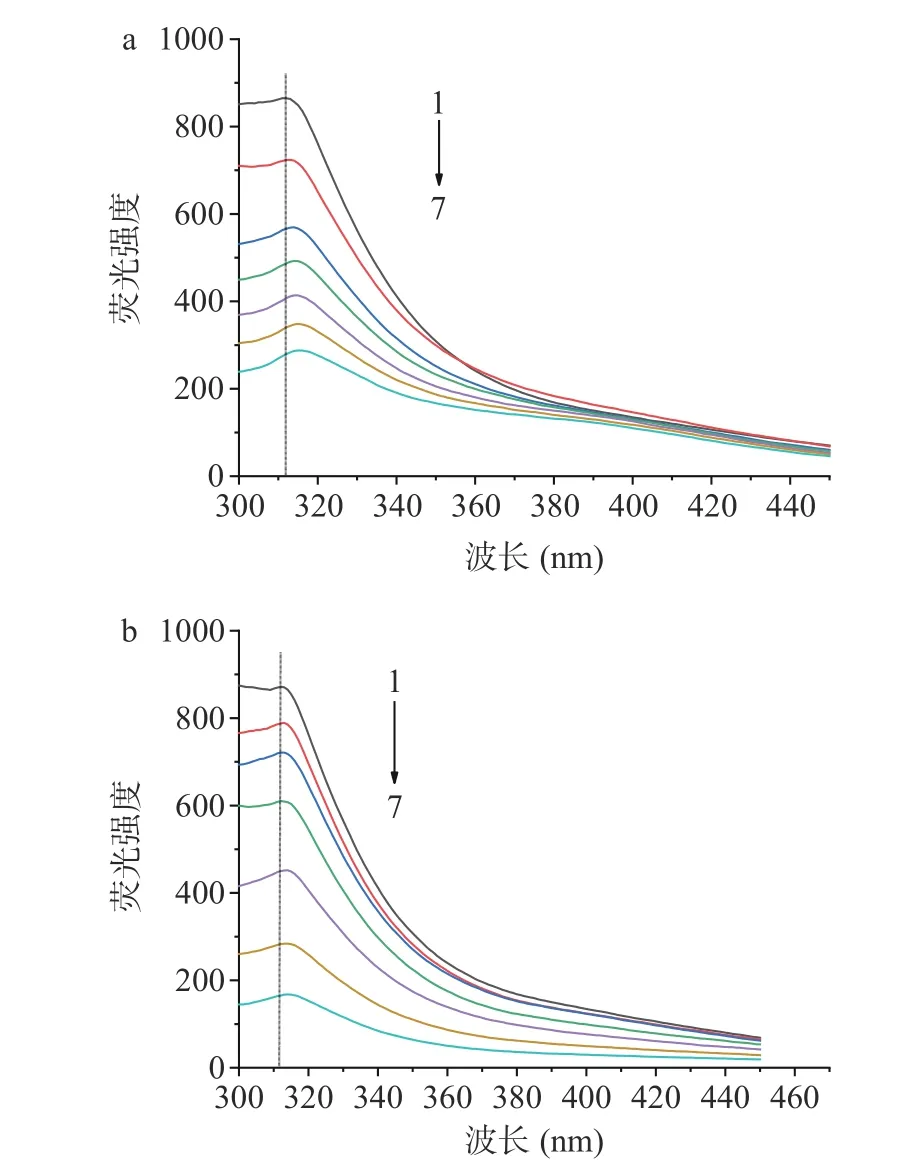
图3 不同浓度C3G(a)和VC(b)对明胶荧光光谱的影响Fig.3 Effect of different concentrations of C3G (a) and VC (b)on the fluorescence spectra of gelatin
2.5 C3G 与明胶相互作用的荧光猝灭机理研究
荧光猝灭可以分为由静态猝灭和动态猝灭,可以用Stern-Volmer 曲线来判断淬灭机理是静态还是动态[10]。
式中:F0为未加入C3G 时明胶的荧光强度;F 为加入C3G 时明胶的荧光强度;Kq为双分子猝灭速率常数(L/(mol·s));Ksv为猝灭常数(L/mol);[Q]为C3G 的摩尔浓度(mol/L);τ0为无C3G 时蛋白质的平均荧光寿命(一般认为平均寿命约为10-8s)[27]。各类荧光猝灭剂对生物大分子的最大猝灭常数约为2.0×1010L/(mol·s),若猝灭常数大于最大扩散猝灭速率常数,则猝灭可认为是静态猝灭;相反,则可以被认为是动态猝灭[30]。
根据式(5),以F0/F 为纵坐标,对[Q]进行线性拟合,绘制得图4,从而计算出C3G 与明胶相互作用的动态猝灭常数(Ksv)和生物大分子猝灭速率常数(Kq)。
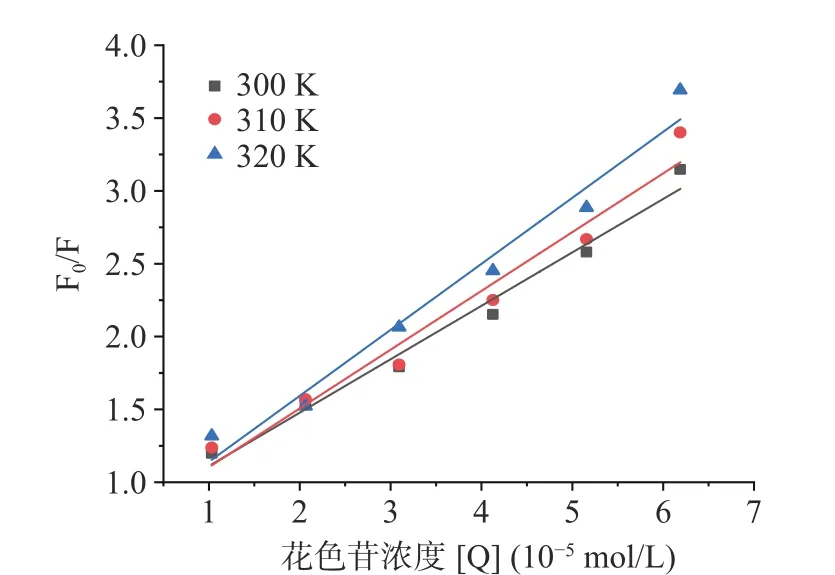
图4 不同温度条件下C3G 与明胶的Stern-Volmer 曲线图Fig.4 Stern-Volmer graph of C3G interacting with gelatin at different tempuratures
从图4 和表2 可以看出,F0/F 与[Q]具有很好的线性关系,所以C3G 与明胶只存在一种猝灭关系。对于动态猝灭而言,Ksv通常会随着温度的升高而增加;但对于静态猝灭,Ksv通常会随着温度的升高而减小,但有时也会存在增加的情况,它会受蛋白质和猝灭剂之间的相互作用力的影响[31]。本研究中随着温度升高,动态猝灭常数Ksv略有升高,但是明胶与C3G 相互作用的Kq值却远高于最大扩散猝灭速率常数(2.0×1010L/(mol·s)),说明C3G 对明胶的猝灭机理仍然是C3G 与明胶结合形成稳定复合物所引起的静态猝灭。
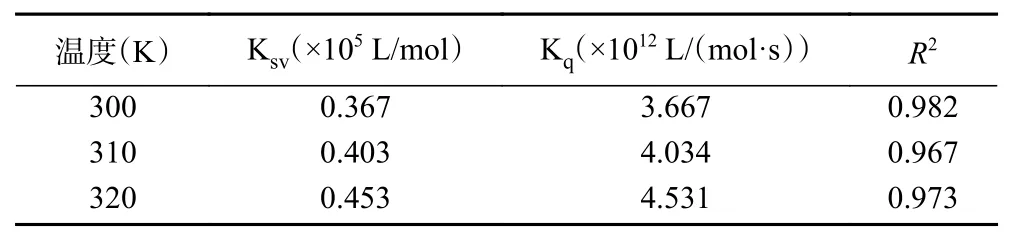
表2 不同温度条件下C3G 与明胶相互作用的猝灭常数Table 2 Quenching constants of the interaction between C3G and gelatin at different temperatures
2.6 VC 与明胶相互作用的荧光猝灭机理研究
VC与明胶相互作用的猝灭机理研究方法参照C3G 与明胶的方法。
根据式(5),以F0/F 为纵坐标,对[Q]进行线性拟合,绘制得图5,从而计算出VC与明胶相互作用的动态猝灭常数(Ksv)和生物大分子猝灭速率常数(Kq)。
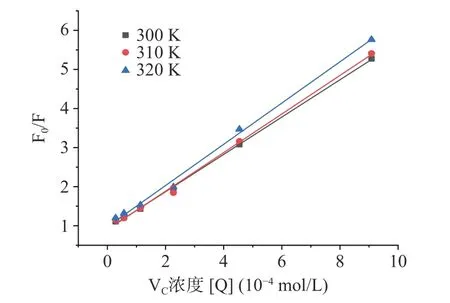
图5 不同温度条件下VC 与明胶的Stern-Volmer 曲线图Fig.5 Stern-Volmer graph of VC interacting with gelatin at different tempuratures
从图5 和表3 可以看出,F0/F 与[Q]具有很好的线性关系。随着温度升高,动态猝灭常数 Ksv略有升高,但是明胶与VC相互作用的Kq值比最大扩散猝灭速率常数(2.0×1010L/(mol·s))高出一个数量级,说明C3G 对明胶的猝灭机理是VC与明胶结合形成基态稳定复合物所引起的静态猝灭。与明胶-VC相比,明胶-C3G 的Ksv值更高,说明明胶与C3G 之间的作用力更强[30]。
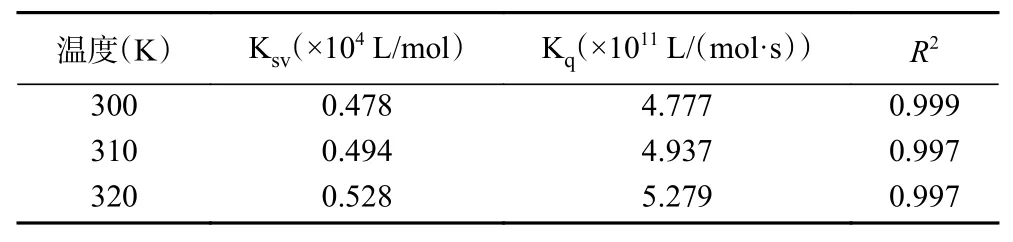
表3 不同温度条件下VC 与明胶相互作用的猝灭常数Table 3 Quenching constants of the interaction between VC and gelatin at different temperatures
2.7 分子对接
选择I 型胶原蛋白作为明胶的模型物与C3G、VC进行分子对接,结果如图6 所示。研究表明,当结合能小于0 时,表明受体蛋白与配体分子可自行结合;当结合能小于-4.0 kcal/mol 时,表明两者有一定的对接活性;当结合能小于-5.0 kcal/mol 时,对接活性较强;当结合能小于-7.0 kcal/mol 时,对接活性强烈[32]。因此,C3G 与明胶的结合能为-7.0 kcal/mol,证明具有较好的结合作用。VC与明胶的结合能为-5.4 kcal/mol,结合作用一般。这表明C3G 与明胶的结合能力强于VC与明胶的结合能力,与前文荧光光谱的研究结果一致。进一步分析二者作用力和作用位点发现,C3G 与明胶的作用力是氢键和疏水作用,在ARG-39 位点形成氢键,氢键的长度为2.4Å,在ILE-27、PRO-30、SER-29、PRO-37、ALA-38、ASP-43、ASP-59、GLN-62、ASN-65 位点形成疏水作用;抗坏血酸与明胶的作用力同样是氢键和疏水作用,在ALA-182、ALA-169、LEU-170 位点形成氢键,氢键的长度分别为2.2Å、2.5Å、2.8Å、2.1Å,在ARG-181、LEU-171、HIS-105 位点形成疏水作用。
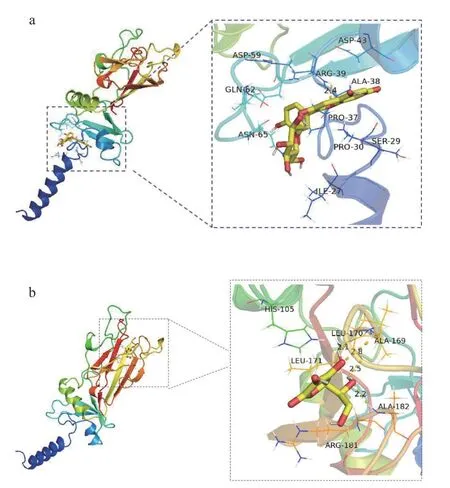
图6 C3G(a)和VC(b)与明胶分子对接图Fig.6 Docking diagram of C3G (a) and VC (b) with gelatin molecule
3 结论
研究表明VC的存在促进了C3G 的降解,而明胶的加入能有效抑制含VC模拟饮料中C3G 的降解,其中明胶质量浓度为0.5 g/L 的效果最好,可使C3G 的半衰期从121 h 延长至191 h。荧光分析表明,C3G 与 VC均能与明胶形成复合物从而导致明胶荧光发生静态猝灭,且C3G 与明胶的结合常数远大于VC与明胶的结合常数。分子对接也证实了明胶与C3G 的结合能力强于明胶与VC的结合能力,且两者与明胶的作用力都主要是氢键及疏水作用。因此推测明胶的加入增加了明胶与C3G 之间的相互作用,从而降低了VC对C3G 的降解作用,提高了C3G 的稳定性。本研究可延长含VC饮料中花色苷的贮存稳定性,对含有花色苷和VC的果汁饮料具有潜在的应用价值。
