pH 对箭筈豌豆白蛋白和球蛋白物化性质的影响
2023-08-25王宇慧张金凤李昊坤王立昊刘全兰
王宇慧,张金凤,李昊坤,王立昊,刘全兰,
(1.青岛科技大学海洋科学与生物工程学院,山东青岛 266045;2.中国海洋大学食品科学与生物工程学院,山东青岛 266003)
豆科(Leguminosae)植物可固定空气中的氮,在土壤养分循环中发挥着重要作用。同时,豆科植物蛋白是人类食品中蛋白的重要来源之一,它们已被越来越广泛地应用在食品加工的各个领域。箭筈豌豆(common vetch,Vicia sativaL.)是一年生牧草绿肥豆科植物,在我国四川、甘肃等省份被广泛种植。箭筈豌豆种子中蛋白含量高,除蛋氨酸外,其余必须氨基酸含量均远超过FAO/WHO 规定的成年人的需求量,优势氨基酸是天冬氨酸(10.03%~10.73%)和谷氨酸(16.78%~17.85%),精氨酸含量为8.69%~9.54%[1]。Ribeiro 等[2]的研究表明箭筈豌豆种子中白蛋白占粗蛋白含量的43.6%,球蛋白占50.8%。Chen 等[3]的研究表明箭筈豌豆种子中粗蛋白含量为27.70%~32.14%,其主要组成成分为白蛋白和球蛋白,白蛋白在粗蛋白中的含量为26.79%~56.12%,球蛋白的含量为22.78%~52.42%。箭筈豌豆蛋白在中性pH 下具有良好的溶解性、乳化性和起泡性,是一种具有潜力的天然食品乳化剂,可作为配料应用于饮料、肉制品和焙烤制品中[4]。但是对箭筈豌豆蛋白的研究并不多,对改性箭筈豌豆蛋白的研究报道更是较少见。
在食品中添加改性蛋白可以增强其功能特性[5],pH 处理是一种常见且效果显著的改性方法,这种方法不仅能改变蛋白质结构,还能改善其功能性质。如,米糠蛋白经过pH 碱性处理后,其二级结构由有序变为无序,这使得米糠蛋白的持油性得到显著改善[6];pH 处理可影响大豆11S 球蛋白的结构、蛋白溶解性:可使蛋白二级结构出现从β-折叠和无规卷曲向α-螺旋转变[7];黑豆分离蛋白在碱性条件下的溶解度更高,乳化稳定性也增加[8]。可见,当蛋白质暴露在不同pH 条件下时,其组成、表面疏水性等结构特征会发生变化,这可以显著改善植物蛋白的溶解性、乳化性、起泡性等功能性质。当前箭筈豌豆蛋白理化功能特性是在中性pH 条件下开展的研究,其结果具有一定的局限性。为了更好的将箭筈豌豆蛋白应用于食品行业,本文探索了箭筈豌豆主要储藏蛋白白蛋白和球蛋白在不同pH 下的物化性质变化,通过pH的变性调控以拓展和改善箭筈豌豆蛋白的功能性质,这可使箭筈豌豆蛋白更加适应市场需求,并使之逐渐成为一种新兴的植物蛋白。
本文采用红外光谱、荧光分光光度法、Zeta-电位、聚丙烯酰胺凝胶电泳等方法研究pH 对箭筈豌豆白蛋白和球蛋白结构和物化性质的影响,以期这些研究结果为箭筈豌豆蛋白在食品领域的应用提供数据支持。
1 材料与方法
1.1 材料与仪器
箭筈豌豆种子(川北) 四川本地品种;大豆油 山东鲁花集团有限公司;氢氧化钠、浓盐酸、氯化钠、牛血清蛋白、考马斯亮蓝G-250、十二烷基磺酸钠(SDS)、三羟甲基氨基甲烷(Tris)、丙烯酰胺、N,N’-甲叉双丙烯酰胺、四甲基乙二胺(TEMED)、过硫酸铵、甲醇、无水乙醇、冰醋酸 国药集团化学试剂有限公司;蛋白Marker、4×蛋白上样缓冲液(还原和非还原)、透析袋(MD77-14000)、考马斯亮蓝R-250北京索莱宝科技有限公司;1.8-苯胺萘磺酸盐(ANS)、甘氨酸 上海麦克林生化科技有限公司;所有试剂均为分析纯。
SIGMA 3K15 冷冻离心机 德国Sigma 公司;FD-1A-50 真空冷冻干燥机 上海比朗仪器有限公司;PHS-25 型数显pH 计 上海精密科学仪器有限公司;UV-2550 紫外分光度计 日本岛津公司;FJ-200 高速剪切机 上海标本模型厂;DYCZ-24A 型双垂直电泳仪 北京六一生物科技有限公司;TYYC-Ⅱ脱色摇床 无锡久平仪器有限公司;GelSMART凝胶成像系统 大龙兴创实验仪器;FL970 荧光分度计 上海泰科仪器有限公司;NanoZS90 动态光散射仪 英国Malvern 公司;VERTEX70 傅里叶变换红外光谱仪 德国Bruker 公司。
1.2 实验方法
1.2.1 CVAP 和CVGP 的制备 参考Osborne 分级分离法[9]并做适当修改。称取100 g 箭筈豌豆种子在25 ℃水浴2 h,待豆子泡软后加入500 mL 去离子水打浆,用220 目滤布滤出溶液并收集,室温下磁力搅拌4 h。之后在室温下6000×g 离心10 min,收集上清液,此时上清液中的蛋白质为箭筈豌豆白蛋白(CVAP)。将离心后的沉淀与500 mL 的5% NaCl混合,室温下磁力搅拌4 h,之后在室温下6000×g 离心10 min,收集上清,此时上清液中的蛋白质为箭筈豌豆球蛋白(CVGP)。得到的上清液均放置在4 ℃冰箱中冷沉过夜。后用1 mol/L HCl 调节pH(白蛋白上清液调节至pH3.5 左右,球蛋白上清液调节至pH4.5 左右),在4 ℃下8000×g 离心10 min,收集沉淀分散于去离子水中,并用1 mol/L NaOH 调pH至7.0。将蛋白溶液倒入透析袋中,在4 ℃下透析48 h,随后冷冻干燥,并将干燥后的蛋白样品(经凯氏定氮测定CVAP 纯度为69.15%,CVGP 纯度为93.66%)置于4 ℃冰箱中冷藏备用。
1.2.2 不同pH 下CVAP 和CVGP 的制备 分别配制1%(w/v)的CVAP 和CVGP 溶液,涡旋振荡10 min。分别用1 mol/L HCl 和1 mol/L NaOH 调节其为pH2.0、pH3.0、pH4.0、pH5.0、pH6.0、pH7.0、pH8.0、pH9.0、pH10.0、pH11.0、pH12.0、pH13.0(使用pH 计测定溶液pH)。配好的蛋白溶液在25 ℃磁力搅拌2 h 后,在室温下8000×g 离心10 min,取上清液备用。部分上清液冷冻干燥成固体样品,留做后续实验。
1.2.3 二级结构的测定 采用衰减全反射法(Attenuated Total Reflectance,ATR)[10]进行傅里叶变换红外光谱扫描分析,测定箭筈豌豆白蛋白和球蛋白的二级结构。冻干蛋白样品放于ATR(ZnSe)附件上进行红外光谱全波段扫描(400~4000 cm-1),扫描次数为32 次,分辨率为4 cm-1,每个样品平行测定三次。用仪器自带软件对图谱进行基线校正,平滑处理。用Peakfit v4.12 软件进行GAUSS 去卷积以及二阶导数拟合直至R2不变为止。记录各个子峰面积百分比,进而计算各部分二级结构含量[11]。
1.2.4 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis,SDS-PAGE)分析 参照Laemmli[12]的方法对CVAP 和CVGP 进行还原性和非还原性的SDSPAGE 电泳分析,1%蛋白溶液与上样缓冲液以1:2 的比例混合,煮沸5 min 后离心。还原条件下,上样缓冲液中加入5%β-巯基乙醇。采用质量浓度分别为12%的分离胶和5%的浓缩胶,每个泳道上样量为10 μL,在80 V(浓缩胶)和120 V(分离胶)的电压下进行电泳。电压结束后用0.1%的考马斯亮蓝R250 染色,用脱色液脱色,用GelSMART 拍照分析。
1.2.5 表面疏水性的测定 参考Kato 等[13]的方法并稍作修改测定表面疏水性。将pH 处理后的蛋白溶液分别稀释到0.05~0.2 mg/mL 的浓度梯度。取4 mL 稀释后的蛋白溶液加入20 μL 8.0 mmol/L ANS溶液,混匀,避光反应15 min。在390 nm 的激发波长和480 nm 的吸收波长下,采用FL970 荧光分度计测定不同浓度蛋白样品的荧光强度,以荧光强度作为纵坐标,蛋白浓度作为横坐标做直线,其斜率即为表面疏水性。
1.2.6 Zeta-电位的测定 参考Deng 等[14]的方法测定Zeta-电位。将pH 处理后的蛋白溶液分别稀释到0.1%,采用NanoZS90 动态光散射仪测定蛋白样品的电位,上样体积为1 mL,每个样品平行测定三次。
1.2.7 溶解度的测定 参考Deng 等[14]方法测定溶解度。采用考马斯亮蓝法测定处理后的蛋白质上清液中可溶性蛋白的含量。溶解度的计算公式为:
1.2.8 乳化性的测定 参考Deng 等[14]方法测定乳化性。取10 mL 处理后的蛋白溶液,加入5 mL 大豆油。用高速剪切机以20000 r/min 乳化2 min。分别在0 min 和30 min 时测定其乳化层的吸光度。具体方法如下:取25 μL 乳化层的蛋白溶液加入到试管中,再加入5 mL 0.1% SDS 溶液,在500 nm 处测定其吸光度值。乳化性的计算公式为:
式中:C 为蛋白质初始浓度,mg/mL;φ为光路,1 cm;θ为油体积分数,0.25;D 为稀释系数,200;A0和A1是0 和30 min 的吸光度,Δ t 为间隔时间,30 min。
1.2.9 起泡性的测定 参考Deng 等[14]方法测定起泡性。取10 mL 处理后的蛋白溶液,用均质机以20000 r/min 均质4 min,分别记录0 min 和30 min时的泡沫体积。起泡性的计算公式为:
式中:V 为原始溶液体积,mL;V0为0 min 蛋白溶液体积,mL;V1为30 min 蛋白溶液体积,mL。
1.3 数据处理
使用Origin 2018 和SPSS 22.0 软件进行统计分析,使用OPUS 7.2 和Peakfit v4.12 软件对红外图谱及数据进行处理。
2 结果与分析
2.1 pH 对CVAP 和CVGP 二级结构的影响
蛋白质的二级结构常用傅里叶红外光谱进行分析,其红外吸收光谱主要是由一系列酰胺吸收带组成,酰胺Ⅰ带的1700~1600 cm-1吸收带对于研究二级结构最有价值[15],但是酰胺Ⅰ带难以区分谱峰重叠的α-螺旋和无规卷曲结构;酰胺Ⅲ带1220~1330 cm-1的吸收带可以更好地区分α-螺旋和无规卷曲结构[16]。因此,CVAP 和CVGP 参照酰胺Ⅰ带和酰胺Ⅲ带的规律来分析蛋白质的二级结构[17]。
从表1 中可以看出,CVAP 含有丰富的α-螺旋、β-折叠和β-转角结构。随着pH 的增加,靠近等电点时,α-螺旋含量增加,β-折叠含量降低,pH 为4.0 时,α-螺旋含量为40.94%±0.41%,β-折叠含量为26.08%±0.13%;远离pH4.0 时,呈现相反趋势。CVAP 远离等电点时,pH 变性处理使蛋白分子展开而暴露出其内部的疏水基团,疏水作用、氢键、二硫键等相互作用影响了α-螺旋、β-折叠的含量,表现出α-螺旋含量降低和β-折叠含量升高的趋势[6]。β-转角在pH4.0时含量为12.97%±0.13%,当pH 为2.0 和3.0 时,β-转角含量降低。这说明蛋白亚基在此pH 条件下易发生解离,这导致CVAP 结构柔性发生变化,CVAP相应部位的构象将更稳定。当pH 为5.0~13.0 时,β-转角含量低于或高于pH4.0的β-转角。这说明蛋白亚基在此pH 范围下发生了波动性的解离,这导致CVAP 结构柔性发生波动性的变化。
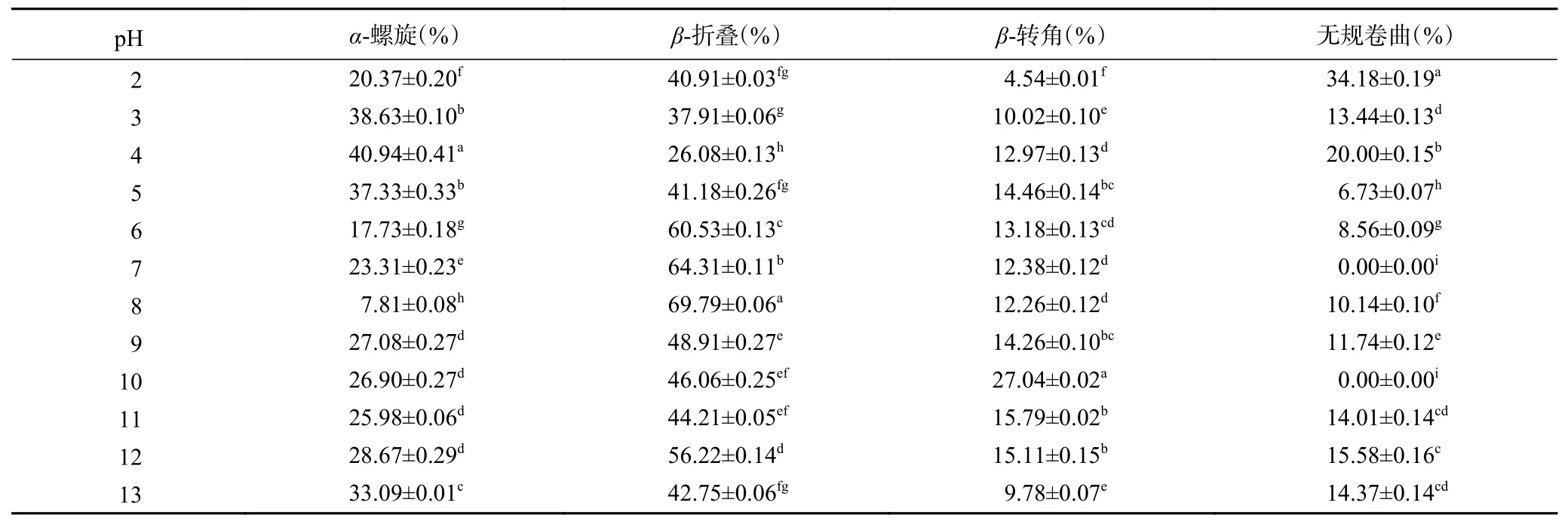
表1 pH 对CVAP 二级结构的影响Table 1 Effect of pH on the secondary structure of CVAP
从表2 中可以看出,相同pH 下,CVGP 中α-螺旋含量低于CVAP 中含量,β-折叠及无规卷曲含量高于CVAP 中含量。CVGP 处于远离等电点的极端pH 环境时,表现出α-螺旋含量增加和β-折叠含量减少的趋势,这不同于CVAP 二级结构的变化,由此推测,CVAP 和CVGP 的二级结构在pH 变化下拥有不同的变化规律。CVGP 中β-转角在pH5.0 时含量为12.59%±0.13%;pH 为6.0~13.0 时(pH9.0 除外),β-转角含量高于pH5.0 时的含量,这说明CVGP蛋白亚基易发生解离,这可导致CVGP 结构柔性发生变化,相应部分构象变得不稳定;pH 为9.0 时,β-转角含量低于等电点,可能是此pH 易导致蛋白亚基解离或其他未知原因导致此现象。
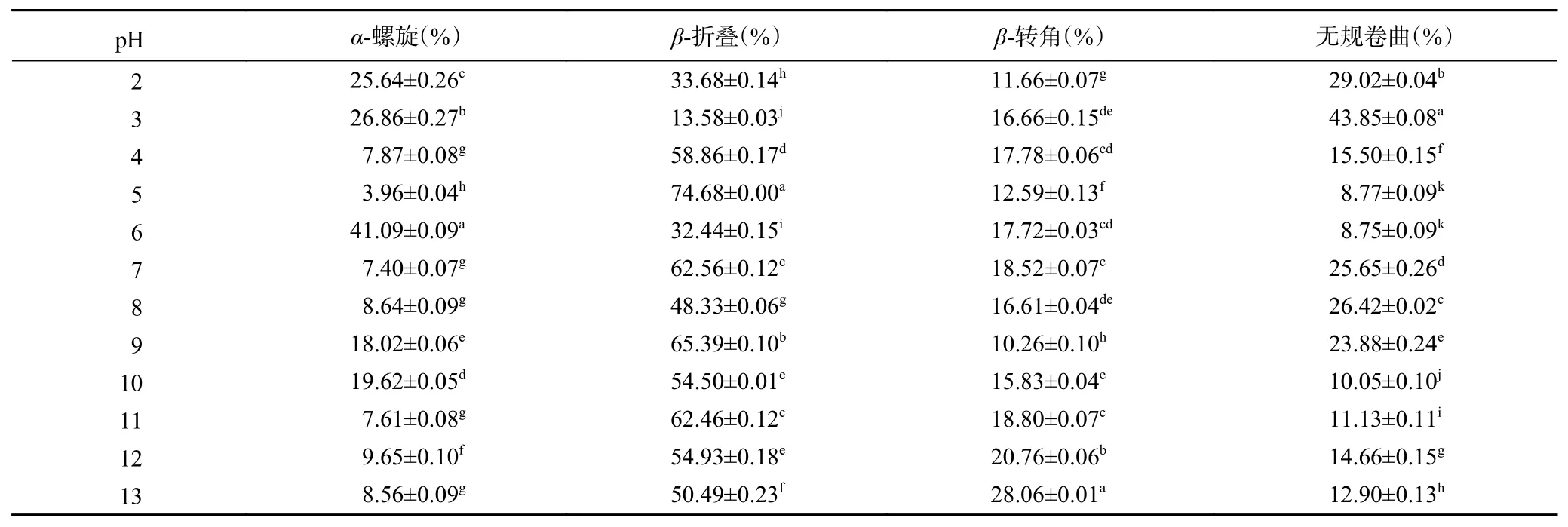
表2 pH 对CVGP 二级结构的影响Table 2 Effect of pH on the secondary structure of CVGP
2.2 pH 对CVAP 和CVGP 组成成分的影响
CVAP 的主要组成成分为7S 亚基,伴有少量的11S;CVGP 的主要组成成分为11S 亚基,伴有少量的7S[5]。它们的组分特征随pH 的变化结果如图1所示。pH 处于等电点附近,即CVAP 在pH4.0 附近时,CVGP 在pH5.0 附近时,蛋白多以聚集体沉淀物的形式存在,蛋白质溶解度低(图4),这导致溶液中的蛋白质含量低而难以在SDS-PAGE 胶上显现。pH远离等电点时,蛋白质溶解度变大,CVAP 和CVGP在SDS-PAGE 胶上出现明显的条带。pH13.0 时,蛋白条带弥散,这表明极端强碱处理导致CVAP 和CVGP 的解聚,蛋白分子的解聚进一步导致了蛋白结构的变化[18]。
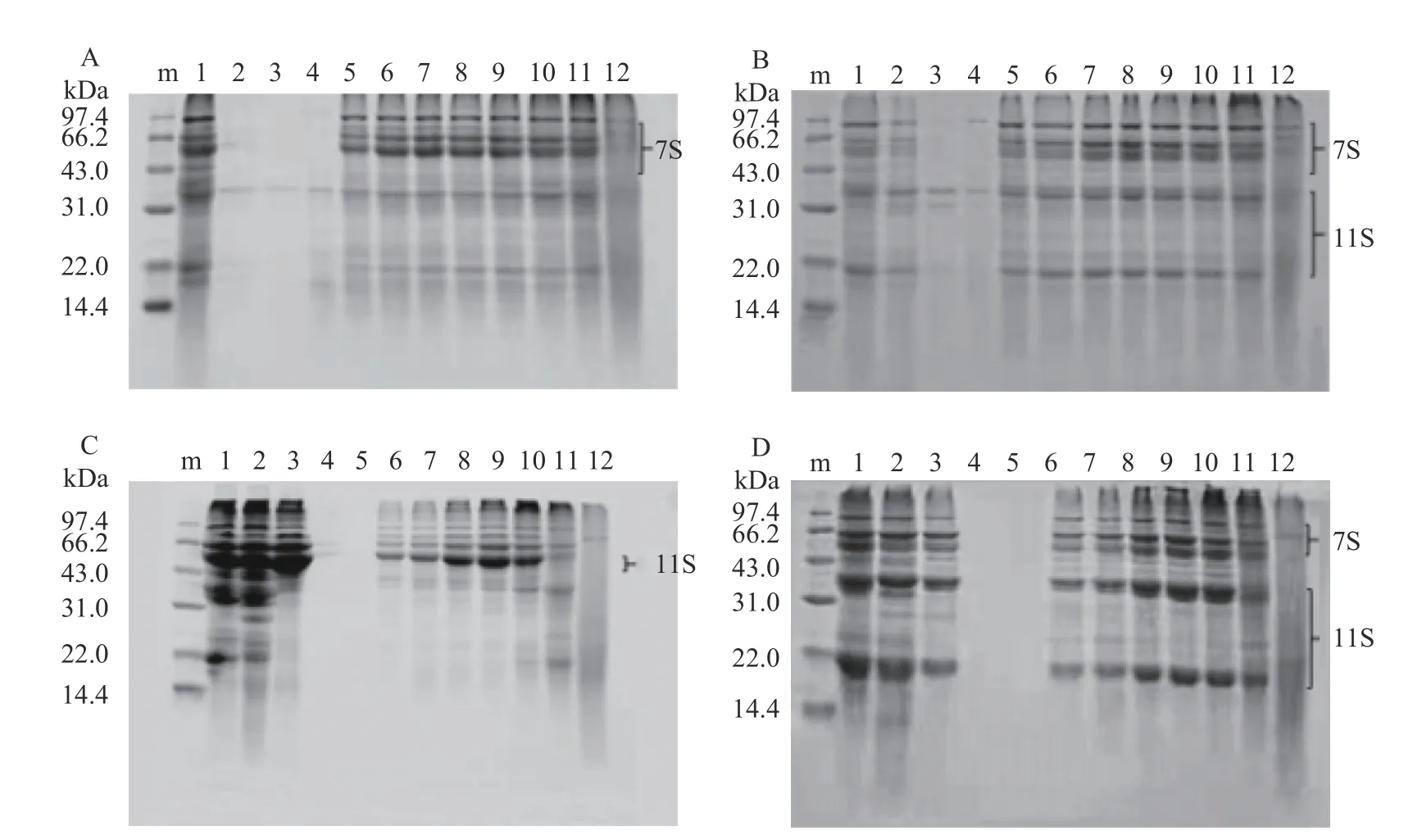
图1 不同pH 下的CVAP 和CVGP 的SDS-PAGE 图谱Fig.1 SDS-PAGE of CVAP and CVGP at different pH values
如图1A 所示,在非还原条件下,CVAP 的主要条带出现在43.0~66.2 kDa 之间,还有少量条带位于22.0 kDa 和31.0~43.0 kDa 之间;pH2.0 时,这些条带的亮度高于其他pH。如图1B 所示,还原条件下,CVAP 的条带分别出现在22.0 kDa、31.0~66.2 kDa之间;与非还原条件相比,22.0 kDa 和31.0~43.0 kDa之间的条带颜色加深,而43.0~66.2 kDa 之间的条带颜色变浅,这说明CVAP 中少量11S 亚基的二硫键在还原条件下打开。结合CVAP 的溶解性(图4),pH2.0 和pH8.0 条件下蛋白溶解度相似,它们的蛋白图谱在还原性SDS-PAGE 胶上相似(图1B 的泳道1 和7),但它们的蛋白图谱在非还原性SDS-PAGE胶上不同(图1A 的泳道1 和7)。这说明CVAP 中11S 亚基的二硫键易在酸性环境下解开形成类似于7S 亚基的分子量成分(22.0 kDa 和31.0~43.0 kDa)。CVGP 的蛋白组分不同于CVAP(图1C 和D)。如图1C 所示,在非还原条件下,CVGP 的条带均出现在43.0~66.2 kDa 之间(pH2.0、3.0 和12.0 除外);在还原条件下(图1D),43.0~66.2 kDa 之间的条带颜色变浅,22.0 kDa 和31.0~43.0 kDa 之间出现了明显条带,这说明11S 亚基43.0~66.2 kDa 之间的蛋白分子的二硫键被打开。
2.3 pH 对CVAP 和CVGP 理化性质的影响
2.3.1 pH 对CVAP 和CVGP 表面疏水性的影响 pH改变了CVAP 和CVGP 的分子组成,其一级结构、高级结构和分子柔性也会发生变化。因此,CVAP和CVGP 表面暴露的疏水基团也会发生改变,这将导致它们表面疏水性的改变。pH 还会影响蛋白质的带电性质、电离作用、溶解性及其他功能性质,这些因素也会影响蛋白质表面疏水性[14]。CVAP 和CVGP表面疏水性随pH 变化趋势如图2 所示。pH 使CVAP 的表面疏水性呈现出波动性变化,pH2.0 处的表面疏水性最高(57911.0),pH4.0 时的表面疏水性最低(2492.4)。与其他pH 下的蛋白分子量相比,pH2.0 时,CVAP 高级结构打开并形成含量近似一致的小分子量的亚基(图1A),这使得蛋白质表面出现更多的疏水基团,并且在pH2.0 的溶解度下,CVAP浓度可能更有利于其疏水结构形成[19]。pH 在等电点时的表面疏水性表现为最低,这可能是因为此时CVAP 以聚集体的形式存在,其亚基表面具有的疏水基团较少[6]。pH11.0~13.0 时的表面疏水性近似于pH 等电点时的表面疏水性,结合SDS-PAGE 图谱,此pH 下的蛋白质多以大分子量的片段、降解弥散的小分子片段、肽或氨基酸存在,这不利于疏水基团的暴露[20]。
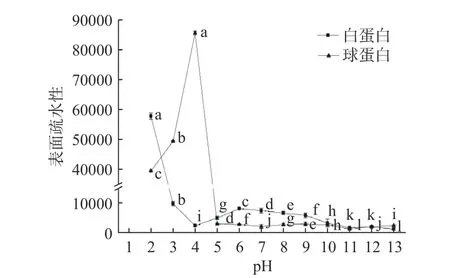
图2 pH 对CVAP 和CVGP 的表面疏水性的影响Fig.2 Effect of pH on surface hydrophobicity of CVAP and CVGP
pH 对CVGP 的表面疏水性不同于CVAP,呈现出表面疏水性急剧上升到最高再急剧下降,之后一直保持在接近于等电点疏水性水平的趋势。pH4.0 时,CVGP 表面疏水性达到最大值85783.0;pH11.0 时,表面疏水性最小为1344.0;pH5.0、pH6.0~10.0、pH12.0和pH13.0 的表面疏水性略高于pH11.0。通过电泳图谱分析可知,pH4.0 时,11S 蛋白亚基是CVGP 的主要成分,11S 蛋白质的碱性亚基中含有大量的疏水基团,这就导致了CVGP 表现出高的表面疏水性[21]。pH 在等电点时,蛋白质溶解度最低,蛋白质以聚集体的形式存在而导致此时的表面疏水性降低[6]。pH6.0~13.0 时的表面疏水性近似于等电点时的表面疏水性,此pH 下的蛋白质多以大分子量的片段和少量的小分子片段存在,这不利于疏水基团的暴露[20]。pH11.0时,CVGP 中的11S 的二硫键被打开而形成了小分子量的片段,CVGP 中蛋白质聚集体(97.4 kDa)的含量较高,还含有一定比例的7S,这些蛋白质成分不利于CVGP 中疏水基团的暴露,使其表面疏水性降低,这在大豆蛋白中也出现同样结果[22]。
2.3.2 pH 对CVAP 和CVGP Zeta-电位的影响 Zeta-电位可以反映蛋白质的结构、组成和功能性质的变化,Zeta-电位的绝对值越大,分子间的静电斥力越强,越能降低分子间的聚集。如图3 所示,CVAP 的Zeta-电位在近等电点pH4.0 附近时为0,CVGP 的Zeta-电位在近等电点pH5.0 附近时为0,这种Zeta电位特征可能与它们的分子结构有关,这一观点在油菜籽蛋白Zeta-电位的研究中也有出现[23]。CVAP的Zeta-电位正电荷的最大值为6.99 mA(pH2.0),负电荷绝对值的最大值为34.37 mA(pH10.0);CVGP的Zeta-电位正电荷的最大值为22.43 mA(pH4.0),负电荷绝对值的最大值为36.17 mA(pH10.0)。Zeta-电位结果说明pH 的变化使蛋白质表面的暴露基团发生改变,影响正电荷和负电荷之间的平衡[18]。
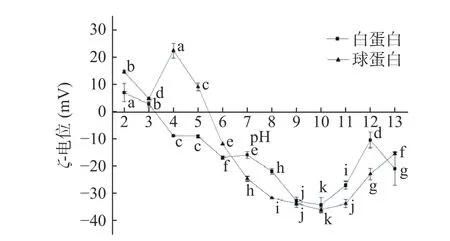
图3 pH 对CVAP 和CVGP 的Zeta-电位的影响Fig.3 Effect of pH on Zeta-potential of CVAP and CVGP
当pH 小于蛋白质等电点时,其表面带正电荷,这些正电荷可能来源于NH3+。Lin 等[24]的研究表明甲壳胺表面的NH3+是其抗细菌活性的重要影响因子。当pH 大于蛋白质等电点时,其表面带负电荷,这可能得益于蛋白羧基去质子化,COO-使蛋白分子表面带负电荷;在pH10.0 的条件下,CVAP 和CVGP的Zeta-电位绝对值达到最大值;pH11.0~13.0 条件下,Zeta-电位绝对值变小。结合SDS-PAGE 研究结果推断,pH11.0~13.0 的Zeta-电位特征可能是因为溶液中复杂成分在氧化交联时形成的可溶性和不溶性聚集体阻碍了蛋白质羧基解离,从而使蛋白质分子间的静电斥力减弱[18]。
2.4 pH 对CVAP 和CVGP 界面性质的影响
2.4.1 pH 对CVAP 和CVGP 溶解度的影响 箭筈豌豆蛋白的溶解度随pH 变化曲线如图4 所示。箭筈豌豆蛋白的溶解度变化趋势呈U 型曲线。CVAP在pH4.0 处溶解度最低,CVGP 在pH5.0 处溶解度最低。随着酸性条件增强,CVAP 和CVGP 的溶解度均逐渐增大;在pH2.0 时,两类蛋白质达到酸性条件下的最大溶解度,分别为39.80%和40.57%。随着碱性条件增强,CVAP 和CVGP 的溶解度均增大,且在pH12.0 时达到此条件下的最大溶解度,CVAP的最大溶解度为63.90%,CVGP 的最大溶解度为42.18%;在pH12.0~13.0 时,两类蛋白质的溶解度开始下降。其他植物蛋白的溶解性也表现出类似特征,如油莎豆蛋白的等电点在pH4.5 附近,酸性条件下溶解度最大值在pH3.0 得到(39%),碱性条件下溶解度最大值在pH10.0 得到(60%)[25]。
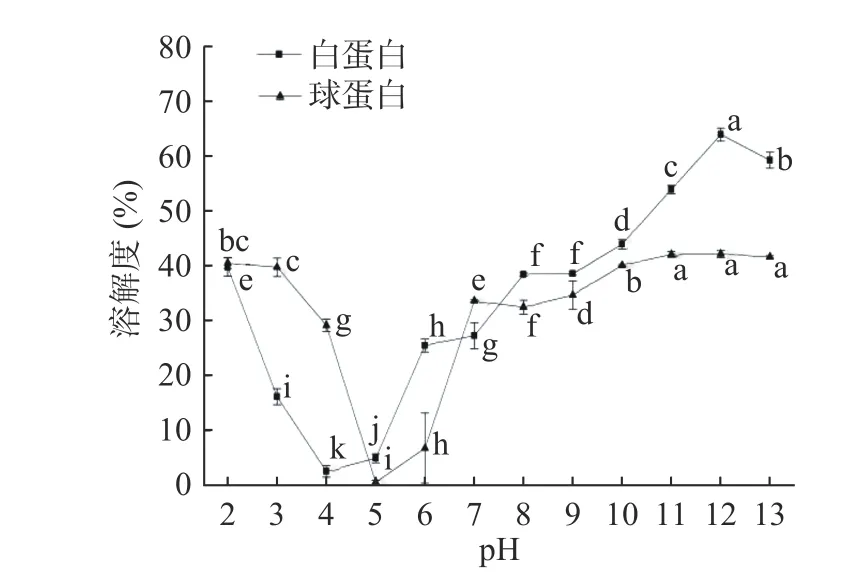
图4 pH 对CVAP 和CVGP 溶解度的影响Fig.4 Effect of pH on solubility of CVAP and CVGP
2.4.2 pH 对CVAP 和CVGP 乳化性的影响 CVAP和CVGP 乳化性随pH 变化趋势如图5 所示。CVAP乳化活性和乳化稳定性的最低值均出在其等电点附近(图5A),这可能是因为靠近等电点时,蛋白质分子间的静电斥力和表面疏水性均小,这导致蛋白质聚集降低其乳化性[8]。随着酸性条件增强,CVAP 乳化活性和乳化稳定性逐渐增大;在pH2.0 时,达到酸性条件下的最大值,分别为15.88 m2/g 和331.54 min。随着碱性条件增强,CVAP 乳化活性和乳化稳定性偶有波动,总体呈现增大趋势;在pH13.0 时,达到最大值,分别为36.50 m2/g 和4245 min。这可能是因为偏离等电点较远时,蛋白质分子结构、疏水作用力、电荷电性和电荷绝对值发生了改变,这增强了蛋白质与油相之间的作用,进而使得其乳化性更好[26]。
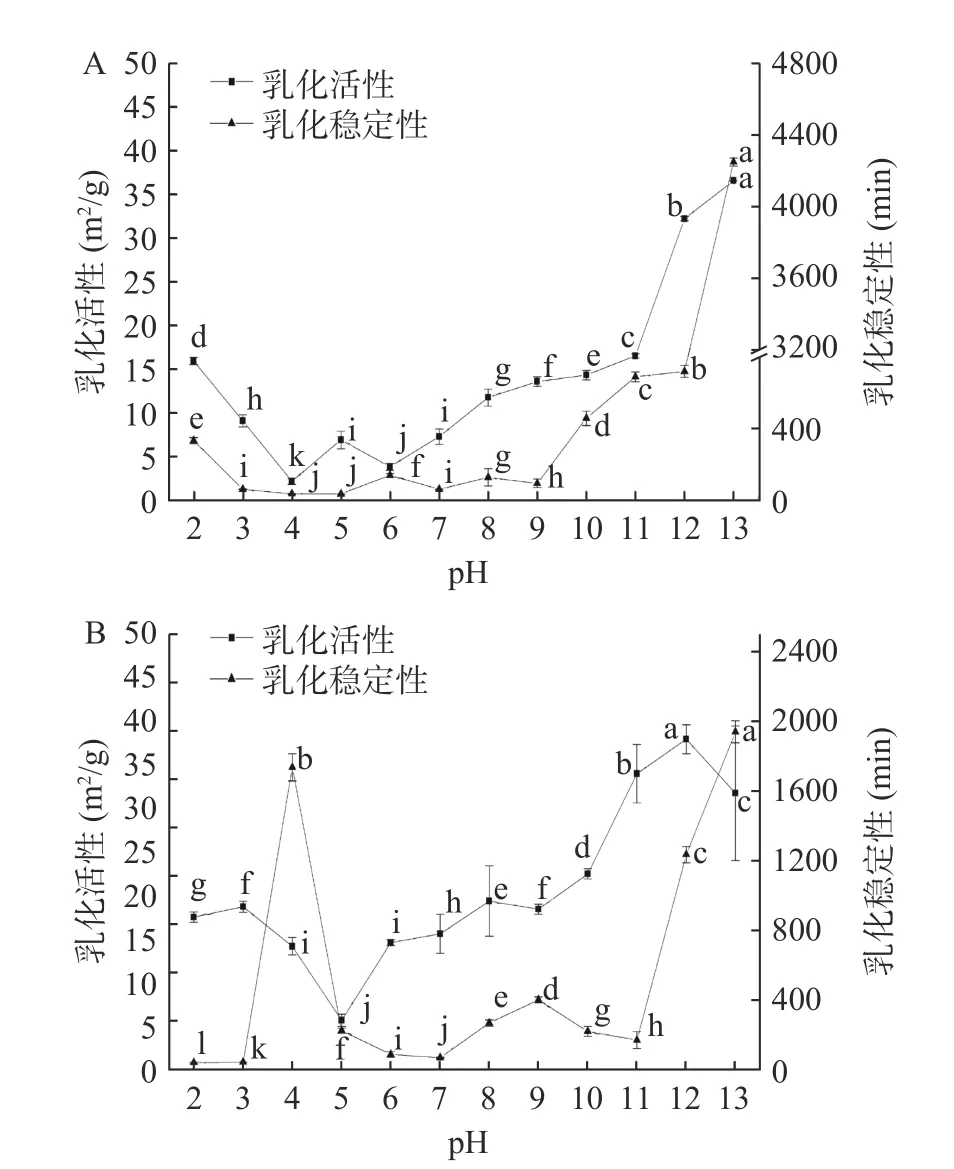
图5 pH 对CVAP(A)和CVGP(B)乳化性的影响Fig.5 Effect of pH on emulsifying properties of CVAP (A) and CVGP (B)
CVGP 乳化活性随pH 变化趋势与溶解度相似(图5B),在其等电点附近出现乳化活性的最小值(5.16 m2/g)。随着酸性条件增强,CVGP 乳化活性呈现逐渐增大;在pH2.0 和3.0 时,乳化活性分别为15.79 m2/g 和16.86 m2/g。随着碱性条件增强,CVAP乳化活性呈现增大趋势;在pH12.0 时,达到最大值(34.14 m2/g)。CVGP 乳化稳定性随pH 变化呈现出波动性变化趋势,其最大值在pH13.0 处得到为1938.75 min,在pH4.0 处也出现了较高的乳化稳定性(1735 min),这可能是CVGP 在不同pH 条件下的表面疏水性、电荷电性和电荷绝对值等与其疏水基团的暴露有关[27],疏水基团使蛋白质通过交联形成分子量更大的聚合物,改变其溶解度,并增强其乳化性和发泡性能[7]。总的来说,CVGP 与CVAP 的乳化稳定性变化趋势不同,这可能是由于它们的分子组成不同,进而导致蛋白质表面暴露的疏水基团不同[7,27]。
2.4.3 pH 对CVAP 和CVGP 起泡性的影响 CVAP和CVGP 起泡性和起泡稳定性随pH 变化趋势如图6 所示。CVAP 的起泡性如图6A 所示,在等电点附近的起泡能力小于其他pH 的起泡能力,pH4.0 时的起泡能力为140%, pH5.0 时的起泡能力为最小值(130%);CVAP 的起泡稳定性在pH 近等电点时(pH4.0)处得到最小值18.52%。随着pH 偏酸或偏碱,CVAP 的起泡能力得到明显改善,起泡稳定性变化不大,其中pH11.0 处的起泡稳定性最大(66.21%)。CVGP 在等电点附近(pH5.0)的起泡能力最小(15%),但此pH 下的起泡稳定性高。随着pH 偏酸或偏碱,CVGP 的起泡性得到明显改善,但它的起泡稳定性没有得到改善。已有研究表明[28-30],蛋白组分、蛋白疏水基团暴露程度、蛋白电荷均影响蛋白质的起泡性。由SDS-PAGE 图谱分析发现CVAP 和CVGP的蛋白组分不同,这可能是导致两种蛋白起泡性不同的主要原因。傅里叶、表面疏水性和Zeta-电位的结果说明pH 影响了它们的二级结构,改变了它们疏水基团的暴露和电荷,从而也会导致它们的起泡性产生差异。
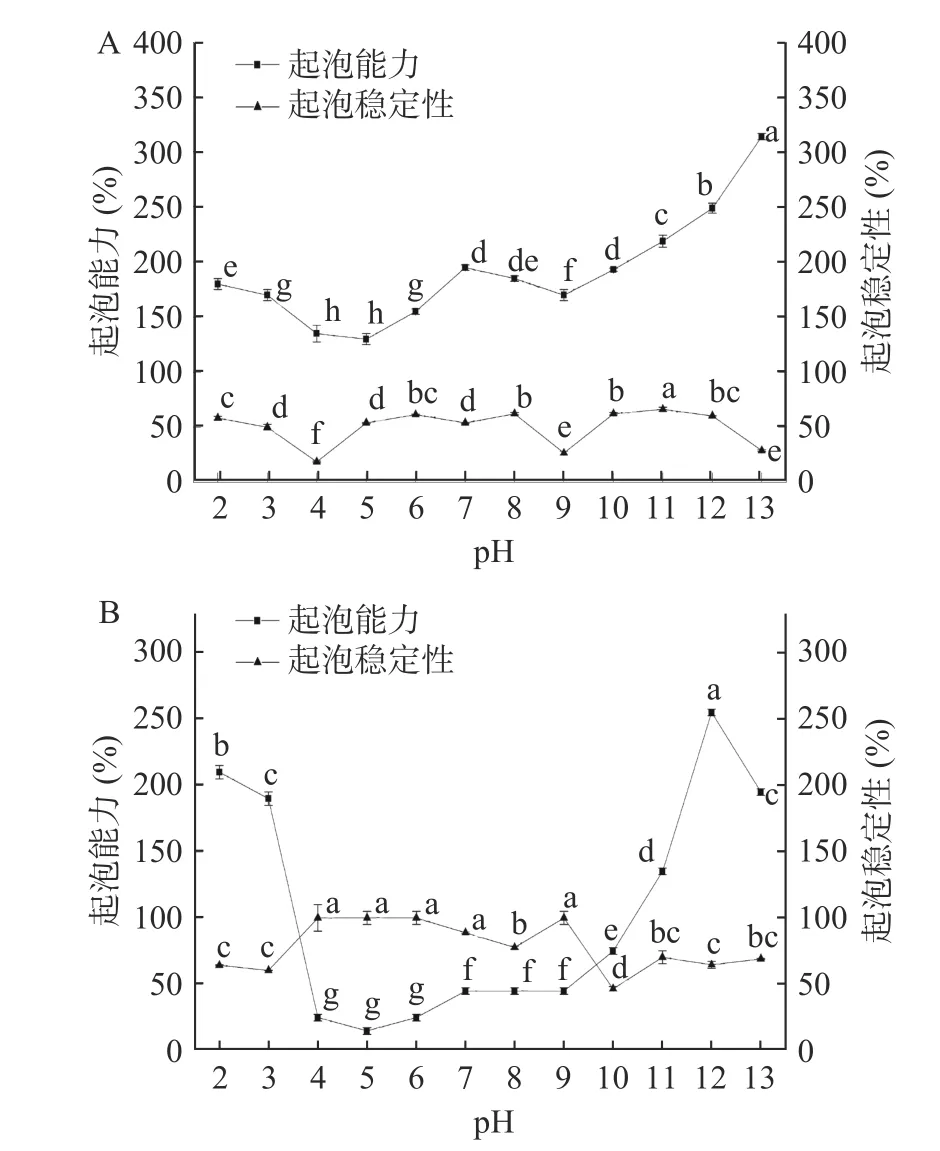
图6 pH 对CVAP(A)和CVGP(B)起泡性的影响Fig.6 Effect of pH on foaming properties of CVAP (A) and CVGP (B)
3 结论
箭筈豌豆蛋白经pH 处理后,其二级结构和物化性质均发生了显著改变。根据分子量组成变化分析,pH 处理促使箭筈豌豆蛋白二级结构展开,箭筈豌豆蛋白11S 亚基的二硫键被打开而释放出蛋白亚基;pH 为13.0 时,箭筈豌豆蛋白被分解成多样的小肽。CVAP 和CVGP 在pH2.0 和3.0 时的表面疏水性均分别高于pH7.0~13.0 的表面疏水性,在pH8.0~11.0下拥有高于其他pH 的Zeta-电位绝对值。在pH2.0~4.0 和pH8.0~13.0 时,CVAP 和CVAP 溶解度高于pH7.0 的溶解度;在pH2.0~4.0 时,CVAP 溶解度低于CVGP;在pH8.0~13.0 时,CVAP 溶解度高于CVGP。在pH2.0~3.0 和pH10.0~13.0 时,CVAP 的乳化性和乳化稳定性均高于pH7.0 的;在pH8.0~13.0 时,CVGP 的乳化性和乳化稳定性均高于pH7.0 的。pH 处理对CVAP 的起泡稳定性没有明显提升,但pH11.0~13.0 的起泡性得到提升;为碱性偏移处理的CVAP 和CVGP 的乳化性和起泡性优于酸性偏移处理的蛋白。由此可见,pH 碱性偏移有助于改善箭筈豌豆蛋白的物化性质。
