YAP-shRNA载体构建及其对食管鳞癌细胞系生物学行为的影响
2023-08-25韩高扬李小丽王瑞娟韩玉杰张仁锋魏创业孔晓煌连欢欢王金龙
韩高扬,李小丽,王瑞娟,韩玉杰,张仁锋,魏创业,孔晓煌,连欢欢,王金龙
(1.郑州大学附属郑州中心医院 胸外科,河南 郑州 450007;2.郑州大学第一附属医院 肿瘤科,河南 郑州 450000)
食管癌(esophageal carcinoma,EC)是造成死亡的第六大癌症[1],全球总发病率的85%左右发生在发展中国家,中国占全球EC病例的50%以上,每年约27万例[2]。尽管手术切除、辅助放化疗和免疫治疗等措施有所进展,但食管鳞癌(esophageal squamous cell carcinoma,ESCC)的5 a生存率仍然很低[3]。传统的治疗方法还远远不能令人满意。与大多数其他癌症一样,ESCC的发展是复杂的,其发生机制尚未完全阐明。
Hippo信号传导通路最初是以果蝇Ste20样激酶Hippo而命名的通路。Hippo通路主要的生物学效应包括控制细胞的分化、调节细胞增殖凋亡平衡、维持细胞的接触性抑制及参与肿瘤的发生[4]。Hippo信号通路故障,动态平衡被破坏,会导致细胞增殖异常,甚至肿瘤的发生[5]。在Hippo信号传导通路中寻找新靶点,在分子水平、细胞水平、动物实验和临床试验等方面研究治疗恶性肿瘤的方法,已成为现在研究Hippo信号传导通路的主要方向。其中Yes相关蛋白(Yes-associated protein,YAP)是Hippo信号传导通路下游的关键效应分子,在人体内,Hippo通路参与细胞增殖的负调控,YAP磷酸化后是抑制转录的关键因子,但有些研究表明YAP是一个癌基因,可促使正常细胞向恶性肿瘤细胞分化。因此本实验通过研究YAP在ESCC中的表达情况,并构建YAP-shRNA来了解其对食管鳞癌细胞系生物学行为的影响,以期找到食管癌治疗的新靶点。
1 对象与方法
1.1 研究对象
选取2015年1月至2016年6月在郑州大学第一附属医院胸外科接受食管癌根治术且病史资料完整的122例食管鳞癌组织标本,同时取正常食管组织(距恶性肿瘤>5 cm)。患者术前无放疗、化疗和免疫治疗史,所有患者均自确诊之日起进行随访,直至2021年6月1日或患者死亡,其中10例患者随访失联,此项研究得到了郑州大学第一附属医院医学伦理委员会的支持。按2017年国际抗癌联盟最新的食管癌TNM分期(第8版)进行分期[6]。由3名不知此研究内容的病理科医生共同判定病理切片免疫组化评分。
1.2 免疫组化结果判定
采用半定量法,结合染色强度和染色范围评判YAP表达结果。根据病理切片染色的强度和染色阳性细胞占总细胞的比率进行评分。染色强度:阴性(强度和阴性对照类似)为0分;弱阳性(淡黄色)为1分;阳性(黄色)为2分;强阳性(棕黄色)为3分。染色阳性细胞占比:阳性细胞数<10%为0分,10%~30%为1分,3l%~51%为2分,52%~70%为3分,>70%为4分。结合染色强度与染色阳性细胞占比的乘积进行综合判定:0分为阴性(-),1~4分为弱阳性(+),5~8分为阳性(++),9~12分为强阳性(+++)。
1.3 细胞培养
人食管鳞状细胞系EC9706和EC109(购自中国科学院上海细胞库)在含有10%(体积分数)胎牛血清的RPMI-1640(Gibco,Invitrogen,NY,USA)中培养。培养温度为37 ℃,二氧化碳体积分数为5%。细胞在转染前24 h接种在六孔板中。
1.4 质粒与转染
针对不同的靶序列(表1),设计了5种用于YAP敲除的shRNA质粒:pGPU6-YAP-1103(shRNA1)、pGPU6-YAP-2217(shRNA2)、pGPU6-YAP-1862(shRNA3)、pGPU6-YAP-1662(shRNA4)和pGPU6-YAP-shNC(shNC)的阴性对照质粒。使用Attractene转染试剂(德国希尔登Qiagen)将质粒转染到相应细胞中。48 h后采用qRT-PCR检测各组YAP RNA表达情况,72 h后采用蛋白质印迹检测各组YAP蛋白表达情况,以评估5种质粒的有效性,从而为后续实验选择最佳质粒。
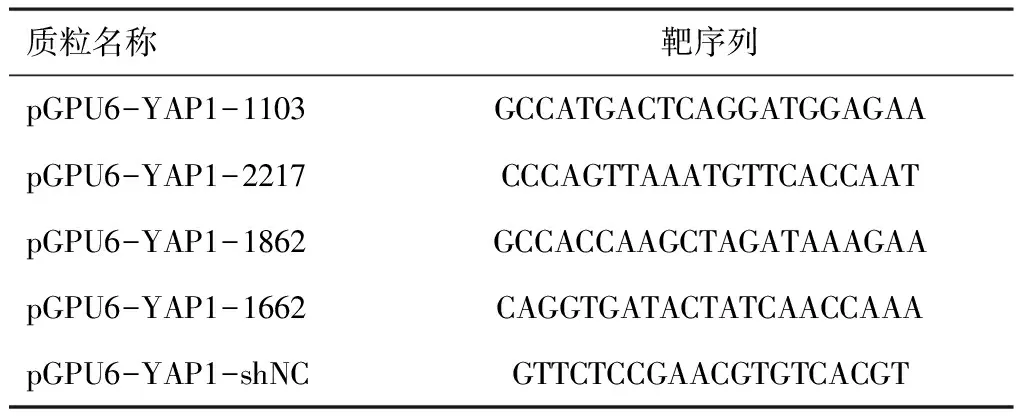
表1 5种不同的靶序列
1.5 qRT-PCR检测
48 h后利用TRIzol(Invitrogen Corporation,加利福尼亚州卡斯巴德)试剂从细胞中提取RNA。按逆转录试剂盒说明书(美国赛默飞世尔科学公司)对每个RNA样本(1 μg)进行逆转录合成cDNA合成。然后利用qRT-PCR检测YAP基因表达量。以管家基因β-actin作为内参,YAP引物序列和β-actin引物序列如(表2)所示。每组设3个复孔,以β-actin作为参照,计算Ct均值,应用相对定量法2-ΔΔCt进行定量分析。
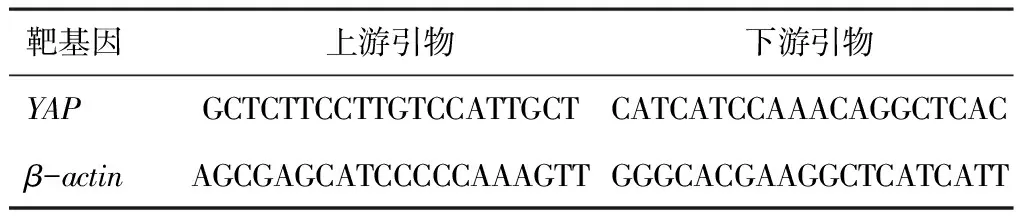
表2 YAP引物序列和β-actin引物序列
1.6 蛋白质印迹检测各组YAP蛋白表达情况
72 h后提取蛋白,采用紫外分光光度计测提取蛋白的水平,配制分离胶,水封,加浓缩胶,跑胶,电泳转膜,封闭,加入一抗(1∶200),在4 ℃冰箱内过夜孵育,用TBST液洗膜3遍,然后再加入稀释的二抗(1∶2 000)进行孵育,用TBST液洗涤3遍,最后加荧光显影剂显影。
1.7 Transwell小室检测侵袭能力
用YAP-shRNA2和YAP-shNC转染EC9706和EC109细胞系,并进行培养。48 h后先用胰蛋白酶分离细胞,再用PBS洗涤,培养在无血清培养液中。在下室中加入600 μL的含血清的培养液,稀释肿瘤细胞悬液至每毫升1×105个,并吸取200 μL细胞悬液加入上室中。在37 ℃、5% CO2的培养箱中培养72 h。用棉签擦去滤膜上方未穿出的肿瘤细胞,滤膜用40 g·L-1多聚甲醛固定,时间约30 min,用结晶紫染色,切下的膜固封在载玻片上,在倒置显微镜下计膜背面的细胞数,计四周和中间的3~4个视野,然后计算出平均值。
1.8 CCK8检测增殖能力
用YAP-shRNA2和YAP-shNC转染EC9706和EC109细胞系,把细胞的水平调整为每毫升1×104个,调整好的细胞悬液按照每孔100 μL的上样量加到 96孔板内,每组细胞5个复孔。在37 ℃、5% CO2的培养箱中培养,分别在12、24、36、48 h在每孔细胞的悬液中加入10 μL的CCK8溶液,然后继续在培养箱中孵育。1 h后从培养箱中取出96孔板,用酶标仪在450 nm处测定各组的吸光度,记录每组5孔的数值,并取平均值。
1.9 统计学方法
采用SPSS 17.0统计软件进行统计分析,运用χ2检验进行统计分析,并以Cox回归模型行多因素预后分析,检验水准α=0.05。
2 结果
2.1 免疫组化结果
YAP蛋白在食管正常组织中染色呈淡黄色,染色部位主要集中于细胞核,少数为细胞质,染色阳性率为9.7%,YAP蛋白在食管鳞癌组织中染色呈棕黄色,在大部分细胞核和细胞质中均染色,阳性率为64.8%(图1)。通过分析,发现YAP蛋白在食管鳞癌组织中的表达与正常食管组织中表达差异具有统计学意义(P<0.05),不同年龄、性别、分化程度、肿瘤大小患者的YAP蛋白表达比较差异无统计学意义(P>0.05),但淋巴结转移有统计学意义(P<0.05)(表3)。通过随访发现食管鳞癌YAP阳性的患者生存期缩短(图2)。
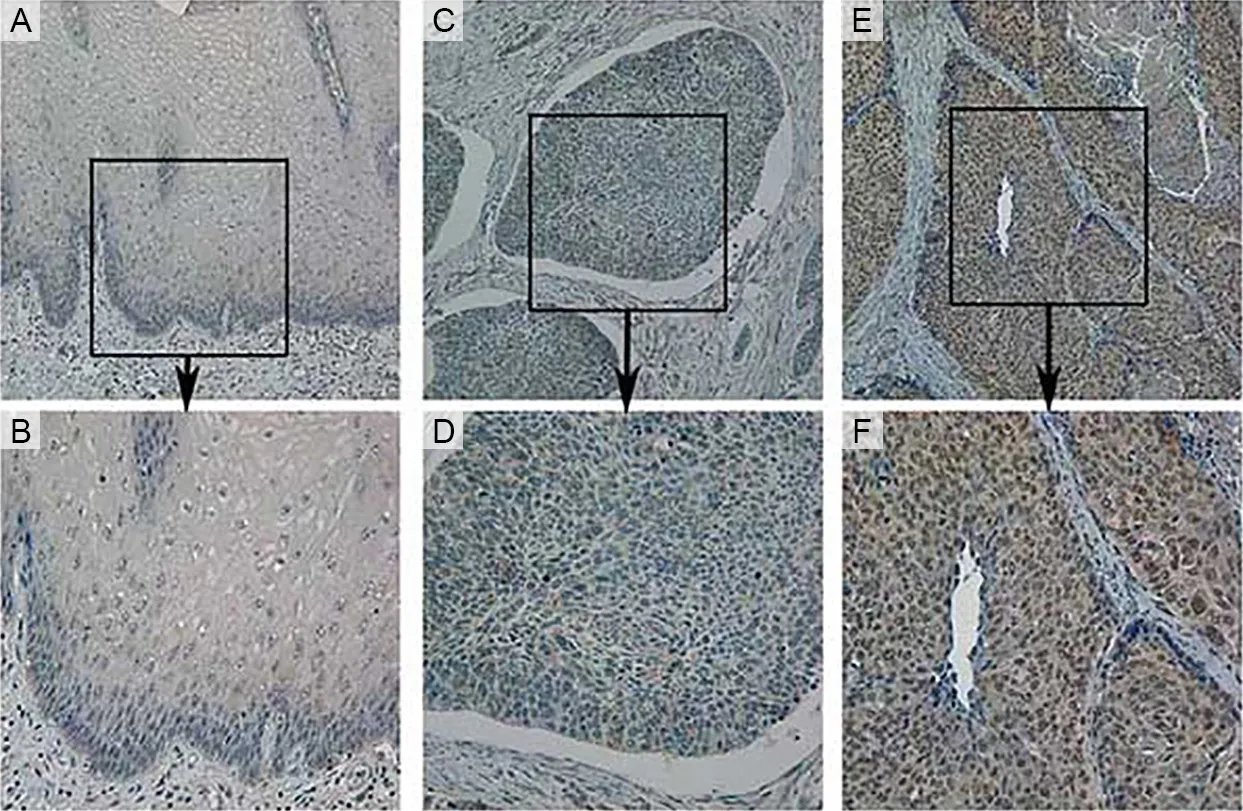
A和B为YAP在正常食管组织的细胞核和细胞质中呈阴性表达;C和D为YAP在食管鳞癌细胞核和细胞质中呈阴性表达;E和F为YAP在食管鳞癌细胞核和细胞质中阳性表达;A、C、E放大倍数为200×,B、D、F放大倍数为400×。
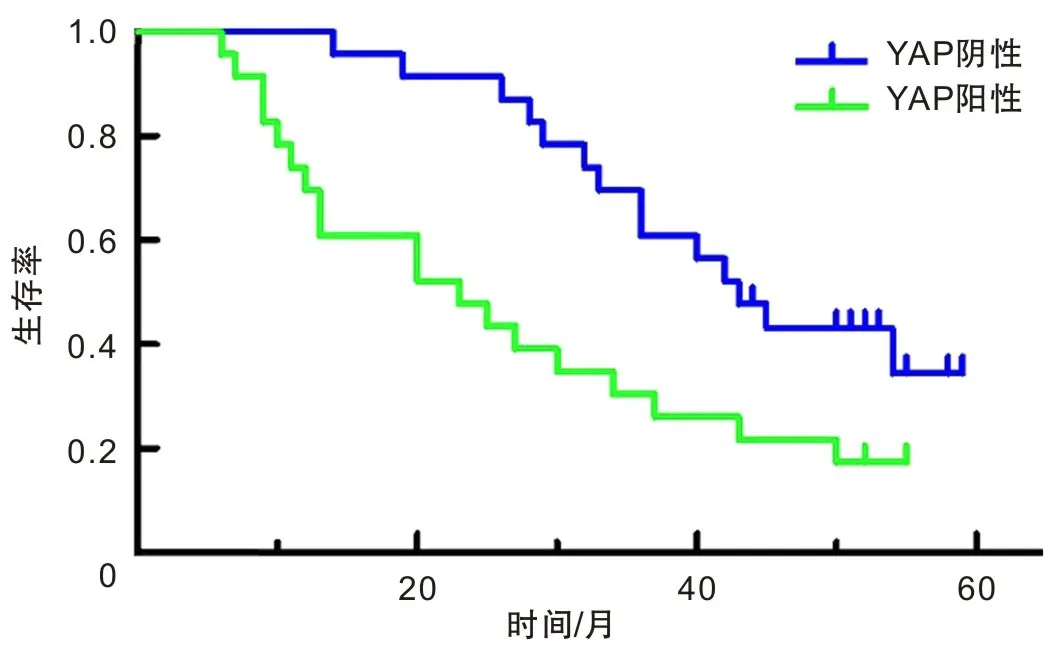
图2 食管鳞癌患者的生存曲线
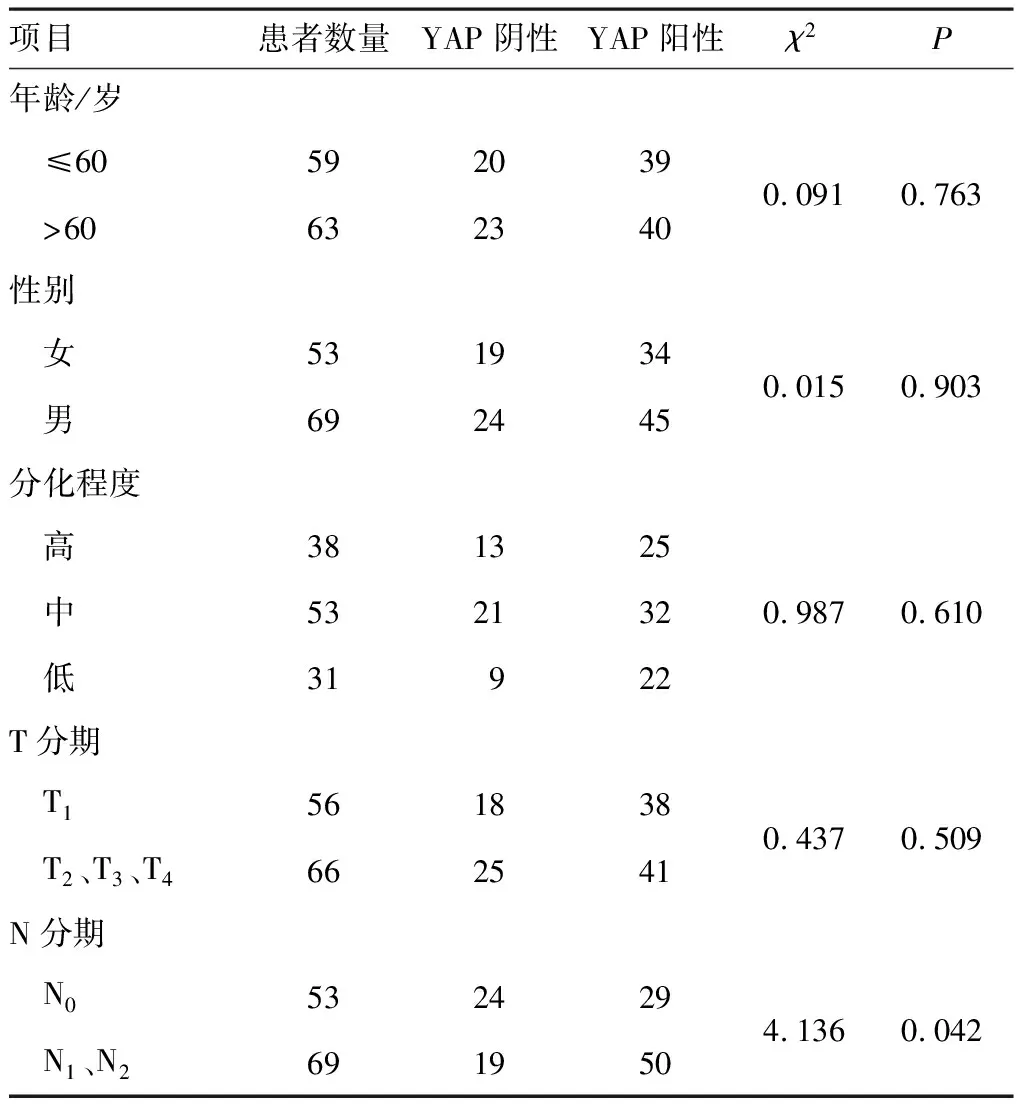
表3 YAP表达与食管鳞癌临床病理因素分析(n=122)
2.2 质粒对YAP基因表达的影响
本研究设计了5种不同YAPshRNA(shRNA1、shRNA2、shRNA3、shRNA4、shNC),经过转染EC9706和EC109细胞系,运用qRT-PCR和蛋白质印迹来检测YAP在该细胞中的表达情况(图3),检测可见经shRNA2和shRNA3转染的EC9706和EC109细胞,YAP表达较低,且shRNA2优于shRNA3,从而挑选出shRNA2为最有效质粒,并培养经shRNA2转染的EC9706和EC109细胞系做下一步实验。
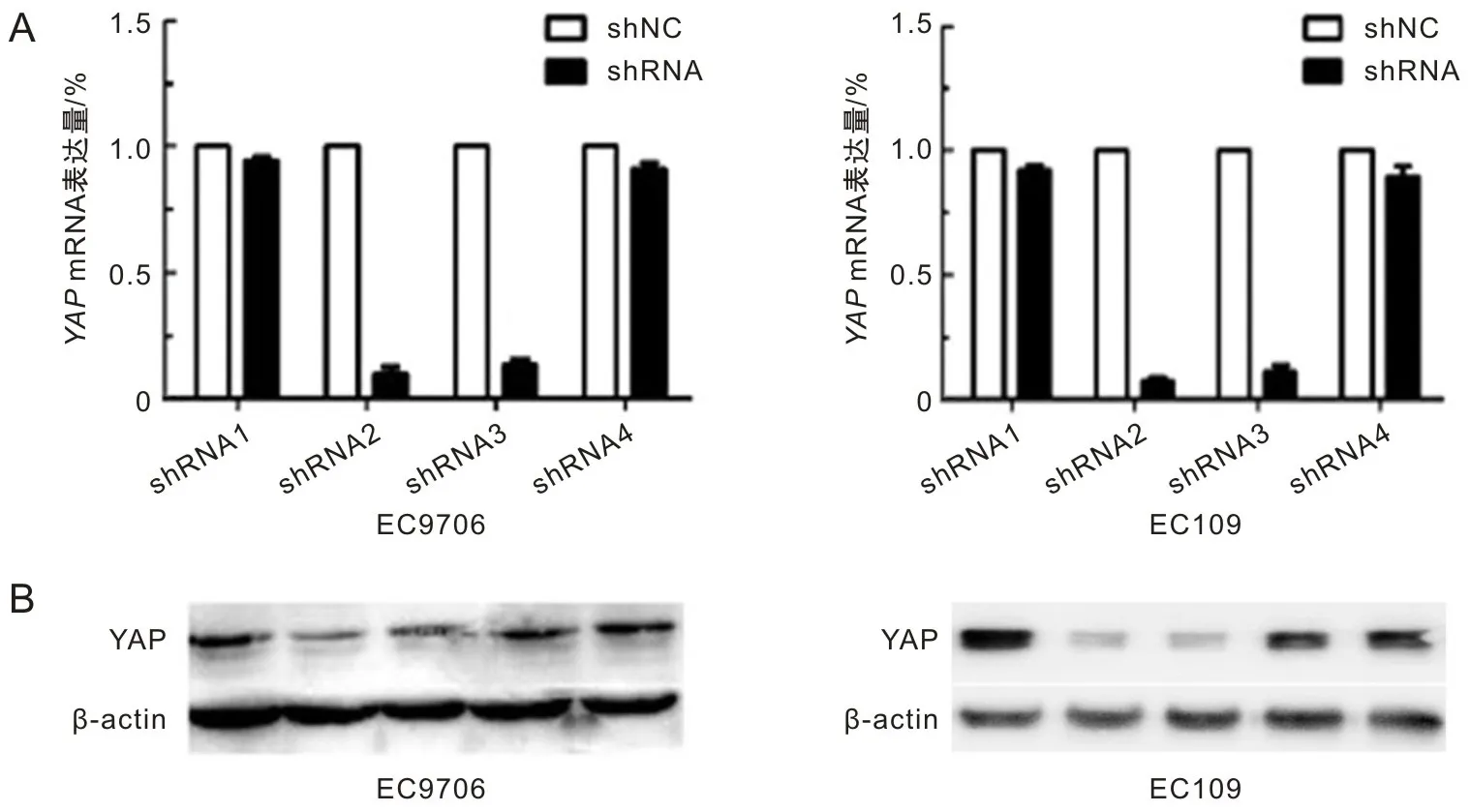
A为RT-PCR检测YAP在EC9706和EC109中的表达;B为蛋白质印迹检测YAP在EC9706和EC109中的表达(shRNA1,shRNA2,shRNA3,shRNA4,shNC)。
2.3 YAP的沉默对肿瘤细胞侵袭和增殖能力的影响
采用Transwell小室实验来检验转染前后肿瘤细胞的侵袭能力,通过计算YAP-shRNA2和YAP-shNC组在Transwell小室中72 h后的穿膜细胞数,可以看到YAP-shRNA2组穿膜的细胞数明显减少(图4),差异具有统计学意义(P<0.05)(图5),提示YAP基因的沉默能够抑制EC9706和EC109的侵袭能力。
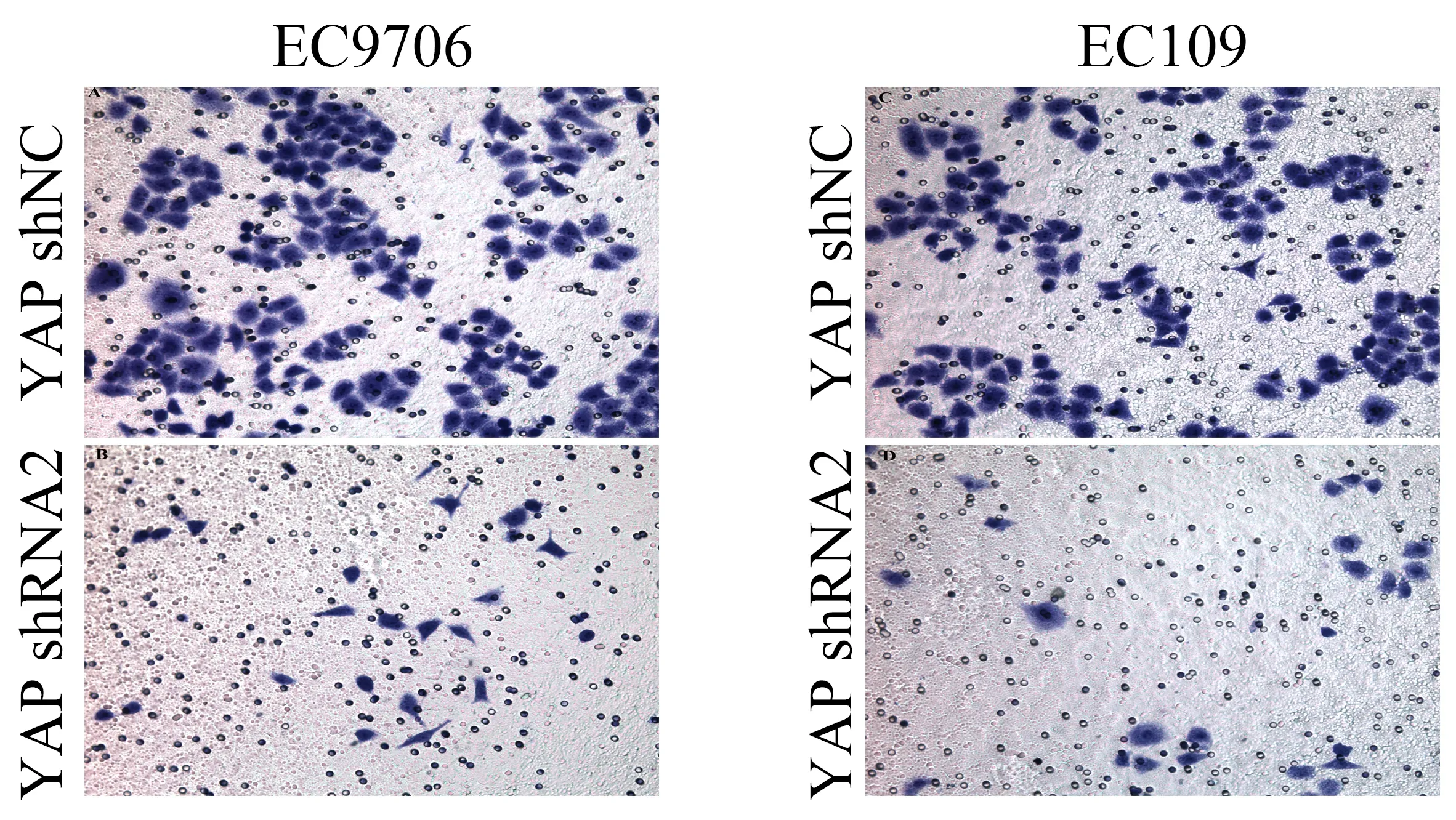
图4 Transwell小室的穿膜细胞

图5 Transwell小室的穿膜细胞数
采用CCK8实验来检验转染前后肿瘤细胞的增殖能力,用酶标仪在490 nm处测定各组的吸光度,记录每组5孔的数值,并取均值。通过绘制生长曲线显示YAP-shRNA2组的增殖数明显下降,差异具有统计学意义(P<0.05)(图6),提示了YAP基因的沉默能够抑制EC9706和EC109的增殖能力。
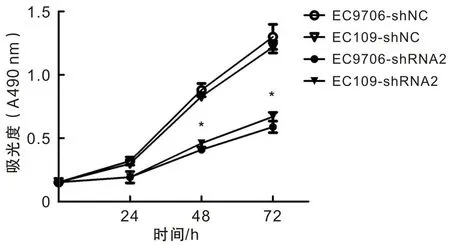
图6 细胞系的生长曲线
3 讨论
YAP在多种恶性肿瘤中高表达已被证实[7-8],然而关于YAP的表达与食管鳞癌的临床病理因素之间的关系及对食管癌细胞系生物学行为的影响却少有报道。在此次研究中,通过对食管鳞癌临床病理因素的分析,证实YAP在食管鳞癌组织中高表达与淋巴结转移密切相关,且YAP高表达的食管鳞癌患者的生存时间缩短,通过shRNA转染EC9706和EC109细胞系使其YAP表达降低,转染后的EC9706和EC109细胞系通过Transwell小室实验和CCK8实验证实其侵袭和增殖能力降低。
Hippo信号传导通路的异常可导致恶性肿瘤发生,因而被广泛关注。YAP是位于染色体11q22上的候选癌基因[9-11],在卵巢癌、胃癌、乳腺癌、前列腺癌等恶性肿瘤组织中呈高表达,且其表达位于细胞核和细胞质[12-17]。一项纳入115例肝癌组织标本的研究显示,YAP的表达与AFP水平呈正相关,并且是影响肝癌患者生存期的独立预后因素[18]。对122例食管鳞癌组织进行了免疫组化研究,研究发现其中64.8%的食管鳞癌组织的细胞核和细胞质中表达YAP,且与正常食管组织表达差异有统计学意义,虽然不同年龄、性别、分化程度、肿瘤大小患者的YAP表达差异无统计学意义,但YAP的表达差异与淋巴结转移相关。结果表明,YAP是在食管鳞癌中高表达的癌蛋白,且与食管鳞癌的不良预后相关。
Hippo信号传导通路可调节细胞增殖和凋亡,使内环境处于动态平衡的状态,而YAP是Hippo信号传导通路下游的关键效应分子。作为候选癌基因,YAP已被证实是调节器官大小和细胞增殖的因子[19]。转基因小鼠肝脏中YAP的过度表达可将肝脏质量从体重的5%增至约25%,并最终导致肿瘤的发生[20]。肝癌中YAP表达的降低可使肿瘤细胞的迁移能力降低,G0/G1期细胞数量显著增加[21]。为了了解YAP对ESCC生物学行为的影响,本研究沉默了EC细胞系中的YAP。YAP-shRNA2转染EC9706和EC109细胞系后,YAPmRNA和YAP蛋白表达水平低于对照组,并且侵袭和增殖能力降低,与以上结果基本一致。
4 小结
YAP作为一种癌蛋白在食管鳞癌中高表达,并且可以增加癌细胞的侵袭和增殖能力。此外YAP的高表达可导致食管鳞癌患者的生存率降低,因此YAP可成为未来食管癌治疗的新靶点。但YAP在食管鳞癌中的分子机制及功能还需要进一步努力阐明。
