条斑紫菜栽培过程中有害藻类的分离与鉴定
2023-08-24杜艺菲王广策牛建峰冯泽中王旭雷卓锦涛邵之卓宫相忠
杜艺菲, 王广策, 牛建峰, 冯泽中, 王旭雷, 卓锦涛, 4, 邵之卓, 4, 郇 丽, 宫相忠
条斑紫菜栽培过程中有害藻类的分离与鉴定
杜艺菲1, 王广策2, 3, 5, 牛建峰2, 3, 5, 冯泽中2, 3, 王旭雷2, 3, 5, 卓锦涛2, 3, 4, 邵之卓2, 3, 4, 郇 丽2, 3, 5, 宫相忠1
(1. 中国海洋大学 海洋生命学院, 山东 青岛 266003; 2. 中国科学院海洋研究所, 山东 青岛 266071; 3. 青岛海洋科学与技术试点国家实验室 海洋生物学和生物技术功能实验室, 山东 青岛 266237; 4.中国科学院大学, 北京 100049; 5. 中国科学院海洋大科学研究中心, 山东 青岛 266071)
针对条斑紫菜栽培过程中出现的有害藻类问题, 进行了叶状体和丝状体有害藻类分离与鉴定等相关研究。通过形态学分析和分子生物学鉴定, 发现叶状体中的杂藻主要有大型绿藻(浒苔、曲浒苔)、大型红藻(红毛菜)以及微型绿藻和硅藻, 丝状体中的杂藻主要为褐藻、微型绿藻和硅藻。针对部分微型杂藻进行了抑制剂处理实验, 结果表明低浓度的抗生素可以有效抑制部分硅藻和绿藻的生长, 二氧化锗对硅藻生长具有显著的抑制效果。研究结果为系统、全面认识条斑紫菜栽培过程中的有害藻类提供了科学依据。
条斑紫菜; 叶状体; 丝状体; 有害藻类; 分离纯化; 分子鉴定
条斑紫菜()隶属于红藻门红毛菜目紫菜属, 是我国重要的栽培海藻。虽然条斑紫菜产量低于坛紫菜, 但产值较高, 其栽培业的发展创造了良好的经济效益。与此同时, 在栽培过程中条斑紫菜大量吸收近岸海域氮磷等营养物质, 具有碳汇能力和重要的生态价值[1]。我国条斑紫菜栽培区域主要分布在江苏省和山东省沿海, 藻体的健康养殖对当地经济发展起着重要作用。然而, 栽培期间筏架和藻体容易受到其他藻类的附着与侵占, 影响了条斑紫菜的产量和产品的品质, 制约了产业发展[2-3]。因此, 开展条斑紫菜栽培期间有害藻类的调查和综合防控等工作非常重要。
条斑紫菜具有两个形态特征明显不同的生活史阶段, 分别为叶状体阶段(单倍配子体)和丝状体阶段(二倍孢子体)。叶状体为宏观世代, 呈膜状, 即我们通常食用的紫菜; 叶状体发育到一定阶段后放散果孢子, 果孢子在贝壳等含碳酸钙的物质上附着萌发形成丝状体; 丝状体发育成壳孢子囊释放壳孢子, 进而附着萌发形成叶状体。叶状体在开放海区的养殖阶段开始于9月下旬至10月中旬前后, 至翌年4月结束[4], 在此期间养殖筏架和网帘会繁生各种杂藻, 一般通过干露、晒网等方式进行处理, 以降低有害藻类的危害[5]。丝状体培养是紫菜人工养殖的基础, 每年的培养时间约为5~6个月, 钻入贝壳的丝状体在培养池中进行培养, 虽然培养丝状体的海水会经过暗沉淀等处理, 但仍然会受到海水中有害藻类的影响。
按照藻体大小可将影响条斑紫菜生长的藻类分为大型有害藻类和微型有害藻类, 其中大型有害藻类一般附生在养殖筏架和网帘上, 微型有害藻类一般附着在条斑紫菜表面。有害藻类的附着会影响条斑紫菜对光照和营养盐的吸收, 从而影响其产量及加工后产品的品质。然而, 目前关于条斑紫菜有害藻类的研究只局限于某一物种或某一类群, 尚未有系统全面的报道。
因此, 本文以条斑紫菜叶状体和丝状体为研究材料, 对其养殖过程中出现的有害藻类进行分离、纯化与鉴定, 同时探索了一系列处理方法以减少有害藻类产生的负面影响。研究结果为系统、全面认识条斑紫菜栽培过程中的有害藻类提供了科学依据, 具有一定的实用价值和推广意义。
1 材料和方法
1.1 材料的采集
2020年12月至2021年5月多次至江苏省赣榆区、山东省即墨区条斑紫菜养殖海域采集样品, 包括条斑紫菜叶状体和附着在养殖筏架上的藻类(图1)。此外, 叶状体和丝状体在实验室培养过程中也会受到其他藻类污染, 因此也将这些藻类作为有害藻类进行相关研究。

图1 栽培于开放海区的条斑紫菜叶状体
1.2 材料的分离与培养
对于采集到的大型海藻, 使用灭菌海水清洗以去除杂质及浮游生物, 选取一段藻体放入培养瓶中进行培养。对于微型杂藻, 在PES海水培养基中添加1%的Agarose灭菌制备固体培养基, 将条斑紫菜表面附着的杂藻涂布于固体平板上, 长出藻落后挑取单个藻落置于PES海水培养基中进行培养。培养环境光照强度为40 μmol photonsּm–2ּs–1, 温度为20 ℃。
1.3 有害藻类的鉴定
使用光镜(ECLIPSE Ti, 尼康)与扫描电子显微镜(S-3400N, 日立)对杂藻进行分类与观察。
将分离出来的单株杂藻收集在EP管中, 离心去除培养基, 加入研磨珠, 使用全自动样品研磨机(JX- FSTPRP-24, 上海净信科技)研磨后, 加入适量TE 缓冲液(T1120, Solarbio)于95 ℃处理15 min, 离心取上清作为DNA模板。
使用表1所示引物进行PCR扩增, 引物由生工生物工程(上海)股份有限公司合成。PCR反应体系为: 10 μL 2×Taq Master Mix, 7 μL RNase-free水, 1 μL Primer F, 1 μL Primer R, 1 μL DNA模板。PCR反应程序为: 95 ℃预变性4 min; 95 ℃变性30 s、退火30 s、72 ℃延伸1 min, 35个循环; 72 ℃延伸10 min, 4 ℃保温。扩增产物进行1%琼脂糖凝胶电泳检测。合格的扩增产物送生工生物工程(上海) 股份有限公司测序, 测序结果在National Center for Biotechnology Information (https://www.ncbi.nlm.nih.gov/)上进行BLAST比对, 获得鉴定结果。

表1 分子鉴定引物列表
1.4 有害藻类的处理
选取指数生长时期的杂藻作为实验对象, 在12 mL培养管里分别加入5 mL含有不同浓度氯霉素(10、20、40 U/mL)、草铵膦(10、20、30 mg/L)、二氧化锗(10、15 mg/L)的PES海水培养基, 同时设置对照组, 每组加入等量同种微藻, 14 d后计数观察不同浓度处理试剂对各种杂藻的作用程度。
在本研究中采取了两种方法进行计算。一种为血球计数板计数法[11], 将培养管中的藻液吹打均匀使用血球计数板(上海市求精生化试剂仪器有限公司)在光镜(ECLIPSE Ti, 尼康)下对对照组和各实验组进行计数, 每个样品重复计数3次, 计算出细胞密度平均值。根据公式: 死亡率=(对照组密度–实验组密度)/对照组密度[12], 计算微藻死亡率。
另一种方法为赤藓红染色法, 使用0.1%赤藓红B对藻细胞进行染色, 随机取样, 使用光镜(ECLIPSE Ti, 尼康)拍照, 其中死细胞染色后为红色, 活细胞颜色不变, 根据被染色细胞比例计算出死亡率[13]。每组处理重复计数3次, 取平均值。
2 结果
2.1 条斑紫菜叶状体养殖过程中有害藻类的鉴定
(1) 曲浒苔(), 大型绿藻, 隶属于绿藻门石莼纲石莼目石莼科石莼属, 分离于条斑紫菜养殖筏架, 藻体深绿色, 单条细长中空, 圆柱状或管状, 有明显柄部, 基部细胞排列整齐, 向上膨胀细胞排列变不规则(图2a)。
(2) 浒苔(), 大型绿藻, 隶属于绿藻门石莼纲石莼目石莼科石莼属, 分离于条斑紫菜养殖筏架。藻体亮绿色或暗绿色, 有明显主枝, 多细长中空管状分支, 由单层细胞组成(图2b)。
(3) 红毛菜(), 大型红藻, 隶属于红藻门红毛菜纲红毛菜目红毛菜科红毛菜属, 分离于条斑紫菜养殖筏架。藻体红褐色至紫红色, 丝状, 韧性差, 大多由双层细胞组成(图2c)。

图2 条斑紫菜栽培过程中分离鉴定的大型有害藻类
(4) 柯氏复球藻(), 微型绿藻, 隶属于绿藻门共球藻纲溪菜目, 分离于实验室养殖材料。绿色球形, 多数聚团生长, 呈二分体或四分体状态(图3a, 图4a)。
(5), 褐藻, 隶属于褐藻门褐藻纲水云目索藻科扭线藻属, 分离于野生条斑紫菜表面。棕褐色, 有若干分枝, 分支由单列细胞组成, 成串珠状排列(图3b, 图4b)。
(6), 硅藻, 隶属于硅藻门硅藻纲硅藻目硅藻科菱形藻属, 分离于野生条斑紫菜表面。藻体形态呈菱形, 中央有一条壳缝, 横纹线相互平行(图3c, 图4c)。
(7), 硅藻, 隶属于硅藻门硅藻纲舟形藻目舟形藻科舟形藻属, 分离于野生条斑紫菜表面。藻体形态呈细长舟形, 两端尖; 硅壳上条纹大致平行, 壳缝较直; 聚集在一起的单个硅藻之间有很大间隙, 经常包埋于胶质管中形成群体(图3d, 图4d)。
(8), 硅藻, 隶属于硅藻门硅藻纲硅藻目硅藻科菱形藻属, 在条斑紫菜丝状体和叶状体均分离出。藻体呈椭圆形, 两端钝圆; 藻体聚集紧密, 常多层叠在一起(图3e, 图4e)。
2.2 条斑紫菜丝状体养殖过程中分离的有害藻类
(1), 微型绿藻, 隶属于绿藻门共球藻纲小球藻目小球藻科, 分离于实验室养殖材料。藻体为球形, 浅绿色, 表面略光滑; 繁殖力极强, 可耐恶劣环境(图3f, 图4f)。
(2), 硅藻, 隶属于硅藻门硅藻纲硅藻目硅藻科筒柱藻属, 分离于实验室养殖材料。藻体中央部分呈菱形, 两端细长, 直或常向一侧弯曲呈现新月形, 有两个载色体(图3g, 图4g)。
(3), 硅藻, 隶属于硅藻门硅藻纲舟形藻目, 分离于实验室养殖材料。藻体呈卵圆形, 横纹对称分布(图3h, 图4h)。
(4), 微型绿藻, 隶属于绿藻门石莼纲石莼目科恩藻科似内枝藻属, 分离于实验室养殖材料。藻体由多细胞组成, 浅绿色, 缠绕在一起(图3i, 图4i)。

图3 条斑紫菜栽培过程中分离鉴定的微型有害藻类(光镜图片)
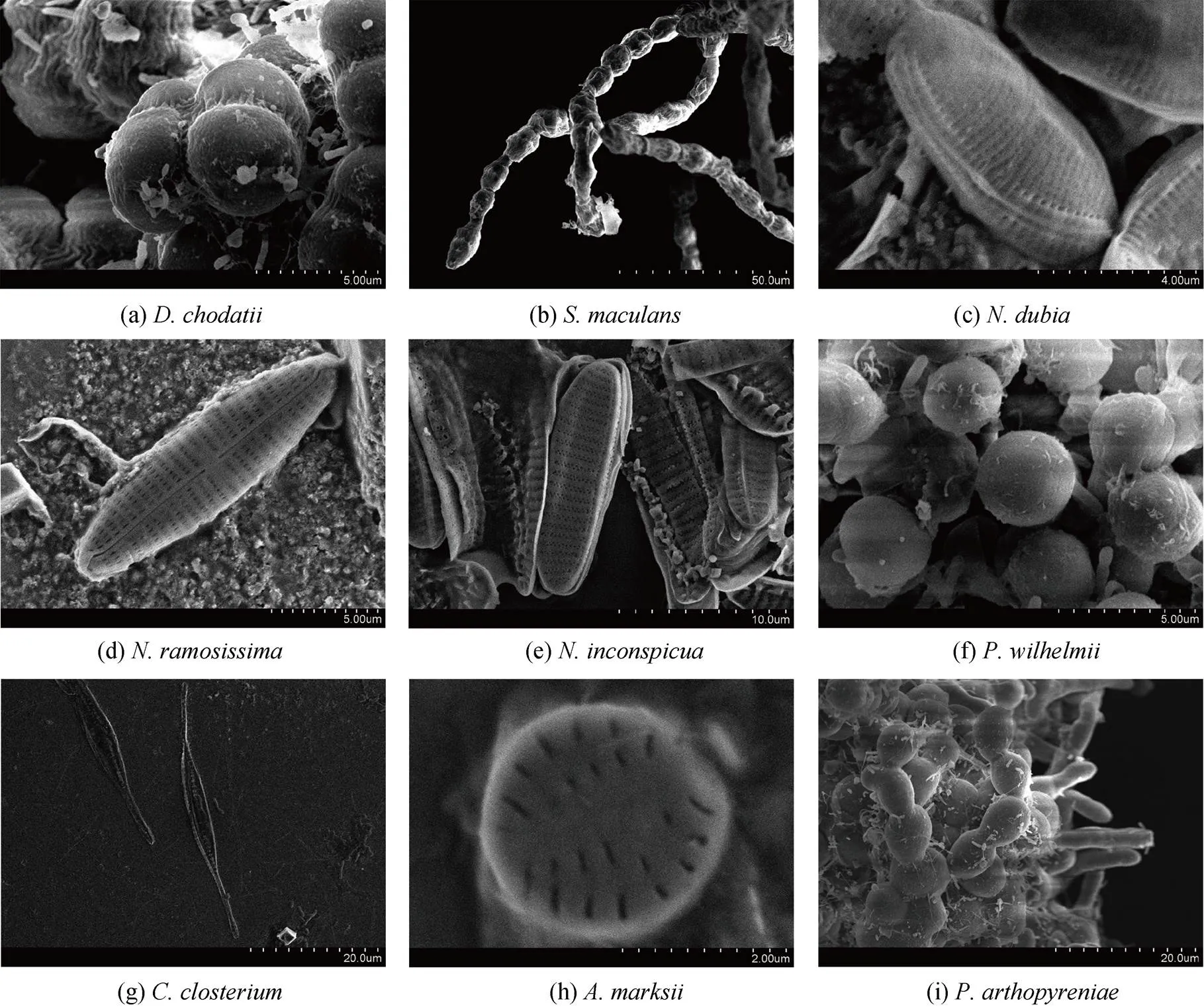
图4 条斑紫菜栽培过程中分离鉴定的微型有害藻类(电镜图片)
2.3 有害藻类的处理
2.3.1 氯霉素对部分微藻的处理结果
选取、、和进行氯霉素处理。经过处理后几种藻类的死亡率如图5所示, 实验浓度的氯霉素对于几种藻类均有一定的抑制效果。、、经氯霉素处理后效果明显, 其中在氯霉素浓度为20 U/mL时已经全部死亡;在20 U/mL氯霉素处理下死亡率达到85.18%, 在40 U/mL浓度处理时全部死亡;对低浓度氯霉素(10 U/mL)耐受性较强, 但在高浓度(40 U/mL)处理时死亡率达到97.08%。虽然氯霉素对于绿藻有一定的处理效果, 但效果不佳, 死亡率均在50%以下。
2.3.2 草铵膦对部分微藻的处理结果
选取、、、、、和进行草铵膦处理实验。经过草铵膦处理后藻类的死亡率如图6所示, 实验浓度的草铵膦除了对于与两种藻没有明显效果外, 对其他杂藻都有比较显著的效果。
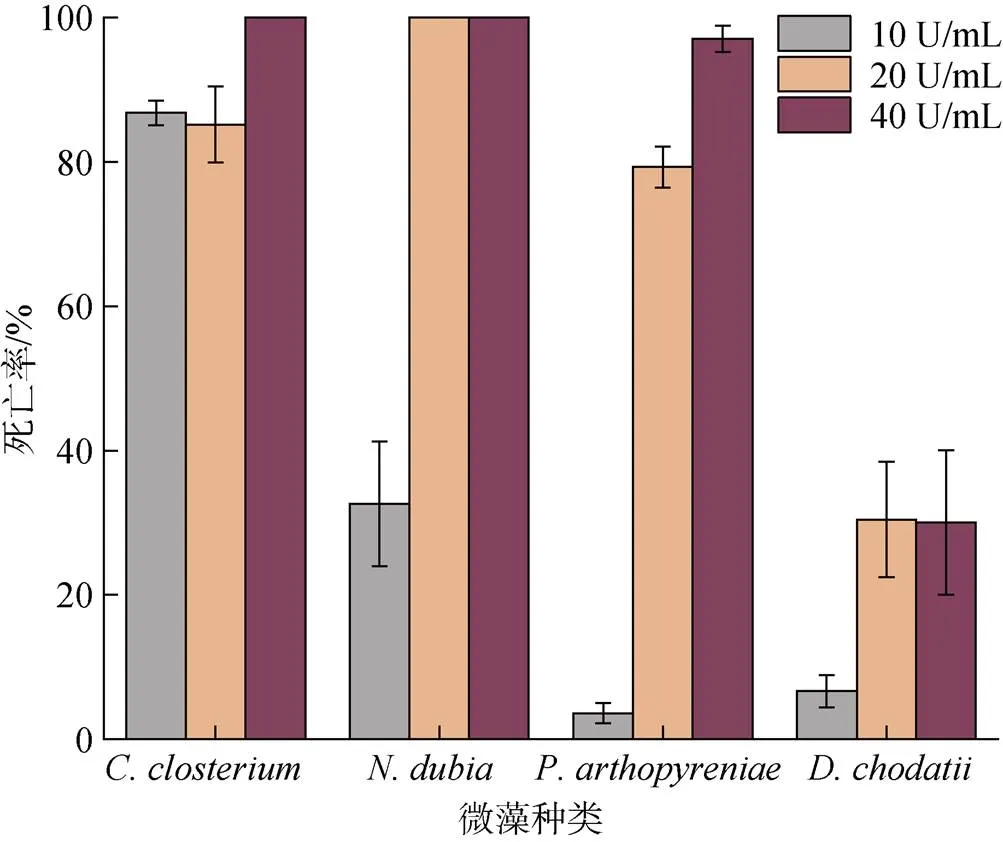
图5 氯霉素对部分微藻的处理结果
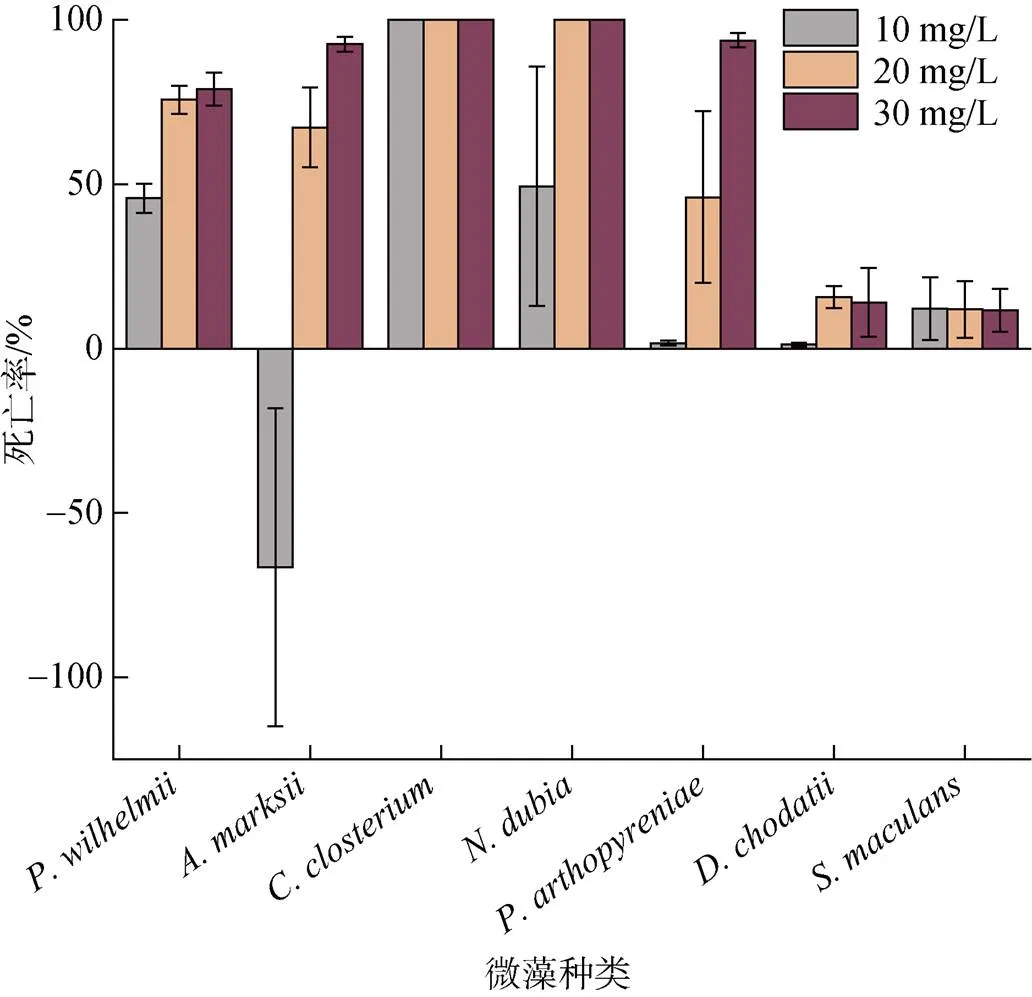
图6 草铵膦对部分微藻的处理结果
对草铵膦格外敏感, 在低浓度(10 mg/L)时就已经全部死亡, 低浓度草铵膦对和也具有一定致死性, 反而对的生长起到促进作用。中浓度草铵膦(20 mg/L)对表现出极高的致死率, 对、和也产生了比较明显的致死效果。在高浓度(30 mg/L)时, 草铵膦对、和的致死率分别达到了92.61%、78.96%、93.82%。整体来看, 草铵膦对硅藻的处理效果更加明显。
2.3.3 二氧化锗(GeO2)处理结果
选取、、和进行GeO2处理实验。实验浓度的GeO2对绿藻处理效果不明显, 死亡率最高为34.81%; 硅藻、、在15 mg/L GeO2处理后死亡率分别为64.88%、92.31%、100%, 其中在GeO2浓度为10 mg/L时已经全部死亡(图7)。
3 讨论
条斑紫菜作为重要经济海藻之一, 其叶状体在栽培过程中容易受到其他大型海藻的影响。据《2017年江苏海洋灾害公报》显示, 2017年江苏省海域马尾藻“金潮”大规模暴发, 漂浮的马尾藻堆积在养殖设施上, 导致紫菜筏架倒塌、缆绳断裂, 受灾之处几乎绝收, 直接经济损失4亿多元, 占全省海洋灾害经济损失的9成以上。除了这种突发性事件外, 紫菜养殖筏架和网绳上还经常会有各种绿藻的附生, 这些绿藻包括浒苔、缘管浒苔、扁浒苔、曲浒苔等[14]。在本研究中, 我们也发现了浒苔和曲浒苔的附着。许多学者开展了紫菜养殖过程中大型绿藻清除方法的研究, 主要包括晒网、柠檬酸浸泡、冷藏网、次氯酸钠和过碳酸钠处理等[5, 15-16], 已取得良好的处理效果并已应用于实际生产过程中。条斑紫菜丝状体养殖过程中也会受到海水中有害藻类的侵染, 目前采用海水黑暗沉淀的方法, 在丝状体繁育前期清除有害藻效果较为显著[3]。
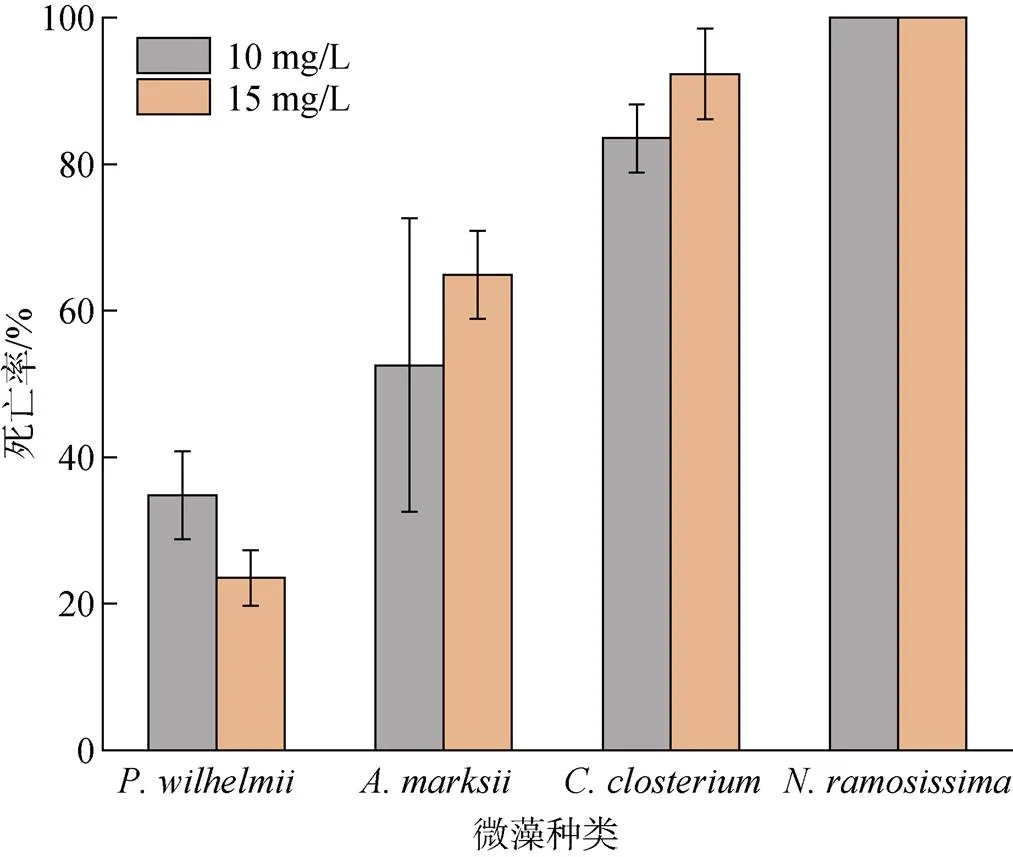
图7 二氧化锗对部分微藻的处理结果
如何减少这些有害藻类对条斑紫菜生长发育带来的影响已经成为众多学者关心和研究的问题[2, 14, 17-18]。但是关于条斑紫菜附生杂藻的研究, 一直以来都是从藻类门类来整体探究, 缺乏对优势有害藻类的针对处理。因此, 在本研究中我们开展了条斑紫菜叶状体和丝状体有害藻类研究,先分离鉴定有害藻类, 再针对具体藻类进行处理,在杂藻污染量化分析和优势杂藻防治等方面具有应用价值。
长期以来, 关于条斑紫菜附生硅藻的研究较多。实验室多采用日本学者的方法使用二氧化锗去除条斑紫菜上的硅藻。马家海曾用多种物理方法如酸碱、干燥、冷藏来去除硅藻的附着, 取得了良好效果[2]。李金波等[17]探索了使用超声波使附着硅藻脱落, 使用机械力给其他生物带来的影响更小。此外, 关于条斑紫菜其他门类杂藻的研究较少, 薛学坤等[19]对于条斑紫菜丝状体的各种杂藻污染给出了一些处理方法, 在硅藻污染时使用反复冲洗和二氧化锗浸泡, 在蓝藻污染时使用抗生素处理并多次换水, 在绿藻污染时降低光照。张美如[18]通过控制光照和使用青霉素及碳酸氢铵, 对丝状体种质扩繁过程中的一些绿藻污染做了有效预防处理。本文选取了氯霉素、草铵膦以及二氧化锗作为除藻剂, 探究对于从条斑紫菜生长过程中分离的各种有害杂藻的去除作用。
紫菜对氯霉素有很高的敏感性, 研究表明条斑紫菜体细胞在氯霉素浓度100 U/mL以下可以存活并持续生长[20], 李扬等[21]发现坛紫菜体细胞在100 μg/mL以下时可以存活1周以上。鉴于较高浓度的氯霉素会使条斑紫菜致死, 本文选取了较低浓度的氯霉素对杂藻进行处理, 根据图5可以看出, 较低浓度的氯霉素可以使多种藻产生了一定致死性, 说明实验浓度氯霉素可以对条斑紫菜一些附生杂藻进行有效清除。
草铵膦作为常用的灭生性除草剂, 对多种藻类都有一定的影响。在对铜绿微囊藻的研究中发现, 草铵膦对其毒性效应有“低促高抑”现象[22], 与本文图6中草铵膦对的作用效果相似。同时, 在草铵膦对普通单细胞小球藻的毒性研究中, 发现使小球藻产生了一定的氧化损伤[23], 本文图6展现了草铵膦对于小球藻科的具有一定的毒害效应。
二氧化锗长期以来作为除硅藻剂广为使用, 有研究发现二氧化锗浓度在20 mg/L以下时, 对条斑紫菜叶状体不产生毒性效应[18]。本文选用的二氧化锗浓度为10 mg/L与15 mg/L, 均低于上述浓度。马家海等[24]的研究表明二氧化锗对硅藻的影响主要是对其细胞壁的破坏, 从而阻碍硅藻细胞形成。本文图7也证实了二氧化锗对硅藻具有较强的处理效果。
基于水产养殖禁用药物品种简表, 氯霉素在水产养殖中被列为禁用抗生素, 同时草铵膦也在一些国家和我国部分省份被禁止使用, 因此本文仅建议相关抑制剂在实验室水平的种质保存方面使用。
4 结论
本文通过形态学分析与分子生物学鉴定, 在条斑紫菜叶状体与丝状体中分离出了多种附生杂藻, 对其形态做了简单描述, 并选取了部分微型杂藻进行了抑制剂实验, 结果显示: 影响条斑紫菜栽培和种质保存的有害藻类种类较多; 低浓度的氯霉素与草铵膦对于部分绿藻与硅藻有一定抑制效果; 二氧化锗对于去除硅藻具有良好效果。本研究有助于全面、深入地了解条斑紫菜生长过程中的有害藻类, 为解决条斑紫菜生长受杂藻影响的问题提供了有效的方法借鉴。
致谢: 感谢中国科学院海洋研究所李宇航博士建议部分新拟中文名称, 特此致谢!
[1] 陆勤勤, 周伟, 朱建一, 等. 中国条斑紫菜产业的历史、现状与发展趋势[J]. 中国海洋经济, 2018(1): 3-11. LU Qinqin, ZHOU Wei, ZHU Jianyi, et al. The history, status quo and development trend ofindustry of China[J].Marine Economy in China, 2018(1): 3-11.
[2] 马家海. 条斑紫菜硅藻附着症防治研究[J]. 上海水产大学学报, 1996, 5(3): 163-169. MA Jiahai. Studies on the prevention and cure for diatom felt disease of[J]. Journal of Shanghai Fisheries University, 1996, 5(3): 163-169.
[3] 施敏健, 王惠冲. 条斑紫菜人工育苗期预防绿藻的方法[J]. 水产养殖, 1996(2): 10-11. SHI Minjian, WANG Huichong. Method for preventing green algae in artificial seedling stage of[J]. Journal of Aquaculture, 1996(2): 10-11.
[4] 中国科学院海洋研究所藻类实验生态组. 条斑紫菜的人工养殖[M]. 北京: 科学出版社, 1978. Algae Experimental Ecology Group, the Institute of Oceanology, Chinese Academy of Sciences. Artificial culture of[M]. Beijing: Science Press, 1978.
[5] 陈昌生, 翁琳, 汪磊, 等. 干露和冷藏对坛紫菜及杂藻存活与生长的影响[J]. 海洋学报, 2007, 29(2): 131-136. CHEN Changsheng, WENG Lin, WANG Lei, et al. Influence of desiccation and cold preservation on the survive and growth ofand unwanted-alga[J]. Acta Oceanologica Sinica, 2007, 29(2): 131-136.
[6] DU G, WU F, MAO Y, et al. DNA barcoding assessment of green macroalgae in coastal zone around Qingdao, China[J]. Journal of Ocean University of China, 2014, 13(1): 97-103.
[7] DARIENKO T, PROESCHOLD T. Toward a monograph of non-marine Ulvophyceae using an integrative approach (Molecular phylogeny and systematics of terrestrial Ulvophyceae II.)[J]. Phytotaxa, 2017, 324(1): 1-41.
[8] LIU C, SUBASHCHANDRABOSE S, MING H, et al. Phycoremediation of dairy and winery wastewater usingsp.MM1[J]. Journal of Applied Phycology, 2016, 28(6): 3331-3341.
[9] 胡蝶, 程宝文, 邢豫明, 等. 滇池水域硅藻DNA多态性检验引物的筛选[J]. 中国法医学杂志, 2018, 33(3): 280-285. HU Die, CHENG Baowen, XING Yuming, et al. Screening of primers for DNA polymorphism test of diatom in Dianchi[J]. Chinese Journal of Forensic Medicine, 2018, 33(3): 280-285.
[10] 薛红凡. 基于DNA条形码技术的山东半岛潮间带褐藻和绿藻分类研究[D]. 青岛: 中国海洋大学, 2014. XUE Hongfan. Classification research of maroalgae of brown algae and green algae from the intertidal zone of Shandong Peninsula based on DNA barcoding technology[D]. Qingdao: Ocean University of China, 2014.
[11] 黄美玲, 何庆, 黄建荣, 等. 小球藻生物量的快速测定技术研究[J]. 河北渔业, 2010(4): 1-3, 14. HUANG Meiling, HE Qing, HUANG Jianrong, et al. A rapid determination ofbiomass[J]. Hebei Fisheries, 2010(4): 1-3, 14.
[12] 霍元子, 田千桃, 徐栅楠, 等. 浒苔对米氏凯伦藻生长的克生作用[J]. 海洋环境科学, 2010, 29(4): 496-499.HUO Yuanzi, TIAN Qiantao, XU Zhanan, et al. Allelopathic effects ofon growth of[J]. Marine Environmental Science, 2010, 29(4): 496-499.
[13] FRANKE J D, BRAVERMAN A L, CUNNINGHAM A M, et al. Erythrosin B: a versatile colorimetric and fluorescent vital dye for bacteria[J]. Biotechniques, 2020, 68(1): 7-13.
[14] 陈斌斌, 马家海, 蔡永超, 等. 江苏省如东海区条斑紫菜栽培筏架固着L.属绿藻的分子生物学与形态学分析[J]. 海洋环境科学, 2013, 32(3): 394-397. CHEN Binbin, MA Jiahai, CAI Yongchao, et al. Morphological and molecular analysis of attachedL. green algae fromrafts from Rudong coasts in Jiangsu Province[J]. Marine Environmental Science, 2013, 32(3): 394-397.
[15] 朱莹. 紫菜养殖筏架固着绿藻的清除方法研究[D]. 上海: 上海海洋大学, 2014. ZHU Ying. Studies on the methods for removing attachedL. green algae fromraft[D]. Shanghai: Shanghai Ocean Universiy, 2014.
[16] 严兴洪, 钟晨辉, 亓庆宝, 等. 鲜冻与酸处理对坛紫菜和浒苔苗存活的影响[J]. 上海海洋大学学报, 2011, 20(5): 697-704. YAN Hongxing, ZHONG Chenhui, QI Qingbao, et al. Effects of refrigeration and acid treatment on the survival of the blades inand[J]. Journal of Shanghai Ocean Universiy, 2011, 20(5): 697-704.
[17] 李金波, 阎斌伦, 秦松, 等. 超声波对条斑紫菜硅藻附着症的作用[J]. 海洋科学, 2007, 31(12): 1-3. LI Jinbo, YAN Binlun, QIN Song, et al. Effect of ultrasonic on diatom felt disease of[J]. Marine Sciences, 2007, 31(12): 1-3.
[18] 张美如. 条斑紫菜种质扩繁与保存中污染控制技术研究[D]. 南京: 南京农业大学, 2010. ZHANG Meiru. Study on large-scale artificial breeding technology of[D]. Nanjing: Nanjing Agricultural University, 2010.
[19] 薛学坤, 唐兴本, 陈百尧, 等. 对条斑紫菜自由丝状体污染的防与治[J]. 水产养殖, 2015(11): 23-25. XUE Xuekun, TANG Xingben, CHEN Baiyao, et al. Prevention and treatment of free filamentous pollution of[J]. Journal of Aquaculture, 2015(11): 23-25.
[20] 沈怀舜, 王素娟. 紫菜体细胞对抗生素的敏感性实验[J]. 海洋科学, 1998, 22(1): 67-69. SHEN Huaishun, WANG Sujuan. The test of antibiotic sensitivity of sommatic cells of[J]. Marine Sciences, 1998, 22(1): 67-69.
[21] 赵扬, 李秀, 左正宏, 等. 坛紫菜叶状体体细胞对抗生素敏感性的研究[J]. 台湾海峡, 2004, 23(4): 496-499. ZHAO Yang, LI Xiu, ZUO Zhenghong, et al. Antibiotics sensitivities of somatic cells ofthallus[J]. Journal of Oceanography in Taiwan Strait, 2004, 23(4): 496-499.
[22] 周聪. 两种灭生性除草剂暴露对铜绿微藻藻毒素产生和分泌影响的机制研究[D]. 杭州: 浙江工业大学, 2013. ZHOU Cong. The synthesis and release mechanism research of microcystin of microcystin aeruginosa exposed to two sterilant herbicides[D]. Hangzhou: Zhejiang University of Technology, 2013.
[23] QIAN H F, CHEN W, SHENG G D, et al. Effects of glufosinate on antioxidant enzymes, subcellular structure, and gene expression in the unicellular green alga[J]. Aquatic Toxicology, 2008, 88(4): 301-307.
[24] 马家海, 刘青. 二氧化锗对坛紫菜自由丝状体生长发育的影响[J]. 水产学报, 1989, 13(1): 36-41. MA Jiahai, LIU Qing. The effect of germanium dioxide (GeO2) on the groeth of free-living conchocelis of[J]. Aquaculture and Fisheries, 1989, 13(1): 36-41.
Isolation and identification of harmful algae during the cultivation of
DU Yi-fei1, WANG Guang-ce2, 3, 5, NIU Jian-feng2, 3, 5, FENG Ze-zhong2, 3, WANG Xu-lei2, 3, 5, ZHUO Jin-tao2, 3, 4, SHAO Zhi-zhuo2, 3, 4, HUAN Li2, 3, 5, GONG Xiang-zhong1
(1. College of Marine Life Sciences, Ocean University of China, Qingdao 266003, China; 2. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 3. Laboratory for Marine Biology and Biotechnology, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China; 4. University of Chinese Academy of Sciences, Beijing 100049, China; 5. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China)
To inhibit harmful algae in the cultivation of, the separation and identification of harmful algae in leafy thalli and filamentous thalli were studied. Through morphological analysis and molecular biology identification, it was revealed that there were large green algae (,), large red alga (), microgreen algae, and diatoms in the leafy thalli. While brown algae, microgreen algae, and diatoms were mainly found in filamentous thalli. The inhibitor treatment experiments were carried out on some harmful microalgae. The results demonstrated that low concentrations of antibiotics could effectively inhibit the growth of some diatoms and green algae, and germanium dioxide exhibited a significant inhibitory effect on the growth of diatoms. The results provide a scientific basis for the systematic and comprehensive understanding of harmful algae in the cultivation of.
; leafy thalli; filamentous thalli; harmful algae; separation and purification; molecular identification
Jul. 14, 2022
P735
A
1000-3096(2023)6-0070-09
10.11759/hykx20220714002
2022-07-14;
2022-08-22
国家藻类产业技术体系(CARS-50), 山东省“泰山学者”工程专项经费资助项目(tspd20210316)
[Supported by the Earmarked Fund for CARS, No. CARS-50, the Research Fund for the Taishan Scholar Project of Shandong Province, No. tspd20210316]
杜艺菲(1998—), 女, 山东泰安人, 硕士研究生, 主要从事藻类分子生理学研究, E-mail: duyifei@foxmail.com; 郇丽(1986—),通信作者, 山东临沂人, 副研究员, 主要从事藻类分子生理学与发育调控研究, E-mail: huanli@qdio.ac.cn; 宫相忠(1963—), 通信作者, 山东青岛人, 教授, 主要从事海藻实验生态学研究, E-mail: gxzhw@ ouc.edu.cn
(本文编辑: 赵卫红)
