老年吸入性肺炎支气管肺泡灌洗液的生物学标志物和病原学分析
2023-08-23时铭蔚周朝娥王立娜孙春萍李君刘新民
时铭蔚 周朝娥 王立娜 孙春萍 李君 刘新民
吸入性肺炎(aspiration pnuemonia, AP)的发病率随着年龄的增长而不断增加,在80岁以上的人群中,60.1%的社区获得性肺炎(community acquired pneumonia, CAP)和86.7%的医院获得性肺炎为AP[1]。AP在老年人中高发的主要原因为:老年人脑血管和退行性神经系统疾病的发病率增加,吞咽困难和咳嗽反射受损,更容易发生口咽部误吸[2]。准确、快速地识别老年AP有助于及时调整治疗以及护理方案,改善病人的预后。胃蛋白酶由胃主细胞分泌,在正常的呼吸标本中不存在,研究证实它可以用于胃食管反流病的辅助诊断[3]。淀粉酶来源于胰腺、唾液腺和胃肠道,不易通过肺泡屏障,当病人发生口咽误吸时,在支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)内可检测到淀粉酶[4]。然而,胃蛋白酶和淀粉酶是否可以作为识别老年AP的生物学标志物尚未得到证实。本研究拟探索BALF中淀粉酶和胃蛋白酶水平对老年AP的诊断价值,并分析老年AP病人BALF中的病原学特征。
1 研究对象和方法
1.1 研究对象 本研究纳入2021年9月至2022年1月北京大学第一医院住院治疗的65名受试者。所有受试者年龄均>60岁,符合肺炎诊断标准[5]。如果病人同时具备以下任何一项条件,则被诊断为AP:(1)护工或他人证实的误吸;(2)因吞咽功能异常或吞咽困难易发生误吸且临床医生严重怀疑AP的病人;(3)胸部CT显示重力依赖性肺段的证据。其余的肺炎病人则定义为非吸入性肺炎(no-AP)病人。排除呼吸机相关肺炎、开放性肺结核、新型冠状病毒肺炎、免疫状态低下和有肺部或头颈部肿瘤的病人。本研究经医院伦理委员会核准后进行(批号:2021-309),病人均知情同意。
1.2 方法
1.2.1 资料收集:根据纳入、排除标准收集病人的病历资料,包括人口学信息(年龄和性别)、合并疾病(高血压、糖尿病、急性心肌梗死以及脑梗死等)、临床表现(呕吐、呼吸困难以及吞咽困难等)。
1.2.2 样本采集:所有病人在入组48 h内按照标准流程完成BALF的采集[6],根据胸部影像学或内镜表现判断取样的节段。
1.2.3 生物学标志物检测:将BALF进行1000 r/min离心,取上清液进行检测。(1)淀粉酶检测:采用全自动生化分析仪(AU5800,贝克曼,美国)检测淀粉酶的活性[4]。(2)胃蛋白酶检测:使用ELISA试剂盒(USCN Life Science,武汉,中国),该试剂盒可以特异性检测人胃蛋白酶A,最低检测限为1.27 ng/mL。运用多功能酶标仪在450 nm的波长下测定吸光度,并计算样品浓度。
1.2.4 BALF中病原学检测:BALF同时送检传统病原学检测,包括细菌、真菌涂片及培养,呼吸道多项病原抗体检测,病毒核酸PCR检测、抗体检测、半乳甘露聚糖试验和(1,3)-β-D-葡聚糖试验等。对于常见的污染微生物,如凝固酶阴性葡萄球菌、草绿色链球菌、棒状杆菌属以及丙酸杆菌属等在本研究中视为阴性。
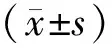
2 结果
2.1 研究人群基本资料 65例病人中有30例病人诊断为AP,AP组中位年龄显著高于no-AP组(P<0.05);AP组病人合并急性心肌梗死、脑梗死、反流性食管炎和骨折的比例明显多于no-AP组(均P<0.05);AP组发生休克、呕吐、呼吸困难、吞咽困难和意识障碍的比例也显著多于no-AP组(均P<0.05)。见表1。年龄≥70岁(86.7%)、脑梗死(66.7%)和肠内营养(70.0%)是AP组最常见的误吸危险因素。53.3%的AP组病人至少存在3个误吸危险因素。见图1。
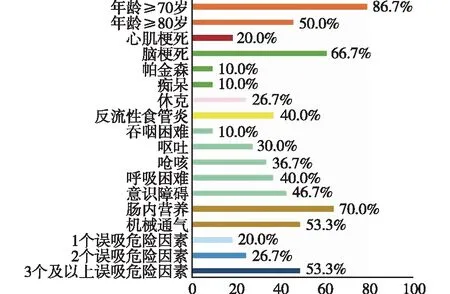
图1 AP组病人误吸危险因素的组成
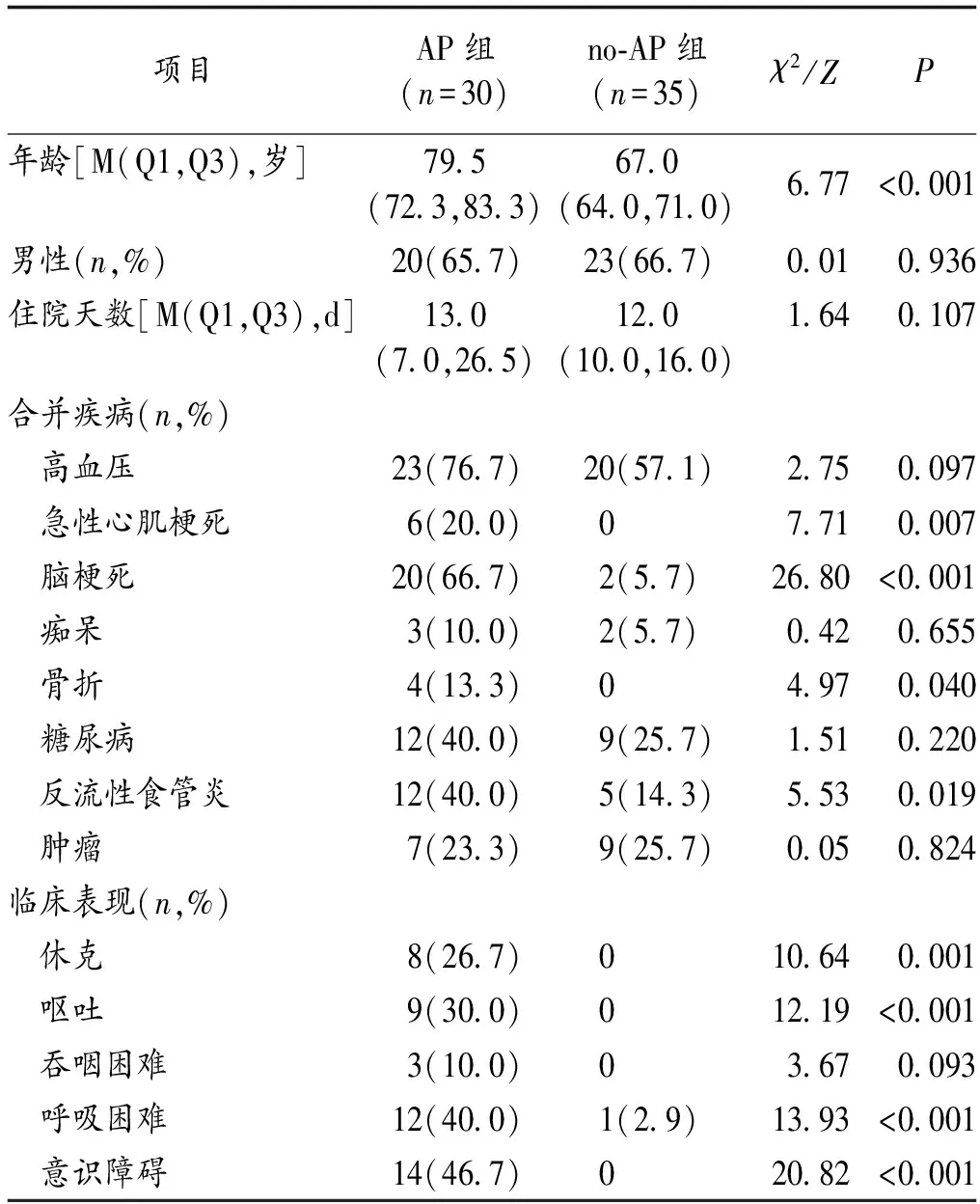
表1 2组受试者的基线特征比较
2.2 2组BALF中胃蛋白酶和淀粉酶水平比较 AP组和no-AP组中位胃蛋白酶水平分别为1.8(0,9.9) ng/mL和1.1(0,4.8) ng/mL,差异无统计学意义(P=0.608)。AP组和no-AP组中位淀粉酶水平分别为878.0(253.9,3394.2) IU/L和88.6(31.0,170.8) IU/L,差异有统计学意义(P<0.001)。
2.3 绘制ROC曲线评估BALF中淀粉酶辅助诊断AP的价值 ROC曲线的AUC为0.83(95%CI: 0.72~0.94),截断值为338.3 IU/L,敏感度为77.3%,特异度为88.6%。
2.4 2组病原体分析 AP组和no-AP组病原体检测阴性率分别为23.3%(7/30)和42.9%(15/35)。AP组检出的微生物主要包括肺炎克雷伯菌、铜绿假单胞菌、金黄色葡萄球菌和鲍曼不动杆菌,no-AP组检出的微生物主要包括白色念珠菌和肺炎克雷伯菌,2组肺炎克雷伯菌和金黄色葡萄球菌检出率差异有统计学意义。见图2。BALF中细菌检测阳性病人(n=43)的中位淀粉酶水平显著高于细菌检测阴性病人(n=22)[408.9(165.3,1979.0) IU/L比48.4(24.2,98.4) IU/L,P<0.001],两者胃蛋白酶水平差异无统计学意义[2.5(0,9.9) ng/mL比0(0,2.6) ng/mL]。
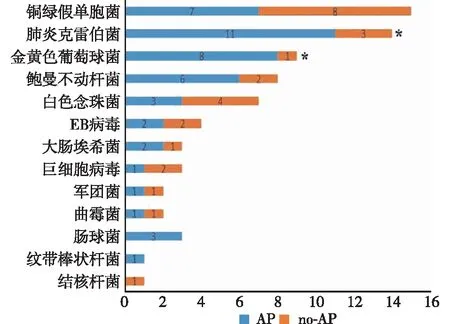
注:与AP组比较,*P<0.05图2 2组病人的微生物检测结果
3 讨论
AP是老年肺炎的一个常见类型,随着年龄的增加,AP的发病率逐渐增加。AP的诊断依据主要是病人的误吸史、误吸危险因素和肺部重力依赖性影像学表现等[2]。但老年AP往往症状不典型、起病隐匿,极易进展为重症肺炎。目前缺少快速准确的诊断方法,病人无法得到及时、有效的诊疗。生物标志物如可溶性髓系细胞触发受体[7]、降钙素原[8]等诊断AP的效果不佳。胃蛋白酶是胃内容物反流到食道和下呼吸道的生物标志物,淀粉酶是口咽分泌物进入肺部的生物学标志物,二者均直观地反映了误吸的过程,本研究分析了这两种误吸生物标志物对老年AP的诊断价值。
本研究发现AP组和no-AP组病人BALF中胃蛋白酶水平差异无统计学意义(1.8 ng/mL比1.1 ng/mL)。主要原因可能是胃蛋白酶在酸性环境下才能保持活性,而BALF的pH值为7.5[9]。目前的研究也尚未明确BALF中胃蛋白酶的半衰期[10],也有可能是本研究中发生胃内容物误吸的病人较少。本研究AP组BALF中淀粉酶水平显著高于no-AP组(878.0 IU/L比88.6 IU/L),淀粉酶诊断AP的AUC为0.83。Suzuki等[11]研究发现,BALF中淀粉酶诊断AP的灵敏度为77.1%,特异度为84.2%。而且淀粉酶的检测窗口时间较长、成本低,临床可以快速获得检测结果,可以作为诊断AP的一个快速有效的生物标志物。本研究发现,BALF中细菌检测阳性者的淀粉酶水平显著高于阴性病人(408.9 IU/L比48.4 IU/L)。Weiss等[12]检测了280例病人的296个BALF样本中的淀粉酶结果,发现细菌性肺炎病人的BALF中淀粉酶显著升高,用BALF中淀粉酶区分培养阳性和阴性肺炎病人的AUC为0.67,这表明BALF中淀粉酶也可能与细菌性肺炎相关。本研究没有采集健康人的BALF,但在no-AP组受试者中也检测到了胃蛋白酶和淀粉酶。Gleeson等[13]通过多导睡眠扫描图发现,50%的健康成年男性在睡眠过程中会发生误吸,这说明健康人也存在一定程度的误吸,AP并不是仅由误吸事件引起的,与宿主防御能力下降和吸入的微生物也密切相关[14]。
本研究结果显示,AP病人BALF中最常见的病原菌是肺炎克雷伯菌、铜绿假单胞菌、金黄色葡萄球菌和鲍曼不动杆菌,我们并未发现厌氧菌。目前的研究也显示,AP的病原学发生了变化,厌氧菌群不再是主要病原体[15-16]。Marin-corral等[15]纳入了2606例CAP病人,其中193例(7.4%)为AP,对所有病人的呼吸道样本进行微生物学检测后发现,AP、有误吸危险因素的CAP以及无误吸危险因素的CAP病人厌氧菌的检出率均较低(0.5%、0.3%、0),可能因为大部分病人都接受了抗厌氧菌药物治疗。老年病人因免疫力低、基础疾病多并且长期使用抗菌药物,易感染肺炎克雷伯菌和铜绿假单胞菌等革兰氏阴性菌[17]。另外,本研究在AP病人中检出了粪肠球菌、白色念珠菌等上呼吸道或肠道的常驻细菌,这些细菌在长期卧床、机械通气、肠内营养的老年病人中易形成牙菌斑被吸入到下气道引发AP[18]。因此,必须重视老年病人的口腔卫生,例如标准的洗手程序、清洁残留在口腔中的食物残渣、假牙清洁以及使用复方氯己定、0.35%聚维酮碘的方法以预防AP的发生和进展[19-20]。
本研究存在一定的局限性。首先,AP没有明确的诊断标准,本研究的纳入标准可能会导致一部分AP病人的漏诊。其次,本研究纳入的样本量小,病原体结果可能不足以代表老年AP的病原体组成。最后,由于在采集样本前多数病人经验性使用抗生素,有误吸危险因素的病人可能已经使用了抗厌氧菌的药物,影响了病人的病原学检测结果。综上所述,BALF中淀粉酶可以作为诊断老年AP的一种快速有效的办法,帮助临床医生早期识别AP并预防AP的进展。
