微球新制剂在药学综合实验教学中的设计与应用
2023-08-22邱立朋方文杰陈敬华
邱立朋,胡 笳,方文杰,陈敬华
(江南大学生命科学与健康工程学院,江苏无锡 214122)
0 引 言
在医药产业高速发展和利好政策的背景下,我国正在向药物研发强国转型,因此,创新型药学应用人才的培养是促进我国提高医药产业竞争力的关键[1-2]。实验教学是药学专业人才培养中的重要实践环节,是培养学生综合知识应用、科学性思路、创新精神和实践动手能力的重要手段[3]。综合型药学实验是在掌握专业理论知识和基本实验操作后进行的多个知识点整合的专业实验教学,其内容涉及多门课程知识或者药物研发和科学研究中的综合知识,突出对专业知识的灵活运用和行业发展的整体把握。目前,越来越多高校重视对药学综合型实验教学的不断改革与探索,不断提高学生对专业的学习兴趣,增强学生动手实践能力和创新研究思维,为医药产业培养高素质创新性药学专业人才而努力[4-5]。
微球是目前备受关注的药物新剂型,它是将药物通过物理或者化学方法溶解、分散或吸附在高分子载体材料中形成的微米级球状实体[6]。微球能够保护药物不被非特异性细胞和组织改变其生物分布或排出体内,实现缓控释放,降低全身血药浓度,提高治疗效果[7-9]。自2000 年注射用醋酸亮丙瑞林微球上市以来,微球制剂作为改良剂型的高端制剂代表,因独特的技术与市场优势,受到医药企业的广泛关注。阿霉素为蒽环类抗肿瘤药物,是一种临床常用的化疗药物,主要用于急性白血病、支气管肺癌、肝癌等的治疗。然而,它有着较大的心脏毒性等副作用,临床需严格限制其使用剂量,以减少其引起的不良反应[10]。因此,近年来药学研究人员一直对阿霉素改良剂型进行研究[11-13]。白蛋白因其良好生物相容性和载药能力被广泛研究[14-15],例如上市药物紫杉醇白蛋白纳米粒。目前被进行研究的白蛋白主要分为卵清蛋白、人血清白蛋白和牛血清白蛋白(Bovine Serum Albumin,BSA)。BSA廉价易得,可以通过物理或化学手段制备成安全性好和可生物降解的微球制剂,从而增加难溶性药物的溶解度、降低药物的毒副作用,实现抗肿瘤药物的靶向递送和缓控释放[16-18]。
实验设计方法是科研过程中筛选和优化处方工艺的常用手段,它可以科学合理地安排实验,提高实验效率,尽快得到最优结果。因此,将科学前沿成果与本科实验教学相结合,把Plackett-Burman 和正交设计法用于药学综合创新实验“阿霉素白蛋白微球的制备与表征”。通过引入不同因素的筛选优化和分析,培养学生科学研究思路和综合运用知识的能力,利于他们把握行业研究现状,开拓学习视野,激发科学研究的兴趣。该实验操作较为简单,具有较强的新颖性和综合性,使学生体验新药研发的思路,感受药物新剂型的魅力,树立为建设新药强国的责任和信心。
1 实验方法
1.1 材料与仪器
牛血清白蛋白(上海碧云天生物有限公司),盐酸阿霉素(上海生工生物工程公司),司盘-80(上海阿达玛斯试剂有限公司),吐温-80(南京化学试剂股份有限公司),戊二醛、液体石蜡、无水乙醇、氯化钠(国药集团化学试剂有限公司),其他所用试剂均为分析纯。
紫外可见分光光度计(UV-2550,日本岛津公司),旋转蒸发仪(RE-2000A,郑州科泰实验设备有限公司),电子分析天平(PR,奥豪斯仪器有限公司),集热式恒温加热磁力搅拌器(DF-101S,巩义市予华仪器有限责任公司),光学倒置显微镜(DMIL LED,徕卡仪器有限公司),超声细胞破碎仪(JY92-IIN,宁波新芝生物科技有限公司)。
1.2 阿霉素标准曲线测定
取空白牛血清白蛋白溶液、盐酸阿霉素溶液在200~800 nm 波长范围内进行扫描,确定最大吸收波长。精密称取盐酸阿霉素25 mg,置于250 mL容量瓶中,配置0.1 g/L的标准液。然后,精密量取1.0、2.0、3.0、4.0、5.0、6.0 mL分别移入10 mL容量瓶中,配制成标准系列浓度,于最大吸收波长处测定吸光度,以吸光度(x)对浓度(y)进行线性回归,绘制标准曲线。
1.3 空白微球的制备
采用乳化-化学固化法制备白蛋白微球。精密称取牛血清白蛋白溶于蒸馏水中,涡旋溶解,作为水相。液体石蜡为油相,司盘-80,吐温-80 作为乳化剂。在适当转速搅拌下,将水相逐滴加入油相中,继续乳化得到W/O型初乳后,再加入适量戊二醛溶液搅拌固化。无水乙醇清洗,20 ℃真空干燥即得空白微球。
在预实验基础上,选择Plackett-Burman 设计法进行处方优化。选择油水体积比、乳化剂的比例、交联剂与白蛋白的比例、水相白蛋白浓度、乳化时间和固化时间6 个因素作为考察的对象,各因素及其水平如表1所示。

表1 Plackett-Burman设计因素与水平
1.4 阿霉素白蛋白微球的制备
精密称取定量牛血清白蛋白和阿霉素避光溶解于蒸馏水中,涡旋溶解,作为水相,其余操作同空白微球制备方法。通过单因素初步确定影响因素后,采用四因素三水平L9(34)的设计正交实验设计法,以微球的包封率和载药率为指标,优化处方和工艺。正交设计因素及水平见表2。

表2 正交设计因素与水平
1.5 微球性质表征
选择光学显微镜辅助image J 进行微球的形态和粒径的评价。粒径分布计算式为SPAN =(D90-D50)/D10,数值越小表示粒径分布宽度越窄。紫外分光光度法测定微球中药物的包封率和载药量:称取阿霉素白蛋白微球和空白微球10 mg,加入20 mL 无水乙醇超声破碎,在480 nm波长处分别测定吸光度,计算包封率和载药量。动态透析法考察载阿霉素白蛋白微球的体外药物释放:选择0.9%的氯化钠溶液作为释放介质,称取5 mg阿霉素原料药和阿霉素白蛋白微球分散后,装于透析袋中(截面相对分子质量Mw=3 500),置于装有20 mL 释放介质的EP 管中,分别于不同时间点吸取2 mL透析液,并补充等量新鲜介质。紫外分光光度法测定阿霉素含量并计算累计释放度。
2 结果与讨论
2.1 标准曲线建立
通过紫外分光光度计扫描确定盐酸阿霉素在480.0 nm处有最大吸收,而空白BSA微球溶液在此波长无干扰,故选定480.0 nm 为检测波长。以吸光度(x)对浓度(y)进行线性作图,得到回归方程为
表明药物在0.01~0.06 g/L浓度线性范围内检测线性关系良好。
2.2 空白微球制备及优化
采用Plackett-Burman 设计法对空白微球的制备进行筛选和优化。以油水体积比(A)、乳化剂的比例(B)、交联剂与白蛋白的比例(C)、水相白蛋白浓度(D)、乳化时间(E)、固化时间(F)为考察因素,微球粒径和粒径分布为响应进行筛选,根据Plackett-Burman试验设计需求,G、H、J、K、L为未知的虚拟变量。实验安排和结果如表3 所示。
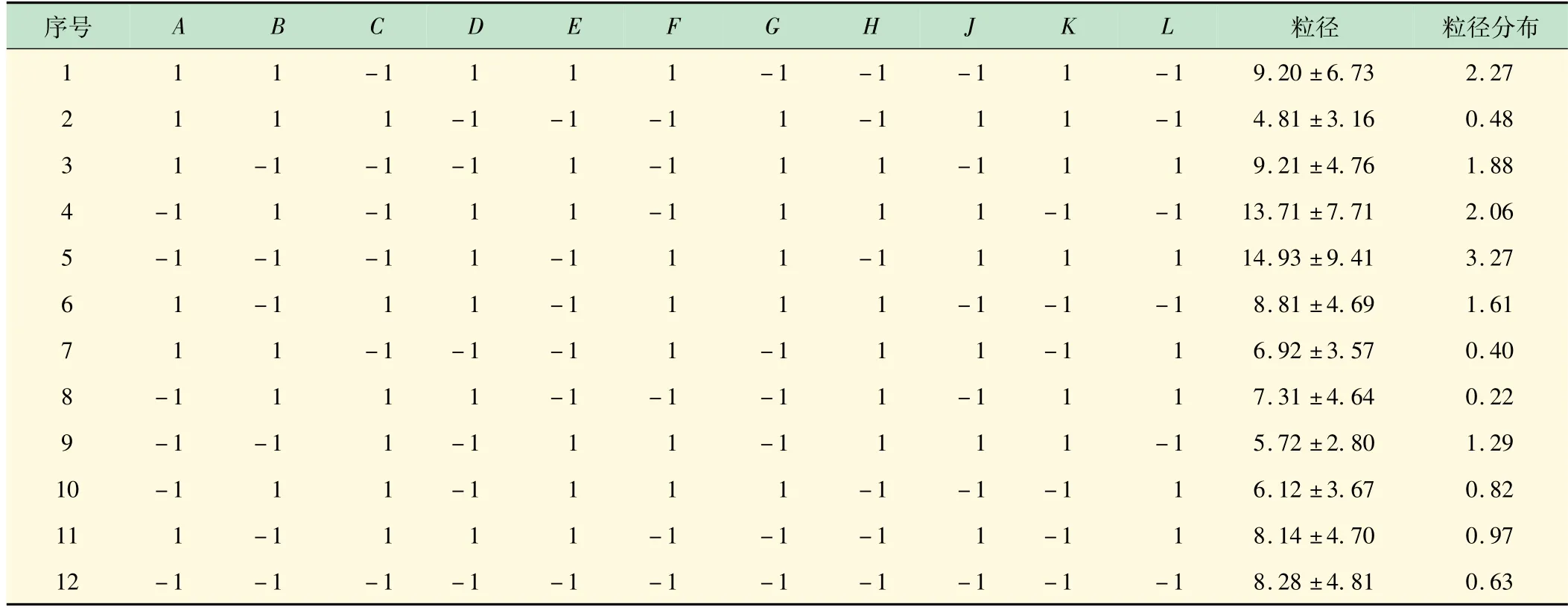
表3 Plackett-Burman设计的粒径和粒径分布结果
采用Design-Expert®软件(Version-12.0.3.0)进行试验结果分析,以多项式回归模型描述结果和因素之间的关系:因素前系数绝对值大小可以反映该变量对于响应的重要程度。结合表4 的F检验可见,各因素对粒径影响的显著性顺序依次为:C≈D>A>B,其中乳化剂比例显著相关(P<0.05),交联剂与白蛋白比例、白蛋白浓度和油水体积比这3 个因素极显著相关(P<0.01)。各因素对粒径分布影响的显著性顺序依次为:C>D>F>B>E,其中固化时间、乳化剂比例、乳化时间这3 个因素显著相关(P<0.05),交联剂与白蛋白比例和白蛋白浓度极显著相关(P<0.01)。
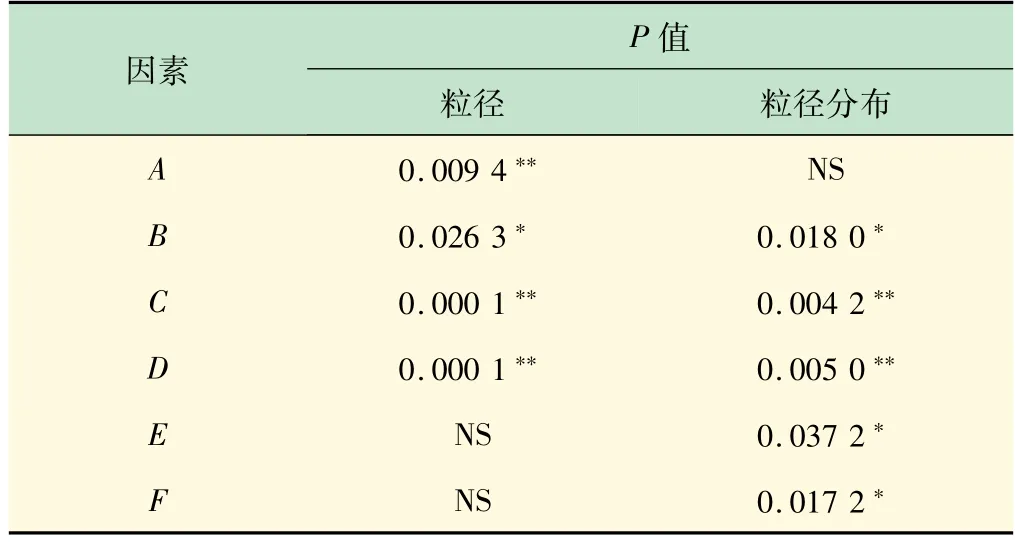
表4 Plackett-Burman设计的因素显著性方差分析结果
帕累托图表现效应对响应的估计影响,每条柱的值代表效应的估计绝对值除以t检验的t值,其中跨过参考线的条值在统计学上显著。如图1 所示,因素C和因素D在全部的6 个因素中对粒径的影响极显著,且因素C对粒径分布的影响也极显著。各因素显著性顺序与F检验结果一致,分析结果可靠。
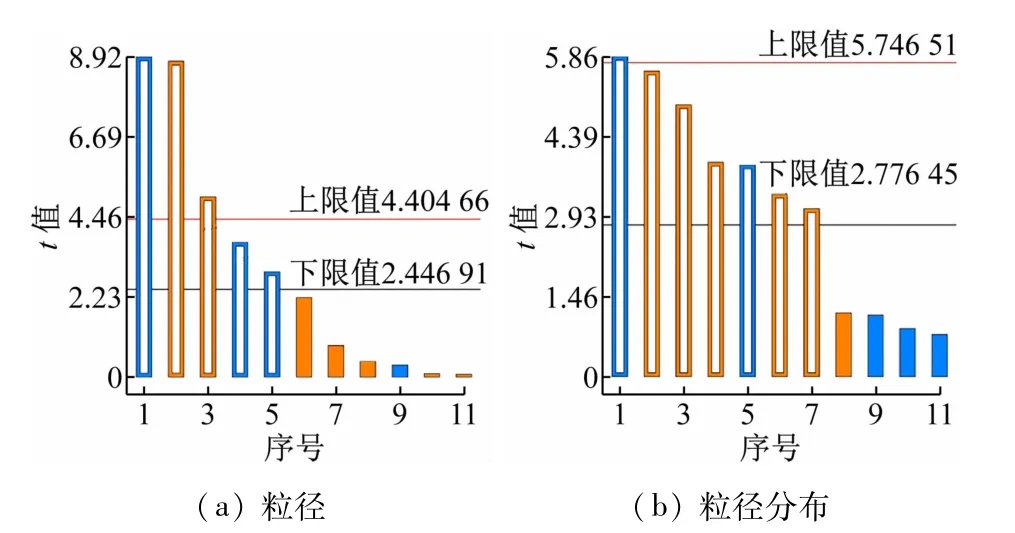
图1 Plackett-Burman设计标准化效应帕累托图
为验证回归模型可有效预测实际试验结果,表5和图2 提供各次试验的预测值与实际值的比较。除粒径分布试验3 外,试验和预测结果的偏差均无统计学意义。这可以认为Plackett-Burman 设计回归模型是基本符合事实的。
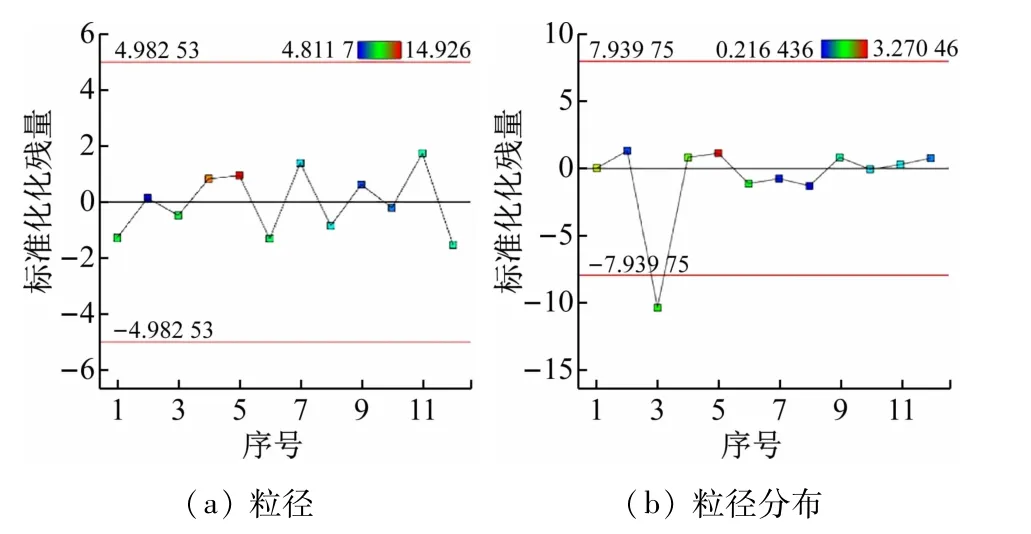
图2 Plackett-Burman设计的响应残差图
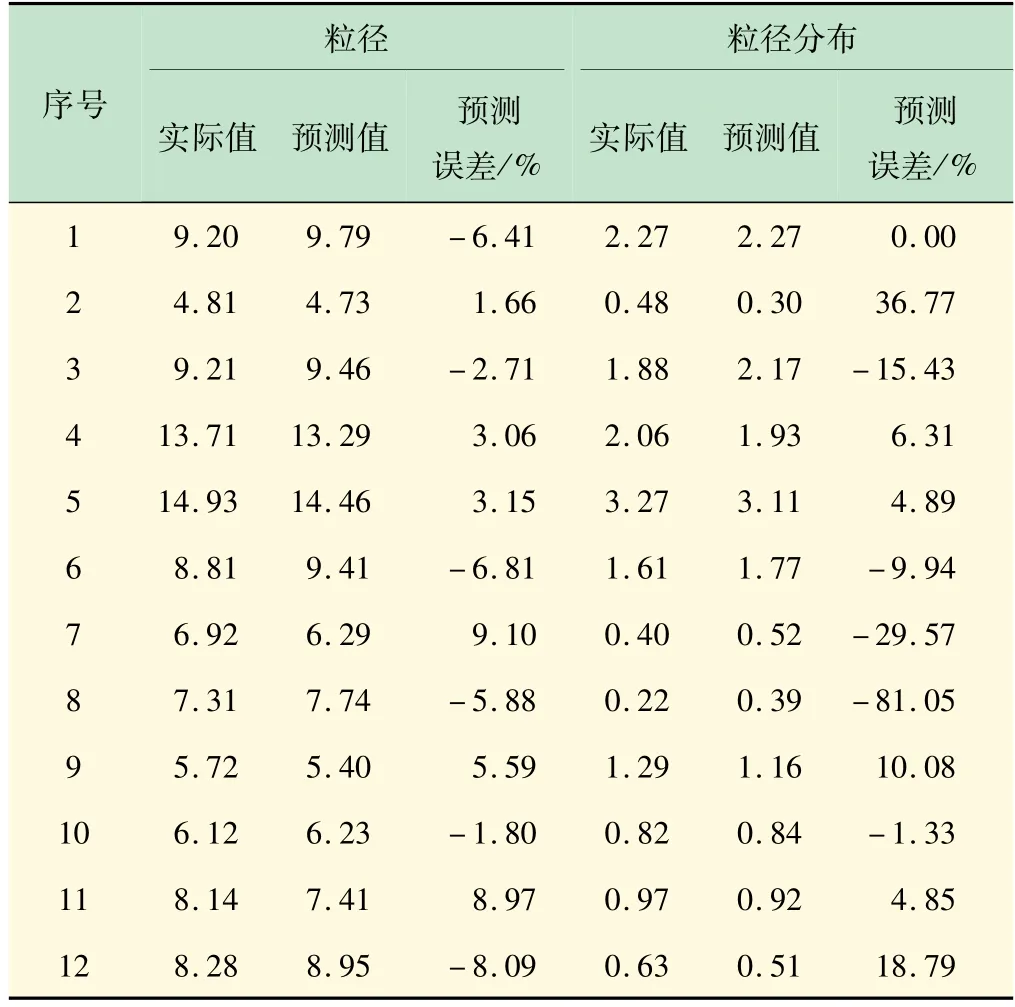
表5 Plackett-Burman设计的粒径和粒径分布实际值和预测值对比
2.3 阿霉素白蛋白微球处方及优化
采用正交实验设计法对载药微球的处方进行筛选和优化。以药物与蛋白质量比(σ)、蛋白浓度(β)、固化剂与蛋白比例(γ)和固化时间(δ)为考察因素,包封率和载药量为筛选指标进行试验。结果如表6 所示。
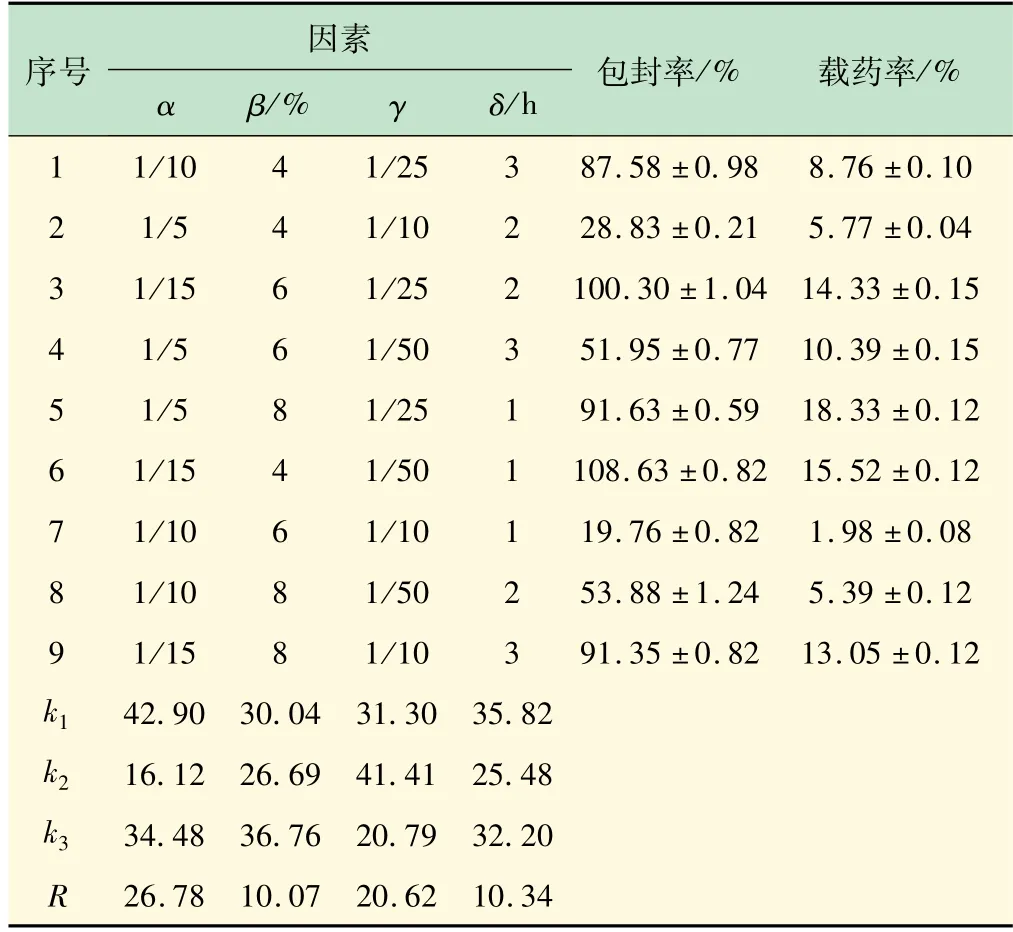
表6 正交试验结果
对实验数据进行极差分析,极差R的大小反应了各个影响因素对载药率的影响程度。从结果中可以看出,各因素对微球载药率的影响大小顺序为:α >γ >δ >β,即药物与白蛋白质量比对微球的载药率影响最大,其次是固化剂与白蛋白之间的比例。由表6 可见,阿霉素白蛋白微球的最佳处方工艺为α1β3γ2δ1,即药物与BSA质量比为1∶15,BSA 浓度为8%,固化剂与BSA比例为1∶25,固化时间为1 h。按照该工艺制备阿霉素白蛋白微球,通过紫外分光光度计测定载药量和包封率分别为16.74 ±0.42%和97.67 ±0.63%。
2.4 微球制剂学表征
通过显微镜观察白蛋白微球和阿霉素白蛋白微球的形态和粒径。由图3 可见,优化后最终制备的空白微球多为圆球形,表面光滑,粒径较均匀,由Image J计算平均粒径为(8.81 ±4.69)μm。阿霉素白蛋白微球为红色粉末,规则较为圆整,粒径均匀,约在10~25 μm。

图3 两种微球的显微图像
阿霉素白蛋白微球的体外释放如图4 所示。微球制剂中药物开始释放速度较快,8 h 累积释放量约30%,后来持续缓慢释放,72 h 的释放度达到(45.08±0.03)%。前期的突释可能是吸附在微球表面的药物引起的,而随后释放介质溶液渗入到微球内部,使得药物缓慢溶出。此外,通过阿霉素原料药的释放曲线发现,游离药物短时间内释放超过80%,这表明阿霉素白蛋白微球能够明显延迟药物的释放速度,具有较好的缓释效果。
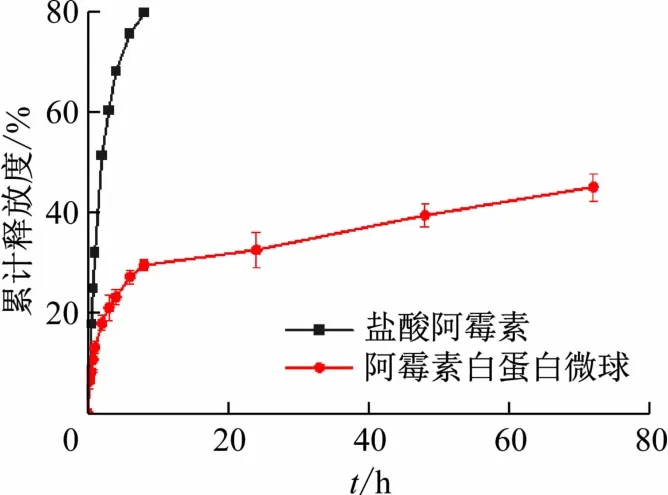
图4 游离药物和载药微球体外释放曲线
3 结 语
本实验教学将行业前沿研究、实验教学和专业人才培养结合起来,设计阿霉素白蛋白微球制备的综合性开放实验,涵盖制剂制备、药物分析、基本性质表征和实验设计方法的应用,使学生掌握新药研发趋势,综合运用专业知识,掌握基本科研思路。该实验通过Plackett-Burman和正交设计实验方法对空白微球和载药微球的处方和工艺进行筛选,然后对微球基本的粒径形态、载药量和体外释放进行考察。结果表明,优化后微球具有较为均一的粒径、良好的包封率和药物缓释作用。通过该实验,学生掌握制剂研发的基本流程,合理运用实验设计法,熟悉知识的交叉运用,拓宽专业学习视野,提高实践操作和综合创新能力。
