金抗肽SIF4 对大肠杆菌基于细胞壁靶点的非细胞质膜损伤抑菌机理
2023-08-22李玉珍肖怀秋曾梦琪赵谋明
李玉珍, 肖怀秋*,, 刘 淼, 王 琳, 曾梦琪, 赵谋明
(1. 湖南化工职业技术学院 制药与生物工程学院,湖南 株洲 412000;2. 华南理工大学 食品科学与工程学院,广东 广州 510641)
食品富含碳水化合物、蛋白质和脂肪等营养组分,在其加工链各节点均极易受到食源性致病菌污染,既影响营养价值,还可产生潜在生物毒素。 食源性致病菌(foodborne pathogen)以大肠菌群污染和大肠杆菌超标为主,是引起食品公共安全事故与食物中毒的重要病原菌[1]。 吴萱等从北京6 个辖区的大型超市和农贸市场随机采集259 份生鲜肉样本,大肠杆菌检出率为65.25%, 对甲氧苄氨嘧啶-磺胺甲恶唑高度耐药,其次为多西环素[2];张耀文等采用大肠杆菌荧光PCR 试剂盒对采集的90 份生鲜驼乳进行致病性大肠杆菌检测发现, 大肠杆菌检出率为20%[3];刘文双等分析山东不同地区蛋鸡养殖场分离的440 株大肠杆菌blaCTX-M基因流行情况及耐药性,32.27%菌株携带blaCTX-M基因, 携带blaCTX-M基因菌株阿莫西林耐药率最高,四环素耐药率次之[4]。
抗菌肽具有抗菌谱广、稳定性好、特异性强、对哺乳动物细胞毒副作用少且不易产生耐药性等优势,可多靶点作用于食源性致病菌,是最具潜力的抗生素替代品,特别适用于多重耐药性食源性致病菌抑制[5-6]。 由于抗菌肽结构和抑菌机理的多样性,存在多种抑菌假说模型[5]。 Alamethicin 通过α-螺旋肽结构以“桶板模型”增强细胞质膜通透性并抑制菌体增殖[7],Cecropin A 以“毯式模型”靶向作用于细胞质膜脂质双分子层[8]。大量研究[9-11]认为,细胞质膜通透性改变和结构受损是最重要且最关键的抑菌机理,但有部分抗菌肽在细胞膜表面形成跨膜孔道进入膜内并导致细胞质膜透性增加,却未直接导致菌体死亡,也就说抗菌肽存在其他非细胞质膜损伤效应靶点[5]。 作者所在课题组前期基于细胞质膜损伤角度研究了金属抗菌肽(简称金抗肽)SIF4对大肠杆菌抑菌机制发现,SIF4可破坏细胞质膜结构、增强细胞质膜通透性、 诱导膜去极化和膜氧化损伤,导致胞内物质泄漏并造成细胞聚沉,并对大肠杆菌细胞壁有破坏作用[12-13],但基于细胞壁靶点的非细胞质膜抑菌机理还不清楚。 因此, 为阐明金抗肽SIF4基于细胞壁损伤靶点的非细胞质膜抑菌机理,作者从细胞壁损伤靶点研究了SIF4对大肠杆菌的非细胞质膜损伤机理, 以期为食源性大肠杆菌生物防控提供理论依据。
1 材料与方法
1.1 材料与试剂
金抗肽SIF4:作者所在课题组自制[12];大肠杆菌ATCC25922:上海保藏生物技术中心获得;牛肉膏、蛋白胨、NaCl、曲拉通(Triton-X100):国药集团;细胞壁脂多糖:北京索莱宝科技有限公司;多黏菌素B:南京都莱生物技术有限公司;其他试剂:国产分析纯。
1.2 仪器与设备
JEM-7500F 型扫描电子显微镜: 日本株式会社;UV-2600 紫外可见分光光度计、IRPrestige-21傅里叶变换红外光谱仪:日本岛津公司。
1.3 方法
1.3.1 对细胞壁损伤的影响 参照文献[14]并修改。 将已活化的大肠杆菌接种至牛肉膏蛋白胨液体培养基中,37 ℃、120 r/min 培养12 h,4 000 r/min离心10 min,收集菌体。 用PBS 溶液(0.03 mmol/L,pH 7.2)稀释至OD630nm为0.1~0.3。 在96 孔细胞培养板中每组每孔先加入100 μL 菌液并分为3 组:A组每孔加入50 μL PBS 缓冲液(阴性对照);B 组每孔加入50 μL TritonX-100 (质量浓度为300 mg/L,阳性对照);C 组每孔加入50 μL SIF4, 终质量浓度为1/2MIC、MIC 和2MIC(MIC = 0.4 mg/L),振荡均匀后于37 ℃恒温培养120 min,每间隔30 min 测定A630nm。
1.3.2 与细胞壁脂多糖竞争性结合抑制分析 以大肠杆菌ATCC25922 为供试菌株,参考刘天琪[15]等方法并修改。 将SIF4与脂多糖(LPS)预先孵育后再测定细胞存活率以验证SIF4与细胞壁脂多糖竞争性结合机制。用无菌PBS 溶液配制SIF4溶液并与质量浓度为1 024、512、256、128、64、32、16、8、4、2、1 mg/L 的大肠杆菌细胞壁脂多糖等体积混合(终质量浓度为1MIC),37 ℃共育60 min; 将共育物与等体积大肠杆菌(1×106CFU/mL)于37 ℃温育2 h;吸取0.1 mL 菌液涂布于牛肉膏蛋白胨平板上,37 ℃培养24 h,计数菌落斑数并计算细胞存活率,以多黏菌素B(终质量浓度为1 g/L)作为阳性对照。
1.3.3 对菌体细胞壁膜组分的影响 参照Helm 等方法并修改[16]。 将对数生长期菌体于4 000 r/min 离心10 min,收集沉淀,用PBS 溶液将菌体洗涤3 次并重悬(OD630nm为0.1~0.3)。 取适量SIF4与等体积大肠杆菌于37 ℃温育2 h (终质量浓度为1MIC),取共培养物置于KBr 透明光学晶片中,减压干燥成透明膜状物,按中国药典方法校准仪器,对比分析SIF4处理前后菌体细胞壁膜组分红外光谱位移规律,解析SIF4处理对菌体细胞壁组分的影响机制。
1.3.4 对菌体形貌的影响 样品制备参考Zhang等方法并修改[17]。 取对数期菌体于4 000 r/min 离心10 min,收集沉淀,用PBS 溶液洗涤数次并重悬;将菌悬液与SIF4等体积混合(终质量浓度为1/2 MIC、1MIC 和2MIC),37 ℃温育2 h,4 000 r/min 离心10 min,加入戊二醛(终体积分数为2.5%)固定过夜,用PBS 洗2 遍,再用乙醇梯度洗脱(体积分数为30%、50%、70%、85%、90%各1 次,体积分数100% 2 次)10 min,滴于洁净盖玻片烘干,将盖玻片粘在样品台上并经离子溅射喷金和扫描电镜观察菌体表面形貌变化,对照组为PBS 组。
2 结果与分析
2.1 对细胞壁损伤的影响
细胞壁在菌体保护、形态维持、细胞增殖和信号转导等方面有重要作用,一旦受损,对细胞形态与胞内生物分子功能有重要影响[18]。 SIF4对菌体细胞壁影响见图1。

图1 SIF4 对菌体细胞壁损伤的影响Fig. 1 Effect of SIF4 on cell wall damage
由图1 可看出, 对照组A630nm吸光值随处理时间增加呈递增趋势, 表明菌体生长没有受到影响;SIF4处理30 min 时, 试验组组间差异不显著 (P>0.05),但与对照组差异显著(P<0.05);处理60、90、120 min 时,组间差异显著(P<0.05),且随着处理时间和处理剂量增加,A630nm值呈显著下降趋势 (P<0.05)。 表明菌体细胞壁受到不同程度损伤,使细胞壁通透性增加, 与抗菌肽MDpep9 对大肠杆菌细胞壁影响相似[14]。 TritonX-100 可破坏菌体细胞壁,导致细胞壁结构变形,从而有助于抗菌肽插入细胞膜和影响胞内物质生物合成,TritonX-100 可能以“毯式模型”介入细胞膜并进入胞内,SIF4对大肠杆菌作用机制类似TritonX-100,但显著低于其对菌体细胞壁的破坏作用(P<0.05)。 抗菌肽主要通过抑制细胞壁合成和(或)直接破坏细胞壁实现抑菌活性[5],如人源抗菌肽β-defensin3 能抑制细胞壁形成并使细胞壁穿孔,破坏细胞正常形态而最终导致细菌死亡[19],sarcotoxins Ⅱ能抑制细胞壁合成而使菌体细胞形态维持受阻,从而阻碍菌体正常生长[20],而家蝇抗菌肽则可破坏大肠杆菌细胞壁结构完整性[14]。 SIF4对细胞壁的破坏作用可能是因为金抗肽SIF4为金属阳离子抗菌肽,可与细胞壁负电性脂多糖竞争性结合破坏细胞壁结构,并与细胞壁负电荷区域结合导致菌体形变等有关[12,21]。
2.2 与细胞壁脂多糖竞争性结合抑制分析
脂多糖(LPS)是革兰氏阴性菌细胞壁外壁的一层较厚的类脂多糖类物质,是抗菌肽主要的非细胞质膜效应靶点[22]。 SIF4与细胞壁脂多糖竞争性结合试验结果见表1。
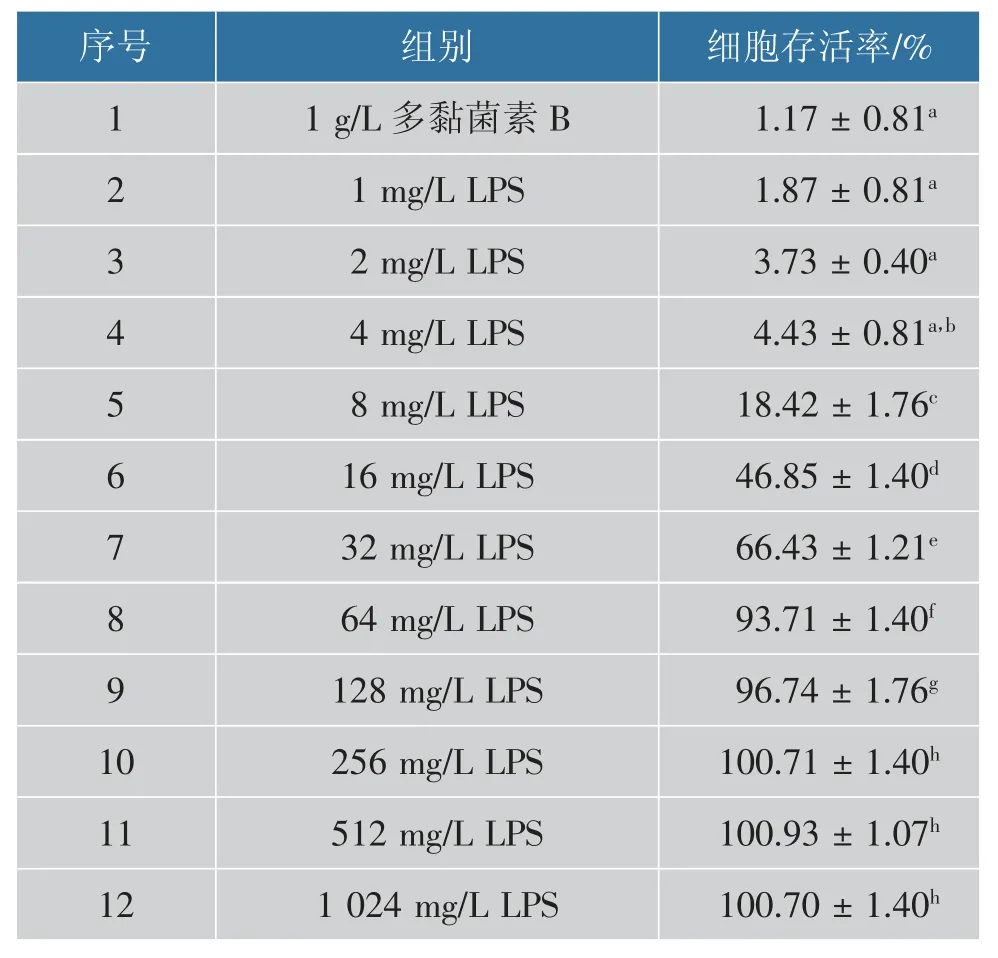
表1 SIF4 与脂多糖竞争性结合试验结果Table 1 Competitive binding results between SIF4 and LPS
由表1 可看出, 随着LPS 质量浓度升高,SIF4抑菌活性降低(细胞存活率上升), 说明SIF4可与LPS 有效结合并影响抑菌活性。 SIF4与LPS 结合效率越高,游离SIF4越少,抑菌效率就越低,否则抑菌效率就越高[23]。 在LPS 质量浓度为256 mg/L 时,细胞存活率为(100.71 ± 1.40)%,SIF4不再具备抗菌活性, 表明SIF4和LPS 最大结合量可达到256 mg/L,研究结论与抗菌肽AP16-A 类似[23]。 研究还发现,SIF4在质量浓度1~4 mg/L 时与多黏菌素B 对细胞存活率影响无显著差异(P>0.05),多黏菌素B 可与细菌外膜LPS 结合,通过破坏细菌外膜渗透性而发挥抑菌活性[24]。 SIF4为金属阳离子抗菌肽[12],带正电荷,脂多糖由脂质和多糖构成,带负电荷,能与SIF4通过静电吸附作用发挥抗菌活性, 也有可能是SIF4结构中的Fe2+可取代Zn2+、Mg2+等维持脂多糖结构稳定的金属离子,从而发挥良好抑菌活性[25]。
2.3 对菌体细胞壁膜组分的影响
傅里叶变换红外光谱(FT-IR)能提供特征性基团吸收光谱谱带,分析微生物细胞红外光谱谱带可用于微生物细胞与微生物组分的鉴别[16,26]。SIF4处理前后菌体细胞壁膜红外光谱见图2。

图2 SIF4 对细胞壁膜组分的影响Fig. 2 Effect of SIF4 on cell wall membrane components
FT-IR 提供的分子特征基团吸收谱带可用于描述细胞壁膜组分信息,其中,900~500 cm-1为指纹信息区;1 200~900 cm-1为细胞壁多糖信息区;1 500~1 200 cm-1为蛋白质和脂肪酸混合信息区域;1 800~1 500 cm-1为多肽酰胺和蛋白质信息区;3 000~2 800 cm-1为脂肪酸信息区[26]。当抗菌肽结合菌体细胞壁并破坏细胞壁膜结构时,可引起红外光谱图谱特征区吸收光谱的改变。 由图2 可看出,与对照组相比,试验组(1MIC 组)在1 200~900、1 500~1 200、3 000~2 800 cm-1的3 个区间红外光谱吸收峰变化明显, 分别对应细胞壁多糖信息区、蛋白质与脂肪酸混合信息区、脂肪酸信息区,表明SIF4对细胞壁多糖信息区、 蛋白质与脂肪酸混合信息区以及脂肪酸信息区域有一定影响,特别是1 200~900 cm-1和1 500~1 200 cm-1区域影响最明显,揭示细胞壁是金抗肽SIF4的潜在抑菌效应靶点[12-13]。
2.4 对菌体形貌的影响
扫描电镜(SEM)是观察微生物菌体形貌最有效的手段,通过电子束对样品外在结构扫描得到三维立体构造,SIF4对菌体形貌影响见图3。

图3 SIF4 处理对菌体形貌的影响Fig. 3 Effect of SIF4 treatment on strain morphology
由图3 可看出,对照组菌体微观结构没有发生明显改变,菌体呈清晰杆状,菌体细胞壁膜结构完整且表面平滑。 1/2MIC SIF4处理后,部分菌体细胞壁膜变粗糙,出现轻微坍塌,菌体表面开始出现皱缩,细胞壁膜结构完整性遭到一定程度破坏。 1MIC SIF4处理后,菌体除表面出现皱缩和凹陷外,部分菌体的细胞膜出现明显崩塌。 2MIC SIF4处理后,菌体表面凹陷和皱缩现象更为明显,胞内原生质体有泄漏,可观测到有部分菌体出现聚集现象。 可能是由于菌体与SIF4互作后,细胞壁膜结构完整性遭到破坏,使胞内蛋白质和核酸等原生质组分泄漏,从而使结构受损细胞产生的细胞碎片与坍塌的菌体出现聚集。 课题组前期研究观察到,SIF4可破坏细胞壁(膜)结构并使胞内容物泄漏,可增强表面疏水性和降低表面zeta 电位, 造成细胞聚沉和生物代谢紊乱[12],SIF4对菌体细胞壁膜影响机理与抗菌肽P7相似[27]。
3 结 语
从细胞壁损伤、 细胞壁脂多糖竞争性结合、细胞壁膜组分衍变及菌体形貌改变等方面系统研究了SIF4对基于细胞壁损伤靶点的大肠杆菌非细胞质膜损伤抑菌机理。研究发现,SIF4可破坏大肠杆菌细胞壁结构,在一定质量浓度范围内,细胞壁受损与SIF4处理时间和处理剂量呈正相关且组间差异显著(P<0.05),细胞壁受损可使细胞壁通透性增加;SIF4可与大肠杆菌细胞壁脂多糖(LPS)有效结合,与LPS 结合量达到256 mg/L 或更大时,抑菌活性消失。FT-IR 分析发现,SIF4对细胞壁多糖信息区和蛋白质与脂肪酸混合信息区影响最明显,表明细胞壁可能是SIF4潜在抑菌效应靶点。 SEM 观测发现,随着SIF4处理剂量的增加, 菌体形貌可出现壁膜变糙、轻微坍塌、表面皱缩、表面崩塌、原生质泄漏及细胞聚集等递进现象,SIF4可使菌体形貌发生显著改变。
