雪上一枝蒿多糖组分XP-10体内外免疫调节作用及机制研究
2023-08-21左爱学李斯文方肇勤万春平
彭 磊,张 霞,左爱学,刘 颖,李斯文,方肇勤*,万春平*
(1.上海中医药大学基础医学院,上海 201203;2.云南中医药大学,云南 昆明 650500;3.个旧市人民医院,云南 个旧 661000)
雪上一枝蒿(Aconiturn brachypodum Diels)是毛茛科乌头属植物短柄乌头的干燥块根,一般认为具有祛风除湿、活血镇痛之功效,为云南、贵州等中国西南地区民间外用药之一,常用于治疗风湿疼痛、关节炎、跌打损伤等。现代化学成分和药理活性研究表明,雪上一枝蒿的活性成分主要为乌头碱,新乌头碱,以及雪上一枝蒿甲素、乙素、丙素、丁素、庚素等多种生物碱[1-2],具有镇痛、抗炎、局部麻醉和抗肿瘤等多种药理作用[3-4]。目前对于雪上一枝蒿的研究主要聚焦于生物碱,而对含量较高的多糖类成分研究较少,造成在雪上一枝蒿的提取过程中,多糖成分常常被当作废弃物弃用,导致珍贵药材资源的浪费。本课题组长期专注雪上一枝蒿的现代研究,以产自云南东川的雪上一枝蒿作为药物原材料,经提取和分离纯化得到1种多糖组分XP-10,免疫活性检测结果显示,雪上一枝蒿多糖组分XP-10具有显著的免疫增强作用,研究成果已取得中国发明专利(专利号:CN107936130B,雪上一枝蒿多糖及提取方法以及应用)。基于此,本研究通过分别构建体外小鼠脾淋巴细胞模型、体内免疫抑制小鼠模型,进一步研究雪上一枝蒿多糖组分XP-10的体内外免疫调节作用,并初步探索其药理机制,为雪上一枝蒿多糖的应用和合理开发提供科学依据。
1 材料和方法
1.1 材料 BALB/c小鼠,雄性,7~8周龄,体质量18~20 g,由成都达硕生物科技有限公司提供,合格证号:SCXK2017-0004。饲养条件:SPF级动物房,恒温(22±1)℃,恒湿(55±5)%,饲料、饮水均消毒,自由摄取。实验动物进行1周以上适应性饲养后使用。严格按照实验动物相关管理条例进行所有动物实验。实验方案通过云南中医药大学第一附属医院医学伦理委员会审查(SD2022-014)。
化合物雪上一枝蒿多糖XP-10性状:焦糖色固体,纯度>75%,易溶于水,具有粘性,由云南中医药大学中药学院左爱学博士提供。
PE-Cy7-anti-mCD4(cloneGK.1.5)、Alexa FluorTM488-conjugated rat anti-mFoxp3(clone 150 D)和 Anti-CD3抗体均购自美国Biolegend公司;注射用环磷酰胺(cyclophosphamide,CTX)购自江苏盛迪医疗有限公司。干扰素 γ(interferon gamma,IFN-γ)、白介素2(interleukin-2,IL-2)和白介素 6(interleukin-6,IL-6)的酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测试剂盒购自美国invitrogen公司。除噻唑兰(thiazolyl blue tetrazolium bromide,MTT)、刀豆蛋白 A(concanavalin A,ConA)购自美国 Sigma公司外,其余均为国产分析试剂。
1.2 主要仪器 3111二氧化碳培养箱(Thermo-fisher,美国)、SpectraMax i3X 酶标仪(MD,美国)、CantoII流式细胞仪(BD,美国)。
2 方法
2.1 制备小鼠脾淋巴细胞悬液 正常小鼠采用酒精消毒后,无菌状态下取其脾脏,载玻片轻轻研磨脾,而后滤膜过滤,离心(1 200 rpm,4 ℃,5 min),弃上清,使用红细胞裂解液裂解红细胞,加入RPMI-1640终止裂解,PBS洗2次,最后加入10% RPMI-1640培养基,并将脾淋巴细胞浓度调至4×106个/mL,备用。
2.2 体外ConA、LPS、Anti-CD3分别诱导脾淋巴细胞增殖 将制备好的正常小鼠脾淋巴细胞悬液接种于96孔板,每孔100 μL,然后加入50 μL不同浓度的 XP-10 和 50 μL 丝裂原 ConA(2.5 μg/mL)、LPS(10 μg/mL)或 Anti-CD3(5 μg/mL)抗体,每个浓度梯度设3个复孔,放入细胞培养箱中培养。待培养48 h后,加入MTT溶液20 μL/孔,放入培养箱中继续培养1~2 h。培养结束后取出96孔板,4℃低温离心10 min,3 000 rpm,小心吸弃上清,加入二甲基亚砜(Dimethyl sulfoxide,DMSO)150 μL/孔,振荡器震荡至蓝紫色结晶完全溶解,使用酶标仪检测各孔570 nm处的吸光度OD值。计算:细胞活力增加率=(OD给药组-OD对照组)/OD对照组×100%。
2.3 酶联免疫吸附法检测细胞因子的产生 常规制备正常小鼠脾淋巴细胞,调细胞浓度为2×106个/mL,将1 mL脾淋巴细胞与1 mL ConA共接种于24孔板上,另设无刺激的对照组,于37℃,5% CO2培养箱中培养24 h,培养结束,收集培养上清,-80℃冻存。细胞因子IFN-γ、IL-2和IL-6浓度采用ELISA法检测,检测方法参照试剂盒产品说明书。
2.4 构建体内免疫抑制小鼠模型、分组及给药 同批次饲养的BALB/c小鼠20只,体质量约18 g,适应性喂养后,按照文献方法[5]诱导体内免疫抑制模型(正常组除外)。具体方法如下:模型小鼠在第1天和第4天注射CTX(80 mg/kg),在第1次注射CTX 2 h后,随机分为模型组、XP-10低剂量组(125 mg/kg)、中剂量组(250 mg/kg)和高剂量组(500 mg/kg),另设正常对照组。低、中高剂量分别以125 mg/kg、250 mg/kg和500 mg/kg剂量灌胃XP-10,连续给药8 d。模型组和正常对照组灌胃等体积的生理盐水。每天分别观察各组小鼠的生存状态并记录小鼠体质量,在末次给药后对所有小鼠进行处理。
2.5 检测体内免疫抑制小鼠模型相关指标 末次给药后称量各小鼠体质量,处理小鼠后,取出小鼠的脾脏和胸腺,于无菌条件下称量。记重后常规制备各组小鼠脾淋巴细胞,调节细胞浓度为4×106个/mL。用于MTT脾淋巴细胞活力和流式细胞术检测。
2.5.1 MTT法脾淋巴细胞活力 将制备好的各组脾淋巴细胞悬液接种于96孔板,每孔100 μL,然后加入 100 μL 丝裂原 ConA(2.5 μg/mL),每个浓度梯度设3个复孔,于5% CO2、37℃细胞培养箱中培养48 h。MTT法检测各组脾淋巴细胞的活力。具体方法见2.2。
2.5.2 流式细胞术检测 流式细胞术检测具体方法[6-7]如下:各组分别取含1×106个脾淋巴细胞对应毫升量的细胞悬液,1 200 rpm离心5 min,弃上清,封闭FcR,再加入带荧光标记的CD4抗体,室温下放置15 min,洗液洗1遍,固定液固定30 min后,固定穿膜液洗2遍,2 000 rpm离心5 min,弃上清后,加入荧光标记Foxp3抗体,孵育45 min,加入流式buffer,离心,采用Flowjo软件进行分析。
2.6 处理数据 采用SPSS进行数据分析处理,组间差异使用One-Way ANOVA单因素方差分析;若方差不齐,采用LSD法分析。所有数据以(±s)表示,P<0.05表示差异具有统计学意义。
3 结果
3.1 XP-10体外干预能显著促进淋巴细胞的增殖刀豆蛋白A(ConA)和脂多糖(LPS)能分别特异性诱导T、B淋巴细胞增殖,因此常被分别用作评价T、B淋巴细胞功能的指标。anti-CD3抗体与CD3结合,能够诱导IL-2受体链(CD25)与IL-2受体结合组成高亲和力受体,从而诱导T细胞发生克隆性增殖。为研究雪上一枝蒿多糖组分XP-10的体外免疫效应,我们分别构建了ConA、LPS和anti-CD3抗体诱导的淋巴细胞增殖模型,并使用不同浓度的XP-10进行干预。XP-10在无任何刺激的状态下,呈浓度依赖性促进淋巴细胞增殖,提示XP-10具有丝裂原样活性。在ConA、LPS诱导的增殖细胞模型中,XP-10能显著促进T淋巴细胞和B淋巴细胞增殖,且呈现浓度依赖性。另外,XP-10在250 μg/mL浓度下可促进anti-CD3抗体诱导的淋巴细胞增殖。结果见图1。
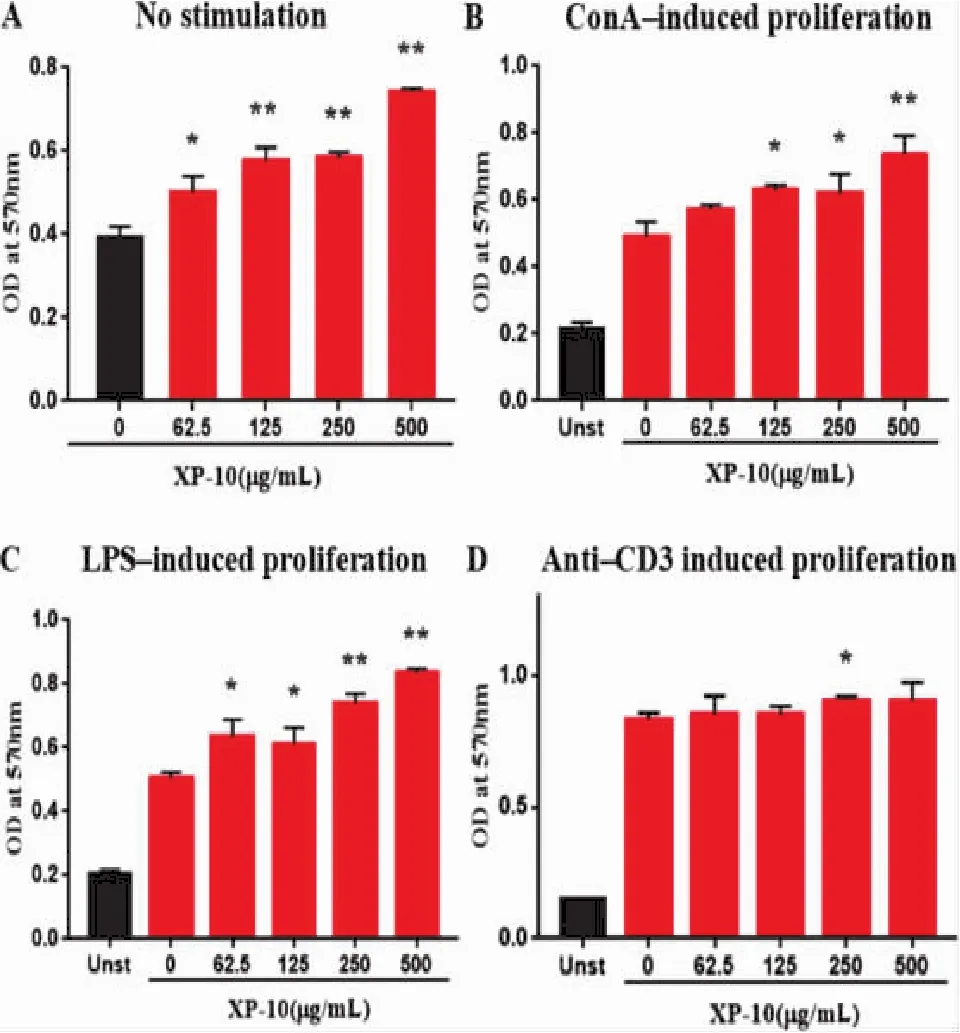
图1 XP-10体外对淋巴细胞增殖功能的影响
3.2 XP-10体外干预能提高淋巴细胞分泌上清中细胞因子IFN-γ和IL-6的水平 如上之体外淋巴细胞增殖结果显示,XP-10体外具有促进淋巴细胞增殖的效应。为进一步研究XP-10对细胞因子的调控作用,初步揭示其增强免疫的机制,采用ELISA法检测XP-10对淋巴细胞产生细胞因子水平的影响。结果如表1所示:在Con A诱导的脾淋巴细胞培养体系中,与对照组比较,XP-10能显著促进脾淋巴细胞培养上清中细胞因子IFN-γ和IL-6水平;与之相反,细胞因子IL-2的表达水平低于阳性对照组。
表1 XP-10对Con A诱导的正常脾淋巴细胞培养上清中细胞因子的影响(±s,n=3)
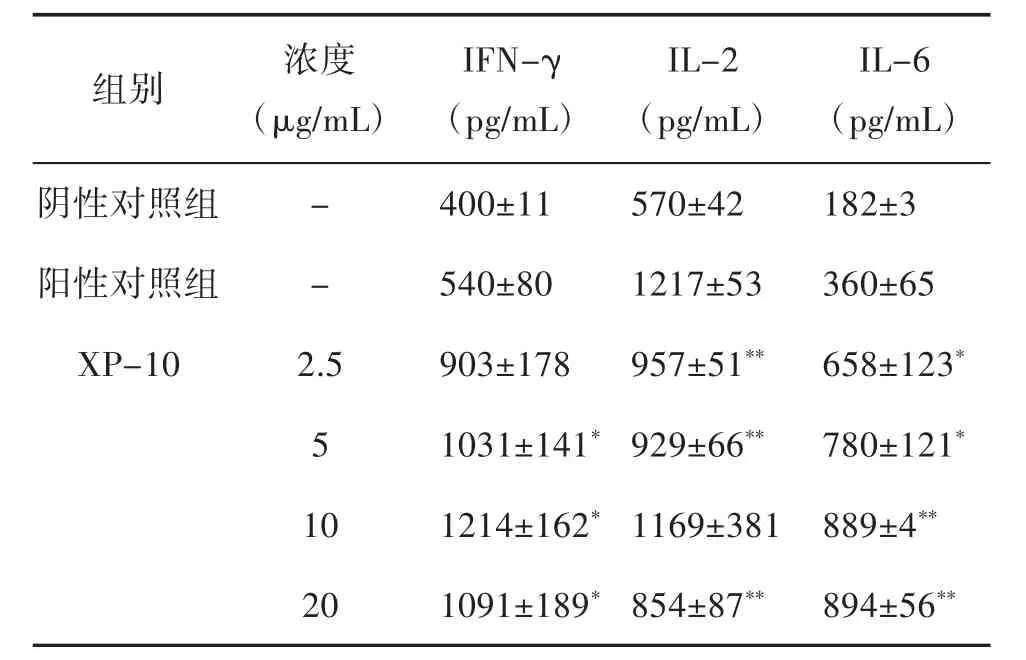
表1 XP-10对Con A诱导的正常脾淋巴细胞培养上清中细胞因子的影响(±s,n=3)
注:与对照组相比,*P<0.05,**P<0.01。
IL-6(pg/mL)阴性对照组 - 400±11 570±42 182±3阳性对照组 - 540±80 1217±53 360±65 XP-10 2.5 903±178 957±51** 658±123*5 1031±141*929±66** 780±121*10 1214±162*1169±381 889±4**20 1091±189*854±87** 894±56**组别 浓度(μg/mL)IFN-γ(pg/mL)IL-2(pg/mL)
3.3 XP-10对环磷酰胺所致免疫抑制模型小鼠器官指数和增殖的影响 为更好地测定XP-10口服灌胃的体内免疫增强作用,我们通过二次腹腔注射CTX,成功构建体内免疫抑制小鼠模型。与正常组相比,免疫抑制模型组小鼠的体质量、脾指数和胸腺指数均显著降低。结果显示:使用XP-10进行灌胃干预能显著提高免疫抑制模型小鼠的免疫功能,小鼠体质量、脾指数和胸腺指数均有所提升,其中以XP-10低剂量组(125 mg/kg)治疗效果尤为显著,差异具有显著性(P<0.05)。MTT法检测淋巴细胞活性结果显示:XP-10低剂量(125 mg/kg)体外灌胃干预,对ConA诱导的淋巴细胞的活性具有显著促进作用(P<0.05)。见图2。
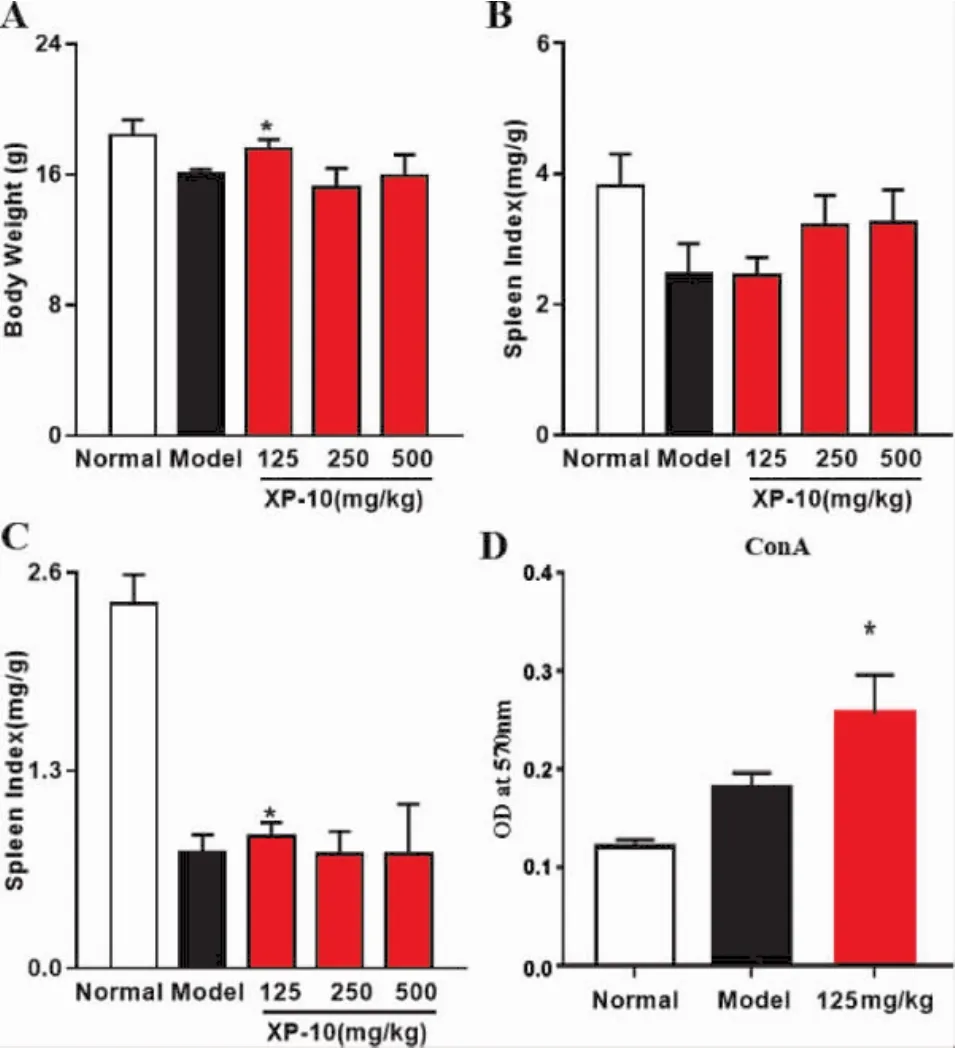
图2 XP-10对免疫抑制模型小鼠器官指数和增殖的影响
3.4 XP-10能够显著下调环磷酰胺所致免疫抑制模型小鼠Treg细胞的表达水平 调节性T细胞(Treg)与机体抗肿瘤免疫应答密切相关,为进一步揭示XP-10诱导免疫反应的机制,我们进一步检测了免疫抑制模型小鼠Treg细胞的表达。流式细胞术检测结果显示,与对照组比较,XP-10低剂量(125 mg/kg)体内灌胃干预后,免疫抑制模型小鼠Treg细胞(CD4+Foxp3+T细胞)的表达比例显著下降,差异具有统计学意义(P<0.05)。见图3。

图3 XP-10对免疫抑制模型小鼠Treg表达的影响
4 讨论
肿瘤免疫治疗主要是通过调动机体的免疫系统,增强肿瘤微环境抗肿瘤免疫力,从而控制和杀伤肿瘤细胞。肿瘤的现代生物免疫治疗所靶向的是人体免疫系统而非直接针对肿瘤,这种从宏观出发的治疗思路与中医学的整体治疗观念高度契合。中医药在肿瘤的综合防治方面有着独特优势,中医学认为“邪之所凑,其气必虚”是肿瘤的基本病机,“扶正固本”“养正积自除”是治疗肿瘤的基本原则和方法,通过调整脏腑气血阴阳,增强人体正气所具的抗病能力以使“正胜邪却”,亦即“正气存内,邪不可干”。扶正疗法在中医学肿瘤防治中具有重要意义,贯穿了肿瘤治疗的全过程,大量现代科学研究也已证明扶正治疗可以调控细胞免疫功能[8]。随着生命科学技术与中医药现代科学技术的不断交叉渗透,扶正疗法、免疫疗法两者可以有机结合造福患者。探索开发具有免疫治疗效用的中药材及其有效成分潜力巨大。研究中药雪上一枝蒿多糖在抗肿瘤免疫方面的作用机制,可在一定程度上丰富肿瘤的中医证候、治法方药等方面的理论依据与科学证据。
多糖是生命体内广泛存在且具有多种生物活性的一类天然大分子物质,其对机体免疫系统的调节作用一直是科学家研究的热点之一。越来越多的研究表明,天然来源的植物多糖可通过与免疫细胞的不同受体结合、诱导机体不同的细胞信号,从而调节机体的免疫系统,包括细胞免疫、体液免疫、补体系统等,主要作用的免疫效应包括:刺激T/B淋巴细胞增殖、诱导巨噬细胞分泌炎症因子、提高自然杀伤细胞杀伤活性、调节细胞因子的释放等[9]。在中药研究早期,多糖活性成分常常作为没有活性的杂质被去除。1972年日本科学家在对香菇多糖研究中发现植物多糖是具有免疫调节活性的,此后,一经发现多糖就被作为抗肿瘤的免疫的辅助用药迅速而广泛地应用于临床。随着植物多糖研究的不断深入,国内外学者相继发现黄芪多糖、人参多糖等多种植物多糖均具有显著的免疫调节活性,能提高机体巨噬细胞及淋巴细胞等的免疫活性[10-11],在科研和临床应用中均发现其具有非常好的提高免疫力、抗抗肿瘤等效果。综上所述,植物多糖作为植物的重要活性成分之一,对免疫系统具有重要调节作用,是临床开发抗肿瘤免疫辅助用药的重要来源之一。
本课题组前期聚焦云南东川产雪上一枝蒿,经提取、分离得到多糖组分XP-10,并成功申获专利。在此基础上,本研究在体外系统评价XP-10对ConA、LPS或anti-CD3抗体诱导淋巴细胞增殖功能的影响,发现XP-10不仅具有丝裂原样活性,而且在ConA、LPS诱导的增殖细胞模型中,XP-10能够显著促进T淋巴细胞和B淋巴细胞增殖,且呈现浓度依赖性。XP-10在250 μg/mL浓度下可促进anti-CD3抗体诱导的淋巴细胞增殖。以上结果提示,雪上一枝蒿多糖组分XP-10在体外具有较好的免疫增强活性,可能在抗肿瘤免疫方面具有较好的应用前景。
IL-2、IFN-γ是T淋巴细胞激活后所产生的两种重要细胞因子,两者具有很强的促进、扩大免疫效应的功能。IL-6是一种多功能细胞因子,在免疫和炎症反应中具有重要作用,是机体重要的免疫-神经-内分泌调节因子。为进一步研究XP-10对细胞因子的影响,初步揭示其诱导免疫细胞活化的机制,我们采用ELISA法检测IFN-γ、IL-2和IL-6水平。结果表明,XP-10药物体外干预能显著提高脾淋巴细胞因子IFN-γ和IL-6水平,然而对IL-2产生无明显的影响。由于IL-2能引起多种淋巴细胞(如T、B细胞及NK细胞等)的增殖,淋巴细胞在增殖过程中,需要消耗大量的IL-2,故推测由于XP-10能显著促进淋巴细胞增殖,从而需要损耗大量的IL-2,因此导致淋巴细胞增殖24 h后,细胞因子IL-2无明显变化。
一般来说,当机体免疫系统受到损害时,对抗原的应答能力一定程度上会有所下降,此时所表现出的这种免疫异常状态即免疫抑制。对于免疫抑制模型,环磷酰胺、氢化可的松、环孢菌素A、地塞米松等是目前较为常用的化学造模试剂。环磷酰胺是临床常用的化疗药物之一,能够真实模拟化疗诱导体内免疫抑制异常状态而应用最广[12]。它的主要机制是通过其代谢产物破坏DNA分子,发挥细胞毒作用,诱导较强免疫抑制效应,因此常用于评价体内给药对细胞免疫和体液免疫影响的疾病模型。结果显示,雪上一枝蒿多糖XP-10干预后,显著提高了环磷酰胺诱导的免疫抑制模型小鼠的免疫功能,包括对环磷酰胺诱导的模型小鼠体质量的提升,对免疫抑制模型小鼠脾和胸腺指数的提高,促进ConA诱导的脾淋巴细胞增殖功能,然而其提高机体免疫功能并不呈剂量依赖性,以XP-10低剂量(125 mg/kg)效果尤佳。分析原因可能如下:(1)多糖组分纯度不太高,可能混有其他成分,从而抵消了多糖的免疫增强效应;(2)文献报道很多免疫增强药物体内给药量效关系不明确,且其确切的机制尚不明确。
T细胞作为免疫系统最重要的细胞类群,与抗肿瘤免疫过程密切相关。Treg细胞是一类具有重要免疫调节功能的淋巴细胞亚群,是抑制抗肿瘤免疫应答的主要抑制性细胞,其表达程度与临床不良预后密切相关,微环境中Treg细胞能够通过抑制效应T细胞的杀肿瘤作用,减弱机体抗肿瘤免疫应答,从而促进肿瘤的生长[13]。因此,靶向Treg细胞,减少Treg细胞数量,提高机体抗肿瘤免疫应答效应是治疗肿瘤的有效方法。本研究结果显示,XP-10(125 mg/kg)药物干预后,Treg细胞(CD4+Foxp3+T细胞)比例显著下降,提示XP-10可通过减少Treg细胞数量而增强机体的抗肿瘤免疫应答功能,可能在对抗化疗药物副作用和抗肿瘤免疫辅助用药方面具有一定的应用前景。
