曲妥珠单抗联合化疗方案治疗乳腺癌的疗效及其作用机制研究
2023-08-21陆佳团王征张浩
陆佳团,王征,张浩
南阳市中心医院乳腺科一病区,河南 南阳 473200
乳腺癌(breast cancer,BC)主要发生于乳腺腺上皮组织,我国BC 筛查率较低,20%的BC 患者确诊时已处于局部晚期,5 年生存率约为24%[1]。目前尚未有统一治疗方案,部分患者存在多种耐药性或多线治疗失败,因而寻找合理有效BC 治疗方案具有重要意义。TP 化疗方案常用于治疗BC,仅采用TP 化疗方案未达到临床预期[2-3]。曲妥珠单抗是一种重组人源化单克隆抗体,可提高HER2 阳性转移性BC 治疗效果[4-5]。但曲妥珠单抗联合TP 化疗方案治疗BC 的临床价值尚未明确。磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(Akt)信号通路异常活化与BC 预后不良有关,Akt 磷酸化可调节丝状肌动蛋白、上皮-间质转化(EMT)相关蛋白表达,促进BC 细胞转移[6],而PI3K/Akt 信号通路是否可作为治疗BC 的潜在靶点尚未明确。本研究探讨其联合治疗BC 的疗效、生存率、毒副反应发生率,并分析其对PI3K/Akt 通路的影响,为临床治疗提供参考。
1 资料与方法
1.1 一般资料 选取2019年3月至2021年1月南阳市中心医院收治的68 例女性BC 患者为研究对象。纳入标准:符合BC 诊断标准[7];经组织病理学检查确诊为BC;生存时间≥6 个月;卡氏功能状态(KPS)评分≥60 分;无化疗禁忌证;签署知情同意书。排除标准:合并其他恶性肿瘤者;精神障碍者;既往放化疗史者;非原发性BC;合并全身感染性疾病者。采用奇偶分组法将患者分为单一组和联合组,每组34 例。两组患者的一般资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。本研究经我院医学伦理委员会批准。
表1 两组患者的一般资料比较[,例(%)]Table 1 Comparison of general information between the two groups[,n(%)]
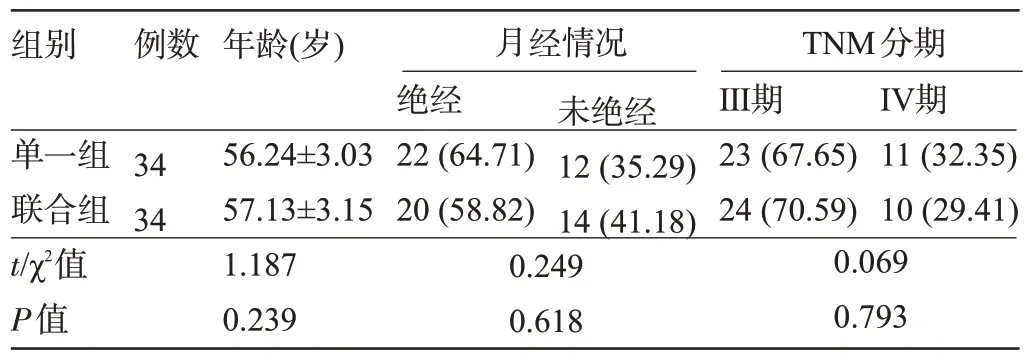
表1 两组患者的一般资料比较[,例(%)]Table 1 Comparison of general information between the two groups[,n(%)]
组别例数年龄(岁)月经情况TNM分期单一组联合组t/χ2值P值34 34 56.24±3.03 57.13±3.15 1.187 0.239绝经22(64.71)20(58.82)未绝经12(35.29)14(41.18)0.249 0.618Ⅲ期23(67.65)24(70.59)Ⅳ期11(32.35)10(29.41)0.069 0.793
1.2 治疗方法
1.2.1 单一组 该组患者予以TP 方案(紫杉醇+顺铂)化疗,化疗前12 h口服地塞米松20 mg(昆药集团股份有限公司,国药准字H53020826,规格:0.75 mg),前30 min内分别肌内注射苯海拉明50 mg(湖北科伦药业有限公司,国药准字H42021175,规格:1 mL∶20 mg)、西咪替丁300 mg(江苏朗欧药业有限公司,国药准字H32025601,规格:2 mL∶0.2 g),第1 天静脉滴注紫杉醇150 mg/m2(海南紫杉园制药有限公司,国药准字H20066558,规格:5 mL∶30 mg),持续3 h;第2 天静脉滴注顺铂25 mg/m2(云南生物谷药业股份有限公司,国药准字H20043889,规格:2 mL∶10 mg),1 次/d,21 d为一个周期,连续治疗3个周期。
1.2.2 联合组 该组患者予以曲妥珠单抗+TP方案化疗,TP化疗方案同单一组,同时予以曲妥珠单抗(上海复宏汉霖生物制药有限公司,国药准字S20200019,规格:150 mg/瓶)治疗,初始剂量8 mg/kg,1.5 h/次,21 d为一个周期,每周期给药一次,连续治疗3个周期。
1.3 观察指标与评价(检测)方法 (1)临床疗效[8]:完全缓解(CR),肿瘤病灶完全消失且至少维持4 周;部分缓解(PR),肿瘤面积缩小≥50%且至少维持4 周;疾病稳定(SD),肿瘤面积增加≤25%或缩小<50%,且至少维持4 周;疾病进展(PD),肿瘤面积增加>25%或出现新病灶。总有效率=(CR 例数+PR 例数)/总例数×100%,疾病控制率=(CR 例数+PR 例数+SD 例数)/总例数×100%。(2)血清肿瘤标志物:于治疗前后分别采集两组患者的外周静脉血5 mL,离心10 min(3 000 r/min)后取血清。ELISA 法检测血清癌胚抗原(CEA)、糖类抗原125(CA125)、糖类抗原153(CA153)水平,上海酶联生物提供检测试剂盒。(3)生化指标:于治疗前后分别采集两组患者的外周静脉血5 mL,离心10 min (3 000 r/min)后取血清。ELISA 法检测血清血小板第4 因子(PF4)、中期因子(MK)、脂质运载蛋白-2(LCN-2)水平,上海酶联生物提供PF4 检测试剂盒,武汉艾美捷科技提供MK 检测试剂盒,上海白益生物提供LCN-2 检测试剂盒。(4)外周血PI3K/Akt 通路相关蛋白表达量:使用非抗凝管分别采集两组患者治疗前后空腹肘静脉血2 mL,提取单核细胞。采用蛋白免疫印迹法(Western blot)检测蛋白表达量:使用500 μL 裂解液提取单核细胞总蛋白,二喹啉甲酸法(BCA)检测蛋白浓度,取蛋白样品(30 μL)经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),分离蛋白转移至聚偏二氟乙烯(PVDF)膜上,加入磷酸化磷脂酰肌醇-3-激酶(p-PI3K)、磷酸化蛋白激酶B(p-AKT)一抗[美国Abcam公司,稀释比1∶1 000]、内参GAPDH 稀释液(稀释比1∶3 000)孵育24 h (4℃),室温孵育山羊抗兔IgG 二抗(美国CST 公司,稀释比1∶5 000) 1 h,使用Quantity One 软件检测蛋白条带灰度值。(5)生活质量和生存率:治疗前后使用欧洲癌症研究与治疗组织生命质量测定量表(EORTC QLQ-C30)评估生活质量[9],包括健康(1 项)、功能(5 项)、症状(9 项),每项0~3 分,分值越高表明生活质量较好。治疗结束后以门诊复查、电话方式进行随访,随访时间为1 年,统计随访期间生存情况。(6)毒副反应:比较两组患者治疗期间的上消化道反应、中性粒细胞减少、蛋白尿、血红蛋白减少等不良反应发生情况。
1.4 统计学方法 应用SPSS24.0 统计学软件分析数据。计量资料以均数±标准差()表示,组间比较采用t检验,计数资料比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的临床疗效比较 联合组患者的治疗总有效率、疾病控制率均高于单一组,差异均有统计学意义(P<0.05),见表2。
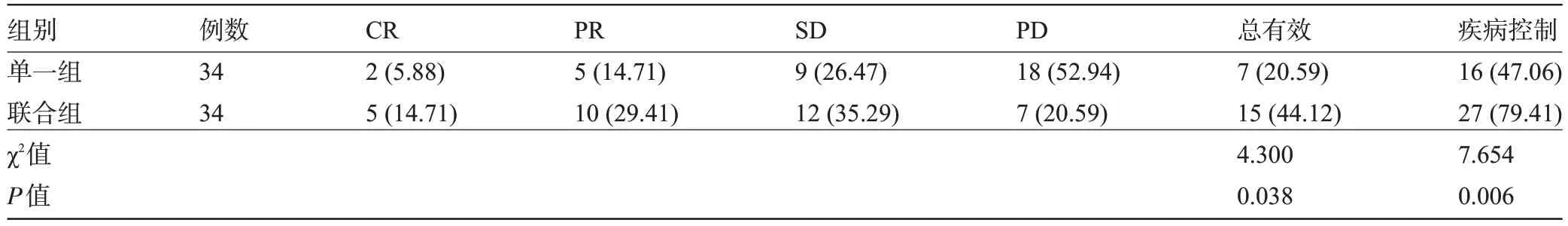
表2 两组患者的临床疗效比较[例(%)]Table 2 Comparison of clinical efficacy between the two groups[n(%)]
2.2 两组患者治疗前后的血清肿瘤标志物水平比较 治疗前,两组患者的血清CEA、CA125、CA153水平比较差异无统计学意义(P>0.05)。治疗后,两组患者的血清CEA、CA125、CA153 水平明显低于治疗前,且联合组明显低于单一组,差异均有统计学意义(P<0.05),见表3。
表3 两组患者治疗前后的血清肿瘤标志物水平比较()Table 3 Comparison of serum tumor marker levels between the two groups()
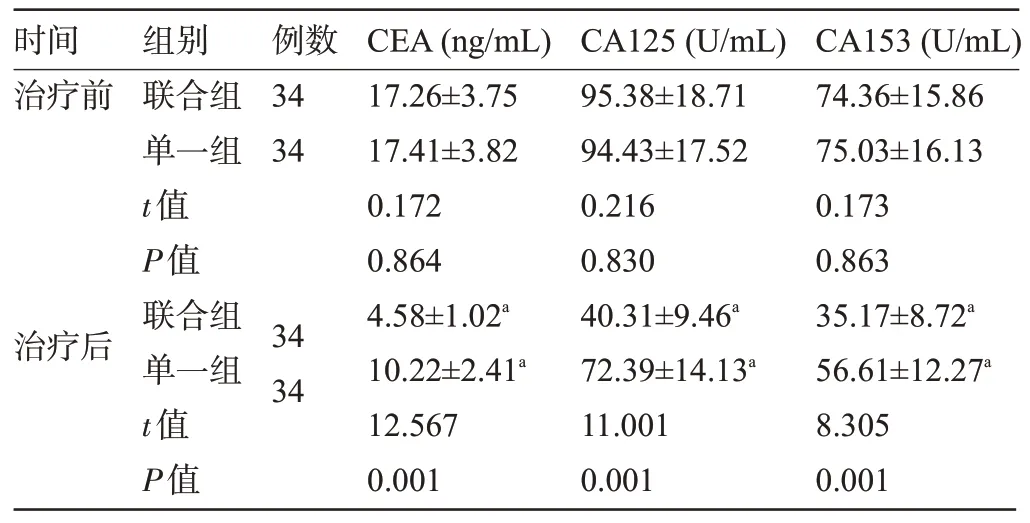
表3 两组患者治疗前后的血清肿瘤标志物水平比较()Table 3 Comparison of serum tumor marker levels between the two groups()
注:与同组治疗前比较,aP<0.05。Note:Compared with that in the same group before treatment,aP<0.05.
时间治疗前例数34 34治疗后组别联合组单一组t值P值联合组单一组t值P值34 34 CEA(ng/mL)17.26±3.75 17.41±3.82 0.172 0.864 4.58±1.02a 10.22±2.41a 12.567 0.001 CA125(U/mL)95.38±18.71 94.43±17.52 0.216 0.830 40.31±9.46a 72.39±14.13a 11.001 0.001 CA153(U/mL)74.36±15.86 75.03±16.13 0.173 0.863 35.17±8.72a 56.61±12.27a 8.305 0.001
2.3 两组患者治疗前后的生化指标比较 治疗前,两组患者的血清PF4、MK、LCN-2 水平比较差异无统计学意义(P>0.05)。治疗后,两组患者的血清PF4、MK、LCN-2水平均较治疗前降低,且联合组患者治疗后的血清PF4、MK、LCN-2 水平明显低于单一组,差异均有统计学意义(P<0.05),见表4。
表4 两组患者治疗前后的生化指标比较()Table 4 Comparison of biochemical indexes between the two groups()

表4 两组患者治疗前后的生化指标比较()Table 4 Comparison of biochemical indexes between the two groups()
注:与同组治疗前比较,aP<0.05。Note:Compared with that in the same group before treatment,aP<0.05.
时间治疗前例数34 34治疗后组别联合组单一组t值P值联合组单一组t值P值34 34 PF4(ng/mL)0.36±0.08 0.34±0.07 1.097 0.277 0.19±0.04a 0.26±0.06a 5.660 0.001 MK(pg/mL)706.41±135.42 711.28±147.09 0.142 0.887 413.21±97.76a 577.09±112.36a 6.416 0.001 LCN-2(ng/mL)95.36±20.78 96.51±22.07 0.221 0.826 65.76±12.05a 74.09±19.63a 2.109 0.039
2.4 两组患者治疗前后的外周血PI3K/Akt 通路相关蛋白表达量比较 治疗前,两组患者的p-PI3K、p-AKT 蛋白表达量比较差异均无统计学意义(P>0.05)。治疗后,两组患者的p-PI3K、p-AKT 蛋白表达量均较治疗前降低,且联合组明显低于单一组,差异均有统计学意义(P<0.05),见表5。
表5 两组患者治疗前后的外周血PI3K/Akt 通路相关蛋白表达量比较()Table 5 The expression of PI3K/Akt pathway related protein in peripheral blood between the two groups()

表5 两组患者治疗前后的外周血PI3K/Akt 通路相关蛋白表达量比较()Table 5 The expression of PI3K/Akt pathway related protein in peripheral blood between the two groups()
注:与同组治疗前比较,aP<0.05。Note:Compared with that in the same group before treatment,aP<0.05.
时间治疗前例数34 34治疗后组别联合组单一组t值P值联合组单一组t值P值34 34 p-PI3K 0.85±0.19 0.82±0.18 0.686 0.495 0.33±0.08a 0.79±0.14 16.635 0.001 p-AKT 0.78±0.13 0.80±0.15 0.588 0.559 0.28±0.04a 0.76±0.10 25.987 0.001
2.5 两组患者治疗前后的生活质量比较 治疗前,联合组和单一组患者的EORTC QLQ-C30 评分分别为(75.43±5.03)分、(74.03±4.91)分,差异无统计学意义(t=1.161,P>0.05)。治疗后,联合组患者的EORTC QLQ-C30 评分为(116.32±9.13)分,明显高于单一组的(101.24±8.46)分,差异具有统计学意义(t=7.064,P<0.05)。
2.6 两组患者的生存率和毒副反应发生率比较 随访1年后,联合组失访2例、单一组失访5例,联合组患者的总生存率为93.75%(30/32),明显高于单一组的72.41%(21/29),差异有统计学意义(χ2=5.053,P=0.025)。而两组患者的毒副反应发生率比较差异无统计学意义(P>0.05),见表6。
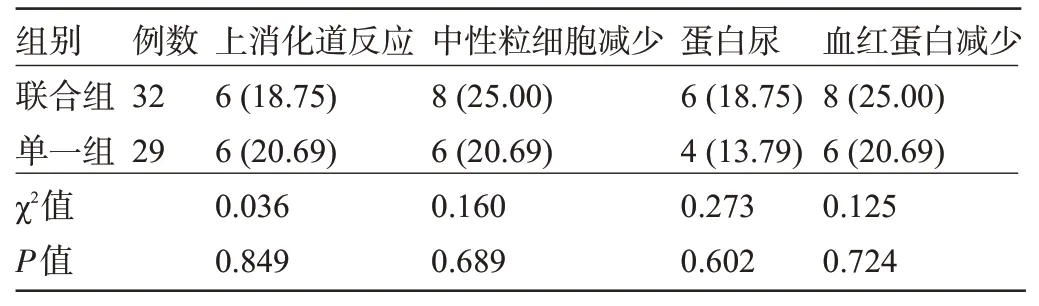
表6 两组患者的毒副反应发生率比较[例(%)]Table 6 Comparison of the incidence of side effects between the two groups[n(%)]
3 讨论
紫杉醇、顺铂化疗可促进微管聚合,抑制微管网重组,诱导细胞周期停滞于M 期,降低肿瘤细胞增殖能力[10]。曲妥珠单抗可结合HER2,减缓肿瘤生长进程,提高侵袭性无病生存期[11-12]。本研究中联合组总有效率、疾病控制率高于单一组,表明联合治疗可提高BC 治疗效果,有效控制BC 发展进程。CEA、CA125、CA153 属于肿瘤标志物,可用于监测病情发展、评估预后[13]。本研究结果与其相似,联合治疗可降低CEA、CA125、CA153水平,表明TP方案加入曲妥珠单抗后全面抗BC作用更为高效,可能与细胞增殖、血管生成得以抑制有关。PF4、MK 可参与BC 血管生成过程,LCN-2 可调节EMT 相关蛋白表达,促进BC 浸润转移[14]。本研究比较治疗前后两组患者的血清PF4、MK、LCN-2 水平,结果发现治疗后联合组患者的血清各指标水平低于单一组,表明联合治疗可降低酪氨酸激酶活性,抑制肿瘤生长、转移。分析原因可能为联合治疗可抑制DNA 合成、HER2 及其相关受体表达,调节肿瘤细胞增殖、分化,有效抑制BC 病情进展。
PI3K/Akt 通路可调节肿瘤淋巴结转移、淋巴管形成,HER2等细胞外信号刺激PI3K后Akt发生膜转位,进入细胞内可参与肿瘤迁移、黏附、细胞外基质降解过程[15]。本研究说明联合治疗可降低p-PI3K、p-AKT蛋白表达。由此推测抑制PI3K/Akt 通路活化可能是联合组疗效显著的原因之一。曲妥珠单抗对HER2具有高度亲和力,可竞争性与恶性细胞或正常细胞HER2 胞外激酶结合,抑制PI3K 磷酸化、PI3K/Akt 通路活化,导致细胞周期停滞于G0/G1期,阻断肿瘤细胞生长进程,促进细胞凋亡[16]。同时本研究分析结果显示,治疗后联合组患者的EORTC QLQ-C30 评分高于单一组,这是由于大部分BC 患者经长期治疗后出现不同程度耐药性,降低生活质量;TP 化疗联合曲妥珠单抗可控制BC 进展,表明联合治疗有助于提高生活质量、生存率。BC 治疗过程中可产生不同程度的毒副作用,本研究结果显示,两组患者的上消化道反应、中性粒细胞减少、蛋白尿、血红蛋白减少发生率比较差异均无统计学意义(P>0.05),表明联合治疗并不会增加毒副反应。
综上所述,曲妥珠单抗联合TP 化疗方案治疗BC效果显著,可降低肿瘤标志物和生化指标水平,提高生存率,改善生活质量,且具有一定安全性,其可能通过抑制PI3K/Akt通路活化发挥作用。
