雾化吸入重组人干扰素α2b 注射液治疗小儿喘息性支气管炎的有效性及安全性研究
2023-08-21孙志伟姜舒亚张海英
孙志伟 姜舒亚 张海英
小儿喘息性支气管炎属于儿科常见病与多发病,疾病发生后会导致患儿出现反复喘鸣、咳嗽, 随着病情加重会导致患儿发生胸闷、呼吸困难等症状, 甚至诱发呼吸衰竭, 危及患儿生命。目前相关研究报道对喘息性支气管炎发病机制尚无统一定论, 大多数学者认为, 疾病发生与细菌、病毒感染有关[1]。因此在对喘息性支气管炎治疗时, 临床上治疗方案以抗菌或抗病毒为主。随着关于喘息性支气管炎发病机制的研究不断实施, 氧化应激反应与炎性因子在喘息性支气管炎发病中的作用受到重视[2]。干扰素可发挥确切的抗病毒效果, 其可与细胞表面受体结合, 使细胞内的DNA 复制得到抑制, 以mRNA 信号传导使病毒的复制受到抑制, 且干扰素可依靠体液免疫作用, 使机体巨噬细胞、T 淋巴细胞对靶细胞具备的病毒杀伤作用增强。研究报道称, 在喘息性支气管炎患儿治疗中, 重组人干扰素α1b 联合布地奈德气雾剂、特布他林可取得超过90%的治疗有效率[3]。本次研究选取2021 年1 月~2022 年1 月中国人民解放军联勤保障部队第904 医院儿科收治的小儿喘息性支气管炎患儿80 例, 探讨雾化吸入重组人干扰素α2b 注射液治疗小儿喘息性支气管炎的有效性及安全性。报告如下。
1 资料与方法
1.1 一般资料 选取本院2021 年1 月~2022 年1 月收治的80 例小儿喘息性支气管炎患儿为研究对象,按照随机数字表法分为对照组和观察组, 每组40 例。对照组男21 例, 女19 例;年龄1~5 岁, 平均年龄(3.50±1.05)岁。观察组男20 例, 女20 例;年龄1~5 岁,平均年龄(3.42±1.10)岁。两组一般资料比较差异无统计学意义(P>0.05), 具有可比性。本研究经医院伦理委员会批准。
1.2 纳入及排除标准 纳入标准:符合相关诊断标准[4];患儿家长知情同意。排除标准:先天性心脏病患儿;胃食管反流患儿;存在自身免疫性疾病患儿;入组前1 个月内接受糖皮质激素治疗患儿。
1.3 研究方法 对照组接受常规对症治疗, 包括平喘、解痉、控制感染, 指导患儿多饮水, 保证充分休息时间, 避免食用辛辣刺激食物, 控制好病室内温湿度,每日开窗通风, 保证空气流通。并根据患儿需求为其实施吸氧支持, 当细菌检测显示合并细菌感染时, 为其应用敏感抗生素治疗, 应用布地奈德吸入气雾剂(鲁南贝特制药有限公司, 国药准字H20030987)雾化吸入治疗, 2 次/d, 连续7 d。观察组在对照组基础上加用重组人干扰素α2b 注射液(上海华新生物高技术有限公司,国药准字S20030012)雾化吸入治疗, 1 μg/(kg·d), 用2 ml 生理盐水溶解后加入到雾化吸入器内实施雾化治疗, 2 次/d, 连续用药7 d。
1.4 观察指标及判定标准
1.4.1 临床疗效 判定标准[5]:疾病症状(咳嗽、咯痰、喘息、喘鸣音)完全消失, 痰病原学培养结果呈阴性为显效;疾病症状缓解, 痰病原学培养结果呈阴性或阳性为有效;疾病症状无改善或加重, 痰病原学培养结果呈阳性为无效。总有效率=(显效+有效)/总例数×100%。
1.4.2 症状缓解时间 临床症状包括咳嗽、咯痰、气喘、发热。
1.4.3 治疗前后炎症因子水平 分别于治疗前后采集空腹静脉血, 以酶联免疫吸附法检测白细胞计数(white blood cell count, WBC)、外周血嗜酸性粒细胞直接计数(direct count of peripheral blood eosinophils, EOS)及白细胞介素-4(interleukin-4, IL-4)水平。
1.4.4 不良反应发生率 包括声音嘶哑、发热及皮疹。
1.5 统计学方法 采用SPSS23.0 统计学软件处理数据。计量资料以均数±标准差(±s)表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组临床疗效比较 观察组治疗总有效率95.00%高于对照组的80.00%, 差异有统计学意义(P<0.05)。见表1。
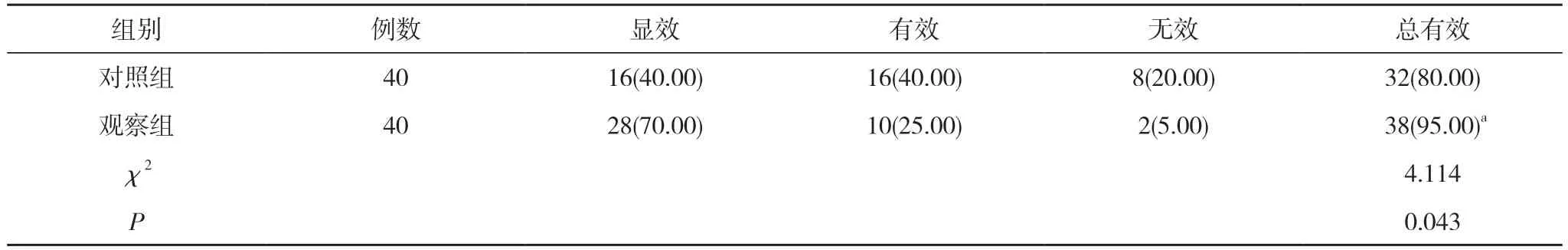
表1 两组临床疗效比较[n(%)]
2.2 两组治疗后症状缓解时间比较 观察组治疗后咳嗽、咯痰、气喘、发热缓解时间短于对照组, 差异有统计学意义(P<0.05)。见表2。
表2 两组治疗后症状缓解时间比较( ±s, d)

表2 两组治疗后症状缓解时间比较( ±s, d)
注:与对照组比较, aP<0.05
组别 例数 气喘 咳嗽 发热 咯痰对照组 40 3.85±0.62 4.12±0.85 2.95±0.32 2.02±0.56观察组 40 2.55±0.50a 2.86±0.54a 1.85±0.30a 1.21±0.20a t 10.323 7.913 15.861 8.615 P 0.000 0.000 0.000 0.000
2.3 两组治疗前后炎性因子水平比较 治疗前, 两组WBC、EOS 与IL-4 水平比较, 差异无统计学意义(P>0.05)。治疗7 d 后, 观察组WBC、EOS 与IL-4 水平低于对照组, 差异有统计学意义(P<0.05)。见表3。
表3 两组治疗前后炎性因子水平比较( ±s)

表3 两组治疗前后炎性因子水平比较( ±s)
注:与对照组治疗7 d 后比较, aP<0.05
组别 例数 时间 WBC(×109/L) EOS(×109/L) IL-4(ng/ml)对照组 40 治疗前 12.52±2.65 1.00±0.35 7.56±1.58治疗7 d 后 10.05±1.82 0.75±0.20 4.35±1.00观察组 40 治疗前 12.50±2.41 0.98±0.28 7.52±1.60治疗7 d 后 7.22±1.06a 0.36±0.10a 2.00±0.64a t两组治疗前 0.035 0.282 0.113 P两组治疗前 0.972 0.779 0.911 t两组治疗7 d 后 8.498 11.031 12.518 P两组治疗7 d 后 0.000 0.000 0.000
2.4 两组不良反应发生率比较 两组不良反应发生率比较差异无统计学意义(P>0.05)。见表4。

表4 两组不良反应发生率比较[n(%)]
3 讨论
喘息性支气管炎是由于细胞因子分泌增加和炎性反应介质爆发导致的气道炎性反应疾病[6]。临床治疗时主要通过免疫疗法, 将患儿机体的Th1 反应增强, 并使Th2 反应得到抑制。布地奈德作为一种糖皮质激素药物, 在喘息性支气管炎治疗中应用率高[7-9]。但有研究发现, 布地奈德应用于喘息性支气管炎, 治疗效果并不十分理想, 主要是由于布地奈德的应用, 并未从根本上使喘息性支气管炎患儿自身出现的Th1/Th2 免疫应答失衡的问题得到解决[10-13]。
研究发现, 病毒侵袭机体后, 机体会对抗病毒特异性蛋白予以分泌, 减轻病毒细胞对机体造成的损伤[14-16]。干扰素属于蛋白物质, 其含有多种生物活性,可使病毒复制受到干扰。机体在受到病毒侵袭的早期阶段就可对干扰素予以生成。受到信号转导途径受体差异的影响, 可将干扰素分为不同类型[17]。干扰素不但可使病毒感染细胞被直接杀伤, 同时也可使自然杀伤细胞被激活, 将病毒感染细胞的抗原提呈能力增强,使病毒感染细胞更容易被机体自然杀伤细胞识别[18]。本次研究中, 观察组治疗总有效率95.00%高于对照组的80.00%, 差异有统计学意义(P<0.05)。观察组治疗后咳嗽、咯痰、气喘、发热缓解时间分别为(2.86±0.54)、(1.21±0.20)、(2.55±0.50)、(1.85±0.30)d, 均明显短于 对 照 组 的(4.12±0.85)、(2.02±0.56)、(3.85±0.62)、(2.95±0.32)d, 差异有统计学意义(P<0.05)。表明在对小儿喘息性支气管炎进行治疗时, 雾化吸入重组人干扰素α2b 注射液可提升治疗效果, 加快患儿疾病症状缓解。分析原因, 干扰素可使小儿喘息性支气管炎致病病毒的DNA 复制受到抑制, 将mRNA 信号转导减少, 使病毒蛋白合成率降低, 促使患儿的疾病症状得到更为有效的缓解。本次研究中, 治疗7 d 后, 观察组WBC、EOS 与IL-4 水 平 分 别 为(7.22±1.06)×109/L、(0.36±0.10)×109/L、(2.00±0.64)ng/ml, 均明显低于对照组的(10.05±1.82)×109/L、(0.75±0.20)×109/L、(4.35±1.00)ng/ml, 差异有统计学意义(P<0.05)。结果表明雾化吸入重组人干扰素α2b 注射液可使喘息性支气管炎患儿的炎性反应减轻。分析原因, 干扰素进入机体后, 可使淋巴细胞亚群的Th1/Th2 平衡调节作用受到干扰, 将Th1 分泌功能增强, 使Th2 分泌作用受到抑制, 将T 淋巴细胞对白细胞介素的分泌减少, 使患儿自身机体血清内的炎性因子水平降低, 取得确切的抗炎效果。本次研究中, 两组用药后不良反应发生率比较差异无统计学意义(P>0.05)。表明雾化吸入重组人干扰素α2b注射液并不会明显增加不良反应, 用药安全性高。采用重组人干扰素α2b 注射液进行雾化吸入, 可使药物直接在病灶局部产生作用, 将全身不良反应减少。
综上所述, 雾化吸入重组人干扰素α2b 注射液可提升小儿喘息性支气管炎治疗效果, 加快疾病症状缓解, 降低机体炎性因子水平, 且不良反应少。
