朱顶红褪绿环斑病毒 RT-LAMP 快速检测体系的建立
2023-08-18赵正婷盖晓彤张俊蕾夏振远姜宁刘雅婷
赵正婷 盖晓彤 张俊蕾 夏振远 姜宁 刘雅婷


摘要:为快速检测朱顶红褪绿环斑病毒(hippeastrum chlorotic ringspot virus, HCRV),根据 HCRV 的核壳体(N )蛋白基因保守核苷酸序列,设计了5组引物进行筛选,并采用单一变量法对 RT-LAMP 体系反应温度、时间、甜菜碱浓度、 dNTPs 浓度、Mg2+浓度、内外引物浓度比等进行逐一优化,建立了 HCRV 逆转录环介导等温扩增(RT-LAMP )检测体系。结果表明,最佳引物组为 P1,最适反应温度为64℃ , Betaine 、dNTPs 、Mg2+的最佳终浓度分别为0.8、0.2、6 mmol/L,最佳内外引物浓度比为5∶1,最佳反应时间50 min 。检测结果显示优化后的 RT-LAMP 经 SYBR Green I 染色可通过肉眼直接判断结果,具有高度特异性,且灵敏度是常规 RT-PCR 的100倍。本研究为 HCRV 的检测提供了一种便捷、高效、可靠的方法。
关键词:朱顶红褪绿环斑病毒; RT-LAMP ;特异性;灵敏度
中图分类号: S435.72 文献标识码: A 文章编号:1007-5119(2023)03-0039-08
Development of an RT-LAMP Assay for Rapid Detection of hippeastrumchlorotic ringspot virus (HCRV)
ZHAO Zhengting1, GE Xiaotong2, ZHANG Junlei3, XIA Zhenyuan2, JIANG Ning2*, LIU Yating1,4*
(1. College of Agronomy and biotechnology, Yunnan Agriculture University, Kunming 650201, China;2. Yunnan Academy ofTobacco Agricultural Sciences, Kunming 650021, China;3. College of Plant Protection, Yunnan Agriculture University, Kunming650201, China;4. College of Tobacco Science, Yunnan Agriculture University, Kunming 650201, China)
Abstract: In order to quickly detect the hippeastrum chlorotic ringspot virus(HCRV), five sets of primers were designed and screened according to the conserved nucleotide sequence of the nucleocapsid (N) protein gene of HCRV, and the RT-LAMP system reaction temperature, time, betaine concentration, dNTP concentration, Mg2+ concentration, and concentration ratio of internal and external primers were optimized by single variable method. A detection system of HCRV reverse transcription loop mediated isothermal amplification (RT-LAMP) was established. The results showed that the optimal primer group was P1, the optimal reaction temperature was 64℃, and the optimal final concentrations of Betaine, dNTPs, and Mg2+ were 0.8, 0.2, 6 mmol/L. The optimal concentration ratio of internal and external primers is 5∶1, and the optimal reaction time is 50 minutes. The test results showed that after staining with SYBR Green I, the optimized RT-LAMP can be directly evaluated by naked eyes, with high specificity and sensitivity, 100 times higher than that of conventional RT-PCR. This study provides a convenient, efficient, and reliable method for the detection of HCRV.
Keywords: hippeastrum chlorotic ringspot virus (HCRV); RT-LAMP; specificity; sensitivity
朱顶红褪绿环斑病毒(Hippeastrum chlorotic ringspot virus, HCRV)是2013年首次在云南昆明朱顶红植株上发现并报道的布尼亚病毒目(Bunyavirales)番茄斑萎病毒科(Tospoviridae)正番茄斑萎病毒属(Orthotospovirus)新成员[1]。该病毒在云南、海南等中国南部省份广泛分布[2],可导致寄主植株叶片局部褪绿,出现坏死斑,葉片畸形等[3],严重损害作物经济价值[4]。2020年本课题组在对云南省烟草正番茄斑萎病毒属病毒的调查中首次发现 HCRV 可单独或复合侵染烟草,阳性检出率高达25%,仅次于番茄斑萎病毒(tomatospotted wilt virus, TSWV),使烟叶出现严重的黄化、沿叶脉坏死的症状[5],因其侵染速度快、传播范围广,所以对烟草产业危害潜力极大,目前尚无有效的防治措施[6,8]。
筛选无毒幼苗是预防 HCRV 大面积传播的主要方法之一[9],但寄主在病毒侵染早期症状表现不明显,给病害防治带来诸多困难。目前 HCRV 的检测方法主要包括电子显微镜检测[10]、血清学检测[11]、分子生物学检测[12]。电子显微镜检测需要专业设备,且样品制备耗时长,操作繁琐,难以满足生产上快速、高效、准确检测病原的要求[13];酶联免疫吸附法(Enzyme Linked Immunosorbent Assay,ELISA)检测需要制备高质量的病毒血清和特异性抗体,检测时间较长[14];聚合酶链式反应(Polymerase Chain Reaction ,PCR)检测要求大量仪器设备,对试验操作要求严格[15],这些缺点大大限制了这些检测方法在实际生产中的推广应用。因此,亟需开发一种灵敏度更高、特异性更强的检测方法。环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)是2000年日本学者Notomi等[16]发明的重要检测技术,针对靶基因的6个区域设计6条特异引物,在恒温条件利用 DNA 链置换聚合酶(Bst DNA polymerase)即可完成靶基因的扩增,加入荧光染料可直接观察结果,具有检测速度快,灵敏度高,不需要专业设备的优点[17-18],已被广泛应用于农业、食品等[19-21]各种领域。
核壳体(N)蛋白是番茄斑萎病毒属(Tospovirus)中最保守的蛋白,N 基因序列是番茄斑萎病毒属不同病毒的主要分类依据[22],因此多数番茄斑萎病毒属病毒检测技术都是基于 N 基因开发[23-24]。目前还没有 LAMP 应用于 HCRV 的报道,本研究基于 N 基因设计引物,对反应体系进行逐一优化,并通过特异性、灵敏性及实验室接种样品检测等对其效果进行评估,建立了一种 HCRV 快速高效、特异性好、灵敏度高的 RT-LAMP 快速检测技术,为 HCRV 早期快速诊断和防控提供技术支持。
1 材料与方法
1.1 病毒样品
本研究中使用的朱顶红褪绿环斑病毒(HCRV)、烟草花叶病毒(tobacco mosaic virus, TMV)、马铃薯 Y 病毒(potato virus Y, PVY)、番茄斑萎病毒(tomato spotted wilt virus, TSWV)、番茄环纹斑点病毒(tomato zonate spot virus, TZSV)、南美红辣椒脉斑驳病毒(chilliveinal mottle virus, ChiVMV)、番茄褐色皱纹果病毒(tomato brown rugose fruit virus, ToBRFV)、黄瓜花叶病毒(cucumber mosaic virus, CMV)、烟草脉带花叶病毒(tobacco vein banding mosaic virus, TVBMV)等,均由本课题组纯化保存后接种于本氏烟,样本经 RT-PCR 检测确认含有单一病毒后,储存在–80℃冰箱。选择在室温生长的健康脱毒烟草作为阴性对照(Negative Control ,NC)。
1.2 主要试剂
TRNzol Universal 总RNA 提取试剂购自北京天根公司, MgSO4(100 mmol/L)、WarmStart?通用 LAMP/RT-LAMP 2×预混液、Bst 2.0 DNA 聚合酶购自美国 New England Biolabs 公司, M-MLV 逆转录酶购自Promege公司,甜菜碱 Betaine、荧光指示剂 SYBR GreenⅠ购自北京索莱宝科技有限公司, dNTPs(10 mmol/L)购自上海 CWBIO 公司,HiScript?II 1st strand cDNA Synthesis Kit 反转录试剂购自江苏Vazyme公司等。
1.3 引物设计
将 HCRV 的 N 基因保守区域(GenBank 序列登录号: JX 833564.1)作为引物设计的参考序列。通过在线软件Primer Explorer 5.0(http://primerexplorer. jp/e/)设计5组引物,其中 F3和 B3为外引物,FIP(F1c+F2)和 BIP(B1c+B2)为内引物,LF 和 LB 为环引物,所有引物均用 PAGE 法纯化,并由生工生物工程(成都)有限公司合成(表1)。
1.4 RNA 提取
参照TRNzol Universal 总 RNA 提取试剂说明书从新鲜叶组织中提取总 RNA。用1.2%琼脂糖凝胶电泳测定 RNA 的质量, RNA 样本在–80℃下保存备用。
1.5 RT-PCR 检测
以总 RNA 为模板,采用PrimeScriptTM II 1st strand cDNA Synthesis Kit 反转录试剂盒,进行 cDNA 的合成。 PCR 检测以等体积 cDNA 为模板, HCRV-F/R 引物进行 cDNA 的 PCR 扩增。得到的 PCR 产物用1.2%琼脂糖凝胶电泳检测分析。
1.6 RT-LAMP 引物筛选
用设计出的5组RT-LAMP 引物(表1)对 HCRV 进行扩增,体系如下:参照Bst 2.0 Warm Start? DNA Polymerase 说明书:10×Thermopol Buffer 2.5μL、MgSO4(100 mmol/L)0.5μL、dNTP (10 mmol/L)0.5μL、 Betaine (5 mmol/L)5μL、FIP/BIP Primers(25×)2μL、 F3/B3 Primers(25×)1μL、LoopF/B Primers(25×)1.5μL、Bst 2.0 DNA 聚合酶(8000 U)0.5μL、M-MLV 逆转录酶(10000 U)0.2μL、Total RNA 1μL、DEPC H2O 補足至总体积25μL。每组引物均设置一个NC,62℃恒温扩增60 min,扩增产物加1000×SYBR GreenⅠ 1μL 进行染色,显示荧光绿为阳性,橙黄色为阴性。取扩增产物4μL 进行1.2%琼脂糖凝胶电泳检测分析,呈现梯状条带为阳性,无条带为阴性。筛选出一组扩增效率高且不出现假阳性的引物。
1.7 RT-LAMP 体系优化
为确定最佳扩增条件,采用控制单一变量法,每个条件设置3次试验重复,对 RT-LAMP 体系条件进行逐一全面优化。每个变量分别设置梯度试验:反应温度58、60、62、64、66、68℃;反应时间30、40、50、60、70、80 min;甜菜碱浓度0、0.6、0.8、1.0、1.2、1.4、1.6 mmol/L;dNTPs 浓度0、0.2、0.4、0.6、0.8、1.0 mmol/L ;Mg2+浓度0、2、4、6、8、10 mmol/L;内外引物浓度比1∶1、2∶1、3∶1、4∶1、5∶1、6∶1、7∶1、8∶1。每个梯度各设置一个 NC,反应结束后取扩增产物4μL 进行1.2%琼脂糖凝胶电泳检测分析。
1.8 RT-LAMP 与 RT-PCR 灵敏度比较
在最佳反应条件下,为了评估 RT-LAMP 与 RT-PCR 的灵敏度,将HCRV 的RNA 稀释100、10-1、10-2、10-3、10-4、10-5、10-6、10-7倍,分别作为 RT-LAMP 和 RT-PCR 的模板,进行灵敏度比较测试。通过 SYBR Green I 染色和1.2%琼脂糖凝胶电泳检测扩增产物。
1.9 RT-LAMP 特异性检验
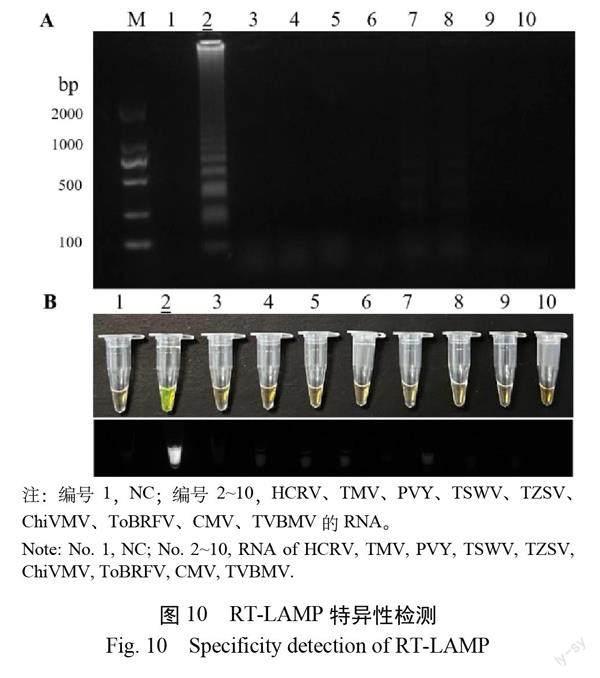
在最佳反应条件下,通过使用9种烟草常见病毒:HCRV、TMV、PVY、TSWV、TZSV、ChiMV、ToBRFV、CMV、TVBMV 的 RNA 作为扩增的模板,分析检测的交叉反应性来评估所建立 RT-LAMP 体系的特异性。通过 SYBR Green I 染色和1.2%琼脂糖凝胶电泳检测扩增产物。
2 结果
2.1 RT-PCR 检测
使用 HCRV-F/R 引物扩增 HCRV 的 RNA(图1),结果显示,扩增出样品相关 DNA 片段,且无杂带,电泳检测结果与目的片段大小一致(432 bp)。而 NC 并未扩增到目标条带,说明样品被 HCRV 成功侵染,而 NC 未被 HCRV 侵染,可进行后续试验。
2.2 引物筛选
根据琼脂糖凝胶电泳检测结果(图2A),第一组引物扩增出明亮条带且未出现假阳性,第二、四、五组引物扩增出现假阳性,第三组引物未扩增出条带且 NC 出现假阳性,荧光检测与凝胶电泳检测结果一致(图2B)。所以选定第一组引物为最佳引物以进行后续优化试验。
2.3 反应时间优化
反应时间优化结果表明,用第一组引物扩增时,30 min 开始出现较淡的梯状条带,50 min 开始出现明亮的梯状条带(图3A),荧光检测与凝胶电泳检测结果一致(图3B),NC 均未出现假阳性,结合高效性考虑,选择最佳反应时间为50 min。
2.4 反应温度优化
酶的活性在很大程度上受到温度的限制,因此必须优化反应温度。反应温度优化结果表明,扩增温度为58~68℃均有梯状条带产生,NC 均未出现假阳性。但扩增温度为58~62℃时梯状条带较淡,扩增温度为64~68℃时梯状条带较明亮(图4A),荧光检测与凝胶电泳检测结果一致(图4B),结合实用性考虑,选择最佳反应温度为64℃。
2.5 甜菜碱浓度优化
甜菜碱浓度优化结果表明,当甜菜碱浓度为0 mmol/L 时几乎没有梯状条带,0.6~1.2 mmol/L 梯状条带亮度逐渐增强,从1.4 mmol/L 开始梯状条带亮度减弱, NC 均未出现假阳性(图5A),荧光检测与凝胶电泳检测结果一致(图5B)。结合降低检测成本考虑,选择最佳甜菜碱浓度0.8 mmol/L。
2.6 dNTPs 浓度优化
dNTPs 浓度优化结果表明,dNTPs 浓度为0 mmol/L 时没有梯状条带产生,从0.2~0.6 mmol/L 梯状条带较为明亮,0.8 mmol/L 开始梯状条带消失。NC 均未出现假阳性(图6A),荧光检测与凝胶电泳检测结果一致(图6B)。结合降低检测成本考虑,选择最佳 dNTPs 浓度为0.2 mmol/L。
2.7 Mg2+浓度优化
Mg2+浓度优化结果表明,Mg2+浓度为0 mmol/L 时没有梯状条带产生,2~8 mmol/L 梯状条带亮度逐渐增强,10 mmol/L 开始 NC 出现假阳性(图7A),荧光检测与凝胶电泳检测结果一致(图7B)。结合降低检测成本及避免假阳性考虑,选择最佳 Mg2+浓度为6 mmol/L。
2.8 內外引物浓度比优化
内外引物浓度比优化结果表明,内外引物浓度比为1∶1~2∶1时没有梯状条带产生,3∶1~8∶1梯状条带亮度逐渐增强, NC 均未出现假阳性(图8A),荧光检测与凝胶电泳检测结果一致(图8B)。结合降低检测成本考虑,选择最佳内外引物浓度比为5∶1。
2.9 灵敏度试验
灵敏度试验结果表明,在1~10-6稀释的模板下, RT-LAMP 可以扩增出梯状条带,随着稀释梯度的增加,条带变弱,10-7时梯状条带消失,即 RT-LAMP 的检测限为10-6(图9A),荧光检测与凝胶电泳检测结果一致(图9B)。而 RT-PCR 在1~10-4稀释的模板下随着稀释梯度的增加,条带变弱,10-5时条带消失,即 RT-PCR 的检测限为10-4(图9C)。因此,本研究建立的 RT-LAMP 检测体系比传统的 RT-PCR 方法灵敏100倍。
2.10 特异性检测
特异性检测结果表明,该 RT-LAMP 体系从 HCRV 中扩增出梯状条带,而在其他病毒(TMV、PVY、TSWV、TZSV、ChiVMV、ToBRFV、CMV、TVBMV)及 NC 中,未扩增出条带(图10A),荧光检测与凝胶电泳检测结果一致(图10B)。表明建立的 RT-LAMP 体系具有良好的特异性。
3 讨论
本研究基于HCRV 的N 基因序列设计了5组引物,依次对反应条件及试剂浓度进行了优化,采用传统 RT-PCR 检测方法进行平行比对验证,确立了 HCRV 的 RT-LAMP 检测体系,将 RT-LAMP 首次应用于 HCRV 的检测。
不同病原体 RT-LAMP 检测的引物、各组分浓度、最佳条件和灵敏度大不相同[25-26]。高彦萍等[27]报道引物、Mg2+浓度和 dNTPs 浓度对马铃薯卷叶病毒(potato leaf froll virus, PLRV)的 RT-LAMP 检测体系影响较明显。本研究结果表明,内外引物浓度比、Mg2+浓度和 dNTPs 浓度对 HCRV 的 RT-LAMP 检测体系影响同样较为明显;本研究利用 SYBR Green I 建立的 HCRV 荧光可视化RT-LAMP 检测体系可以检测到稀释10-6倍的 HCRV 基因组 DNA ,检测灵敏度比高雪等[5]建立的 RT-PCR 提高了100倍。 RT-LAMP 检测技术最大的问题就是假阳性,与其他 RT-LAMP 应用研究相比,本研究各条件的优化试验在执行严格的工作分区以及避免气溶胶污染的同时每个浓度均设置 NC,以重点探讨除气溶胶污染外导致假阳性出现的原因。结果表明在该体系中只有 Mg2+浓度的变化会引发假阳性出现,结合 RT-LAMP 在新型冠状病毒(SARS-CoV-2)检测中降低 Mg2+浓度可消减假阳性的报道[28],推测在 RT-LAMP 体系中引物较稳定的情况下, Mg2+浓度与假阳性的产生关联最强,但还需进一步验证。
在实验室接种 HCRV 的本氏烟样品检测中,本研究建立的 HCRV RT-LAMP 检测体系所得结果与传统 RT-PCR 方法检测结果一致,且 RT-LAMP 检测64℃恒温扩增50 min 即可通过肉眼观察直接判断结果,较 RT-PCR 简单,可满足科研和基层单位及简陋现场对该病毒检测的需要,对于生产上快速地诊断和防治 HCRV 具有重要应用价值。
4 结论
本研究建立了 HCRV RT-LAMP 检测体系,可快速准确地从感病烟叶中检测出 HCRV,为 HCRV 早期快速诊断和防控提供技术支持。下一步研究可以考虑将 RNA 粗提取与 RT-LAMP 相结合,建立一步法 RT-LAMP 检测体系,进一步提高检测效率。
参考文献
[1] DONG J H, YIN Y Y, FANG Q, et al. A new Tospovirus causing chlorotic ringspot on hippeastrum sp. in China[J]. Virus Genes, 2013, 46(3):567-570.
[2] XU Y, LOU S G, LI X L, et al. Complete S RNA and M RNA nucleotide sequences of a Hippeastrum chlorotic ringspot virus (HCRV) isolate from Hymenocallis littoralis (Jacq.) salisb in China[J]. Archives of Virology, 2013, 158(12):2597-2601.
[3] 黄亚宁,董玉梅,徐烨,等. 昆明市园艺植物番茄斑萎病的初步鉴定[J].云南农业大学学报(自然科学),2015,30(4):648-652.
HUANG Y N, DONG Y M, XU Y, et al. Preliminary identification of horticultural plant Tomato spotted wilt virus in Kunming[J]. Journal of Yunnan Agricultural University(Natural Science), 2015, 30(4):648-652.
[4] LI Q, XU Y, ZHU M, et al. Genetic diversity of the nucleocapsid protein gene of Hippeastrum chlorotic ringspot virus from Hymenocallis littoralis in southern China[J]. Archives of Virology, 2017, 61(1):116-122.
[5] 高雪,王偲博,李正洋,等.云南省煙草正番茄斑萎病毒属病毒的调查和鉴定[J].中国烟草学报,2020,26(1):84-90.
GAO X, WANG S B, LI Z Y, et al. Investigation and identification of Orthotospovirus on tobacco in Yunnan province, China[J]. Acta Tabacaria Sinica, 2020, 26(1):84-90.
[6] GAO X, JIA Z Q,TAO H Z, et al. Use of deep sequencing to profile small RNAs derived from Tomato spotted wilt orthotospovirus and Hippeastrum chlorotic ringspot orthotospovirus in infected Capsicum annuum[J]. Virus Research, 2022, 309:198648.
[7] 王宇琪,吴保为,陶宏征,等.侵染昆明园林植物的4个 HCRV 分离株核壳体蛋白氨基酸序列分析[J].云南农业大学学报(自然科学版),2021,36(1):165-168.
WANG Y Q, WU B W, TAO H Z, et al. Amino acid sequence analysis of four isolates of Hippeastrum chlorotic ringspot virus nucleocapsid protein in several garden plants in Kunming[J]. Journal of Yunnan Agricultural University (Natural Science), 2021, 36(1):165-168.
[8] 高君直,吳保为,高雪,等.云南不同地区蜘蛛兰上朱顶红褪绿环斑病毒 RNA S 序列分析[J].云南农业大学学报(自然科学),2017,32(2):218-225.
GAO J Z, WU B W, GAO X, et al. S RNA Analysis of Hippeastrum chlorotic ringspot virus on spider lily from different Areas in Yunnan province[J]. Journal of Yunnan Agricultural University(Natural Science), 2017, 32(2):218-225.
[9] 许云玉,贾志强,高雪,等.番茄斑萎病毒侵染辣椒后病毒积累量动态变化[J].分子植物育种,2023,21(5):1603-1609.
XU Y Y, JIA Z Q, GAO X, et al. Dynamic changes of virus accumulation in pepper infected by Tomato spotted wilt virus[J]. Molecular Plant Breeding, 2023, 21(5):1603-1609.
[10] 张涵,王茂森,王田田,等.水鬼蕉感染 HCRV 不同发病时期的病毒粒体分布与亚细胞病变特征[J].植物病理学报,2023,42(1):53-61.
ZHANG H, WANG M S, WANG T T, et al. Virions distribution and subcellular pathological characteristics at different stages of Hymenocallis littoralis infected with Hippeastrum chlorotic ringspot orthotospovirus[J]. Acta PhytopathologicaSinica, 2023, 42(1):53-61.
[11] 方琦,董家红,丁铭,等.侵染水鬼蕉和花朱顶红的番茄斑萎病毒属病毒的电镜和 DAS-ELISA 诊断[J].园艺学报,2011,38(10):2005-2009.
FANG Q, DONG J H, DING M, et al. DAS-ELISA and electron microscopic diagnosis of Tospoviruses infecting Hymenocallis littoraris and Hippeastrumvittatum in Kunming[J]. Acta HorticulturaeSinica, 2011, 38(10):2005-2009.
[12] 高雪,王傀博,李正洋,等.云南省烟草正番茄斑萎病毒属病毒的调查和鉴定[J].中国烟草学报,2020,26(1):84-90.
GAO X, WANG S B, LI Z Y, et al. Investigation and identification of Orthotospovirus on tobacco in Yunnan province, China[J]. Acta TabacariaSinica, 2020, 26(1):84-90.
[13] ROINGEARD P. Viral detection by electron microscopy: past,present and future[J]. Biology of the Cell, 2008, 100(8):491-501.
[14] BOONHAM N, KREUZE J, WINTER S, et al. Methods in virusdiagnostics: from ELISA to next generation sequencing[J]. Virus Research, 2014, 186:20-31.
[15] 张静雅,何衍彪.植物病毒病检测及防治技术研究进展[J].安徽农学通报,2019,25(12):79-81,83.
ZHANG J Y, HE Y B. Research progress of plant virus disease detection and management technology[J]. Anhui Agricultural Science Bulletin, 2019, 25(12):79-81, 83.
[16] NOTOMI T, OKAYAMA H, MASUBUCHI H, et al. Loop-mediatedisothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12): E63.
[17] BHAT A I, AMAN R, MAHFOUZ M. Onsite detection of plantviruses using isothermal amplification assays[J]. Plant Biotechnol Journal, 2022, 20(10):1859-1873.
[18] WANJALA B W, ATEKA E M, MIANO D W, et al. Loop-mediatedisothermal amplification assays for on-site detection of the main sweet potato infecting viruses[J]. Journal of Virological Virol Methods, 2021, 298:114301.
[19] TREDER K, CHOLU J, ZACHARZEWSKA B, et al. Optimizationof a magnetic capture RT-LAMP assay for fast and real-time detection of Potato virus Y and differentiation of N and Oserotypes[J]. Archives of Virology, 2018, 163(2):447-458.
[20] SUPAKITTHANAKORN S, VICHITTRAGOONTAVORN K,SUNPAPAO A, et al. Tobacco mosaic virus infection of chrysanthemums in Thailand: development of colorimetric reverse-transcription loop-mediated isothermal amplification (RT-LAMP) technique for sensitive and rapid detection[J]. Plants (Basel), 2022, 11(14):1788.
[21] NIESSEN L, VOGEL R F. Detection of Fusarium graminearumDNA using a loop-mediated isothermal amplification (LAMP) assay[J]. International Journal of Microbiology, 2010, 140(2-3):183-191.
[22] 盧训,丁铭,方琦,等.侵染云南烟草的番茄环纹斑点病毒 N 基因的分子变异分析[J].植物病理学报,2012,42(2):195-201.
LU X, DING M, FANG Q, et al. Molecular variation of natural populations of Tomato zonate spot virus infecting fluecured tobacco in Yunnan[J]. Acta PhytopathologicaSinica, 2012, 42(2):195-201.
[23] 张仲凯,丁铭,方琦,等.番茄斑萎病毒属(Tospovirus)病毒在云南的发生分布研究初报[J].西南农业学报,2004(S1):163-168.
ZHANG Z K, DING M, FANG Q, et al. The preliminary study of the occurrence and distribution of Tospovirus in Yunnan[J]. Southwest China Journal of Agricultural Sciences, 2004(S1):163-168.
[24] 忽靖宇,阙开娟,缪田丽,等.侵染鸢尾的番茄斑萎病毒鉴定[J].园艺学报,2023,50(1):170-176.
HU J Y, QUE K J, MIAO T L, et al. Identification of Tomato spotted wilt orthotospovirus infecting iris tectorum[J]. Acta HorticulturaeSinica, 2023, 50(1):170-176.
[25] TIAN Z, YANG L, QI X, et al. Visual LAMP method for thedetection of Vibrio vulnificus in aquatic products and environmental water[J]. BMC Microbiology, 2022, 22(1):256.
[26] WANG M, TANG Z, LIAO M, et al. Loop-mediated isothermalamplification for detecting the Ile-2041-Asn mutation in fenoxaprop-p-ethyl-resistant Alopecurus aequalis[J]. Pest Management Science, 2022, 79(2):711-718.
[27] 高彦萍,张武,王国祥,等.马铃薯卷叶病毒 PLRV RT-LAMP 检测方法优化[J].植物保护,2019,45(6):259-264,306.
GAO Y P, ZHANG W, WANG G X, et al. Optimization of the PLRV RT-LAMP detection method[J]. Plant Protection, 2019, 45(6):259-264, 306.
[28] HEITHOFF D M, BARNES L T, MAHAN S P, et al. Assessment ofa smartphone-based loop-mediated isothermal amplification assay for detection of SARS-CoV-2 and influenza viruses[J]. JAMA Network Open, 2022, 5(1): e2145669.
