烟草种子萌发过程低温响应相关蛋白与多肽研究
2023-08-18索文龙王国平牛永志李元君许杰乔雨郑昀晔
索文龙 王国平 牛永志 李元君 许杰 乔雨 郑昀晔
摘要:为探究烟草种子萌发过程对低温胁迫的响应,对萌发1 d 、2 d 和3 d 的種子分别进行2 d 低温处理(LT1、LT2和 LT3),分析不同萌发时期种子遇到低温的蛋白与多肽变化,分别以萌发2 d、3 d 和4 d 的种子为对照(GS2、GS3和 GS4),形成3个组合 GS2 vs LT1、GS3 vs LT2和 GS4 vs LT3。结果显示, GS2 vs LT1、GS3 vs LT2和 GS4 vs LT3的差异多肽集合的交集共计20个多肽, GO 和 KEGG 富集分析发现3个组合的差异蛋白均与碳代谢、氨基酸生物合成相关;此外鉴定到8个参与到低温应答的多肽,其中 Nitab4.5_0002257g0090多肽在3个组合中同时被鉴定到,可能在低温应答过程中存在重要的功能。本研究为后续挖掘多肽在低温应答过程的功能提供了研究基础。
关键词:烟草种子;低温;蛋白;多肽
中图分类号: S572.01 文献标识码: A 文章编号:1007-5119(2023)03-0031-08
Study on Differentially Expressed Proteins and Polypeptides in Response to Low Temperature Stress during Tobacco Seed Germination
SUO Wenlong, WANG Guoping, NIU Yongzhi, LI Yuanjun, XU Jie, QIAO Yu, ZHENG Yunye*
(Yuxi Zhongyan Tobacco Seed Co., Ltd, Yuxi, Yunnan 653100, China)
Abstract: To investigate the response of tobacco seed germination process to low temperature stress, the seeds germinated for 1, 2 and 3 days were treated with low temperature for 2 days (samples were named LT1, LT2 and LT3 respectively), and the changes of proteins and polypeptides in seeds exposed to low temperature at different stages of germination were analyzed. The seeds germinated for 2, 3 and 4 days were used as control (samples were named GS2, GS3 and GS4 respectively), forming three combinations of treatment GS2 vs LT1, GS3 vs LT2 and GS4 vs LT3. The results showed that the intersection of differentially expressed protein of GS2 vs. LT1, GS3 vs. LT2 and GS4 vs. LT3 had a total of 20 polypeptides. The results of GO and KEGG enrichment analysis indicated that the differential polypeptides of the three combinations were related to carbon metabolism and amino acid biosynthesis. In addition, eight peptides were identified to be involved in low temperature response, and the peptide Nitab4.5_0002257g0090 was identified in three combinations at the same time, suggesting that it may have an important function in low temperature response. This study revealed the responsiveness of tobacco seeds to low temperature signaling pathways, and provided a data basis for the subsequent mining of peptides in the low temperature response process.
Keywords: tobacco seeds; low temperature; protein; peptipide
烟草(Nicotiana tabacum)是一种特殊的经济作物,对我国的国民经济起到重要作用。目前,我国大部分烟叶产区在育苗过程中经常遇到低温,对烟草种子正常萌发造成不利影响,从而影响育苗进程和育苗质量。研究烟草种子萌发期间对低温应答相关机制对调控种子萌发具有重要意义。
蛋白质差异表达是生物体自身基因表达模式在多变的环境条件下的综合体现,有助于人们更全面地了解低温胁迫的伤害机制和植物的适应机理[1]。目前关于植物低温胁迫的蛋白质应答研究较多,在番茄、马铃薯、小麦、玉米等有相关报道[2-5],关于种子萌发过程中蛋白质的变化在大豆、燕麦、水稻、小麦、玉米等[1,6-9]也有相关研究报道。烟草种子蛋白质的研究主要集中在种子成熟过程[10]以及不同类型烟草种子蛋白比较[11],而关于低温胁迫对烟草种子萌发过程中蛋白质的影响尚未见报道。
植物多肽分子是植物细胞信号转导的重要媒介,具有广泛的生物学功能,近年来随着检測技术的进步,多肽分子鉴定与功能分析技术逐步成熟,多肽分子鉴定与功能研究成为热点,研究发现多肽分子广泛参与植物细胞的增殖、花粉调控、气孔调控、根系发育、抵御病虫害等生长发育和环境适应性调控过程[12-16],而参与烟草种子萌发过程低温响应的多肽分子尚未见研究报道。
本研究通过分析低温胁迫下烟草种子萌发过程中差异蛋白和多肽,以期筛选潜在的烟草种子萌发过程响应低温的多肽分子,为后续研究相关多肽在低温响应中的功能及多肽产品开发提供基础,为解决低温天气对烟草种子萌发影响提供有效方案。
1 材料与方法
1.1 试验材料与处理
试验材料为烟草品种 K326,由玉溪中烟种子有限责任公司提供。
将烟草种子均匀播撒到垫有湿润滤纸的培养皿中,放置于人工气候箱内进行萌发。本研究对25℃萌发1、2和3 d 的种子分别再进行8℃、2 d 的低温处理,样品命名为 LT1、LT2和 LT3;对照按照生长状态一致的标准进行取样,分别为25℃下萌发2、3和4 d 的样品,命名为 GS2、GS3和 GS4。最后形成3个组合 GS2 vs LT1、GS3 vs LT2和 GS4 vs LT3。将萌发不同天数的种子样品保存于?80℃冰箱备用。每个样品3个重复。
1.2 试验方法
1.2.1 抗氧化酶活性测定称取0.05 g 样品,利用试剂盒(分光光度法,北京索莱宝科技有限公司)测定不同样品种子的过氧化氢酶(CAT)活性。
1.2.2 蛋白质提取与制备向样品中加入裂解液[1%十二烷基硫酸钠,8 mol/L 尿素,1×蛋白酶抑制剂混合物(Roche Ltd. Basel, Switzerland)],振荡研磨3×400 s ,冰上裂解30 min。高速离心15 min (15000 r/min,4℃)后取上清。采用10 K 超滤管(Millipore, Billerica)于4℃下8000 g 离心30 min 去除高分子量的蛋白。收集流穿液,流穿液用离心浓缩仪浓缩抽干,用100 mmol/L 三乙胺-碳酸缓冲液复溶。采用 C18除盐柱除盐后,肽段洗脱液真空抽干,?80℃保存。
1.2.3 多肽检测将?80 ℃冻存的样品用 LC-MS/MS 进行分析。 LC-MS/MS 为串联 EASY-nanoLC 1000的 Orbitrap Fusion Lumos 质谱仪(Thermo Fisher Scientific, MA, USA),配备在线纳喷离子源。上样量5μL,分析柱 Acclaim PepMap C18,75μm×25 cm,柱流量400 nL/min,柱温55℃ , 电喷雾电压2 kV,色谱梯度如下:流动相 A 相,0.1%甲酸水溶液; B 相,含0.1%甲酸的 ACN 溶液;以120 min 的梯度分离样品,柱流量控制在400 nL/min,柱温为55℃ , 梯度从4%的B 相起始,在110 min 以非线性梯度升高到60%,8 min 内升高到100%,维持8 min。
质谱仪在数据依赖采集模式下运行,自动在 MS 和 MS/MS 采集间切换。质谱参数设置如下:
(1)MS:扫描范围(m/z)=200~1500,分辨率=120000,AGC target=4e5,最大注入时间=50 ms,扫描电荷=1~7。(2)HCD-MS/MS(top 10):分辨率=15000,隔离窗口 m/z=3,AGC target=5e4,最大注入时间=35 ms,碰撞能量=35,动态排除时间=30 s。
1.2.4 多肽组样本搜库完成质谱分析后,串联质谱的原始数据经过 PEAKS Studio version X+(Bioinformatics Solutions Inc., Waterloo, Canada) 分析。PEAKS DB 对烟草基因组数据来源的烤烟数据库搜库。设置非酶切,搜库参数碎片离子质量容许误差为0.02 Da,母离子质量容许误差为7×10-6 Da,可变修饰: Oxidation (M)15.99,Acetylation (Protein N-term)42.01。肽段经过1% FDR 质控过滤。
通过1% FDR 质控过滤的肽段的非标计定量通过 PEAKS Studio version X+完成。首先,软件分别识别各样本中肽段母离子的峰面积即肽段的相对丰度,然后采用高性能的保留时间对齐算法对来源于不同样本的相同肽段进行对齐。采用样本的总离子流(TIC)进一步对数据进行归一化处理,样本中各肽段的丰度由原始丰度除以归一化系数获得。
1.2.5 多肽数据初步分析获得的多肽原始数据使用 PEAKS 鉴定,鉴定的最小肽段长度为7,在谱图水平接近1% FDR 时曲线平滑上升,且鉴定的肽谱匹配数值合理,表明该次鉴定结果可信且数量理想。
使用 PEAKS 提取肽段峰强度、峰面积、液相色谱保留时间等信息用以计算多肽定量值,定量使用 PEAKS 默认参数。接着使用总和归一化方法对不同重复间蛋白的定量值进行归一化处理。
1.2.6 GO 和 KEGG 富集分析 GO 富集分析以及 KEGG 注释使用以下 R 包:clusterProfiler[14](用于富集分析)、topGO(用于绘制 GO 富集图片)、
AnnotationHub[15](用于下载数据库)、BioFileCache(依赖包)、dbplyr(依赖包)、pathview(用于分析 KEGG pathway)。采用的烟草数据库为烤烟 v1.0 Edwards 2017 BLAST ( https://solgenomics.net/ organism/Nicotiana_tabacum/genome),分析过程所使用的数据库编号为 AH93857。信号肽预测分析采用 signal IP4.1( https://services.healthtech.dtu.dk/ service.php?SignalP-4.1)。
2 结果
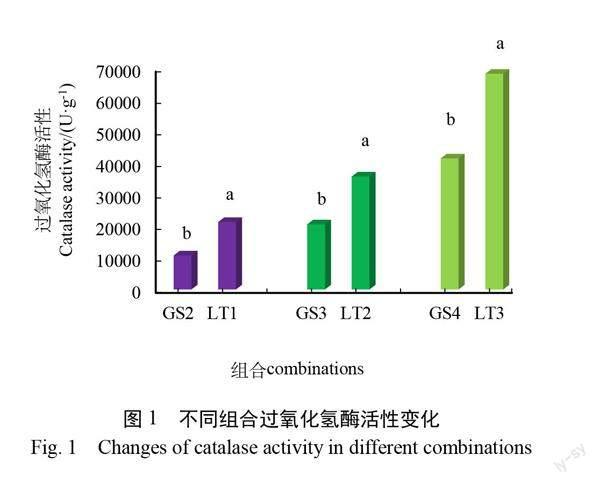
2.1 低温胁迫后的 CAT 活性
按照生长状态一致的标准进行取样,对不同样品的抗氧化酶活性进行分析[17]。从图1可知,由于低温胁迫时间较长,对种子萌发速度影响较大,处理 LT1与对照 GS2相比(GS2 vs LT1),经过低温8℃处理后,LT1的过氧化氢酶活性显著高于 GS2,处理 LT1过氧化氢酶活性为21295.62 U/g,GS2处理为10733.12 U/g;同样,处理 LT2、LT3的过氧化氢酶活性也显著高于对照 GS3、GS4。说明处理和对照样品存在表型差异,可用于后续分析。
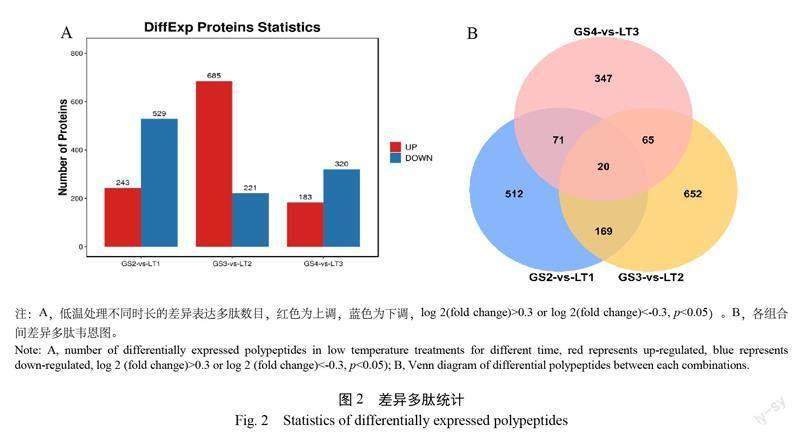
2.2 低温胁迫后的差异多肽分析
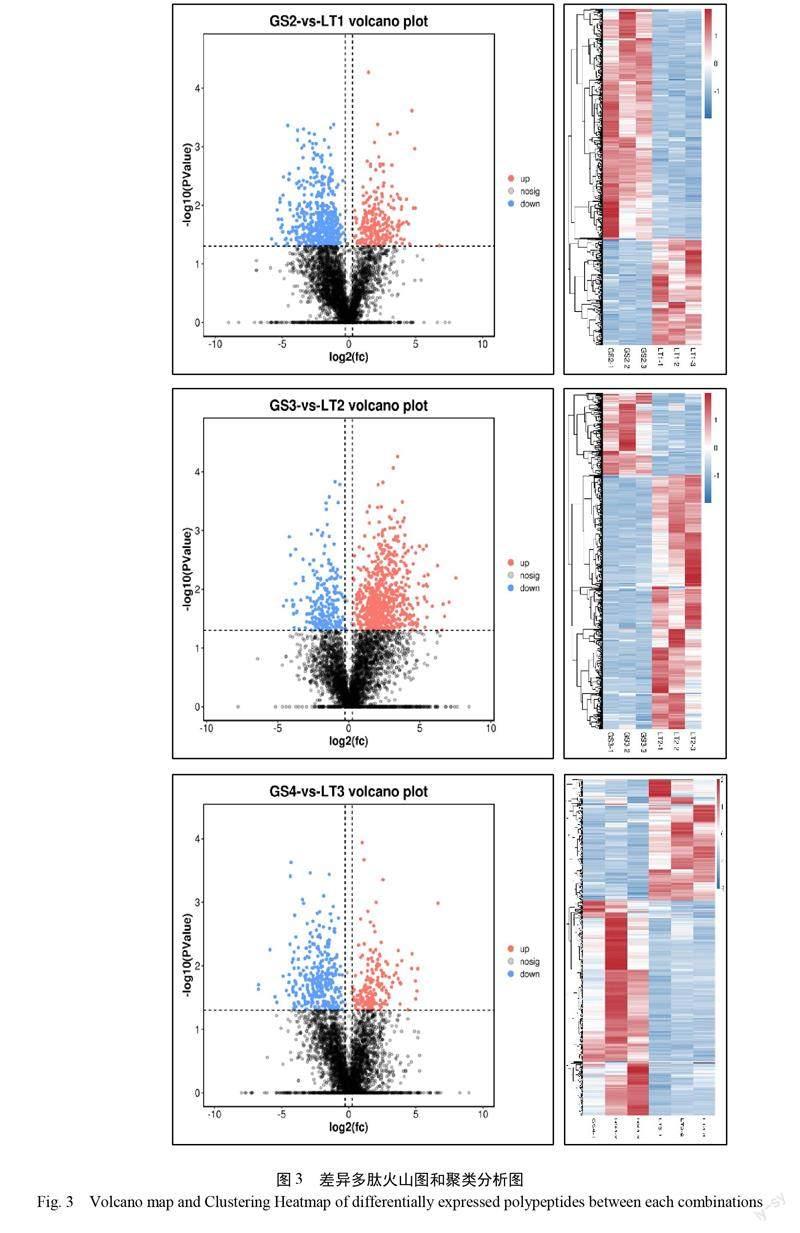
为了分析种子萌发过程低温胁迫处理后的差异多肽,采用10 kDa超滤管除去高分子蛋白,并将低分子蛋白进行质谱鉴定。鉴定的差异多肽数量如图2A 所示,GS2 vs. LT1鉴定到243个上调表达,529个下调表达; GS3 vs. LT2鉴定到685个上调表达,221个下调表达; GS4 vs. LT3鉴定到183个上调表达,320个下调表达。3个组合差异多肽集合的交集共计20个,其中 GS2 vs. LT1与 GS3 vs. LT2组差异多肽共计189个,GS2 vs. LT1与 GS4 vs. LT3组差异多肽共计91个, GS3 vs. LT2与 GS4 vs. LT3组差异多肽共计85个(图2B);各组差异多肽火山图和聚类分析图见图3。
2.3 差异多肽所属蛋白的 GO 和 KEGG 富集分析
GS2 vs. LT1差异多肽所属蛋白GO 富集分析表明:在细胞组分方面主要富集在核、蛋白核酸复合物和核小体等(图4A);在分子功能方面主要富集在顺式还原酮加双氧酶、氧化还原酶活性、加双氧酶活性和过氧化物酶活性、抗氧化剂活性等(图4B);在生物过程方面主要富集在单细胞到多细胞生物过程、多细胞生物发育及多细胞生物过程、系统发育、生殖发育、种子发育和对刺激的响应等(图4C)。 KEGG 主要富集到次生代谢物生物合成、代谢途径、碳代谢、氨基酸生物合成等过程(图4D)。
GS3 vs. LT2差异多肽所属蛋白的GO 富集分析表明,在细胞组分方面主要富集在高尔基体、内膜系统、胞外区等(图5A);在分子功能方面主要富集在异构酶活性、抗氧化剂活性、翻译延伸因子活性、顺反异构酶活性等(图5B);在生物过程方面主要富集在生殖結构和系统发育、参与生殖的发育过程、己糖代谢过程、胚发育等(图5C); KEGG 主要富集到次生代谢物生物合成、核糖体、碳代谢、光合生物中的碳固定、氨基酸生物合成过程(图5D)。
GS4 vs. LT3差异多肽所属蛋白的GO 富集分析表明:在细胞组分方面主要富集在线粒体内膜、细胞器内膜、细胞器被膜、线粒体被膜、线粒体膜、线粒体等(图6A);在分子功能方面主要富集在小分子结合、氧化还原酶活性、辅酶Ⅰ活性等(图6B);在生物过程方面主要富集在 ATP 代谢过程、核苷三磷酸代谢过程、嘌呤核苷三磷酸代谢过程等(图6C)。 KEGG 主要富集到代谢途径、碳代谢、氨基酸生物合成等过程(图6D)。
综合 GS2 vs. LT1、GS3 vs. LT2和 GS4 vs. LT3的 GO 和 KEGG 富集结果,发现3个组合的差异多肽所属蛋白均参与碳代谢、氨基酸生物合成等,同样也发现不同萌发时间所富集的蛋白参与的信号途径具有一定的差异性。
2.4 低温胁迫后的目标多肽鉴定
为挖掘烟草种子萌发过程中对低温应答起关键功能的多肽分子,对所匹配的蛋白进行筛选,选择的蛋白条件为:前体蛋白大小不超过250个氨基酸,具有 N 端信号肽。筛选结果显示,GS2 vs. LT1中联合鉴定到4 个多肽分子: Nitab4.5_0002257g0090、Nitab4.5_0000477g0210、 Nitab4.5_0011894g0010和 Nitab4.5_0002172g0040; GS3 vs. LT2 中联合鉴定到4 个多肽分子Nitab4.5_0002257g0090、Nitab4.5_0003998g0060、 Nitab4.5_0000077g0160和 Nitab4.5_0003931g0030; GS4 vs. LT3种子中联合鉴定到3个多肽分子 Nitab4.5_0002257g0090、Nitab4.5_0011894g0010和 Nitab4.5_0002046g0190(表1)。其中有1个多肽分子 Nitab4.5_0002257g0090在3个组合中同时被鉴定到,有1个多肽分子 Nitab4.5_0011894g0010在 GS2 vs. LT1和 GS4 vs. LT3都被鉴定到。
3 讨论
种子萌发是植物生长的基础。种子萌发时蛋白质的变化反映了植物基因组第一次被激活基因的表达情况[18]。蛋白质差异表达是复杂的生命活动中生物体繁复的基因表达模式及多变的环境条件的综合体现,因此,从蛋白质入手有助于更全面地了解低温胁迫的伤害机制和植物的适应机理。本研究对受到低温胁迫的 K326烟草种子萌发期间的蛋白和多肽的变化进行了系统的分析。在 GO 和 KEGG 分析中发现3个组合的差异蛋白均参与碳代谢、氨基酸生物合成。
本研究使用10 kDa超滤管去除较大的蛋白质,并进一步通过信号肽和序列长度筛选多肽分子,总共鉴定到8个多肽分子,其中多肽 Nitab4.5_ 0000477g0210(KTI5)参与防御反应[19],Nitab4.5_ 0011894g0010(AGP30)参与根系发育调控、种子休眠过程的调控[20],Nitab4.5_0000077g0160(RNS2)参与 rRNA 分解代谢、RNA 分解代谢过程和自噬的负调节[21-22],Nitab4.5_0003931g0030( CYP20-1)参与根发育[23],Nitab4.5_0002046g0190(ACP1)参与蛋白质去磷酸化,这些过程均与植物对低温逆境响应有关;类似驱动蛋白(KP1)、电压依赖阴离子通道蛋白3(VDAC3)、冷休克蛋白(CSP1和 CSP2)也参与植物对低温逆境响应[24-25]。多肽 Nitab4.5_0002257g0090在3个组合中同时被鉴定到,暗示该多肽可能在 K326种子对低温胁迫的响应过程中扮演重要角色。本研究鉴定到的3个多肽分子尚未被研究报道,为后续研究相关多肽在烟草种子对低温应答中的功能提供了基础。
本研究仅从蛋白和多肽层面分析了一个品种的烟草种子萌发期间受到低温胁迫后的蛋白质的变化,有待对多个品种的种子从转录组、蛋白组、代谢组多个层面系统分析其萌发期间受到低温胁迫后的变化,系统解析烟草种子萌发期间受到低温胁迫后应答机制。同时,烟草幼苗受到低温胁迫后,幼苗叶形、抗氧化酶活性及相关基因表达亦将发生变化[26-29],有待从多个层面系统开展种子到幼苗对低温响应研究,不断完善低温胁迫后应答机制,为后续开发提升种子和幼苗活力的增效剂提供科学依据。
4 结论
本研究筛选到烟草种子萌发过程响应低温胁迫相关蛋白与多肽。从分子功能层面,GO 富集发现3个组合的差异蛋白均参与碳代谢、氨基酸生物合成; KEGG 富集发现3个组合的差异蛋白与碳代谢、氨基酸生物合成相关。鉴定到8个参与低温响应的多肽,其中多肽 Nitab4.5_0002257g0090在3个组合中同时被鉴定到,暗示其可能在低温响应过程中存在重要功能。
参考文献
[1] 王霞霞,李龑,李岩,等.低温胁迫对燕麦种子萌发期蛋白质组影响的研究[J].种子,2017,36(3):28-32.
WANG X X, LI Y, LI Y, et al. Analysis of protein changes during oat seed germination under low temperature stress[J]. Seed, 2017, 36(3):28-32.
[2] 王藝璇,孟庆伟,马娜娜.番茄低温响应 WRKY 转录因子的鉴定和分析[J].植物生理学报,2021,57(6):1349-1362.
WANG YX, MENG Q W, MAN N. Characterization and analysis of some chilling-response WRKY transcription factors in tomato[J]. Plant Physiology Journal, 2021, 57(6):1349-1362.
[3] 李文翔,王舰,王芳.马铃薯响应低温胁迫的蛋白质组学分析[J].西北农业学报,2022,31(6):1-15.
LI W X, WANG J, WANG F. Proteomic analysis of potato response to low temperature stress[J]. Acta AgriculturaeBoreali-occidentalis Sinica, 2022, 31(6):1-15.
[4] 李林杰.小麦倒春寒响应蛋白挖掘与功能分析[D].郑州:河南农业大学,2021:1-58.
LI L J. Mining and functional analysis of spring freezing response proteins in wheat[D]. Zhengzhou: Henan Agricultural University, 2021:1-58.
[5] 邹金鹏.玉米苗期响应低温胁迫的蛋白组学研究及抗冷蛋白挖掘[D].黑龙江:东北农业大学,2021:1-79.
ZHOU J P. Proteomics analysis of maize seedlings responses to chilling stress and chilling tolerance protein mining[D]. Heilongjiang: Northeast Agricultural University, 2021:1-79.
[6] 徐晓燕.大豆种子萌发的蛋白质组研究[D].南京:南京农业大学,2006:20-50.
XU X Y. A Proteomic approach to analyze soybean seed germination[D]. Nanjing: Nanjing Agricultural University, 2006:20-50.
[7] 韩超.水稻种子萌发的蛋白质组学研究[D].北京:中国科学院大学,2014:15-88.
HAN C. Proteomics analysis of rice seed germination[D]. Beijing: University of Chinese Academy of Sciences, 2014:15-88.
[8] 刘向标,段江燕.小麦种子萌发时期胚差异蛋白表达分析[J].生物技术通报,2013(3):60-64.
LIU X B, DUAN J Y. A nalysis of differentially expressed proteins of embryo during seed germination in wheat[J]. Biotechnology Bulletin, 2013(3):60-64.
[9] 孟令波.玉米种子萌发的蛋白质组学研究[D].黑龙江:东北林业大学,2008:29-103.
MENG L B, Proteomic research during maize(Zea mays L.)seed germination[D]. Heilongjiang: Northeast Forestry University, 2008:29-103.
[10] 李勇,逄涛,郑昀晔,等.烟草种子成熟过程的蛋白组学研究[J].西南农业学报,2020,33(6):1121-1125.
LI Y, PANG T, ZHENG Y Y, et al. Proteomics research of maturing tobacco seeds[J]. Southwest china journal of agricultural sciences, 2020, 33(6):1121-1125.
[11] 杨琼,侯小东,刘艳华,等.不同类型烟草种子蛋白质、脂肪及其主要活性成分分析[J].中国烟草科学,2019,40(6):95-102.
YANG Q, HOU X D, LIU Y H, et al. Analyses of protein, fat and main active components in the seeds of tobacco (Nicotiana spp.) types.[J]. Chinese Tobacco Science, 2019, 40(6):95-102.
[12] NIJAT I, NADIATUL A. MOHD-R, HUW A. O et al. Thepeptide-encoding CEP1 gene modulates lateral root and nodule numbers in Medicago truncatula[J]. Journal of Experimental Botany, 2013, 64(17):5395-5409.
[13] TETSUYAH and HIDENORI T. The mechanism and key moleculesinvolved in pollen tube guidance[J]. Annual Review of Plant Biology, 2015, 66:393-413.
[14] QU X, CAO B, KANG J, et al. Fine-tuning stomatal movementthrough small signaling peptides[J]. Frontiers in Plant Science, 2019, 10:69.
[15] PATEL N, MOHDRADZMAN N A, CORCILIUS L, et al. Diversepeptide hormones affecting root growth identified in the Medicago truncatula secreted peptidome[J]. Molecular & Cellular Proteomics, 2018, 17(1):160-174.
[16] HENRIK U. S, BRANDI S, YUEJU W , et al. A defensin fromtomato with dual function in defense and development[J]. Plant Molecular Biology, 2009, 71(1):131-143.
[17] YANG CP, WEIHR. Designing microarray and RNA-Seq experimentsfor greater systems biology discovery in modern plant genomics[J]. Molecular Plant, 2015, 8:196–206.
[18] 司曉敏,李巧云,晏月明.蛋白质组技术及小麦蛋白质组研究进展[J].麦类作物学报,2005,25(3):100-105.
SI X M, LI Q Y, YAN Y M. Proteome approach and advance in wheat proteome researches[J]. Journal of Triticeae Crops, 2005, 25(3):100-105.
[19] ARNIZ A, TALAVERA-MATEO L, GONZALEZ-MELENDI P, et al.Arabidopsiskunitz trypsin inhibitors in defense against spider mites[J]. Front. Plant Sci., 2018, 9:986-986.
[20] VAN HENGEL A J, ROBERTS K. AtAGP30, anarabinogalactan-protein in the cell walls of the primary root, plays a role in root regeneration and seed germination[J]. Plant J, 2003, 36:256-270.
[21] HILLWIG M, CONTENTO A L , MEYER A, et al. RNS2, aconserved member of the RNase T2 family, is necessary for ribosomal RNA decay in plants[J]. Proc Natl Acad Sci, 2011, 108(3):1093-1098.
[22] GAUDET P, LIVSTONE M S, LEWIS S E, et al. Phylogenetic-basedpropagation of functional annotations within the gene ontology consortium[J]. Brief Bioinform, 2011, 12(5):449-462.
[23] JACKON K., S0ELL D. Mutations in a new Arabidopsis cyclophilindisrupt its interaction with protein phosphatase 2A[J]. Mol. Gen. Genet, 1999, 262:830-838.
[24] YANG X Y, CHEN Z W, XU T, et al.Arabidopsis kinesin KP1specifically interacts with VDAC3, a mitochondrial protein, and regulates respiration during seed germination at low temperature[J]. Plant Cell, 2011, 23(3):1093-1106
[25] KARLSON D, IMAI R. Conservation of the cold shock domainprotein family in plants[J]. Plant Physiol, 2003, 131(1):12-15.
[26] 李琦瑶,王树声,周培禄,等.低温胁迫对烟苗叶形及生理特性的影响[J].中国烟草科学,2018,39(1):17-23.
LI Q Y, WANG S S, ZHOU P L, et al. Effects of low temperature stress on leaf shape and physiological characteristics in tobacco seedlings[J]. Chinese Tobacco Science, 2018, 39(1):17-23.
[27] 周培禄,刘光亮,王树声,等.低温胁迫下烟苗多酚代谢及其抗氧化能力分析[J].中国烟草科学,2018,39(5):33-39.
ZHOU P L, LIU G L, WANG S S, et al. Analysis of polyphenol metabolism and antioxidant capacity of tobacco seedlings under cold Stress[J]. Chinese Tobacco Science, 2018, 39(5):33-39.
[28] 高軍平,李晓旭,文利超,等.烟草 DGAT3基因响应冷胁迫应答的功能研究[J].中国烟草科学,2022,43(5):1-8.
GAO J P, LI X X, WEN L C, et al. Functional study of DGAT3 gene in response to cold stress in tobacco[J]. Chinese Tobacco Science, 2022, 43(5):1-8.
[29] 侯含,王升平,张超群,等.烟草过氧化氢酶基因 CAT2克隆与表达特征分析[J].中国烟草科学,2019,40(1):1-8.
HOU H, WANG S P, ZHANG C Q, et al. Cloning of Catalase 2(CAT2) gene and study on its expression pattern in Nicotiana tabacum L [J]. Chinese Tobacco Science, 2019, 40(1):1-8.
