K326全基因组分子模块库构建及其农艺、抗病性状评价
2023-08-18王永达宋时洋蒋彩虹潘旭浩耿锐梅任民刘旦蒲文宣刘万峰王东毛辉余祥文昝艳君程立锐杨爱国
王永达 宋时洋 蒋彩虹 潘旭浩 耿锐梅 任民 刘旦 蒲文宣 刘万峰 王东 毛辉 余祥文 昝艳君 程立锐 杨爱国


摘要:為构建烟草全基因组模块库,开展烟草分子模块育种,以 K326为轮回亲本,烤烟 OX2028和香料烟 Samsun 为供体亲本,经过杂交、连续多代回交、自交,最终获得两套以 K326为背景,覆盖供体亲本整个基因组的分子模块库。分子模块的基因组大部分回复到了轮回亲本 K326,其田间农艺及抗病性等重要性状偏向亲本 K326,不同材料间存在较广泛的遗传变异;群体的基本农艺性状呈现连续的正态或近似正态分布,符合数量性状的表型分布特性;鉴定了7个重要性状显著改变的分子模块,其中较 K326中上部叶片开片明显改善的材料32份,叶数明显提高的材料25份, TMV 、CMV 、PVY 病毒病抗性明显提高的材料分别为111、25和5份,黑胫病、青枯病抗性显著提高的材料44和52份。构建的烟草分子模块库可用于后续开展烟草重要性状的 QTL 定位和基因功能研究。
关键词:烟草;分子模块;设计育种;数量性状
中图分类号: S572.03 文献标识码: A 文章编号:1007-5119(2023)03-0001-09
Construction of the K326 Whole Genome Molecular Module Library and Evaluation of Its Agronomic and Disease Resistance Traits
WANG Yongda1, SONG Shiyang1, JIANG Caihong1, PAN Xuhao1, GENG Ruimei1, REN Min1, LIU Dan1, PUWenxuan2, LIU Wanfeng2, WANG Dong2, MAO Hui3, YU Xiangwen4, ZANYanjun1, CHENG Lirui1*, YANGAiguo1*
(1. Tobacco Research Institute, Chinese Academy of Agricultural Sciences; Qingdao 266101, China;2. China Tobacco HunanIndustry Company, Changsha 410014, China;3. Xiangxi Autonimous Prefecture Tobacco Company of Hunan Province, LongshanCounty Autonimous Prefecture, Longshan, Hunan 416800, China;4. Sichuan Branch of China National Tobacco Corporation,Chengdu 610000, China)
Abstract: To construct a tobacco whole-genome module library and carry out tobacco molecular module breeding, in this study we used K326 as the recurrent parent and flue-cured tobacco OX2028 and aromatic tobacco Samsun as donor parents. After hybridization, continuous multi-generation backcrossing, and selfing, two sets of molecular module libraries covering the entire genome of the donor parents were obtained with K326 as the background. The genome of the molecular module mostly returned to the recurrent parent K326, and field agronomic and disease resistance traits were biased towards the parent K326. However, there was still a wide range of genetic variation. Among them, the coefficient of variation for waist leaf length was the smallest for two consecutive years, and the coefficient of variation for internode length was the largest for two consecutive years. The basic agronomic traits of the population showed a continuous normal or near-normal distribution, which is consistent with the phenotypic distribution characteristics of quantitative traits. Seven molecular modules with significant changes in important traits were identified. Compared to K326, 32 materials with significantly improved upper leaf opening, 25 materials with significantly increased leaf number, 111, 25, and 5 materials with significantly increased resistance to TMV, CMV, and PVY virus diseases, and 44 and 52 materials with significantly increased resistance to black shank and bacterial wilt diseases were identified. The tobacco molecular module library constructed in this study can be used for subsequent QTL mapping and gene function research on important tobacco traits.
Keywords: tobacco; molecular module; design breeding; quantitative traits
烟草是一种重要经济作物,培育优质、多抗、低害、农艺性状优良的品种一直是烟草育种的目标。由于烟草农艺性状和病害抗性等重要性状大多属于由多基因控制的复杂数量性状,易受环境、遗传背景等因素的影响,利用常规育种策略改良这些复杂性状的效率很低[1],无法解决复杂农艺性状的遗传改良问题[2]。
染色体片段导入系由于遗传背景一致,能够在多个环境下对性状进行评价以获取更全面和准确的性状表现信息,已在多种作物的遗传研究和品种培育中得到广泛应用。通过将供体亲本的染色体片段导入到轮回亲本中,形成具有单个或多个染色体替代片段的染色体片段导入系材料[3],其遗传背景清楚,可有效检测微效基因及隐蔽基因,打破优良基因与不良基因的连锁,准确评价供体染色体片段的遗传效应,将复杂性状分解为单个孟德尔因子,进行精细定位和克隆[4]。基于导入系的优点,分子模块设计育种的理念首先在水稻中产生,被用于解析复杂性状遗传基础和培育新品种[5-7]。目前,利用分子模块设计技术对水稻[8-9]、玉米[2]等进行农艺性状遗传基础解析和育种已经取得初步成效,高产[10]、抗病[11]、氮高效[12]等复杂性状的分子模块解析,证明了该育种方法的可行性[13]。目前国内外关于烟草导入系群体的研究还比较缺乏,只有一个以烤烟种质 Y3为轮回亲本,雪茄烟种质Beinhart 1000-1及烤烟品种 K326为供体亲本的群体被创建[14]。
因此,本研究以优质主栽烤烟品种 K326为轮回亲本,以优质多抗烤烟品种 OX2028和香料烟品种 Samsun 为供体亲本,利用两种不同类型烟草基因资源,将控制复杂性状的多基因系统创制为可操控的染色体片段导入系遗传材料,构建以 K326为轮回亲本的烟草全基因组分子模块库。通过多年多点表型鉴定,初步筛选出了多个目标性状显著改变的分子模块材料,以期为重要性状的遗传机制解析、基因挖掘和聚合育种提供材料基础,并为推动烟草育种从传统育种向分子设计育种转变做出贡献。
1 材料与方法
1.1 供试材料
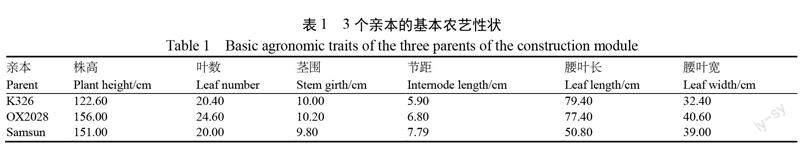
以 K326为轮回亲本,以 OX2028和 Samsun 为供体亲本,构建以 K326为轮回亲本的两个烟草分子模块库。其中 K326为美国引进烤烟品种,是目前我国主栽品种,OX2028为美国引进烤烟品种,免疫普通花叶病毒,综合性状表现优良;Samsun 为日本香料烟品种,在农艺性状、品质等重要性状与烤烟品种存在显著差异。3个亲本的基本农艺性状如表1所示,亲本材料均由国家烟草种质资源中期库(青岛)提供。
1.2 群体构建
2014年5—9月,在中国农业科学院烟草研究所青岛试验基地利用 K326与 Samsun 和 OX2028分别杂交获得了 F1代种子;2015年5—9月,利用 K326为轮回亲本,与 F1材料进行了回交,获得了两个组合的 BC1F1代种子;2016年5—9月,种植两个组合的 BC1F1材料,随机选择两个组合的100个 BC1F1单株,分别与轮回亲本 K326杂交,收获 BC2F1代种子。
2017年5月,在中国农业科学院烟草研究所青岛试验基地种植轮回亲本 K326及其两个组合的 BC2F1材料,利用飞行质谱对不同组合的 BC2F1材料进行遗传背景选择和导入片段的前景选择[15],获得遗传背景尽可能回复到轮回亲本 K326且导入片段覆盖整个轮回亲本基因组的后代;7月份,入選的 BC2F1单株继续与轮回亲本 K326回交,获得 BC3F1代种子。
2017年11月,在云南西双版纳加代种植轮回亲本 K326及两个组合的 BC3F1代材料,利用分子标记重复开展前景和背景选择,选择背景回复率高、导入片段长度短,并覆盖烟草供体亲本整个基因组的后代材料,确定为BC3F1单株群体;2018年1月,入选的单株继续与轮回亲本 K326杂交,收获 BC4F1代种子。
2018年5月,在中国农业科学院烟草研究所青岛试验基地种植 BC4F1材料,利用分子标记继续对群体材料进行前景和背景选择,选择背景回复率高、导入片段长度短,并覆盖轮回亲本 K326整个基因组的分子模块材料,自交收获 BC4F2代种子。
2018年10月,在中国农业科学院烟草研究所西南试验基地温室条件下种植 BC4F2代,继续进行分子标记前景选择和背景选择,筛选获得目标区段纯合的个体,最终构建以K326为轮回亲本,OX2028和 Samsun 两个不同类型烟草品种为供体亲本的烟草全基因组分子模块库,其中 K326×OX2028组合的分子模块群体包括2565份材料,K326×Samsun 组合的分子模块群体包括1195份材料,构建过程见图1。
1.3 表型数据调查
2019年5月至9月将3760份 BC4F2世代分子模块材料种植于中国农业科学院烟草研究所青岛试验基地、西昌试验基地和湖南湘西;调查两个群体3760份模块材料田间农艺性状,并根据分子标记优化模块材料的片段导入情况,在青岛选择片段覆盖整个烟草基因组且纯合的785份材料并留种;2020年5月至9月将785份 BC4F3世代分子模块材料分别种植于中国农业科学院烟草研究所西昌试验基地和湖南湘西。田间试验每个株系种植30株,株距50 cm,行距120 cm,按当地优质烟生产技术措施进行栽培管理。每个株系随机调查5个单株,取平均值。其中 K326×OX028组合记为 OX2028模块群体,K326×Samsun 组合记为 Samsun 模块群体。
大田农艺性状表型调查:2019、2020年农艺性状测定按照 YC/T 142—2010《烟草农艺性状调查方法》要求进行,在烟株打顶前调查各株系的株高、茎围、最大叶片长、最大叶片宽、叶片数、节距共计6个主要农艺性状。
温室苗期病害抗性调查:于2020年对 BC4F3世代材料在温室分别进行 TMV 、CMV 、PVY、黑胫病、青枯病人工接种鉴定,统计每个株系的病情指数。病害调查及病情指数分级标准参照 GB/T 23222—2008《烟草病虫害分级及调查方法》要求进行。
1.4 数据统计与分析
利用 Excel 2019软件,对农艺性状和病害抗性数据进行整理。利用 SPSS 软件对两年山东、湖南和四川3个环境下农艺性状数据进行统计分析。
2 结果
2.1 OX2028和 Samsun 群体农艺性状的变异特点表2表明,2019年在青岛、湘西和西昌3地,两个模块群体的6个基本农艺性状存在一定程度的分离。其中湘西 OX2028模块群体的腰叶长性状变异最小,变异系数为6.16%,其亲本表型分别为79.40、77.40 cm ,后代中 OX2028模块群体均值为67.46 cm ,变异幅度为51.00~83.00 cm。青岛Samsun 模块群体的节距性状变异系数最大,变异系数为28.51%,亲本表型为5.90、7.79 cm ,后代 Samsun 模块群体节距均值为5.49 cm ,变异幅度为2.00~9.00 cm。
表3表明,2020年在湘西、西昌两地,两个模块群体的6个基本农艺性状也存在一定程度的分离。其中湘西 OX2028模块群体的腰叶长性状变异系数最小为4.24%,亲本表型为79.40、77.40 cm ,后代中 OX2028模块群体均值为81.54 cm,变异幅度为72.00~90.00 cm。西昌 OX2028模块群体的节距性状变异系数最大为14.48%,亲本表型分别为5.90、6.80 cm ,后代 OX2028模块群体均值为4.04 cm ,变异幅度为2.64~5.43 cm。
2.2 模块群体中各农艺性状的表型分布特点
基于2019—2020年三点的两个群体中各农艺性状的测量值,由图2-3可知,模块群体的基本农艺性状呈现连续的正态或近似正态分布,符合数量性状的表型分布特性。2020年 BC4F3群体的表型分布方差较2019年 BC4F2群体的变小,表明随着亲本的杂合度降低,模块材料基因型越来越纯合。
2.3 2020年 BC4F3群体病害抗性表现
如表4所示,在 OX2028模块群体中,材料对 CMV、黑胫病的抗病性介于两个亲本 K326和 OX2028之间,平均病情指数分别为75.81、44.22,其中对 CMV 的抗性更趋向于 K326;对 TMV 和 PVY 的抗病性低于两个亲本,平均病情指数为37.79和78.13;对青枯病的抗病性高于两个亲本,平均病情指数为54.51。
Samsun 模块群体对 CMV、TMV、黑胫病和青枯病的平均病情指数均介于两个亲本 K326和 Samsun 之间,分别为74.19、37.50、55.67、55.83,对 CMV 、TMV 和黑胫病的抗病性均趋向于亲本 K326,对青枯病的抗病性趋向于亲本 Samsun,对 PVY 的抗病性低于两个亲本,平均病情指数为80.93。综上,模块群体虽然遗传背景已经基本回复到轮回亲本 K326,但是不同模块材料在抗病性状上仍然存在着广泛的遗传变异,有待深入挖掘相关抗病基因。
2.4 重要性状模块筛选
根据2019—2020年两年两点模块群体在田间的农艺性状表现以及苗期病害鉴定结果,初步筛选出了多个目标性状突出的模块材料,包括较亲本 K326叶数提高的叶数模块;较亲本 K326叶宽增加的叶宽模块;较亲本 K326抗病性提高的 TMV 抗性模块、CMV 抗性模块、PVY 抗性模块、黑胫病抗性模块、青枯病抗性模块。重要性状模块材料表现如图4a~i 所示。
叶数模块:根据两个群体的田间表现,筛选得到25份在两个环境下表型一致、有效叶片数增加的材料,其中15份来自 OX2028模块群体,10份来自 Samsun 模块群体。与 K326相比,叶数显著增加,湘西叶数模块提高了2.88(图4-a),西昌叶数模块提高了5.16(图4-b)。
叶宽模块:叶宽性状是复杂的数量性状,受环境影响较大,常规育种过程中很难获得开片好、环境间表型稳定的遗传材料。根据两地两个群体的田间表现,筛选到了在湘西和西昌两个环境点表型一致、叶片宽度显著增加的32份材料,其中16份来自 OX2028模块群体,16份来自 Samsun 模块群体。与 K326相比,叶宽模块叶片宽度显著增加,湘西模块平均增加5.9 cm(图4-c),西昌模块平均增加8.8 cm (图4-d)。
TMV 抗性模块:通过抗性鉴定共筛选到抗 TMV 材料111份。如图4-e 所示, TMV 抗性模块平均病情指数为10.08,与 K326(病情指数为30.68)相比,病情指数降低,对 TMV 抗性显著提高。通过N基因标记对来自于OX2028模块的材料进行筛选,鉴定到17份材料携带N 基因,其中9份对 TMV 免疫,病情指数为0。
CMV 抗性模块:筛选得到抗 CMV 抗性材料25份。其中有3份来自 OX2028模块群体模块的材料对 CMV 免疫,并且2份同时对 CMV 和 TMV 免疫。如图4-f 所示,CMV 模块平均病情指数为6.81,与 K326(76.37)相比,病情指数降低,对 CMV 抗性显著提高。
PVY 抗性模块:筛选得到抗 PVY 抗性模块材料5份,均来自 OX2028模块群体,其中1份为高抗。如图4-g 所示, PVY 模块材料平均病情指数为29.99,与亲本 K326(68.00)相比,病情指数降低,对 PVY 的抗性显著提高。
黑胫病抗性模块:经筛选得到抗黑胫病模块材料44份,其中36份来自 OX2028模塊群体,18份来自 Samsun 模块群体。如图4-h 所示,黑胫病模块平均病情指数为10.81,与亲本 K326(29.78)相比,平均病情指数降低,黑胫病抗性显著提高。
青枯病抗性模块:共筛选出抗青枯病模块材料52份,其中46份来自 OX2028模块群体,6份来自 Samsun 模块群体。如图4-i 所示,青枯病模块平均病情指数为25.11,与亲本 K326(68.32)相比,平均病情指数降低,青枯病抗性显著提高。
3 讨论
传统育种方法由于材料遗传背景的不确定性和遗传效应难以控制,需要进行多代的选择和迭代,从而导致育种周期长,进展缓慢。而且在传统育种方法中,鉴定和克隆目标基因是一项困难而耗时的工作。相比之下,染色体片段导入系能够稳定地得到遗传背景单一且包含目标基因或基因组区域的材料,便于对目标基因进行功能研究和表达调控。通过向目标育种材料中导入具有抗性、适应性或其他有益性状的染色体片段,可以丰富品种的遗传多样性,更好地改良品种的性状。
国内外烟草染色体片段导入系的研究起步较晚,报道较少,仅有童治军等[14]以烤烟 Y3为轮回亲本,雪茄烟Beinhart 1000-1及烤烟 K326为供体亲本构建的染色体片段导入系,该群体仅包含256个不同导入系株系。由于烟草基因组较大,较小的群体难以覆盖整个基因组,且导入片段较大的株系同样会产生基因间的互作干扰。本研究以优质主栽烤烟品种 K326为轮回亲本,以优质烤烟 OX2028和香料烟Samsun 为供体亲本,经过一系列的杂交、回交和自交,成功建立了以 K326为轮回亲本的两套烟草全基因组分子模块库。与亲本相比,两个模块群体后代产生了广泛的表型变异,筛选了3760 份材料进行鉴定,基本保证了基因组覆盖的完整性。通过对导入片段进行分析,可以为复杂性状 QTL 定位、创建近等基因系、新品种选育提供材料。
鉴定目标性状突出的模块材料是解析农艺、抗病相关性状,探索聚合育种的基础。根据分子模块的表型数据,本研究筛选到提高产量的叶宽、叶数模块,提高抗病性的病毒病、黑胫病、青枯病抗性模块。烟草叶宽是影响产质量的重要農艺性状,叶宽增加带来的叶面积增加,不仅可以增加烤后烟叶的工业可用性,也能增加经济效益。有研究表明采取适当措施,提高烟叶上、中部叶片的宽长比,可以改善烟叶质量[16]。以往的遗传研究主要采用单双亲群体,开发简单,只有两个基因组的重组会导致用于 QTL 定位的等位基因多样性不足[17]。本研究采用两个相关的双亲群体设计,将不同烟草类型(特别是香料烟 Samsun 和优质烤烟 OX2028)的片段引入相同的遗传背景 K326,提供了更丰富的等位基因多样性,为研究不同等位基因对烟草叶宽的影响提供了材料基础。为了在主栽品种 K326中导入病毒病抗性基因,本研究选择了性状优良且免疫普通花叶病毒病的 OX2028[18],在来自 OX2028的 TMV 抗性模块中,筛选到了7份免疫 TMV 的模块材料,对另外两种病毒病也表现为抗病,同时在其他性状上与轮回亲本 K326表现一致,达到预设目标。
K326和 OX2028都属于烤烟品种[19],遗传距离较近,因此以 OX2028为供体的模块群体的农艺性状变异不大,同时由于 OX2028抗病性更加优良,群体的病毒病平均抗性较 K326有明显提高。而 Samsun 为香料烟品种,与 K326相比,农艺性状差异较大,因此供体片段来自 Samsun 的群体变异程度高于 OX2028模块群体。
4 结论
本研究利用杂交、回交、自交和分子标记辅助选择手段构建了两套以主栽烤烟品种 K326为轮回亲本,以烤烟 OX2028和香料烟 Samsun 为供体亲本的分子模块库;通过田间栽培和温室试验,对模块群体6种农艺性状和5种抗病性状进行调查统计分析,筛选了一批目标性状模块材料,获得携带不同导入片段的目标模块。本研究为烟草育种创制了重要的遗传材料,可用于进一步分析复杂性状的 QTL,挖掘烟草的遗传基因。
参考文献
[1] 王献生,张忠锋,肖炳光. 中国烟草育种研究进展[J].烟草科技,2007(5):53-57.
WANG X S, ZHANG Z F, XIAO B G. Recent advance in tobacco breeding in China[J]. Tobacco Science & Technology, 2007(5):53-57.
[2] 郝怀庆,刘丽丽,姚远,等.分子模块设计育种技术在玉米育种中的应用及前景展望[J].中国科学院院刊,2018,33(9):923-931.
HAO H Q, LIU L L, YAO Y, et al. Application and prospect of molecular module-based crop design technology in maize breeding[J]. Bulletin of Chinese Academy of Sciences, 2018, 33(9):923-931.
[3] 廖长见,王颖姮,潘光堂.作物染色体导入系的构建及其应用[J].分子植物育种,2007( S1):139-144.
LIAO C J, WANG Y H, PAN G T. Construction and application of chromosome introgression lines in crops[J]. Molecular Plant Breeding, 2007(S1):139-144.
[4] XU J J, ZHAO Q A, DU P N, et al. Developing high throughput genotyped chromosome segment substitution lines based on population whole-genome re-sequencing in rice (Oryza sativa L.)[J]. Bmc Genomics, 2010, 11:656.
[5] 万建民.作物分子设计育种[J].作物学报,2006(3):455-462. WANG J M. Perspectives of molecular design breeding in crops[J]. Acta agronomicasinica, 2006(3):455-462.
[6] 黎志康.我国水稻分子育种计划的策略[J].分子植物育种,2005(5):603-608,618.
LI Z K. Strategies for molecular rice breeding in China[J]. Molecular Plant Breeding, 2005(5):603-608, 618
[7] 薛勇彪,段子渊,种康,等.面向未来的新一代生物育种技术——分子模块设计育种[J].中国科学院院刊,2013,28(3):308-314.
XUE Y B, DUAN Z Y, ZHONG K, et al. Next-generation biotechnological breeding techniques for the future——designer breading by molecular modules[J]. Bulletin of Chinese Academy of Sciences, 2013, 28(3):308-314.
[8] 薛勇彪,王道文,段子渊.分子设计育种研究进展[J]. 中国科学院院刊,2007(6):486-490.
XUE Y B, WANG D W, DUAN Z Y. Progress of research on crop breeding with molecular design[J]. Bulletin of Chinese Academy of Sciences, 2007(6):486-490.
[9] 薛勇彪,种康,韩斌,等.开启中国设计育种新篇章——“分子模块设计育种创新体系”战略性先导科技专项进展[J].中国科学院院刊,2015, 30(3):393-402,282.
XUE Y B, ZHONG K, HAN B, et al. New chapter of designer breeding in China: update on strategic program of molecular module-based designer breeding systems[J]. Bulletin of Chinese Academy of Sciences, 2015, 30(3):393-402, 282.
[10] WANG S K, WU K, YUAN Q B, et al. Control of grain size, shapeand quality by OsSPL16 in rice[J]. Nat Genet, 2012, 44(8):950-954.
[11] DENG Y W, ZHAI K R, XIE Z, et al. Epigenetic regulation ofantagonistic receptors confers rice blast resistance with yield balance[J]. Science, 2017, 355(6328):962-965.
[12] HU B, WANG W, OU S J, et al. Variation in NRT1.1B contributesto nitrate-use divergence between rice subspecies[J]. Nat Genet, 2015, 47(7):834-838.
[13] 薛勇彪,韓斌,种康,等.水稻分子模块设计研究成果与展望[J].中国科学院院刊,2018,33(9):900-908.
XUE Y B, HAN B, ZHONG K, et al. Achievements and prospect of designer breeding by molecular modules in rice[J]. Bulletin ofChinese academy of sciences, 2018, 33(9):900-908.
[14] 童治军,焦芳婵,方敦煌,等.烟草染色体片段代换系的构建与遗传评价[J].作物学报,2016,42(11):1609-1619.
TONG Z J, JIAO F C, FANG D H, et al. Construction and genetic evaluation of chromosome segment substitution lines in tobacco(Nicotiana tabacum L.)[J]. Acta AgronomicaSinica, 2016, 42(11):1609-1619.
[15] 李苇舟,明建,肖星凝,等.飞行时间质谱技术及其在植物多酚鉴定中的应用[J].食品与机械,2017,33(4):200-204.
LI Z J, MING J, XIAO X N, et al. The time of flight mass pectrometry technology and its application in plant polyphenols identification[J]. Food and Machinery, 2017, 33(4):200-204.
[16] JIANG H L, XU C, WANG D B, et al. Effect of tobacco leafwidth/length ratio on tobacco quality: a case study in the chongqing tobacco production area[J]. Australian Journal of Crop Science, 10(10):1455-1459.
[17] 赵会纳,雷波,程立锐,等.烟草叶宽性状主效 QTL 定位及育种评价[J].中国烟草科学,2023,44(1):1-7.
ZHAO H N, LEI B, CHEN L R, et al. Identification of major-effect QTLs associated with leaf width of tobacco and breeding evaluation[J]. Chinese Tobacco Science, 2023, 44(1):1-7.
[18] 王倩,刘贯山.烟草 N 基因及其介导的抗 TMV 信号转导分子机制[J].中国烟草科学,2016,37(3):93-99.
WANG Q, LIU G S. The tobacco N gene and the signal transduction of N-mediated TMV resistance[J]. Chinese Tobacco Science, 2016, 37(3):93-99.
[19] 李梅云,卢秀萍,李永平,等.优异烤烟种质资源的筛选[J].安徽农业科学,2010,38(25):13663-13668.
LI M Y, LU X P, LI Y P, et al. Screening of germplasm resource of excellent flue-cured tobaccos[J]. Journal of Anhui agricultural sciences, 2010, 38(25):13663-13668.
