网络药理学联合生物信息学及分子对接探索黄芪甲苷抗肝癌的作用机制
2023-08-17张晖汉邓弘扬徐小东
张晖汉,邓弘扬,徐小东
兰州大学第二医院 普通外科,甘肃 兰州 730030
肝癌是全球最常见的恶性肿瘤之一,也是癌症相关死亡的第3 大原因,5 年生存率仅为18%[1],即使施行了首次根治性切除,肝癌的5 年复发率仍高达70%[2]。经动脉化疗栓塞术的重复使用以及索拉菲尼化疗也对肝癌患者产生诸多负面影响[3]。随着现代医学的发展,传统中药及其药效成分具有的抗癌活性及其较小的细胞毒性逐渐受到了广泛关注[4]。《神农本草经》曾记载黄芪有健脾益气固表、脱毒生肌、利尿排脓等功效[5]。黄芪甲苷作为一种芳香族皂苷,是黄芪的最重要的药效成分之一。有研究表明,黄芪甲苷在神经保护[6]、抗纤维化[7]、抗炎[8]、抗氧化应激[9]及抗肿瘤[10]方面有广泛的药效作用。最近,多项研究报道黄芪甲苷在抗肝癌方面显示出了良好前景[11-13],但其具体作用机制尚不清楚,缺乏系统性研究。本研究利用生物信息学肝癌患者测序样本及网络药理学[14]联合分子对接的方法对黄芪甲苷抗肝癌的作用分子机制系统性探索,旨在为肝癌的临床治疗和基础研究提供新思路。
1 材料和方法
1.1 黄芪甲苷靶点获取
在 CTD 数据库[15]和 OMIM 数据库[16]以“astragaloside IV”为关键词检索黄芪甲苷的作用靶点。从PubChem 数据库检索黄芪甲苷“SDF”格式二维结构式,并将其输入PharmMapper 数据库[17],依据结构预测黄芪甲苷靶点。用“org.Hs.eg.db”R包将靶点统一转换为“Gene Symbol”格式,转换失败的靶点剔除,以3 个数据库所得结果合并后作为所有黄芪甲苷药效靶点。
1.2 TCGA 和GEO 数据处理及肝癌靶点获取
从TCGA 数据库下载TCGA-LIHC 数据集转录组数据,其中包含了371 例肝癌组织和53 例癌旁组织。从GEO 数据库下载GSE14520 数据集转录组数据[18],其中包含225 例肝癌组织和220 例癌旁肝组织。以R 语言“limma”包行差异分析,以P<0.01 且lg2FC>1 为标准筛选差异基因,结果以火山图和热图呈现,且差异基因合并后纳入肝癌治疗靶点。此外,从CTD 数据库和GeneCards 数据库以“hepatocellular carcinoma”检索肝癌靶点,其中GeneCards 结果仅relevance score≥20”的靶点。最后将差异基因和数据库靶点合并作为所有肝癌预测靶点。
1.3 黄芪甲苷抗肝癌靶点预测及富集分析
将黄芪甲苷和肝癌靶点取交集得到黄芪甲苷抗肝癌靶点,并用“clusterProfiler”R 包行基因本体论(GO)和京都基因与基因组百科全书(KEGG)富集分析,结果于条形图和气泡图呈现。
1.4 核心靶点筛选
把黄芪甲苷抗肝癌靶点导入STRING 数据库构建蛋白相互作用(PPI)网络,物种设定为“homo sapiens”。将PPI 网络导入Cytoscape 软件,以CytoNCA 插件计算该网络节点的 betweenness centralities(BC)、closeness centralities(CC)、degree cntralities(DC)、eigenvector centralities(EC)、local average connectivity-based method centralities(LAC)和network centralities(NC)6 项拓扑值,以大于该6 项指标中位数进一步筛选核心靶点,并对核心靶点KEGG 富集分析。
1.5 分子对接
从PDB 数据库获取核心靶点的PDB-ID,导入PyMOL 2.5.2 软件中去除有机物和溶剂,保存为pdb格式备用。把黄芪甲苷的SDF 格式二维结构式于OpenBabel 2.3.2 软件中转换为pdb 格式。将核心靶点和黄芪甲苷的pdb 格式结构导入Autodock 4.2.6软件行对接操作,以对接结合能最低的构象作为最终结果。若对接能量<0 kcal/mol(1 cal=4.4 J)则可以说明二者具有结合潜力,若对接能量<−6 kcal/mol,说明二者有良好结合潜力,并于PyMOL软件中呈现。
2 结果
2.1 黄芪甲苷靶点预测结果
依据PubChem 数据库获取的黄芪甲苷二维结构式,于PharmMapper 中预测到148 个靶点。OMIM和CTD 数据库中分别得到674 个和39 个靶点。3个数据库预测结果合并后去除重复共得到841 个黄芪甲苷靶点。
2.2 肝癌靶点预测结果
经计算,TCGA-LIHC 数据集共得到2 917 个差异基因,其中1 162 个上调基因和1 755 个下调基因(图1A、B),而GSE 14520 数据集共得699 个差异基因,其中283 个上调基因和416 个下调基因(图1C、D)。从GeneCards 获得relevance score≥20 靶点407 个。此外,从CTD 数据库中获得了69个肝癌靶点。4 项结果合并去除重复后得到3 564 个肝癌靶点。
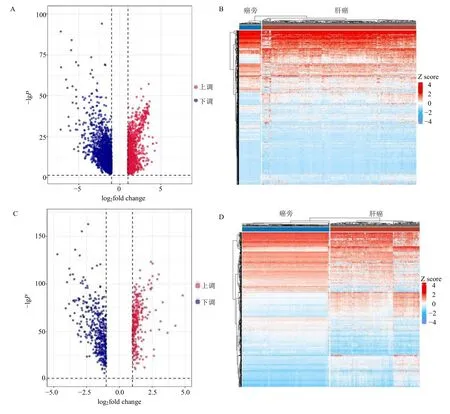
图1 差异分析结果Fig.1 Difference analysis result
2.3 黄芪甲苷抗肝癌靶点预测和富集分析结果
将黄芪甲苷和肝癌靶点取交集得到201 个黄芪甲苷抗肝癌靶点(图2)。对这些靶点富集分析可知,生物过程(BP)显著富集了老化、氧化应激反应、细胞对化学压力的反应、对活性氧的反应、腺发育等,细胞组分(CC)显著富集了内质网腔、含有胶原的细胞外基质、基底膜、血液微粒等,分子功能(MF)显著富集了细胞外基质结构成分、固醇转运蛋白活性、胆固醇转移活性、氧气结合、内肽酶抑制剂活性。KEGG 富集分析显著富集了磷脂酰肌醇3-激酶(PI3K)–蛋白激酶B(Akt)信号通路、relaxin信号通路、乙型肝炎、低氧诱导因子-1(HIF-1)信号通路、表皮生长因子受体(EGFR)酪氨酸激酶抑制剂耐药性等相关通路(图3)。
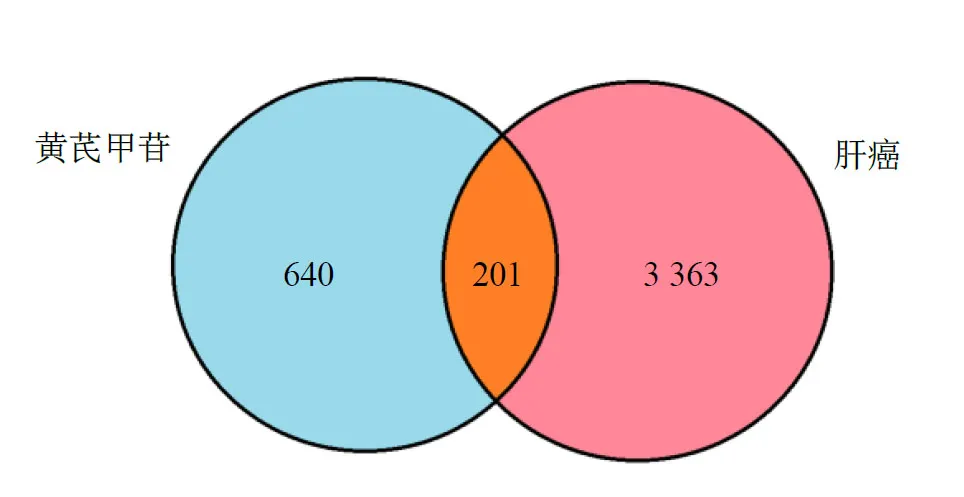
图2 黄芪甲苷和肝癌交集靶点韦恩图Fig.2 Venn diagram of astragaloside IV and liver cancer target intersection
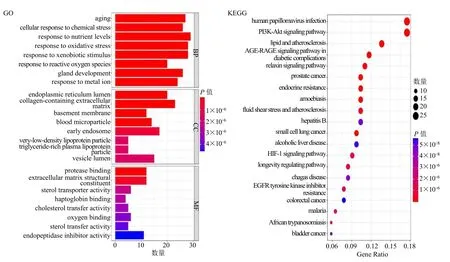
图3 黄芪甲苷抗肝癌靶点富集分析结果Fig.3 Enrichment analysis of astragaloside IV anti-liver cancer targets
2.4 核心靶点筛选结果
经筛选,从201 个靶点中最终筛选出9 个黄芪甲苷抗肝癌的核心靶点,分别为基质金属蛋白酶-9(MMP-9)、肿瘤坏死因子(TNF)、肿瘤蛋白p53(TP53)、白细胞介素(IL)-6、雷帕霉素激酶作用靶点(MTOR)、细胞凋亡相关半胱氨酸蛋白酶(CASP3)、丝裂原活化蛋白激酶3(MAPK3)、Akt1、白蛋白(ALB),见图4。这些核心靶点与细胞凋亡、细胞衰老、癌症中的碳代谢、乙型肝炎、丙型肝炎、IL-17 信号通路、铂类耐药、癌症中的蛋白聚糖以及TNF 信号通路等密切相关,见图5。

图4 黄芪甲苷抗肝癌靶点网络及核心靶点筛选结果Fig.4 Astragaloside IV anti-liver cancer target network and core target screening results

图5 核心靶点KEGG 富集分析Fig.5 Enrichment analysis of core targets
2.5 分子对接结果
将核心靶点与黄芪甲苷对接后,发现这些核心靶点与黄芪甲苷均有结合潜力,其中IL-6、CASP3、ALB 与黄芪甲苷有良好结合潜力,见图6、表1。
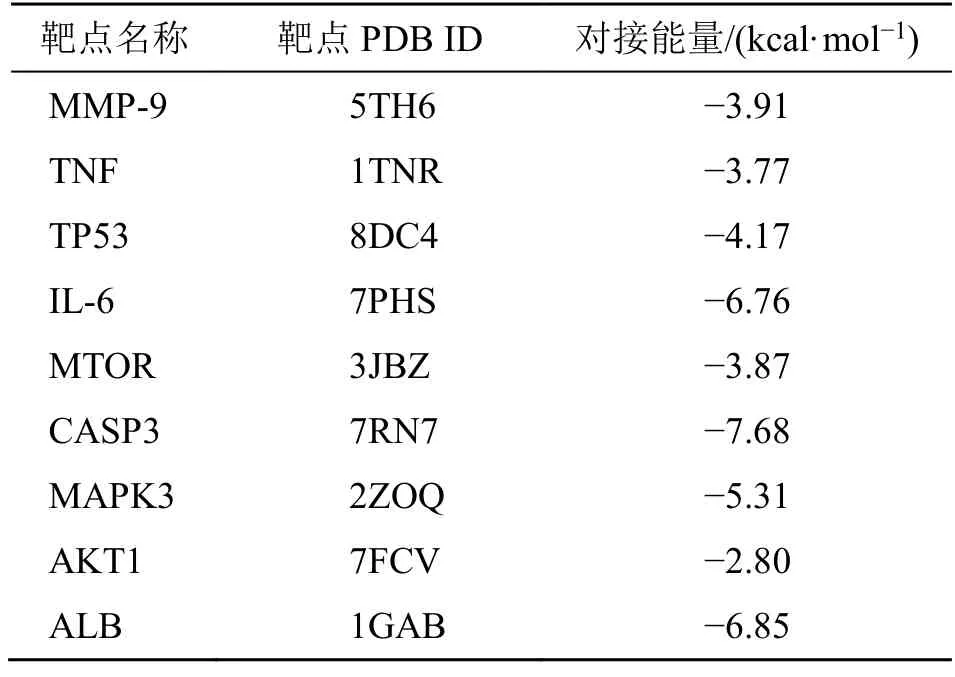
表1 核心靶点与黄芪甲苷的分子对接结果Table 1 Molecular docking results of core targets with astragaloside IV
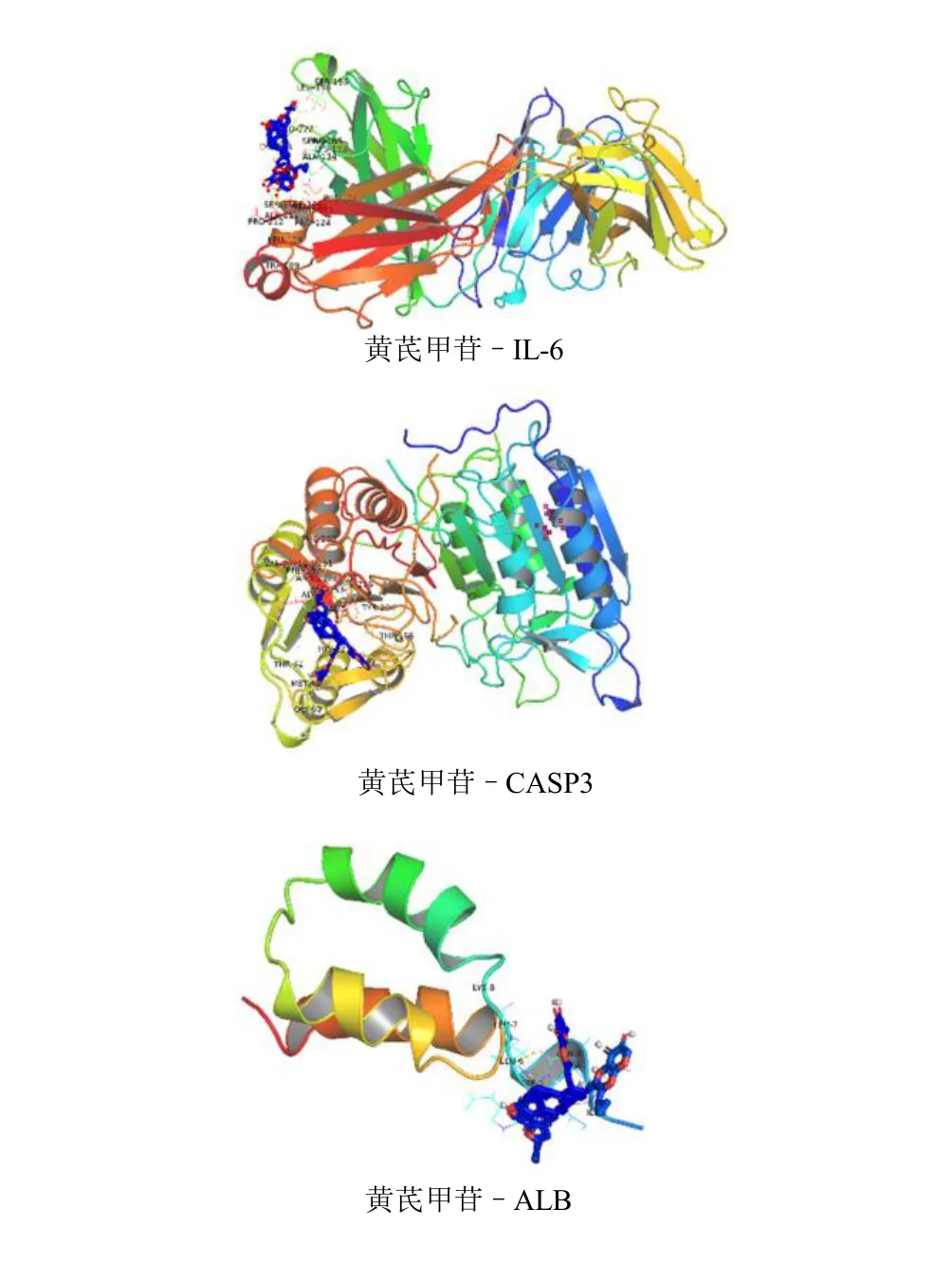
图6 靶点对接结果Fig.6 Molecular docking results of targets
3 讨论
肝癌作为全球癌症死亡的主要原因之一,尽管在诊断和治疗方面取得了重大进展,但预后依然不尽人意,尤其是晚期肝癌患者可选的治疗方式十分有限[19],探索新的治疗方法或许能为肝癌患者带来新希望。传统中草药以多靶点作用、不良反应小、毒性低等优点,在抗肿瘤领域逐渐受到关注[20]。作为黄芪的主要药效成分之一的黄芪甲苷,其抗肝癌作用已被多项研究证实[21-22]。探索该药效作用,可为进一步应用提供依据。
本研究共筛选出201 个黄芪甲苷抗肝癌靶点,说明黄芪甲苷通过多靶点发挥抗肝癌作用。GO 富集分析结果提示黄芪甲苷的抗肝癌作用很可能与老化、氧化应激以及脂质代谢等过程相关。此外,对靶点KEGG 富集分析发现的多条通路与肝癌密切相关,如PI3K-Akt 通路[23]、relaxin 通路[24]、乙肝[25]、HIF-1 信号[26]、EGFR 酪氨酸激酶抑制剂耐药性[27],这些通路均为介导肝癌进展的重要途径,表明本研究所筛选靶点具有可靠性。
为了进一步明确黄芪甲苷抗肝癌的核心靶点,本研究利用201 个靶点构建PPI 网络,并通过该网络6 项拓扑值筛选出了9 个核心靶点。MMP-9 是基质金属蛋白酶的一种,它可以负向调节异柠檬酸脱氢酶2,从而促进细胞迁移和肝癌转移[28]。TNF与肝细胞凋亡中代偿性肝细胞增殖有关,推动了肝细胞向肝癌发展[29]。TP53 在13%~48%的肝癌病例中有突变[30],它在肝癌中诱导细胞生长停滞或凋亡,是一个抑癌基因。IL-6 可以磷酸化并激活转录激活因子3(STAT3),导致肝癌细胞增殖、耐药、侵袭转移等[31]。MTOR 是PI3K-Akt 通路下游分子,是参与肝癌发病的经典失调通路[32]。CASP3 是抑制肝癌及减轻肝损伤的关键因子[33]。MAPK3 被证实可以靶向血管内皮生长因子A(VEGFA)促进肝癌血管生成[34]。Akt1 与细胞存活、增殖、代谢等过程相关,对肿瘤生长至关重要[35]。ALB 被证实是影响肝癌患者总生存期的独立危险因素[36]。总之,这些核心靶点均在肝癌的进展中起关键作用,这在对它们的KEGG 富集中得到佐证,也证实了黄芪甲苷抗肝癌的潜在价值。本研究最后对核心靶点与黄芪甲苷的分子对接发现IL-6、CASP3、ALB 与黄芪甲苷有良好结合潜力,说明它们可能是黄芪甲苷抗肝癌的关键作用靶点,这为进一步研究提供了参考。
综上,本研究通过网络药理学联合生物信息学及分子对接系统性探索了黄芪甲苷抗肝癌的作用机制,结果一方面证实了黄芪甲苷的抗肝癌的潜在价值,一方面说明黄芪甲苷通过多靶点以及多通路实现该功能,为后续研究及肝癌临床治疗提供了理论依据。
利益冲突所有作者均声明不存在利益冲突
