大兴安岭南麓东北马鹿种群遗传多样性分析
2023-08-16郭金昊刘鑫鑫张明海
李 峥,郭金昊,刘鑫鑫,张明海
(东北林业大学野生动物与自然保护地学院,哈尔滨,150040)
由于人类活动和自然环境变化,野生动物的生存面临诸多威胁,如栖息地丧失、生境破碎化等严重威胁着野生动物的扩散和繁衍[1],甚至导致种群近交风险上升、遗传多样性丧失,从而使种群对环境变化的响应及适应能力下降[2]。遗传多样性水平往往与种群的稳定和健康息息相关,遗传变异水平较高的种群对环境变化的适应能力更强,即使在种群数量下降后仍具备很强的恢复潜力[3]。遗传多样性水平的高低是衡量种群健康状况的重要依据,是进行种群管理与保护决策的重要工具之一[4]。
东北马鹿(Cervus elaphus xanthopygus)是我国北方森林生态系统中具有代表性的有蹄类动物,在维持森林和草原生态系统的平衡与稳定中发挥重要作用,曾广泛分布于黑龙江省大小兴安岭、完达山、老爷岭及张广才岭,吉林省长白山地区,大兴安岭南麓内蒙古和河北省森林—草原过渡带地区[5-9]。然而由于非法盗猎、森林资源过度利用以及自然环境变化,许多生境逐渐不适合马鹿的生存与活动,由此导致野生种群数量下降,分布区退缩,部分地区马鹿种群甚至出现斑块化分布,近亲繁殖、遗传多样性丧失的风险日益增大[10-11]。
大兴安岭南麓高格斯台罕乌拉国家级自然保护区(以下简称“高格斯台保护区”)是我国重要的马鹿分布区,马鹿平均密度为1.11只/km2,是目前野生马鹿种群密度最高的地区[12-13],对野生马鹿种群的恢复和历史分布区的重建具有重要意义。因此,本研究通过分子粪便学技术对分布在高格斯台保护区内的马鹿进行遗传学研究,评估马鹿种群遗传多样性现状,为马鹿种群保护及健康状况监测等工作提供理论依据。
1 材料与方法
1.1 样品采集
样品均来自高格斯台保护区,保护区隶属于内蒙古赤峰市阿鲁科尔沁旗。2021年12月—2022年1月,根据马鹿在保护区的分布现状,确定采样区域(图1)。选择样线调查法跟踪马鹿新鲜足迹链,并收集马鹿新鲜粪便,同时GPS 定位。共采集新鲜粪便样品 246 份,肌肉对照样品1 份(来自野外发现的自然死亡雌性马鹿个体)。所有样品放置在超低温冰箱-80 ℃保存。
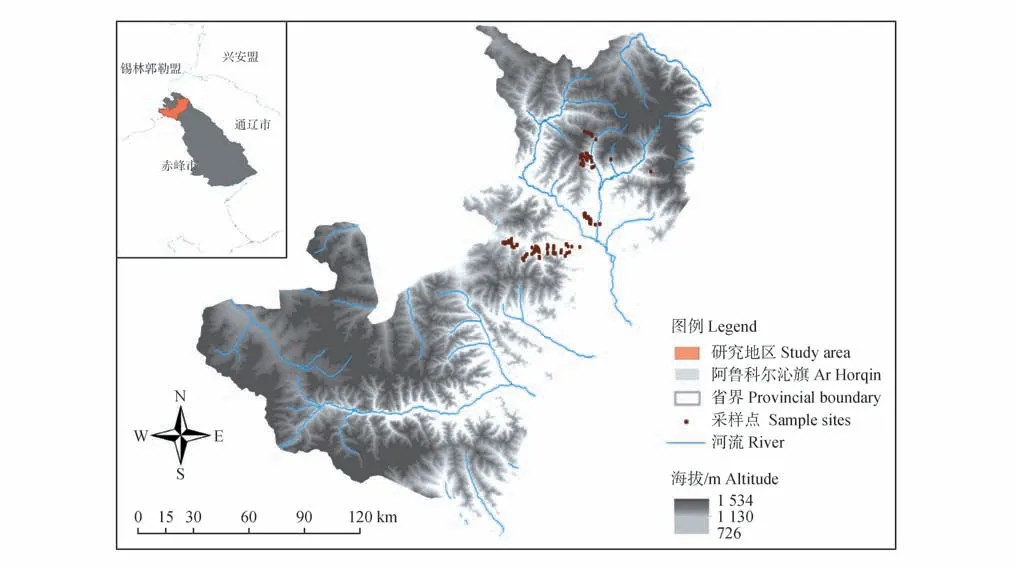
图1 马鹿粪便采样点示意图(内蒙古高格斯台保护区)Fig.1 Fecal sample collection sites of red deer(Gaogesitai Reserve in Inner Mongolia)
1.2 DNA提取及物种鉴定
粪便DNA 提取使用QIAamp Fast DNA Stool Mini Kit(Qiagen,Germany),按操作说明进行。选择mtDNACyt b引物[14-15],L14724:5′-CGAGATCTGAAAAACCATCGTTG-3′;H15149:5′-AAACTGCAGCCCCTCAGAATGATATTTGTCCTCA-3′用于粪便DNA 的PCR 扩增(400~500 bp)。扩增体系20 μL:2×RapidTaqMaster Mix 10 μL,10 μmol/L Forward Primer 0.8 μL,10 μmol/L Reverse Primer 0.8 μL,25~50 ng/μL DNA 2 μL,ddH2O 6.4 μL。反应条件:95 ℃预变性3 min;95 ℃变性30 s,53 ℃退火30 s,72 ℃延伸30 s,35 个循环;最后72 ℃终延伸5 min,4 ℃保存,每次扩增均用肌肉DNA 作阳性对照。1%琼脂糖凝胶电泳检测PCR 扩增结果后,将含有目的条带的扩增产物进行纯化并双向测序。所得序列使用DNAStar 软件进行正反序列的拼接、比对和校正。最后在NCBI数据库中进行Blast同源比对,以确定粪便的物种来源。
1.3 个体识别
根据东北马鹿已有研究结果,选取9 对微卫星引物(ETH225、T501、T156、BM848、T530、C143、DM45、N、T507[16])用于东北马鹿个体识别。所有引物合成时,上游引物5′端均进行荧光标记(Fam、Hex、Tamra或Rox),下游引物不标记(表1)。扩增体系20 μL:2×RapidTaqMaster Mix 10 μL,10 μmol/L Forward Primer 0.8 μL,10 μmol/L Reverse Primer 0.8 μL,25~50 ng/μL DNA 6 μL,ddH2O 2.4 μL。反应条件同物种鉴定方法。采用多管PCR 扩增法,对每个位点进行3~7 次重复的阳性PCR,得到的产物使用ABI 3730XL 测序仪(Applied Biosystems Inc.,America)进行基因扫描和判读等位基因大小。使用软件Excel mircosatellite tool kit 寻找数据中相匹配的基因型[17]。判断不同样品属于同一个体的依据是:所有位点上的基因型均相同,或只有1个位点的1个等位基因不同[18]。
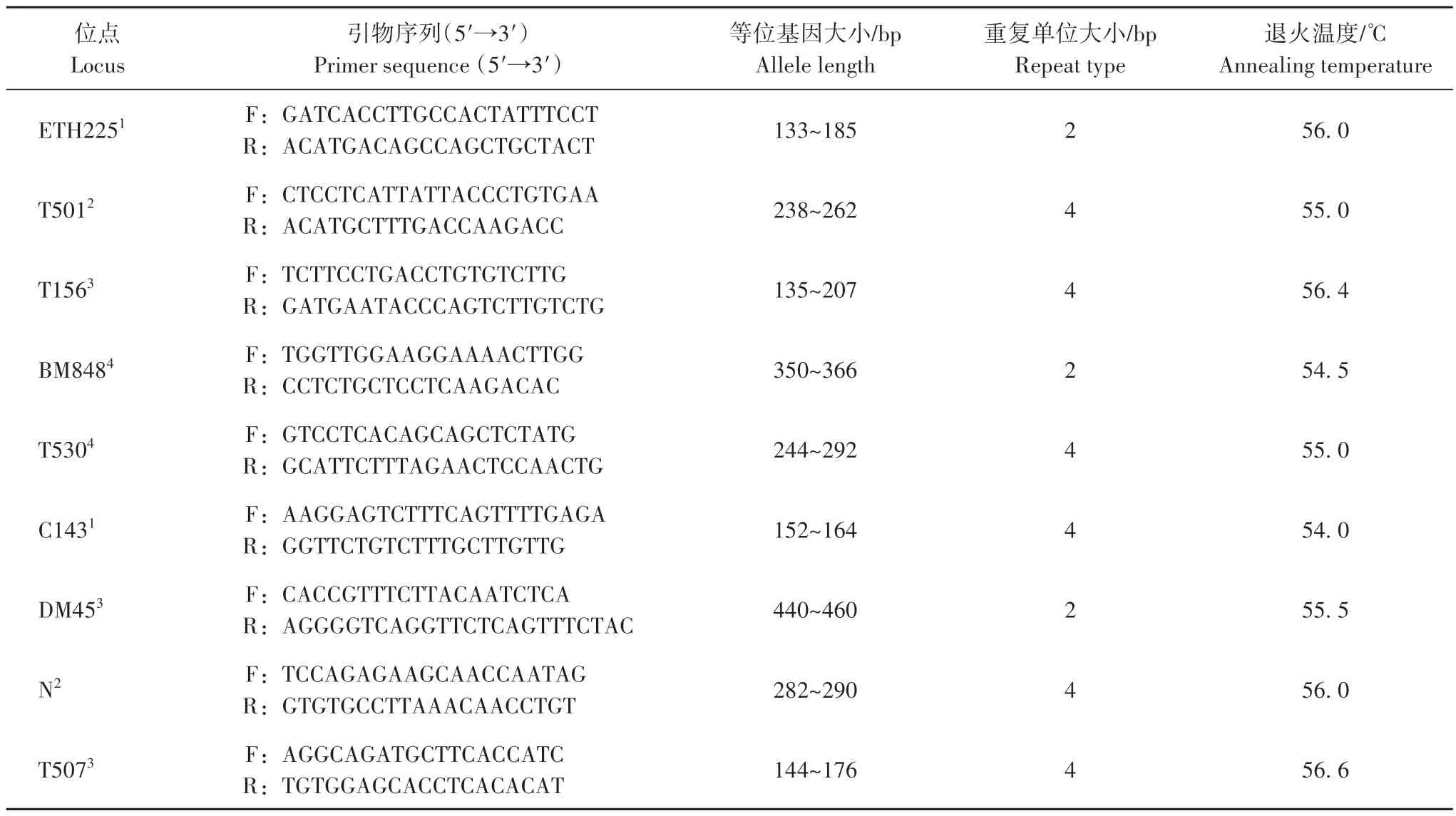
表1 用于东北马鹿个体识别的9对微卫星引物信息Tab.1 Details of nine microsatellite loci used for red deer individual identification
1.4 性别鉴定
性别鉴定使用SRY12 和BMC1009 两对引物对粪便DNA 进行复合扩增,其中引物SRY12 扩增Y 染色体中的SRY 区域片段,引物BMC1009 扩增常染色体微卫星位点,作为反应的阳性对照[19-20]。使用SRY 引物对所有样本再次单独扩增,以避免因引物间互相干扰造成的扩增失败(表2)。根据PCR 结果中条带的出现情况对东北马鹿的性别进行判别。
表2 东北马鹿性别鉴定引物信息Tab.2 Gender primer sequences of red deer
1.5 遗传数据分析
对于mtDNA 序列,使用软件DnaSP 6.12 分别计算变异位点数(variable sites,S)、单倍型数量(number of haplotypes,H)、单倍型多样性(haplotype diversity,Hd)和核苷酸多样性(nucleotide diversity,Pi)[21]。
对于微卫星数据,使用GenAlEx 6.5将等位基因数据转化为分析软件所需的各种格式,并计算等位基因数(number of alleles,Na)、有效等位基因数(effective allele number,Ne)、观测杂合度(observed heterozygosity,Ho)和期望杂合度(expected heterozygosity,He)[22]。应用Cervus 3.0 计算微卫星位点的多态信息含量(polymorphism information contents,PIC);使用GIMLET 1.3.3[23]计算9 个微卫星位点的联合PID值,即无亲缘关系或同胞个体之间具有相同基因型的概率;使用Microchecker 2.2.0.3[24]检测微卫星位点是否存在无效等位基因(null allele)。使用GENEPOP 4.0[25]测算总体和每个位点是否偏离哈迪温伯格平衡(Hardy-Weinberg equilibrium,HWE),同时检验各位点间连锁不平衡(linkage disequilibrium,LD),LD 和HWE 检验通过马尔科夫链法(Markov chain method)生成p值,并使用Bonferroni法对显著性进行校正[26]。
2 结果
2.1 物种鉴定及个体识别
共采集粪便样品246 份,其中成功提取DNA 样品222 份,样品利用率为90.24%。222 份样品成功扩增Cyt b基因,扩增产物为424 bp。序列经过正反拼接、校正及Blast 比对后,最终鉴定出209 份马鹿DNA样本。
GIMLET 分析结果显示,9 个微卫星位点的联合Prod(unbias)为6.398×10-10,即使出现双胞胎,误判概率Prod(sibs)只有0.047 3%。当2 个多态性最高的位点扩增失败时,Prod(sibs)增加到0.460 0%,仍小于1.000 0%(图2)。因此,9个微卫星位点中至少有7 个位点扩增成功才可用于后续分析。209 份马鹿样品中获得了203 个成功扩增的微卫星样本,基因分型利用率为97.13%。基于9 个微卫星位点,同时结合线粒体和性别鉴定结果,个体识别结果显示 203份马鹿粪便样本属于182只不同的马鹿个体。
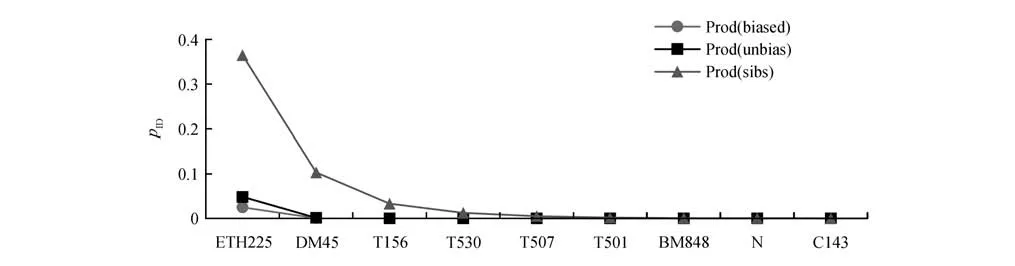
图2 9个微卫星位点按照pID顺序的个体基因型相似概率曲线Fig.2 Probability of identity(pID)curve generated by nine microsatellite loci
根据扩增结果,最终在182 只马鹿个体中鉴定出雌性马鹿125 只,雄性马鹿57 只,雌雄性比为2.19∶1。
2.2 基于mtDNA的遗传多样性
182 条Cytb序列(424 bp)共检出5 个变异位点,包括4个转换位点和1个颠换位点(C/A,350 bp处),未发现插入或缺失位点。5个变异位点中,单一变异位点2 个(128、367 bp),简约信息位点3 个(250、295、350 bp)。(G+C)整体含量较低,为37.8%,存在AT偏倚性,符合脊椎动物线粒体碱基的组成特点。
182 条序列共测定3 个单倍型,分布频率分别为78.0%、21.4%和0.5%,研究地区整体单倍型多样性指数(Hd)为(0.347±0.035),核苷酸多样性指数(Pi)为(0.248±0.025)%。
2.3 基于微卫星标记的遗传多样性
根据多态信息含量(PIC)对9 个扩增位点进行筛选。当PIC<0.250 时,认为多态性较低,故舍去C143位点。最终选择8 个高度多态位点(PIC>0.500)的扩增数据进行后续分析(表3)。各位点检测结果显示未发现无效等位基因及等位基因丢失等情况,说明基因分型结果可靠,可用于后续分析。
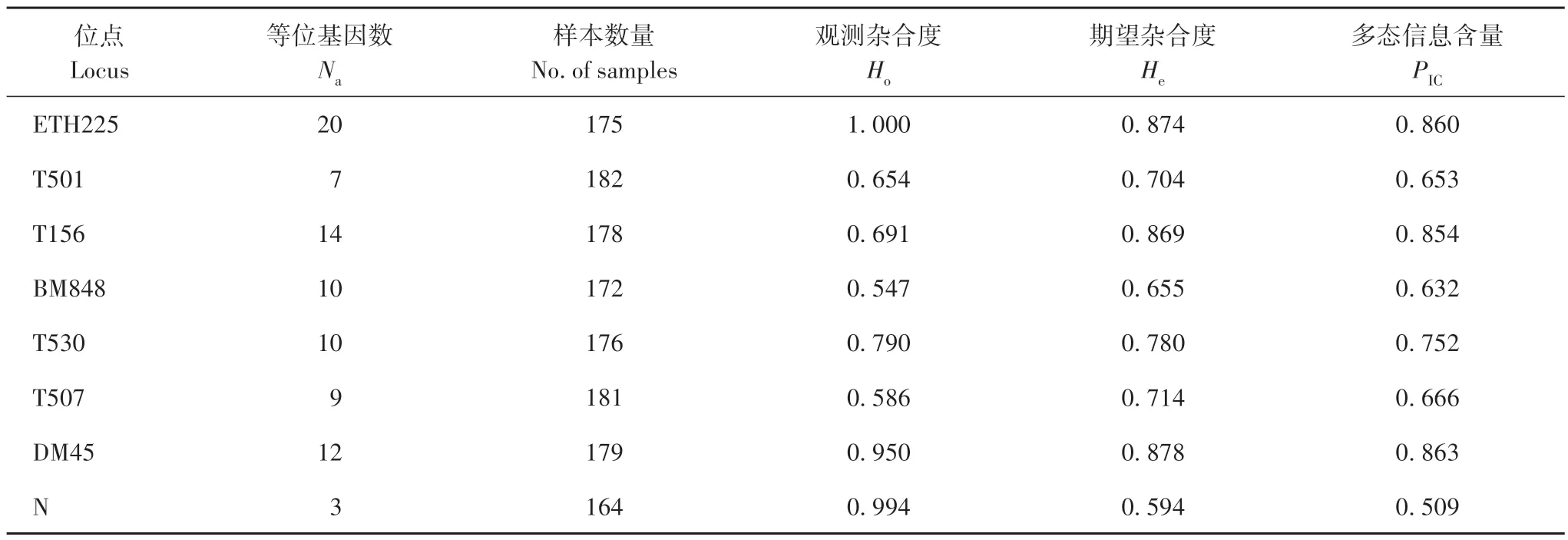
表3 8个微卫星位点的遗传多样性参数Tab.3 Genetic diversity indicators for the eight microsatellite loci
Hardy-Weinberg 平衡检测结果显示,研究地区整体水平显著偏离Hardy-Weinberg 平衡,但固定系数为负值(Fis=-0.062),证明不存在无效等位基因或近交的影响。连锁不平衡分析结果显示8 个位点间不存在连锁不平衡,可进行后续种群遗传学分析。
研究区域整体种群平均等位基因数(Na)为(7.40±0.47);平均有效等位基因数(Ne)为(4.40±0.30),有效等位基因与等位基因数二者差异显著(p<0.01)。等位基因丰富度(AR)为4.537;平均多态信息含量(PIC)为0.691。平均期望杂合度(He)为(0.729±0.016);平均观测杂合度(No)为(0.768±0.029),观测杂合度与期望杂合度之间存在差异(p<0.05)。
3 讨论
野生动物的性比既是估计物种生存力的重要指标,又是描述种群结构的重要参数,深入了解珍稀濒危野生动物的性比对制定保护与管理策略具有重要指导意义[27]。本研究表明,大兴安岭南麓森林—草原过渡带马鹿种群雌雄性比为2.19∶1,与杨淼[28]和张沼等[29]对内蒙古地区马鹿的研究结果一致,均显示雌性高于雄性,符合马鹿一雄多雌的交配体制。
本研究选择线粒体与核微卫星2 种分子标记,从不同角度对种群遗传多样性状况进行评价。单倍型多样性(Hd)与核苷酸多样性(Pi)是衡量线粒体DNA 多样性水平的重要参数[30]。已有学者利用线粒体Cytb基因对马鹿部分亚种进行遗传多样性研究,如刘鑫鑫[31]研究表明东北地区的马鹿野生群体单倍型多样性较高(Hd=0.586),核苷酸多样性相对较低(Pi=0.305%);刘艳华等[32]研究表明西藏东南部分布的西藏马鹿(Cervus elaphus wallichi)整体遗传多样性较高(Hd=0.897,Pi=2.781%);塔依尔江·麦麦提等[33]发现塔里木马鹿(Cervus elaphus yarkandensis)3 个地理种群的遗传多样性不平衡(Hd=0.845,Pi=1.500%)。本研究在182 只马鹿个体中发现3 个单倍型,单倍型多样性(0.347)和核苷酸多样性(0.248%)均低于西藏马鹿、塔里木马鹿及分布在黑龙江和吉林地区的马鹿。根据对比国内其他马鹿亚种基于线粒体Cyt b基因的研究结果(表4),结合种群遗传多样性水平的判定标准(Hd≥0.500,Pi≥0.500%)[34-35],研究地区东北马鹿线粒体DNA 多样性水平处于中等偏低水平。

表4 中国马鹿种群遗传多样性参数Tab.4 Comparison of genetic diversity of red deer populations in China
微卫星位点的多态信息含量(PIC)是衡量遗传标记所提供信息含量的参数,根据Botstein等[43]提出的多态信息含量标准,本研究选择的9 个微卫星位点中仅有C143 位点PIC=0.180<0.250,表明C143 位点提供的遗传信息相对匮乏,故最终确定其他8 个高度多态位点用于遗传多样性分析。研究结果显示整体种群平均等位基因数(Na)为7.40,平均有效等位基因数(Ne)为4.40,二者差异显著(p<0.01),可能存在等位基因丢失的风险。研究区域整体种群观测杂合度(Ho)为0.768,期望杂合度(He)为0.729。杂合度作为有效量化遗传多样性水平的参数[44],与其他地区马鹿亚种研究结果相比较,发现本研究地区马鹿遗传多样性处于中等偏低水平。
线粒体表达的遗传多样性水平低于微卫星标记,这可能与标记方法本身有关。微卫星标记的进化速度高于线粒体DNA。相比之下,线粒体DNA 的整体结构、大小及基因排列相对保守,一般不发生重组。线粒体DNA 为单倍体母系遗传,有效种群大小仅为核DNA 的1/4,因此,对瓶颈效应等种群变化较为敏感[45],本研究表明大兴安岭南麓马鹿种群历史上可能经历了瓶颈效应。基于Cyt b测序结果可知,本研究检出的单倍型数量相对较少,Hap3 仅有1 只个体构成,稀有单倍型比例达33.33%。20世纪50年代,由于林业资源采伐、放牧和狩猎,本地区野生马鹿种群数量急剧下降。直到本世纪初期,经过合理的管理措施,马鹿种群数量才逐渐恢复。因此,为了马鹿种群的可持续发展,有必要对稀有单倍型实施监测,并且加强管理和保护该地区的马鹿种群,防止遗传多样性进一步下降,甚至丧失。
致谢:感谢内蒙古高格斯台罕乌拉国家级自然保护区钱宏远局长、石光磊副局长对本研究调查工作的大力支持,感谢保护区业务部、资源部及科研管理部以阮行舟、宝音达来等为主要代表的全体参与者的热心帮助和大力配合。
