郫县豆瓣酱香气萃取方法优化与其成分表征
2023-08-15唐源于明光王宝松王莹宋焕禄
唐源,于明光,王宝松,王莹,宋焕禄
(北京工商大学 食品与健康学院,北京,100048)
郫县豆瓣酱源于四川,是中国著名的地理标志性产品,作为一种调味品,其色泽红亮,香气独特,被誉为“川菜之魂”[1]。豆瓣酱通常由辣椒和蚕豆两大原料经微生物发酵和晒缸工艺制成[2]。风味是反应豆瓣酱整体质量的重要指标,明确豆瓣酱中的关键香气化合物对其后续工业化生产的质量把控有重要意义[3]。目前,国内外对豆瓣酱香气研究所用的萃取方法可以归结为3类,以固相微萃取(solid phase micro-extraction, SPME)和搅拌棒吸附萃取(stir bar sorptive extraction, SBSE)为代表的非溶剂萃取的萃取方式,以溶剂辅助风味蒸发(solvent-assisted flavor evaporation, SAFE)为代表的有溶剂辅助的萃取方式,以同时蒸馏萃取(simultaneous distillation extraction, SDE)为代表的蒸馏萃取方式[4-5]。乔鑫等[6]采用固相微萃取-气相色谱-质谱联用技术(solid phase micro-extraction- gas chromatography-mass spectrometry,SPME-GC-MS)对工业化生产豆瓣酱和传统酿造豆瓣酱的挥发性成分进行分析,分别鉴定出39和38种挥发性化合物;ZHAO等[7]采用SBSE与GC-MS联用,并结合气相色谱-嗅闻(gas chromatography-olfactometry,GC-O)技术,结果显示,乙酸和苯乙醛等化合物对豆瓣酱香气有重要贡献;ZHANG等[8]采用SDE-GC-O-MS与香气化合物稀释分析(aroma extraction dilution analysis, AEDA)结合,鉴定出22种香气化合物,其中4-乙基愈创木酚、苯甲醛和2,5-二甲基吡嗪等化合物的风味稀释(flavor dilution, FD)因子较高,是豆酱中的关键香气物质;LI等[9]使用SAFE与SPME两种萃取方法与GC-O-MS联用,结合AEDA在豆瓣酱中共鉴定出苯乙醇、3-甲基丁酸等13种FD≥2的香气活性化合物。这些研究表明采用不同的萃取方法会导致鉴定出的关键香气化合物的种类和数量存在差异,从而影响豆瓣酱的特征香气表征的全面性和准确性。同时,关于豆瓣酱的特征香气能否被上述方法最大程度萃取也鲜有报道,只有选择合适的方法才能萃取出种类更为全面的香气化合物,最大限度地反映样品的真实香气特征[10]。
本研究首先对比不同萃取方法对豆瓣酱香气的提取效果,筛选出更适合豆瓣酱样品香气物质的萃取方法;然后基于筛选出的萃取方法,结合AEDA解析各香气化合物的贡献程度,明确豆瓣酱中关键的香气活性化合物;最后对关键香气活性化合物进行定量分析并计算气味活性值(odor activity value, OAV),进一步表征豆瓣酱的香气特征。研究将为豆瓣酱风味特征的全面解析提供理论支持与指导。
1 材料与方法
1.1 材料与试剂
样品Y1和Y2,鹃城牌郫县豆瓣酱公司,样品信息如下:
Y1:二荆条辣椒、晒瓣子等,晒缸制作,发酵3年;Y2:二荆条辣椒、美国红辣椒、烘瓣子等,晒场条池制作,发酵1个月。在分析之前所有样品均储存在实验室冰箱内(4 ℃)。
无水乙醚、无水Na2SO4、NaCl(分析纯),国药集团化学试剂有限公司;正己烷、正构烷烃(C8~C25)、2-甲基-3-庚酮、己醛、庚醛、1-辛烯-3-酮、2,5-二甲基吡嗪、二甲基三硫醚、壬醛、1-辛烯-3-醇、苯甲醛、3-甲基丁酸、α-萜品醇和4-乙基愈创木酚(色谱纯),美国Sigma公司;氦气(99.999 0%)、氮气(99.999 2%)和液氮(99.999 0%),北京氦普北分气体工业有限公司。
1.2 仪器与设备
GC-MS包括7890A型气相色谱和7000型质谱,美国Agilent公司;极性DB-WAX毛细管柱(30 m×0.32 mm,0.25 μm),美国J&W Scientific公司;ODP4型嗅闻仪,德国Gerstel公司;GC×GC-MS包括8890A型气相色谱和5977型质谱,美国Agilent公司;SSM1800固态调制器,中国上海J&X Technologies公司,使用2根色谱柱,DB-Wax色谱柱(30 m×0.25 mm,0.25 μm),美国J&W Scientific公司和DB-17毛细管柱(1.85 m×0.18 mm,0.18 μm),美国J&W Scientific公司;Sniffer 9100型嗅闻仪,瑞士Brechbuhler公司;多功能自动进样器(multi-purpose autosampler, MPS)、热脱附系统(thermo-desorption unit, TDU)、PTV冷却型进样口(cool injection system , CIS)和玻璃衬管,德国Gerstel公司;溶剂辅助风味蒸发装置,德国Glasblaserei Bahr公司;Vigreux柱(10 cm×1 cm),北京半夏科技发展有限公司;HN200氮吹仪,济南海能仪器股份有限公司。
1.3 香气萃取方法
1.3.1 SPME
取2 g豆瓣酱、8 g超纯水和1 g NaCl于20 mL顶空瓶中,加入1 μL 2-甲基-3-庚酮(0.816 μg/μL),55 ℃平衡20 min,然后插入75 μm CAR/PDMS/DVB萃取头,吸附40 min。吸附结束后在GC进样口230 ℃下解析5 min。每种样品重复3次。
1.3.2 SBSE
参考并根据实际情况优化ZHAO等[7]的SBSE萃取法。取2 g豆瓣酱、8 g超纯水和1 g NaCl于40 mL顶空瓶,加入1 μL 2-甲基-3-庚酮(0.816 μg/μL)。随后加入搅拌棒萃取器(PDMS涂层,长10 mm,厚度0.5 mm),在55 ℃下设定转速120 r/min,萃取90 min,萃取结束后用超纯水清洗晾干,转移到玻璃热脱附管中进行解析。每种样品重复3次。
1.3.3 SAFE
取25 g豆瓣酱,加入10 μL 2-甲基-3-庚酮(0.816 μg/μL),使用100 mL乙醚进行萃取,180 r/min搅拌2 h(4 ℃),重复2次,合并有机相,在40 ℃的真空环境下进行SAFE蒸馏,将所得馏出物用Na2SO4(无水)干燥,使用Vigreux柱浓缩至10 mL,然后氮吹至500 μL,进样1 μL。每种样品重复3次。
1.4 气相色谱-质谱参数
1.4.1 GC分析条件
色谱柱:DB-WAX(30 m×0.25 mm, 0.25 μm);不分流模式进样;载气为99.999%氦气,流量1 mL/min,压力15.71 kPa;升温程序:初始温度50 ℃,然后以3 ℃/min的速率升温至230 ℃。
1.4.2 GC×GC分析条件
SPME和SBSE进样,不分流模式;液体进样,采用分流模式,分流比9∶1;载气为99.999%氦气,流量1 mL/min,压力15.71 kPa;进样口温度230 ℃,两根色谱柱分别为DB-Wax色谱柱(30 m×0.25 mm, 0.25 μm)和DB-17毛细管柱(1.85 m×0.18 mm, 0.18 μm);柱温箱升温程序:初始温度50 ℃,然后以3 ℃/min的速率升温至230 ℃;固态调制器测定的冷区温度-50 ℃,加热区的入口和出口温度分别为70、160 ℃;调制周期4 s。
TDU升温程序:初始温度50 ℃,维持1 min,后以100 ℃/min升至280 ℃,维持5 min。
CIS升温程序:超低温液氮先将CIS温度迅速降到-80 ℃,待TDU解吸完成之后,再以10 ℃/min升到250 ℃,维持1 min。
1.4.3 MS条件
电子轰击(electronic ignition,EI)离子源,电离能量70 eV;离子源温度230 ℃,四杆温度150 ℃,扫描模式为全扫模式,溶剂延迟4 min,质量范围m/z40~350。
1.4.4 嗅闻仪条件
传输线温度280 ℃,嗅闻口温度200 ℃,通入湿润的N2气保持实验员鼻腔湿润。实验员准确记录嗅闻到的气味特征和出现时间。
1.5 定性分析
通过质谱图(MS)、保留指数(retention index,RI)、嗅闻结果(olfactometry,O)和标准化合物(standard compound,STD)对比鉴定郫县豆瓣酱中的香气化合物。化合物的保留指数则通过正构系列烷烃(C8~C25)的保留时间计算得到,RI值计算如公式(1)所示:
(1)
式中:n,系列烷烃中碳原子个数;Tn,正构烷烃Cn的保留时间,min;Ta,样品中化合物a的保留时间(化合物a的保留时间在Cn与Cn+1之间),min。
1.6 AEDA
通过调节分流比(0、1∶3、1∶9、1∶27、1∶81等)进行AEDA分析,直到实验员在嗅闻口闻不到任何气味时停止稀释,得到相应的FD定义为1、3、9、27、81等。香气化合物的FD因子越高,该化合物对食品整体香气贡献就越大。
1.7 香气活性化合物定量分析
根据AEDA的结果,使用GC-MS对豆瓣酱香气活性化合物(FD≥9)进行精确定量[11],将标准品梯度稀释,根据加入标准品溶液的浓度与其经仪器分析得到的峰面积之间的关系,绘制标准曲线,然后在相同实验条件下对豆瓣酱样品进行检测,将测得的香气化合物的峰面积带入对应标准品的标准曲线,即可得到豆瓣酱样品中对应物质质量分数,以μg/kg为单位计算。所有分析重复3次。
1.8 OAV的计算
OAV定义为香气化合物浓度与阈值之比,可验证香气化合物对样品特征香气的贡献程度。按公式(2)计算:
(2)
式中:ρa,化合物a的质量浓度,μg/kg;ρ(OTa),化合物a在水中的阈值,μg/kg。
1.9 数据处理
样品中香气化合物的含量均以平均值±标准差表示。采用Microsoft Excel 2016对数据进行统计分析,柱状图由Origin 2018软件进行绘制。
2 结果与分析
2.1 三种萃取方法的效果对比
为避免使用单个样品的实验偶然性和片面性,本研究选用2种发酵时长差异较大的豆瓣酱样品。3种前处理方法结合GC×GC-O-MS在Y1和Y2中共鉴定出香气化合物45种,如表1所示。其中,醇类11种、酸类9种、醛类7种、酯类6种、酮类4种、酚类3种、吡嗪类2种、吡咯类1种和含硫化合物2种。Y1中共检测到香气化合物45种,SPME、SBSE和SAFE分别提取到香气化合物33、39和24种。其中,3-甲基丁醛、2/3-二甲基丁酸乙酯和二甲基三硫醚等9种香气化合物仅通过SBSE富集后被感官人员所嗅闻到,明显高于SPME(3种)和SAFE(1种)萃取方式中特有的香气化合物。Y2中共检测到香气化合物36种,SPME、SBSE和SAFE分别提取到香气化合物25、33和26种。与Y1相同,采用SBSE富集到的可被嗅闻到的香气化合物的种类最为丰富,同时特有化合物的种类也最多。这说明,不同萃取方法对于豆瓣酱中的香气化合物的萃取效果有较大差异[12]。因此,针对不同的样品选择适合的香气萃取方法是必要的。从萃取的香气化合物数量上来看,对于豆瓣酱样品,萃取效果依次为:SBSE、SPME、SAFE,这可能是因为SAFE制样操作复杂、耗时长造成了香气化合物的损失[13],SBSE的吸附剂涂层量比SPME大,因此SBSE具有更大的样品容量和更好的重现性[14]。因此,相比于SPME和SAFE,SBSE是更适合豆瓣样品香气化合物富集的有效方法。

表1 不同萃取方法下豆瓣酱的香气化合物萃取结果
2.2 豆瓣酱香气化合物分析
不同萃取方法下2个豆瓣酱样品中各类香气化合物的数量如图1-a、图1-b所示。2个豆瓣酱样品中,采用3种提取方法得到的醇类、醛类、酸类和酯类化合物数量较多,酮类、酚类、吡嗪类、吡咯类和含硫化合物数量较少。Y1中检测到的各类化合物数量普遍多于Y2,这可能是因为Y1的发酵时间较长,而豆瓣酱的香气主要在后熟发酵过程中产生[15]。原料中的蛋白质、淀粉和脂肪等大分子物质分解生成各类小分子风味前体物,继而在多种微生物的共同作用下生成酚类、醛类、酮类、醇类等小分子风味物质,从而形成了豆瓣酱的典型风味特征。
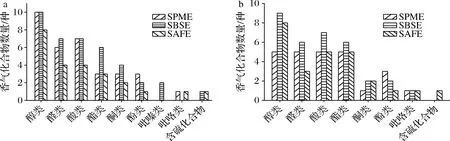
a-Y1中香气化合物数量;b-Y2中香气化合物数量
醇类化合物是酯化反应的重要前体物,主要由不饱和脂肪酸氧化降解产生,对郫县豆瓣整体风味有重要贡献,在食品中常呈甜香气味[16]。在Y1和Y2中检测到的醇类化合物数量最多。2,3-丁二醇、1-辛烯-3-醇和3-甲基丁醇等化合物在Y1和Y2中均被检出。据报道,这些醇类香气化合物不仅存在于中国豆瓣酱[17]中,也存在于日本味噌[18]和韩国大酱[19]中,是豆类发酵食品中常见的香气化合物。
醛类化合物主要呈现青草、柑橘等气味,通常由脂肪氧化和Strecker降解产生[20]。醛类化合物阈值较低,对豆瓣酱的整体香气有较大贡献。其中,3-甲基丁醛、壬醛和糠醛等醛类化合物在2种豆瓣酱样品中均被检出,这与前人报道豆瓣酱的香气化合物结果相似[21]。
豆瓣酱中的酸类物质有微生物降解、原料酶解、脂肪水解等多种来源[7]。在2种豆瓣酱样品中共检测出了乙酸、3-甲基丁酸等9种酸类香气化合物,这些酸类物质在豆制品发酵产品中较为常见[18],在食品中产生汗酸味、腐臭味等不愉快气味。
2.3 香气活性化合物分析
Y1中检测到的香气化合物总数高于Y2(表1),且2个样品中SBSE法检测到的香气化合物数量高于SPME和SAFE。为较为全面地分析郫县豆瓣酱中香气活性化合物,故选用SBSE法对香气特征更为丰富的Y1进行AEDA,通过逐渐缩短提取时间达到稀释效果。结果如表2所示,39种香气活性化合物在Y1中被检出,其中11种化合物被认为是重要的香气活性化合物(FD≥9)。

表2 SBSE法对Y1样品香气活性化合物的AEDA结果
Y1中各类化合物FD因子如图2所示。Y1中醇类和酸类香气活性化合物个数较多,然而香气贡献率不高,两者不呈正相关,可能是因为醇类、酸类化合物阈值普遍比较大,故对豆瓣酱的整体香气的贡献度较低[22]。但1-辛烯-3-醇较为特殊(FD=81),表现出类似蘑菇香气,这可能是由于其为不饱和醇,其阈值低于饱和醇,易被人感知[23],1-辛烯-3-醇在封闭式和开放式发酵的豆瓣酱中均被鉴定为关键香气活性化合物[24],对豆瓣酱特征香气有较大贡献。含硫化合物为二甲基三硫醚(FD=243),能赋予豆瓣酱肉香、洋葱等香气,推测来源于豆瓣酱中添加的蒜等香辛料[25]。4-乙基愈创木酚(FD=81)呈烟熏味,在豆瓣酱中通常相对含量较高[26],是豆瓣酱后熟发酵的重要关键香气成分。

图2 Y1中各类化合物的FD
2.4 豆瓣酱中关键化合物的定量分析与OAV分析
采用外标法对AEDA得到的11个关键香气活性化合物进行定量分析,结果如表3所示,所有香气物质标准曲线相关性系数R2均介于0.992 2~0.998 1,线性良好,Y1中3-甲基丁酸和2,5-二甲基吡嗪含量较高。3-甲基丁酸通常被认为由亮氨酸分解产生,是发酵制品中常见的挥发性化合物[27]。吡嗪类化合物主要来源于原料中蛋白质和氨基酸的热分解和美拉德反应,2,5-二甲基吡嗪是美拉德反应的重要产物,能赋予食品浓郁的坚果香气[28]。然而,Y1中3-甲基丁酸和2,5-二甲基吡嗪的FD因子和OAV较低,其原因是这2种化合物的气味阈值较高,难以被人们感知,因此,单独分析香气化合物含量的多少并不能说明该物质对食品整体香气的贡献。
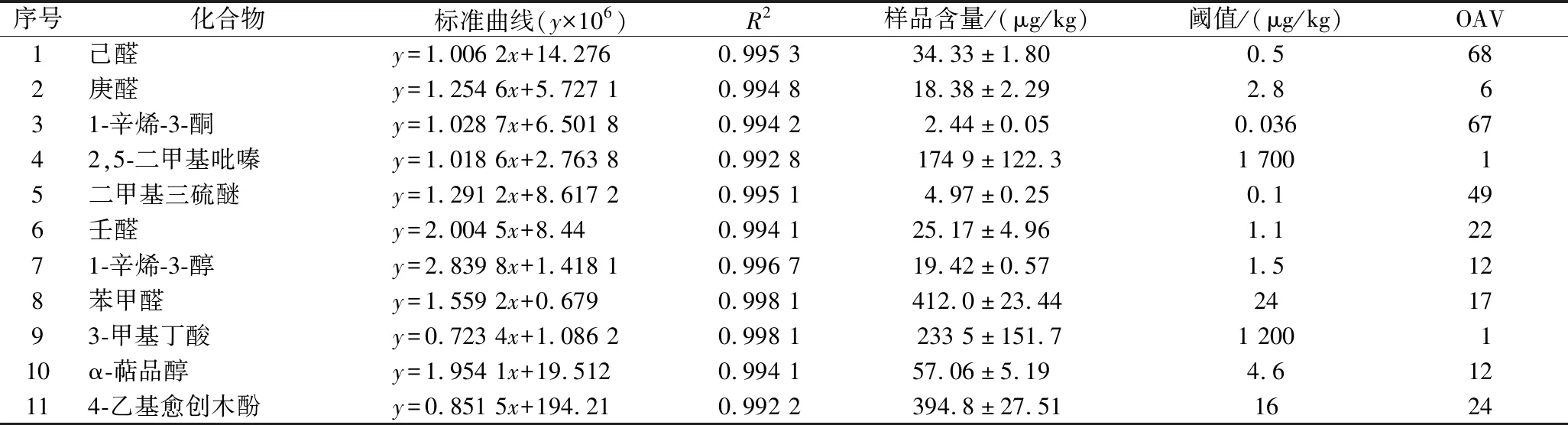
表3 豆瓣酱关键香气活性化合物定量结果和OAV
OAV是评价香气化合物香气强弱以及样品香气贡献度大小的重要指标之一,OAV≥1,表明该化合物对豆瓣酱整体风味具有贡献,数值越大表示贡献越大[29]。Y1中己醛(FD=729,OAV=68)和1-辛烯-3-酮(FD=729,OAV=67)对豆瓣酱的整体香气贡献较大,分别为豆瓣酱提供了青草味和蘑菇味。己醛是豆制品中常见的化合物,是豆浆、豆腐等豆制品中豆腥味的主要来源[30],也是评估油脂氧化程度的重要指标,在肉制品、乳制品等食品原料中均有应用[31]。己醛和1-辛烯-3-酮主要来自于花生四烯酸和亚油酸等不饱和脂肪酸的氧化[32],豆瓣酱中的脂肪主要来源于蚕豆、辣椒等植物性原料,含量约为12.25%,脂质经微生物代谢分解成脂肪酸等小分子物质,为豆瓣酱中己醛和1-辛烯-3-酮等香气活性化合物形成提供了原料[33]。
3 结论
本研究使用GC×GC-O-MS结合SPME、SBSE和SAFE三种萃取方法对豆瓣酱的香气进行全面的解析,并比较了不同萃取方法富集豆瓣酱样品的香气化合物的适宜程度。结果表明,使用SBSE法对豆瓣酱香气化合物的萃取更全面,采用SBSE-GC×GC-O-MS,在Y1中共检测出39种香气活性化合物,经过计算FD因子和OAV,筛选出其中11种关键香气化合物,分别为己醛、庚醛、1-辛烯-3-酮、2,5-二甲基吡嗪、二甲基三硫醚、壬醛、1-辛烯-3-醇、苯甲醛、3-甲基丁酸、α-萜品醇和4-乙基愈创木酚,对豆瓣酱的青草味、烟熏味和蘑菇味等香气有较大贡献。本研究筛选出了一种适合豆瓣酱的香气化合物萃取方法,明确了豆瓣酱中的关键香气化合物,可以作为改进豆瓣酱生产工艺的理论依据。