转录因子NbERF RAP2-1在黄瓜绿斑驳花叶病毒侵染中的功能
2023-08-15于连伟姜兴林杨灵玲王贺张玉阳谢莉娜夏子豪李洪连杨雪施艳
于连伟,姜兴林,杨灵玲,王贺,张玉阳,谢莉娜,夏子豪,李洪连,3,4,杨雪,2,施艳
转录因子NbERF RAP2-1在黄瓜绿斑驳花叶病毒侵染中的功能
于连伟1,姜兴林1,杨灵玲1,王贺1,张玉阳1,谢莉娜1,夏子豪5,李洪连1,3,4,杨雪1,2,施艳1
1河南农业大学植物保护学院,郑州 450002;2河南农业大学作物学博士后流动站,郑州 450002;3河南省粮食作物协同创新中心,郑州 450002;4小麦玉米作物学国家重点实验室,郑州 450002;5沈阳农业大学植物保护学院,沈阳 110866
【背景】黄瓜绿斑驳花叶病毒(cucumber green mottle mosaic virus,CGMMV)是我国重要的检疫性植物病毒,对蔬菜和瓜类产业造成严重的经济损失。ERF转录因子可以调控植物生物和非生物胁迫,参与植物对多种病害的防御作用。前期研究显示CGMMV侵染后可以显著下调寄主转录因子NbERF RAP2-1的表达。【目的】明确ERF转录因子家族成员在CGMMV侵染过程中的作用,为CGMMV病害防治提供理论依据。【方法】运用MEGA7.0构建系统进化树,对基于NbERF RAP2-1蛋白的氨基酸序列进行系统进化分析;构建的荧光表达载体,并观察其亚细胞定位;利用qRT-PCR技术分析在CGMMV侵染不同时期的表达量;通过烟草脆裂病毒(tobacco rattle virus,TRV)介导的基因沉默(VIGS)和瞬时过表达分析其在CGMMV侵染过程中的作用。【结果】系统进化树分析表明,NbERF RAP2-1与多种烟草的ERF转录因子同源性极高,与拟南芥的ERF转录因子亲缘关系较远;亚细胞定位结果显示NbERF RAP2-1定位于细胞核,作为转录因子行驶功能;CGMMV侵染对本氏烟内源基因的转录水平影响结果显示,在CGMMV侵染6、9、12 d时的表达量无明显变化,在CGMMV侵染15和18 d时表达量显著下调;TRV介导的VIGS可以将植物内源基因有效沉默,在沉默的植株系统叶上接种CGMMV,8 d对照植株系统叶出现斑驳、卷曲症状而沉默植株无症状,同时CGMMV RNA水平和蛋白水平检测结果也表明TRV:可以有效抑制CGMMV的积累;同样,分别在本氏烟叶片瞬时过表达NbERF RAP2-124、48和72 h时检测CGMMV RNA水平和蛋白水平表达量,结果显示在病毒侵染早期,即复制阶段就抑制CGMMV的表达。【结论】NbERF RAP2-1可以有效抑制CGMMV侵染初期病毒复制,即病毒RNA复制阶段;随着CGMMV不断侵染,在CGMMV细胞间运动和系统运动时期,CGMMV识别防御相关基因并抑制该基因的转录;当缺失后可能抑制了下游蛋白的转录或表达,从而抑制病毒侵染后期的积累。由此可见,NbERF RAP2-1在CGMMV侵染过程中发挥了重要作用。
黄瓜绿斑驳花叶病毒;;致病机制
0 引言
【研究意义】在植物病毒与宿主长期互作过程中,两者均形成各自的攻防体系。越来越多的研究表明,病毒利用植物中的组分来帮助自身侵染,而植物内也进化出多种防御体系来抵抗病毒的入侵,两者都在不断进化从而有利于自身的生存。黄瓜绿斑驳花叶病毒(cucumber green mottle mosaic virus,CGMMV)是我国重要的检疫性病毒,主要危害黄瓜、西瓜、甜瓜、南瓜等葫芦科作物[1-2]。研究哪些寄主因子参与调控CGMMV的侵染,可为有效防控病毒病害提供理论依据。【前人研究进展】CGMMV侵染本氏烟()后,叶片表面出现皱缩、斑驳和花叶等症状;黄瓜受害后,新生叶片表面出现黄色小斑点,后逐渐变成浓绿色突起,叶脉间褪色呈绿带状,果实黄化或变白并同时产生墨绿色水疱状坏死斑[3];侵染西瓜会出现不规则的褪色或淡黄色花叶、叶片凹凸不平、叶缘上卷、果实表面有浓绿原斑或不明显的深绿色瘤疱、病果有弹性、肉质纤维化、果梗有坏死条纹,严重时整株变黄直至死亡[4]。CGMMV自2005年首次传入我国东北部,并在辽宁西瓜田流行传播[5]。近年来在我国江苏、广东、北京、山东和湖南等省(直辖市)均已检测到CGMMV[6-9]。CGMMV属于烟草花叶病毒属的正义单链RNA病毒[2]。其病毒粒体为杆状,长300 nm,直径18 nm,在形态上与烟草花叶病毒(tobacco mosaic virus,TMV)无明显区别。CGMMV的基因组全长约为6.4 kb,可编码4种蛋白,分别为129和186 kDa的复制相关蛋白、29 kDa的运动蛋白以及17 kDa的外壳蛋白[10]。CGMMV病毒粒子稳定,常通过带毒种子、花粉、受污染工具的机械损伤以及受污染的砧木嫁接等方式传播给寄主植物,另外菟丝子等寄生植物也可造成CGMMV的传播[11]。目前受限于研究的深度与广度,防治药剂开发较难,生产上仍然缺乏有效控制CGMMV的方法。前期研究发现乙烯响应因子NbERF RAP2-1(ethylene response factor related AP2-1)可以参与植物对CGMMV的调节作用[12]。AP2/ERF转录因子家族是植物中特有的,分为AP2、RAV和ERF转录因子亚家族[13]。AP2家族蛋白包含两个重复的AP2/ERF结构域;RAV家族蛋白包含一个B3结构域;而ERF转录因子家族包含一个AP2/ERF结构域,该结构域具有DNA结合活性[14]。ERF转录因子在许多生物和生理过程中起着重要的调节作用,如植物形态发生、对各种胁迫的响应机制、激素信号转导和代谢产物调节等[15]。值得注意的是,一些ERF转录因子可以参与多种病原物的侵染过程。有研究报道ERF转录因子有效抑制多种灰霉病侵染寄主,例如葡萄中VaERF16增强对灰霉病抗性[16],拟南芥中ERF72增强植物对灰霉病菌的抗性[17];番茄中ERF2增强植物对番茄白斑病的抗性[18];水稻中OsBIERF3可以正调控水稻对真菌和细菌性病害的抗性[19]等。另外,有些ERF转录因子家族成员也可以帮助病原物侵染,例如水稻中OsERF922负调控水稻对稻瘟病的抗性[20]。ERF转录因子也可以参与调节病毒病害的侵染过程。在抗/感病性番茄品种中SiERF-B3转录因子通过与GCC盒结合能力的强弱来调节植物对番茄黄化曲叶病毒(tomato yellow leaf curly virus,TYLCV)防御反应[21]。在烟草中异源表达大豆GmERF可以增强植物对青枯雷尔氏菌()、链格孢菌()和TMV侵染的抵抗力[22]。【本研究切入点】通过RNA-Seq数据分析发现,CGMMV侵染后会特异性下调本氏烟内源基因,该基因属于ERF转录因子家族。NbERF RAP2-1蛋白在植物与病毒互作中的作用还未见报道。【拟解决的关键问题】通过对NbERF RAP2-1氨基酸序列进行系统发育树分析、亚细胞定位、CGMMV侵染对内源转录水平的影响以及沉默和过表达对CGMMV侵染作用的研究,明确NbERF RAP2-1转录因子在CGMMV侵染中的功能,为黄瓜绿斑驳花叶病毒病防治提供理论依据。
1 材料与方法
试验于2022年5月至2023年4月在河南农业大学植物保护学院完成。
1.1 材料
野生型本氏烟以及组蛋白H2B-RFP转基因本氏烟在光周期为16 h光照/8 h黑暗,温度为25 ℃的条件下生长。大肠杆菌DH5感受态购于擎科生物;GV3101感受态为本实验室所保存菌液制作。CGMMV农杆菌GV3101菌株保存于本实验室-80 ℃超低温冰箱。病毒诱导的基因沉默(virus induced genetic silencing,VIGS)系列载体TRV-RNA1和TRV-RNA2,亚细胞定位载体pEG103均由本实验室保存。
1.2 NbERF RAP2-1同源进化树的构建
在NCBI网站查找不同植物中ERF的氨基酸序列与NbERF RAP2-1的氨基酸序列进行Blast比对,对同源性高的氨基酸序列采用邻接法(neighbor-joining,NJ)进行系统进化分析。利用MEGA 7.0软件建立系统发育树。
1.3 亚细胞定位
以为模板,使用引物GFP-F/GFP-R(表1),利用RT-PCR方法扩增,利用Gateway方法将连接到pEG103载体上,从而构建-GFP荧光表达载体,转化农杆菌感受态GV3101,挑选单菌落验证正确后摇菌。将含有-GFP质粒的农杆菌用瞬时转染缓冲液(10 mmol·L-1MgCl2,10 mmol·L-1MES,200 μmol·L-1乙酰丁香酮,pH 5.6)悬浮后OD600值定为0.5,静置2 h后分别浸润到7—8叶龄的H2B-RFP转基因本氏烟叶片(5—6叶位)下表皮,接种48 h后使用共聚焦显微镜(Nikon eclipse Ti2)观察本氏烟叶表皮细胞中GFP荧光,其激发波长为514 nm;RFP荧光,其激发波长为593 nm。
1.4 VIGS系统沉默
的系统沉默利用烟草脆裂病毒(tobacco rattle virus,TRV)介导的VIGS技术完成。以为模板,利用SGN VIGS Tool(http://vigs.solgenomics.net)在基因上预测一段300 bp的片段进行TRV介导的VIGS,并设计引物VIGS-F/VIGS-R(表1),通过PCR扩增出目的片段。利用Gateway方法将构建到TRV-RNA2载体上。将构建成功的TRV-RNA2-表达载体进行农杆菌转化,利用菌液PCR验证,单克隆摇菌。将TRV-RNA2-与TRV-RNA1农杆菌用瞬时转染缓冲液悬浮后OD600值分别定为1.0,静置2 h后等量混匀,使用1 mL无菌注射器浸润本氏烟,以TRV-RNA2和TRV-RNA1等量混匀作为空白对照,以TRV-RNA2-PDS和TRV-RNA1等量混匀作为指示作用。每处理20个重复。定期观察烟草生长状况。
1.5 病毒接种
将保存于-80 ℃含有CGMMV克隆载体的菌液活化后,在LB液体培养基(50 mg·L-1Rif、50 mg·L-1Kan)28 ℃,200 r/min培养过夜,然后将菌液6 000 r/min离心2 min,弃上清并将沉淀溶解于瞬时转染液中,OD600定为1.0,静置2 h,注射到长势较好的本氏烟植株中,7—10 d系统叶发病。采集刚发病的系统叶叶片研磨并摩擦接种到本氏烟植株上。

表1 载体构建相关引物核苷酸序列
1.6 qRT-PCR分析
采用Trizol法提取本氏烟植株叶片的总RNA,总RNA通过HiScript&III RT SuperMix for qPCR(+gDNA wiper)试剂盒反转录为cDNA。使用Real-Time System荧光定量PCR仪检测相关基因的表达量(表2)。参照SYBR Green I说明书进行,反应条件:98 ℃预变性30 s;循环体系(95 ℃ 10 s,56 ℃ 30 s,72 ℃ 30 s)40个循环,95 ℃ 10 s,65 ℃10 s,95 ℃ 5 s;反应总体系10 μL:2×SYBR Master mix 5 μL,正向和反向引物各0.2 μL,cDNA 1 μL,ddH2O 3.6 μL,每个样品设3个技术重复。

表2 qRT-PCR相关引物核苷酸序列
1.7 Western blot分析
采集叶片样品,迅速置于液氮中快速制冻,将样品研磨破碎,加入蛋白裂解液充分裂解30 min,13 000 r/min高速低温离心10 min,取上清液加入5×Loading buffer后PCR仪99 ℃变性10 min,将处理组和空白对照蛋白样品进行SDS-PAGE凝胶电泳;使用转膜仪在25 v电压25 min条件下将特异性蛋白从凝胶上转到NC膜上;使用5%的脱脂奶粉封闭缓冲液对NC膜进行封闭,然后转入5%的脱脂奶粉配制的一抗(1﹕5 000)4 ℃过夜孵育,二抗使用羊抗兔或羊抗鼠抗体(1﹕10 000);使用底色化学发光剂eECL(诺唯赞生物试剂公司)进行显色并利用ImageJ对图片进行分析。供试一抗CGMMV CP抗体为本实验室制备,GFP抗体购自abmart公司。
1.8 数据处理与分析
CGMMV侵染不同时期转录水平的统计分析使用单因素方差分析,然后用最小显著性差异(LSD)检验。VIGS和瞬时过表达后基因表达水平的统计分析使用T测验分析。数据用平均值±标准误表示。采用GraphPad Prism 8.0.2软件制作柱形图。
2 结果
2.1 NbERF RAP2-1同源进化树分析
通过MEGA 7.0构建系统进化树,对NbERF RAP2-1(Nbv5tr6241794.1)蛋白的氨基酸序列进行同源进化分析。由图1可知,NbERF RAP2-1与多种烟草中的ERF RAP蛋白分离物聚到一小支,同源性极高;与拟南芥中的ERF RAP转录因子亲缘关系较远。
2.2 NbERF RAP2-1亚细胞定位
利用共聚焦显微镜观察NbERF RAP2-1-GFP亚细胞定位情况,NbERF RAP2-1-GFP与细胞核marker蛋白H2B-RFP共定位于细胞核中,而对照蛋白GFP定位于细胞质和细胞核中,推测NbERF RAP2-1作为转录因子其主要在细胞核中调节下游基因的转录参与病毒侵染(图2)。
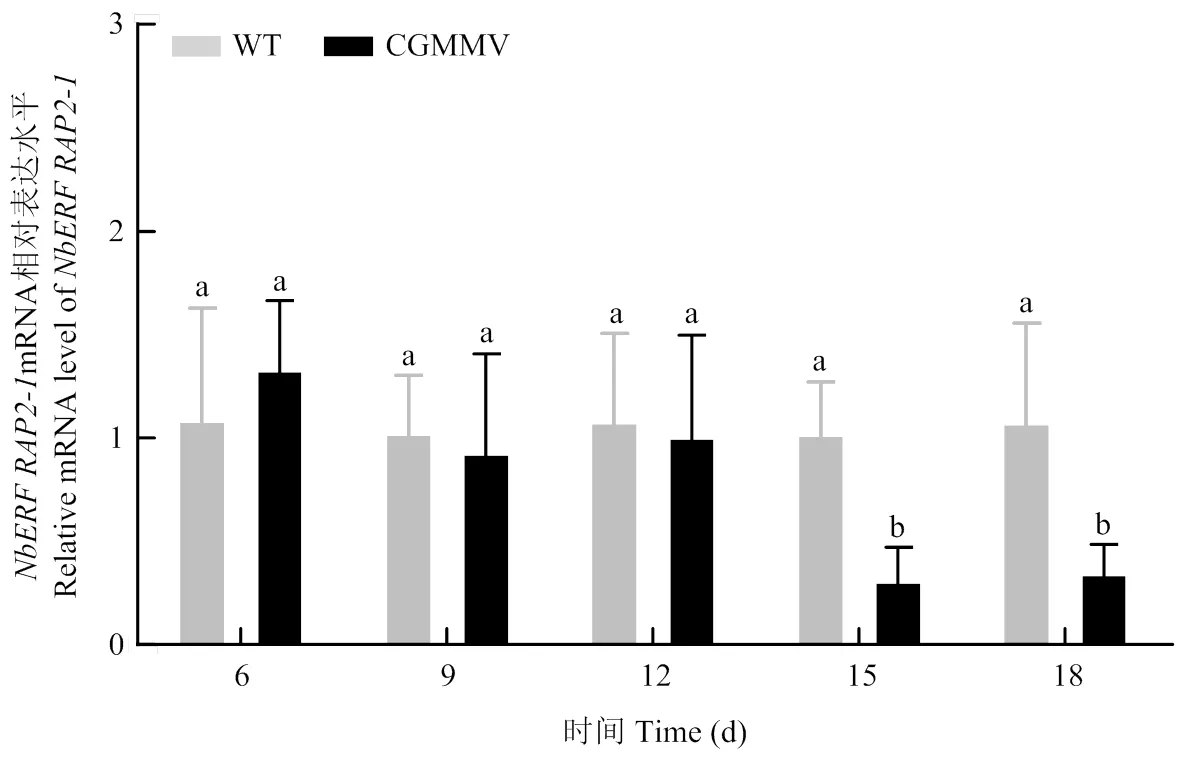
2.3 CGMMV侵染对NbERF RAP2-1转录水平的影响
利用qRT-PCR方法,在CGMMV侵染的情况下检测的表达情况。由于CGMMV侵染后6 d出现症状,在CGMMV侵染后6、9、12、15、18 d使用直径1 cm的取样器分别在CGMMV侵染系统叶与WT植株对应叶位采集样品,检测CGMMV侵染前期、中期和后期,植物内源的表达情况。qRT-PCR结果显示,在CGMMV接种6、9、12 d时的表达量与WT植株相比无明显变化,15、18 d时表达量显著下调。结果表明,CGMMV侵染后期抑制的转录表达(图3)。

图1 基于氨基酸序列的NbERF RAP2-1进化树分析

图2 NbERF RAP2-1和GFP的亚细胞定位
2.4 NbERF RAP2-1沉默后抑制了CGMMV的侵染
上述结果表明CGMMV侵染后期显著抑制了的转录水平,为进一步明确NbERF RAP2-1是否在CGMMV侵染过程中起一定作用,利用TRV介导的VIGS系统将植物内源沉默。将含有沉默片段的TRV-RNA2-载体的农杆菌与TRV-RNA1共注射到本氏烟叶片中进行基因沉默,标记为TRV:;对照植物用空载的TRV-RNA2和TRV-RNA1进行共注射,标记为TRV: 00。qRT-PCR结果显示在沉默后10 d TRV:植株没有表型变化(图4-A)。检测的沉默效率发现TRV:中的转录水平是对照植株的65%(图4-B),说明植物内源被有效沉默。
在沉默10 d的植株上摩擦接种CGMMV。接种8 d后对照植株TRV: 00系统叶片出现卷曲症状,而TRV:未观察到卷曲症状(图4-A)。使用直径1 cm的取样器,在TRV:发病的系统叶以及TRV: 00对应的叶位采集样品,分别提取RNA和蛋白,利用qRT-PCR和Western blot分别检测CGMMV RNA水平及蛋白水平的积累情况,结果显示与对照相比,沉默植株上的CGMMV积累量无论是RNA水平(图4-C)还是蛋白水平(图4-D)均显著降低。说明沉默后有效抑制了CGMMV的侵染。
柱上标有不同字母表示差异显著(P<0.05)Different letters on the bars represent significantly different at 0.05 level

A:TRV: NbERF RAP2-1和TRV: 00在CGMMV侵染后的生物学表型Biological phenotypes of TRV: NbERF RAP2-1 and TRV: 00 after infection with CGMMV;B:VIGS NbERF RAP2-1的沉默效率Silencing efficiency of VIGS NbERF RAP2-1;C:TRV: NbERF RAP2-1对CGMMV CP转录水平的影响 Effect of TRV: NbERF RAP2-1 on the transcription level of CGMMV CP;D:TRV: NbERF RAP2-1对CGMMV CP蛋白水平的影响 Effect of TRV: NbERF RAP2-1 on the protein level of CGMMV CP
2.5 NbERF RAP2-1瞬时过表达抑制CGMMV侵染
上述结果表明被有效沉默后,CGMMV在本氏烟中的侵染显著被抑制,那么当NbERF RAP2-1的表达显著增强后是否影响CGMMV的侵染?首先在本氏烟7—8叶位摩擦接种CGMMV,1 h后在同一叶位的两侧过表达NbERF RAP2-1-GFP及对照GFP。在病毒接种24、48和72 h时使用荧光显微镜观察NbERF RAP2-1-GFP及对照GFP,发现有绿色荧光表达,同时在CGMMV侵染24、48和72 h的摩接叶上使用直径1 cm的打孔器分别取GFP对照和NbERF RAP2-1-GFP浸润叶片,提蛋白利用Western blot检测发现24 h时NbERF RAP2-1-GFP与GFP已经表达(图5-A),通过荧光显微镜可以观察到NbERF RAP2-1在24、48和72 h时均有荧光表达;Western blot检测24、48和72 h时CGMMV CP蛋白表达量,发现NbERF RAP2-1过表达可导致CGMMV CP蛋白积累量显著抑制(图5-B);通过ImageJ分析CGMMV CP蛋白相对表达水平,也证明了NbERF RAP2-1瞬时过表达显著抑制了CGMMV的侵染(图5-C);使用qRT-PCR检测CGMMV的mRNA相对表达量(图5-D),显示NbERF RAP2-1过表达后抑制CGMMV的复制。说明NbERF RAP2-1过表达后在病毒侵染早期,即复制阶段就抑制了CGMMV的侵染。
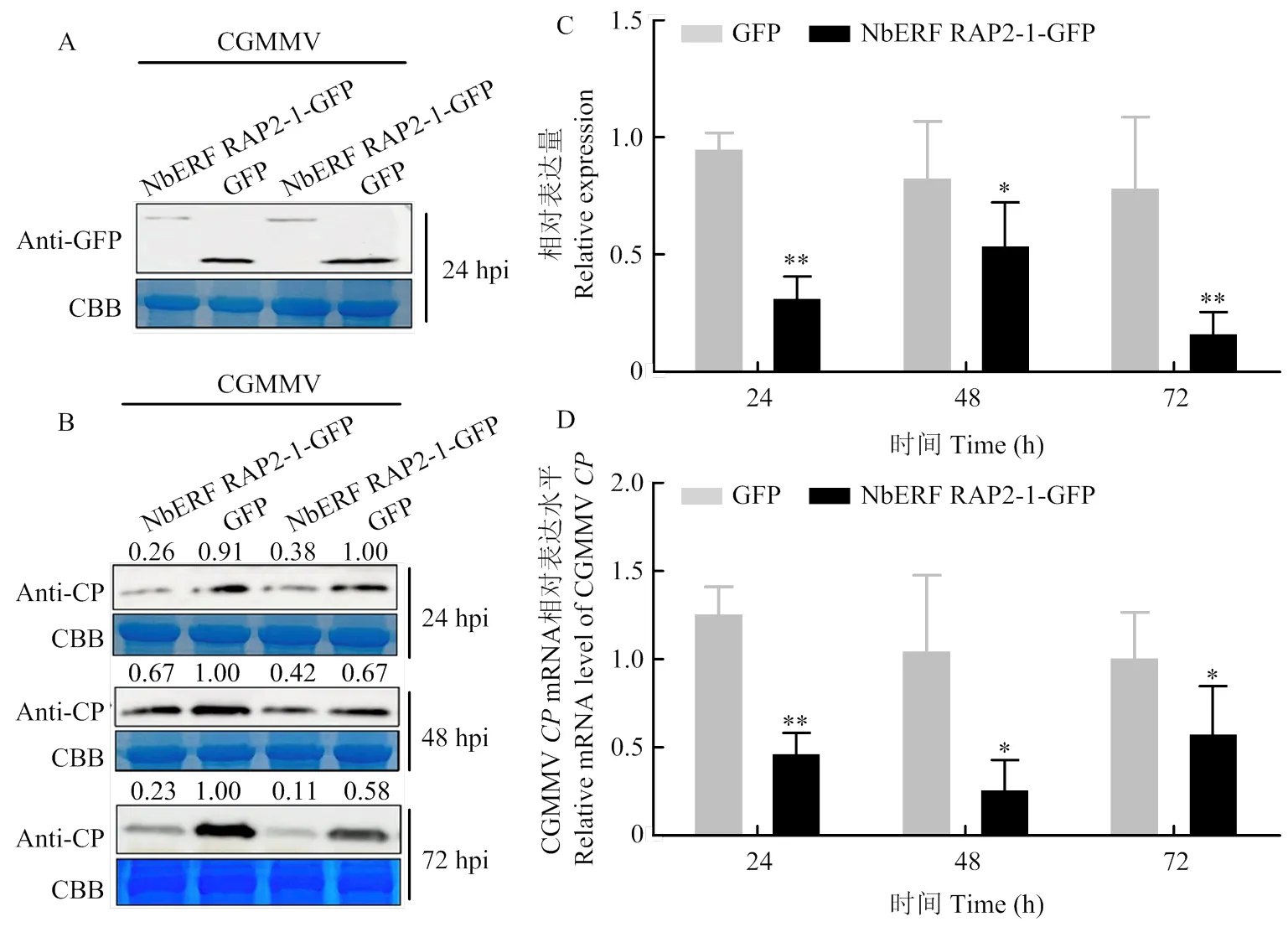
A:NbERF RAP2-1-GFP 24 h时Western blot表达验证Verification of NbERF RAP2-1-GFP expression at 24 h by Western blot;B:NbERF RAP2-1瞬时过表达对CGMMV CP蛋白水平的影响 Effects of transient overexpression of NbERF RAP2-1 on the protein level of CGMMV CP;C:24、48、72 h摩接叶CGMMV CP蛋白相对表达强度分析Analysis of the relative expression of CGMMV CP protein in inoculated leaves at 24, 48 and 72 h;D:NbERF RAP2-1瞬时过表达对CGMMV CP转录水平的影响Effect of transient overexpression of NbERF RAP2-1 on the transcription level of CGMMV CP
3 讨论
3.1 NbERF RAP2-1作为转录因子调控病毒侵染
黄瓜绿斑驳花叶病毒(CGMMV)是我国重要的检疫性病毒,近年来在北美[1]和澳大利亚[23]发现CGMMV能够侵染西瓜,2005年以来,我国多个地区均检测到CGMMV的发生,给瓜类和蔬菜产业造成严重的经济损失。前期通过CGMMV侵染本氏烟的RNA-Seq数据筛选到乙烯相关的转录因子NbERF RAP2-1。本研究检测了CGMMV侵染不同时期内源转录水平,检测结果与RNA-Seq结果一致,在CGMMV侵染后期可以有效抑制的转录(图3)。这与之前的报道有所不同,在之前的报道中环境中的生物和非生物胁迫都可以诱导植物中ERF的转录[24-26],例如大丽轮枝菌()分泌的效应子PevD1和丁香假单胞菌(pv.DC3000)可诱导拟南芥中的ERF114转录上调[27]。但本研究中在CGMMV侵染后期会抑制的转录,推测NbERF RAP2-1具有一定的抗病作用,CGMMV在其侵染后期识别后抑制其转录表达。通过氨基酸序列分析发现NbERF RAP2-1仅含有一个AP2结构域,属于ERF转录因子亚家族。利用其氨基酸序列进行系统发育树比对,表明NbERF RAP2-1与多种烟草的ERF RAP具有高度相似性(图1),同时通过亚细胞定位显示NbERF RAP2-1定位于细胞核(图2),推测NbERF RAP2-1作为ERF家族转录因子成员行使功能。
3.2 NbERF RAP2-1在CGMMV侵染中的作用
在沉默的本氏烟植株中,CGMMV侵染的第8天其病毒积累量显著降低(图4)。而NbERF RAP2-1过表达后也会显著抑制CGMMV的积累,并且在病毒侵染初期,24 h时就可检测到CGMMV积累量降低(图5)。推测在CGMMV侵染初期,即病毒RNA复制阶段,NbERF RAP2-1可以有效抑制病毒复制;但随着CGMMV不断侵染,在CGMMV细胞间运动和长距离运动时期,CGMMV识别防御相关基因并抑制该基因的转录。而当植物中缺失后,不能在CGMMV侵染前期有效抑制CGMMV的复制,但是缺失可能抑制了下游蛋白的转录或表达,从而抑制了病毒系统运动,继而抑制病毒的侵染。这与之前报道的本氏烟中的高迁移率核蛋白(high mobility group nucleoprotein,NbHMG1/2a)类似,核蛋白NbHMG1/2a无论过表达或者沉默对竹子花叶病毒(bamboo mosaic virus,BaMV)系统运动的影响一致[28]。
3.3 NbERF RAP2-1可能参与植物免疫过程调节CGMMV侵染
ERF蛋白作为转录因子,其APs结构域具有DNA结合活性,与下游基因的GCC盒特异性结合,从而调控下游基因的表达,参与植物对生物胁迫和非生物胁迫的响应。例如,ERF68可以通过与防御相关基因的GCC盒直接结合来调节番茄和烟叶对病原体的抗病性[29];拟南芥的ERF96通过与启动子中的GCC基序结合,增加了JA/ET防御相关基因的转录水平,从而增强了对坏死性营养病原体的抵抗力[30];DEMAX可以与PDF2.1启动子中的GCC盒元件结合并增加了拟南芥和亚麻荠对灰葡萄孢()的抗性[31]。另外,ERF也可以和其他蛋白互作参与植物对生物胁迫和非生物胁迫的响应。DONG等[32]研究表明,ERF可以通过与其他蛋白相互作用在植物免疫活动中发挥重要作用。苹果的MdERF10和MdHLH92相互作用从而提高对白粉病的抗性[33];拟南芥的AtERF72被发现与ACBP相互作用来调节防御[34],并可以通过与TGA4相互作用来直接增强抗病性[35];AtERF72被证明与ORA59相互作用以增强对胡萝卜乳杆菌的抗病性[36]。但是关于NbERF RAP2-1在CGMMV侵染过程中如何调控下游基因转录或者蛋白表达仍需进一步研究。推测NbERF RAP2-1参与植物免疫过程,主要调控下游基因的转录或下游互作蛋白的表达来参与植物抗病毒过程。
4 结论
NbERF RAP2-1作为ERF家族转录因子在细胞核中行使功能,其在CGMMV侵染后期表达量显著下调;沉默和瞬时过表达均抑制CGMMV的积累。推测NbERF RAP2-1可以有效抑制CGMMV侵染初期病毒RNA的复制;随着CGMMV不断侵染,CGMMV识别防御相关基因并抑制该基因的转录;当缺失后可能抑制了下游蛋白的转录或表达,从而抑制了病毒侵染后期的积累。由此可见,NbERF RAP2-1在CGMMV侵染过程中发挥了重要作用。
[1] LING K S, LI R, ZHANG W. First report of cucumber green mottle mosaic virus infecting greenhouse cucumber in Canada. Plant Disease, 2014, 98(5): 701.
[2] DOMBROVSKY A, TRAN-NGUYEN L T T, JONES R A C. Cucumber green mottle mosaic virus: Rapidly increasing global distribution, etiology, epidemiology, and management. Annual Review of Phytopathology, 2017, 55: 231-256.
[3] 周红珍, 张志勇, 彭辉. 黄瓜绿斑驳花叶病毒病的发生症状及防控措施. 现代农业科技, 2013(18): 138, 140.
ZHOU H Z, ZHANG Z Y, PENG H. Occurrence symptoms and control measures of cucumber green mottle mosaic virus disease. Modern Agricultural Science and Technology, 2013(18): 138, 140. (in Chinese)
[4] 林燚, 杨瑜斌, 王驰, 王文华, 毛玲荣. 温台地区西瓜发生黄瓜绿斑驳花叶病毒病调查初报. 浙江农业科学, 2012(1): 83-85.
LIN Y, YANG Y B, WANG C, WANG W H, MAO L R. Investigation of cucumber green mottle mosaic virus disease on watermelon in Wentai region. Journal of Zhejiang Agricultural Sciences, 2012(1): 83-85. (in Chinese)
[5] 陈红运, 赵文军, 程毅, 李明福, 朱水芳. 辽中地区西瓜花叶病病原的分子鉴定. 植物病理学报, 2006, 36(4): 306-309.
CHEN H Y, ZHAO W J, CHENG Y, LI M F, ZHU S F. Molecular identification of the virus causing watermelon mosaic disease in Mid-Liaoning. Acta Phytopathologica Sinica, 2006, 36(4): 306-309. (in Chinese)
[6] 程兆榜, 任春梅, 缪倩, 王锋, 张重阳, 周益军, 范永坚. 江苏黄瓜绿斑驳花叶病毒的发生和防治. 江苏农业科学, 2013, 41(2): 114-117.
CHENG Z B, REN C M, MIAO Q, WANG F, ZHANG C Y, ZHOU Y J, FAN Y J. Occurrence and control of cucumber green mottle mosaic virus in Jiangsu. Jiangsu Agricultural Sciences, 2013, 41(2): 114-117. (in Chinese)
[7] 李小妮, 任小平, 王琳, 王明强, 周国辉. 广东省黄瓜绿斑驳花叶病毒分子检测及防疫. 植物保护学报, 2009, 36(3): 283-284.
LI X N, REN X P, WANG L, WANG M Q, ZHOU G H. Molecular detection and epidemic prevention of cucumber green mottle mosaic virus in Guangdong, China. Acta Phytopathologica Sinica, 2009, 36(3): 283-284. (in Chinese)
[8] 田永蕾, 刘冬梅, 张永江, 李明福, 马占鸿. 黄瓜绿斑驳花叶病毒北京和山东分离物的生物学测定及其基因组比较. 植物检疫, 2009, 23(6): 1-6.
TIAN Y L, LIU D M, ZHANG Y J, LI M F, MA Z H. Bioassay and genomic studies on the two isolates of cucumber green mottle mosaic virus from Beijing and Shandong. Plant Quarantine, 2009, 23(6): 1-6. (in Chinese)
[9] 赵慧茹, 林振亚, 朱俊子, 张亚东, 高必达. 湖南首次检测到黄瓜绿斑驳花叶病毒. 植物病理学报, 2013, 43(2): 219-221.
ZHAO H R, LIN Z Y, ZHU J Z, ZHANG Y D, GAO B D. First report of cucumber green mottle mosaic virus (CGMMV) in Hunan Province. Acta Phytopathologica Sinica, 2013, 43(2): 219-221. (in Chinese)
[10] UGAKI M, TOMIYAMA M, KAKUTANI T, HIDAKA S, KIGUCHI T, NAGATA R, SATO T, MOTOYOSHI F, NISHIGUCHI M. The complete nucleotide sequence of cucumber green mottle mosaic virus (SH strain) genomic RNA. Journal of General Virology, 1991, 72(7): 1487-1495.
[11] 李俊香, 古勤生. 黄瓜绿斑驳花叶病毒传播方式的研究进展. 中国蔬菜, 2015(1): 13-18.
LI J X, GU Q S. Research progress on the transmission mode of cucumber green mottle mosaic virus. China Vegetables, 2015(1): 13-18. (in Chinese)
[12] YANG L L, LI Q L, HAN X Y, JIANG X L, WANG H, SHI Y J, CHEN L L, LI H L, LIU Y Q, YANG X, SHI Y. A cysteine-rich secretory protein involves in phytohormone melatonin mediated plant resistance to CGMMV. BMC Plant Biology, 2023, 23(1): 215.
[13] NAKANO T, SUZUKI K, FUJIMURA T, SHINSHI H. Genome-wide analysis of the ERF gene family inand rice. Plant Physiology, 2006, 140(2): 411-432.
[14] RIECHMANN J L, HEARD J, MARTIN G, REUBER L, JIANG C, KEDDIE J, ADAM L, PINEDA O, RATCLIFFE O J, SAMAHA R R,.transcription factors: genome-wide comparative analysis among eukaryotes. Science, 2000, 290(5499): 2105-2110.
[15] MIZOI J, SHINOZAKI K, YAMAGUCHI-SHINOZAKI K. AP2/ERF family transcription factors in plant abiotic stress responses. Biochimica et Biophysica Acta, 2012, 1819(2): 86-96.
[16] ZHU Y, ZHANG X, ZHANG Q, CHAI S, YIN W, GAO M, LI Z, WANG X. The transcription factors VaERF16 and VaMYB306 interact to enhance resistance of grapevine toinfection. Molecular Plant Pathology, 2022, 23(10): 1415-1432.
[17] LI Y, LIU K, TONG G, XI C, LIU J, ZHAO H, WANG Y, REN D, HAN S. MPK3/MPK6-mediated phosphorylation of ERF72 positively regulates resistance tothrough directly and indirectly activating the transcription of camalexin biosynthesis enzymes. Journal of Experimental Botany, 2022, 73(1): 413-428.
[18] YANG H, SUN Y, WANG H, ZHAO T, XU X, JIANG J, LI J. Genome-wide identification and functional analysis of the ERF2 gene family in response to disease resistance againstin tomato. BMC Plant Biology, 2021, 21(1): 72.
[19] HONG Y, WANG H, GAO Y, BI Y, XIONG X, YAN Y, WANG J, LI D, SONG F. ERF transcription factor OsBIERF3 positively contributes to immunity against fungal and bacterial diseases but negatively regulates cold tolerance in rice. International Journal of Molecular Sciences, 2022, 23(2): 606.
[20] LIU D, CHEN X, LIU J, YE J, GUO Z. The rice ERF transcription factor OsERF922 negatively regulates resistance toand salt tolerance. Journal of Experimental Botany, 2012, 63(10): 3899-3911.
[21] HUANG Y, ZHANG B L, SUN S, XING G M, WANG F, LI M Y, TIAN Y S, XIONG A S. AP2/ERF transcription factors involved in response to tomato yellow leaf curly virus in tomato. The Plant Genome, 2016, 9(2). doi: 10.3835/plantgenome2015.09.0082.
[22] ZHANG G, CHEN M, LI L, XU Z, CHEN X, GUO J, MA Y. Overexpression of the soybean GmERF3 gene, an AP2/ERF type transcription factor for increased tolerances to salt, drought, and diseases in transgenic tobacco. Journal of Experimental Botany, 2009, 60(13): 3781-3796.
[23] TESORIERO L A, CHAMBERS G, SRIVASTAVA M, SMITH S, CONDE B, TRAN-NGUYEN L T T. First report of cucumber green mottle mosaic virus in Australia. Australasian Plant Disease Notes, 2016, 11: 1.
[24] THIRUGNANASAMBANTHAM K, DURAIRAJ S, SARAVANAN S, KARIKALAN K, MURALIDARAN S, ISLAM V I H. Role of ethylene response transcription factor (ERF) and its regulation in response to stress encountered by plants. Plant Molecular Biology Reporter, 2015, 33(3): 347-357.
[25] YANG R, LIU J, LIN Z, SUN W, WU Z, HU H, ZHANG Y. ERF transcription factors involved in salt response in tomato. Plant Growth Regulation, 2018, 84: 573-582.
[26] PHUKAN U J, JEENA G S, TRIPATHI V, SHUKLA R K. MaRAP2-4, a waterlogging-responsive ERF from, regulates bidirectional sugar transporter AtSWEET10 to modulate stress response in. Plant Biotechnology Journal, 2018, 16(1): 221-233.
[27] LI Z, ZHANG Y, REN J, JIA F, ZENG H, LI G, YANG X. Ethylene-responsive factor ERF114 mediates fungal pathogen effector PevD1-induced disease resistance in. Molecular Plant Pathology, 2022, 23(6): 819-831.
[28] ALAZEM M, HE M H, CHANG C H, CHENG N, LIN N S. Disrupting the homeostasis of high mobility group protein promotes the systemic movement of bamboo mosaic virus. Frontiers in Plant Science, 2020, 11: 597665.
[29] LIU A C, CHENG C P. Pathogen-induced ERF68 regulates hypersensitive cell death in tomato. Molecular Plant Pathology, 2017, 18(8): 1062-1074.
[30] CATINOT J, HUANG J B, HUANG P Y, TSENG M Y, CHEN Y L, GU S Y, LO W S, WANG L C, CHEN Y R, ZIMMERLI L. ETHYLENE RESPONSE FACTOR 96 positively regulatesresistance to necrotrophic pathogens by direct binding to GCC elements of jasmonate- and ethylene-responsive defence genes. Plant, Cell and Environment, 2015, 38(12): 2721-2734.
[31] JU S, GO Y S, CHOI H J, PARK J M, SUH M C. DEWAX transcription factor is involved in resistance toinand. Frontiers in Plant Science, 2017, 8: 1210.
[32] DONG L, CHENG Y, WU J, CHENG Q, LI W, FAN S, JIANG L, XU Z, KONG F, ZHANG D, XU P, ZHANG S. Overexpression of GmERF5, a new member of the soybean EAR motif-containing ERF transcription factor, enhances resistance toin soybean. Journal of Experimental Botany, 2015, 66(9): 2635-2647.
[33] ZHANG Y, ZHANG L, MA H, ZHANG Y, ZHANG X, JI M, VAN NOCKER S, AHMAD B, ZHAO Z, WANG X, GAO H. Overexpression of the apple (×) MdERF100 inincreases resistance to powdery mildew. International Journal of Molecular Sciences, 2021, 22(11): 5713.
[34] LI H Y, XIAO S, CHYE M L. Ethylene- and pathogen-inducibleacyl-CoA-binding protein 4 interacts with an ethylene- responsive element binding protein. Journal of Experimental Botany, 2008, 59(14): 3997-4006.
[35] BüTTNER M, SINGH K B.ethylene-responsive element binding protein (AtEBP), an ethylene-inducible, GCC box DNA-binding protein interacts with an ocs element binding protein. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(11): 5961-5966.
[36] KIM N Y, JANG Y J, PARK O K. AP2/ERF family transcription factors ORA59 and RAP2.3 interact in the nucleus and function together in ethylene responses. Frontiers in Plant Science, 2018, 9: 1675.
Function of Transcription Factor NbERF RAP2-1 in Cucumber Green Mottle Mosaic Virus Infection
YU LianWei1, JIANG XingLin1, YANG LingLing1, WANG He1, ZHANG YuYang1, XIE LiNa1, XIA ZiHao5, LI HongLian1,3,4, YANG Xue1,2, SHI Yan1
1College of Plant Protection, Henan Agricultural University, Zhengzhou 450002;2Crop science postdoctoral programme of Henan Agricultural University, Zhengzhou 450002;3Collaborative Innovation Centre of Henan Grain crops, Zhengzhou 450002;4State Key Laboratory of Wheat and Maize Crop Science, Zhengzhou 450002;5College of Plant Protection, Shenyang Agricultural University, Shenyang 110866
【Background】Cucumber green mottle mosaic virus (CGMMV) is an important quarantine plant virus in China, which has caused serious economic losses to vegetable and melon industry. The ERF transcription factor is involved in biotic and abiotic stress and the defense response against a variety of plant pathogens. In previous study, it was demonstrated that the host transcription factor NbERF RAP2-1 was significantly down-regulated after CGMMV infection.【Objective】Theobjective of this study is to clarify the function of the ERF transcription factor family members in CGMMV infection, and to provide a theoretical basis for disease control caused by CGMMV.【Method】MEGA7.0 was used to construct a phylogenetic tree to analyze the amino acid sequence of NbERF RAP2-1. The expression vector-GFP was constructed to observe the subcellular localization of. The transcript level ofat different stages of CGMMV infection was analyzed by qRT-PCR. VIGS and transient overexpression ofwere conducted to analyze the function ofduring CGMMV infection.【Result】Phylogenetic tree analysis showed that NbERF RAP2-1 was highly homologous to ERF transcription factors in tobacco, and was far from ERF transcription factors in. The results of subcellular localization showed that NbERF RAP2-1 was localized in the nucleus and acted as a transcription factor. The effect of CGMMV infection on the transcript level of theshowed that the expression level ofdid not significantly change at the 6, 9, and 12 d after inoculation, but at the 15 and 18 d after inoculation, the expression level of1 was significantly down-regulated. tobacco rattle virus (TRV) mediated VIGS was used to silence the, and CGMMV was inoculated in TRV:and TRV: 00 plants. At 8 d after inoculation, the leaves of TRV: 00 plants showed mottling and curling, while the TRV:plants showed no symptoms. At the same time, the detection results of CGMMV RNA and protein levels showed that TRV:could effectively inhibit the accumulation of CGMMV. Similarly, transient overexpression of NbERF RAP2-1 inhibited the accumulation of CGMMV at 24, 48, and 72 h, respectively.【Conclusion】effectively inhibit the initial CGMMV replication, i.e. the viral RNA replication stage. With the invasion of CGMMV, i.e. the intercellular and systemic movements of CGMMV, CGMMV recognizes and inhibits the transcript level of. Whenis knocked down, that may inhibit the transcription of downstream proteins, thereby inhibiting the accumulation of CGMMV at a later stage.plays an important role during the CGMMV infection.
cucumber green mottle mosaic virus (CGMMV);; pathogenic mechanism

10.3864/j.issn.0578-1752.2023.15.007
2023-05-11;
2023-06-10
国家自然科学基金(3210170372)、河南省青年人才托举工程项目(2022HYTP037)、河南农业大学科技创新项目(KJCX2021A13)、河南省重点研发与推广专项(222102110059)
于连伟,E-mail:ylwnet972@163.com。通信作者杨雪,E-mail:yangxuepphappy@126.com。通信作者施艳,E-mail:shiyan00925@126.com
(责任编辑 岳梅)
