JAK/STAT通路介导免疫缺陷大鼠CD4+T细胞分化的研究
2023-08-14谢小丽,张予晋,谭瑶,邓玉霞,卜佑青,钱珍珍,巴玉琛,王军文
谢小丽,张予晋,谭瑶,邓玉霞,卜佑青,钱珍珍,巴玉琛,王军文
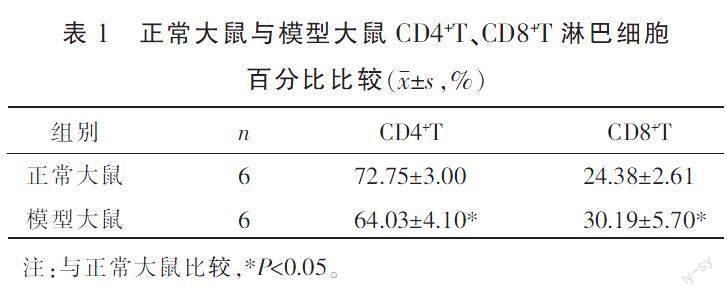
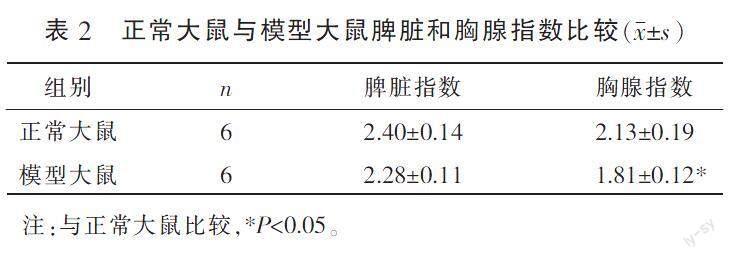





〔摘要〕 目的 基于酪氨酸激酶/信號传导及转录激活蛋白(Janus kinase/signal transducer and activator of transcription, JAK/STAT)信号通路与免疫缺陷性疾病中CD4+T细胞占比减少的相关性,探讨免疫缺陷大鼠CD4+T淋巴细胞分化的机制。方法 将SPF级SD大鼠48只,随机分为正常大鼠(24只)和模型大鼠(24只),采用环孢素制备免疫缺陷模型。每组随机选6只验证造模效果,将剩余36只大鼠分为正常组、低鲁组、高鲁组、模型组、模型低鲁组、模型高鲁组,每组6只。低鲁组和模型低鲁组分别注射1.75 mg·kg-1鲁索利替尼,高鲁组和模型高鲁组分别注射3.5 mg·kg-1鲁索利替尼,正常组和模型组注射1.75 mg·kg-1生理盐水,隔日1次,共注射6次。采用流式细胞术检测CD4+T和CD8+T淋巴细胞百分比,计算大鼠脾脏和胸腺指数,HE染色法观察脾脏和胸腺病理改变,ELISA检测白细胞介素-2(interleukin-2, IL-2)、γ-干扰素(interferon-γ, IFN-γ)、白细胞介素-12(interleukin-12, IL-12)、白细胞介素-4(interleukin-4, IL-4)、白细胞介素-6(interleukin-6, IL-6)、白细胞介素-10(interleukin-10, IL-10)细胞因子表达量,Western blot检测脾脏组织中酪氨酸激酶2(Janus kinase 2, JAK2)、T盒家族转录因子表达蛋白(T-box family transcription factor expression protein, T-bet)、信号传导及转录激活蛋白4(signal transducer and activator of transcription 4, STAT4)、信号传导及转录激活蛋白6(signal transducer and activator of transcription 6, STAT6)和GATA结合蛋白-3(GATA-binding protein-3, GATA3)蛋白表达量。结果 模型组大鼠CD4+T淋巴细胞百分比、胸腺指数较正常组明显下降(P<0.05)。与正常组比较,模型组CD4+T淋巴细胞百分比减少(P<0.05),IL-2、IFN-γ和IL-12表达量下降(P<0.01),IL-10表达量升高(P<0.05);与模型组相比,模型高鲁组CD4+T淋巴细胞百分比、胸腺和脾脏指数、IL-2、IFN-γ显著下降(P<0.05),而GATA3、STAT6蛋白表达量升高(P<0.05),IL-6、IL-10表达量明显增加(P<0.05,P<0.01)。结论 免疫缺陷疾病以CD4+T淋巴细胞减少为主要特征,CD4+T细胞亚群失调与JAK/STAT信号通路表达失衡有关,其机制可能与IL-12/STAT4通路表达下调和IL-4/STAT6通路表达上调有关,CD4+T淋巴细胞分化由辅助性T细胞1(helper T cell 1, Th1)向辅助性T细胞2(helper T cell 2, Th2)漂移,造成Th1/Th2失衡,引发免疫缺陷。
〔关键词〕 免疫缺陷;JAK/STAT信号通路;Th1/Th2;白细胞介素-12;白细胞介素-4;信号传导及转录激活蛋白4;信号传导及转录激活蛋白6
〔中图分类号〕R275 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.07.009
JAK/STAT pathway-mediated CD4+T cell differentiation
in immunodeficient rats
XIE Xiaoli1, ZHANG Yujin2, TAN Yao3, DENG Yuxia3, BU Youqing3, QIAN Zhenzhen3,
BA Yuchen3, WANG Junwen2,3*
1. Hunan Provincial Hospital of Integrated Chinese and Western Medicine, Changsha, Hunan 410006, China;
2. The Second Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410005, China;
3. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To explore the mechanism of CD4+T lymphocyte differentiation in immunodeficient rats based on the correlation between Janus kinase/signal transducer and activator of transcription (JAK/STAT) signaling pathway and a low percentage of CD4+T lymphocytes in immunodeficiency diseases. Methods A total of 48 SPF SD rats were randomly divided into normal group (n=24) and modeling group (n=24), and the immunodeficiency models were established using cyclosporine. Then 6 rats were randomly selected from each group to verify the modeling effects. After modeling, the remaining 18 normal rats were subdivided into normal group, low-, and high-dose ruxolitinib groups, while the remaining 18 model rats into model group, low- and high-dose ruxolitinib model groups, with 6 rats in each group. Low-dose ruxolitinib group and low-dose ruxolitinib model group were injected with 1.75 mg·kg-1 ruxolitinib, high-dose ruxolitinib group and high-dose ruxolitinib model group were injected with 3.5 mg·kg-1 ruxolitinib, while normal group and model group were injected with 1.75 mg·kg-1 normal saline, once every other day, with a total of 6 injections in each group. Then, the percentage of CD4+T and CD8+T lymphocytes was determined by flow cytometry; the spleen and thymus indexes of rats were calculated; the pathological changes of the spleen and thymus were observed by HE staining; the expression levels of interleukin-2 (IL-2), interferon-γ (IFN-γ), interleukin-12 (IL-12), interleukin-4 (IL-4), interleukin-6 (IL-6), and interleukin-10 (IL-10) were examined by ELISA; Western blot was used to check the expression levels of Janus kinase 2 (JAK2), T-box family transcription factor expression protein (T-bet), signal transducer and activator of transcription 4 (STAT4), signal transducer and activator of transcription 6 (STAT6), and GA TA-binding protein-3 (GATA3) in the spleen. Results The percentage of CD4+T lymphocytes and the thymus index in model group were significantly lower than those in normal group (P<0.05). Compared with normal group, the percentage of CD4+T lymphocytes in model group decreased (P<0.05), so did the expression levels of IL-2, IFN-γ, and IL-12 (P<0.01), but the expression level of IL-10 increased (P<0.05). Compared with model group, the percentage of CD4+T lymphocytes, the thymus and spleen indexes, and the expression levels of IL-2 and IFN-γ in high-dose ruxolitinib model group were significantly lower (P<0.05), while the expression levels of GATA3 and STAT6 proteins were higher (P<0.05) and those of IL-6 and IL-10 significantly increased (P<0.05, P<0.01). Conclusion Immunodeficiency diseases are broadly characterized by reduction in CD4+T lymphocytes, and the dysregulation of CD4+T cell subsets is related to the imbalance of JAK/STAT signaling pathway expression, with the possible mechanism of down-regulation of IL-12/STAT4 pathway expression and up-regulation of IL-4/STAT6 pathway expression. In addition, CD4+T lymphocyte differentiation drifts from helper T cell 1 (Th1) to helper T cell 2 (Th2), thus resulting in Th1/Th2 imbalance, which induces immunodeficiency.
〔Keywords〕 immunodeficiency; Janus kinase/signal transducer and activator of transcription signaling pathway; helper T cell 1/helper T cell 2; interleukin-12; interleukin-4; signal transducer and activator of transcription 4; signal transducer and activator of transcription 6
人體感染人类免疫缺陷病毒(human immunode?鄄ficiency virus, HIV)后通常会发生免疫系统功能缺陷,HIV主要损害的靶细胞为CD4+T淋巴细胞,可能会导致CD4+T淋巴细胞的各项功能受到限制。CD4+T淋巴细胞计数是评价机体免疫状态和治疗效果的重要免疫学指标之一[1]。CD4+T淋巴细胞是影响机体健康和疾病的关键调节因子[2]。研究表明[3-5],HIV引起的免疫异常有CD4+T淋巴细胞数量减少、CD4+T淋巴细胞功能障碍和异常免疫激活。CD4+T淋巴细胞被激活后,在不同的分化途径中具有不同的生物学功能。CD4+T细胞主要分为辅助性T细胞1(helper T cell 1, Th1)和辅助性T细胞2(helper T cell 2, Th2)细胞亚群,Th1细胞产生白细胞介素-12(interleukin-12, IL-12)、γ-干扰素(interferon-γ, IFN-γ)、白细胞介素-2(interleukin-2, IL-2)等细胞因子介导细胞免疫[6-7];而Th2细胞产生白细胞介素-4(interleukin-4, IL-4)、白细胞介素-5(interleukin-5, IL-5)等细胞因子介导机体体液免疫。酪氨酸激酶/信号传导及转录激活蛋白(Janus kinase/signal transducer and activator of transcription, JAK/STAT)信号通路的持续激活与许多免疫性疾病、炎症和肿瘤等密切相关[8-10],不同STAT蛋白在参与细胞因子信号转导过程中具有高度特异性,信号传导及转录激活蛋白(signal transducer and activator of transcription, STAT)调控CD4+T细胞向Th1方向分化[11],转录因子信号传导及转录激活蛋白6(signal transducer and activator of transcription 6, STAT6)调控CD4+T细胞向Th2方向分化[12],转录因子信号传导及转录激活蛋白4(signal transducer and activator of transcription 4, STAT4)和STAT6介导细胞因子转录,都是通过JAK/STAT信号通路实现的。大量研究发现[13-15],JAK/STAT信号通路是由细胞因子刺激的信号转导通路,主要参与细胞的增殖、凋亡、分化及免疫调节等重要过程。
在艾滋病的研究中可以建立免疫缺陷动物模型开展相关研究[16]。环孢素对大鼠免疫抑制的作用,以CD4+T淋巴细胞占比减少为主要特征性表现,这与感染HIV引起的CD4+T淋巴细胞数量减少和免疫异常有高度相似性,较好地模拟了机体免疫缺陷状态,为该疾病的免疫相关研究提供了合适的动物模型[17-19]。本研究通过使用环孢素诱导大鼠免疫缺陷模型,模拟艾滋病的免疫缺陷状态,探讨JAK/STAT信号通路与免疫缺陷大鼠CD4+T淋巴细胞分化的相关性。
1 材料
1.1 实验动物
SPF级SD大鼠48只,雄雌各半,体质量120~150 g,购于湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2019-0004。所有动物均饲养在湖南中医药大学实验动物中心,实验单位使用许可证号:SYXK(湘)2019-0009,饲养条件:温度22~26 ℃,湿度50%~70%。本研究所涉及的动物实验经湖南中医药大学伦理委员会审查批准,批准号:LLBH-202103230003。
1.2 药物
环孢素(杭州中美华东制药有限公司,批号:H10960121)。鲁索利替尼(美国Good Laboratory Practice Bioglence公司,批号:GC37575)。
1.3 主要试剂
大鼠CD3抗体、大鼠CD8抗体、大鼠CD4抗体(杭州联科生物技术有限公司,批号分别为:70-AR00301-50、70-AR008A0205-50、70-AR00404-50);大鼠IFN-γ、IL-2、IL-4、白细胞介素-6(interleukin-6, IL-6)、白细胞介素-10(interleukin-10, IL-10)、白细胞介素-12(interleukin-12, IL-12)ELISA试剂盒(江苏晶美生物科技有限公司,批号分别为:JM-01605R、JM-01599R1、JM-01598R1、JM-01597R1、JM-01602R1、JM-01547R1);JAK2(英国Abcam公司,批号:ab108596);STAT6、STAT4、T盒家族转录因子表达蛋白(T-box family transcription factor expression protein, T-bet)、GATA结合蛋白-3(GA-TA-binding protein-3, GATA3)、β-actin(美国Proteintech公司,批号分别为:51073-1-AP、51070-2-AP、13700-1-AP、10417-1-AP、66009-1-Ig);乌来糖(上海源叶生物科技有限公司,批号:S11036);无水乙醇、二甲苯、氨水、中性树胶(上海医药集团股份有限公司,批号分别为:100092683、10023418、10002118、10004160);4%多聚甲醛(北京兰杰柯科技有限公司,批号:BL539A);二甲基亚砜(德国Biofroxx公司,批号:1084);蛋白酶抑制剂(北京金泰宏达生物科技有限公司,批号:583794);苏木精染液套装(武汉谷歌生物有限公司,批号:G1005);显影液、定影液(上海佳信照相用品有限公司,批号分别为:BW-61、BW-62);溶血素(苏州百源基因技术有限公司,批号:20220101);细胞染色缓冲液(美国Biolegend公司,批号:420201)。
1.4 主要仪器
水平低速离心机(美国Thermo公司,型号:75008800);流式细胞仪(美国BD公司,型号:LSRFortessa);脱水机、包埋机(武汉俊杰电子有限公司,型号:JJ-12J、JB-P5);病理切片机(上海徕卡仪器有限公司,型号:RM2016);组织摊片机(浙江省金华市科迪仪器有限公司,型号:KD-P);台式冷冻离心机(中国湖南湘仪实验室仪器开发有限公司,型号:H1650R);电泳仪、电泳槽、转膜仪(北京六一生物科技有限公司,型號:DYY-6C、DYCZ-24DN、DYCZ-40D);旋涡混合器(江苏海门其林贝尔仪器制造有限公司,型号:GL-88B);普通冰箱(奥克斯集团有限公司,型号:BCD-196A);精密pH计(无锡雷磁仪器仪表有限公司,型号:PHS-3C);电子天平(美国双杰,型号:JJ224BC);生物样品均质仪(杭州奥盛仪器有限公司,型号:BioPrep-24);化学发光成像系统(上海勤翔科学仪器有限公司,型号:ChemiScope6100);正置光学显微镜、成像系统[尼康映像仪器销售(中国)有限公司,型号:Nikon Eclipse E100、Nikon DS-U3]。
2 方法
2.1 分组与给药
SD大鼠48只,随机分为正常大鼠(24只)和模型大鼠(24只)。造模方法和给药剂量参照前期实验研究结果和参考文献[20-21],根据人与动物之间体表面积折算[22]而成,模型大鼠按照17.5 mg·kg-1的剂量腹腔注射环孢素,隔日1次,共注射3次。正常大鼠同步腹腔注射等量生理盐水。每天定期观察正常大鼠和模型大鼠的一般症状,在末次注射第2天随机选取正常大鼠与模型大鼠各6只,分别检测T淋巴细胞亚群百分比、脾脏和胸腺脏器指数,根据一般症状和相关指标检测判断免疫缺陷模型构建是否成功,当大鼠逐渐出现进食减少、反应迟缓、毛发松散、毛发无光泽等表现,T淋巴细胞亚群百分比下降时,提示免疫缺陷动物模型建立成功[20-21]。在成功建立免疫缺陷模型当天,将剩余18只正常大鼠和18只免疫缺陷大鼠分别重新分组,其中正常大鼠分为正常组、低鲁组、高鲁组,免疫缺陷大鼠分为模型组、模型低鲁组、模型高鲁组,每组6只。参照相关文献[23]和预实验结果,低鲁组和模型低鲁组按照1.75 mg·kg-1的剂量腹腔注射JAK抑制剂鲁索利替尼,高鲁组和模型高鲁组按照3.5 mg·kg-1的剂量腹腔注射JAK抑制剂鲁索利替尼,正常组和模型组同步腹腔注射1.75 mg·kg-1生理盐水,隔日1次,共注射6次。
2.2 标本采集与指标观察
每只大鼠称重后,用25%乌来糖腹腔注射麻醉,采集血液和胸腺、脾脏组织。
2.2.1 一般表现 造模过程中每天观察正常大鼠与模型大鼠的进食、饮水、精神状态、毛发表现等一般表现。
2.2.2 各组CD4+T、CD8+T淋巴细胞百分比测定 取对应数量流式管,在每管中加入CD3/CD4/CD8抗体各5 μL,然后加入对应编号的外周血100 μL,室温避光孵育15 min。加入100 μL溶血素,室温避光孵育10 min,然后加入1 mL去离子水,震荡混匀,室温避光孵育10 min。离心5 min,弃上清液,PBS洗涤细胞2~3次;加入500 μL细胞染色缓冲液,重悬细胞后上机检测。
2.2.3 脾脏和胸腺指数检测 脾脏和胸腺组织称重后分别计算脏器指数,计算公式为:脏器指数=脏器质量/体质量。
2.2.4 HE染色观察各组脾脏、胸腺组织学变化 用4%多聚甲醛固定胸腺、脾脏组织,经过石蜡包埋、切片、HE染色,显微镜下观测胸腺、脾脏组织变化。
2.2.5 ELISA检测大鼠血清IL-2、IFN-γ、IL-12、IL-4、IL-6、IL-10的表达 取出于-80 ℃保存的大鼠血清,按照ELISA试剂盒说明书进行操作,分别检测IL-2、IFN-γ、IL-12、IL-4、IL-6、IL-10水平。
2.2.6 Western blot检测脾脏组织中JAK2、T-bet、GATA3、STAT4、STAT6蛋白水平的表达 取大鼠脾脏组织,加入预冷含PBS的RIPA裂解液提取蛋白,取200 μL蛋白上清液,加50 μL 5×loading buffer混匀,沸水煮5 min,放入冰盒中速冷备用。根据蛋白定量的结果电泳,按照分子量分别切胶后转膜,封闭液封闭90 min。一抗孵育4 ℃过夜,第2天室温下放置30 min。4 ℃过夜后PBST洗3次,二抗孵育90 min后PBST洗3次,ECL显色、曝光、显影和观察。
2.3 统计学分析
采用 SPSS 25.0软件进行统计学分析,计量资料以“x±s”表示,两组间比较符合正态分布者用独立样本t检验,不符合正态分布者用秩和检验;多组间比较符合正态分布及方差齐性者选用单因素方差分析,若方差齐,组间两两比较采用LSD检验,方差不齐者采用Games-Howell检验,不满足正态分布者,采用非参数Kruskal wallis H检验。P<0.05表示差异有统计学意义。
3 结果
3.1 造模评价
3.1.1 一般表现 与正常大鼠相比,模型大鼠逐渐出现进食减少、反应迟缓、毛发松散、毛发无光泽等表现,初步判断免疫缺陷动物模型建立成功。
3.1.2 CD4+T、CD8+T淋巴细胞百分比 与正常大鼠比较,模型大鼠的CD4+T淋巴细胞百分比下降(P<0.05),CD8+T淋巴细胞百分比上升(P<0.05)。详见表1。
3.1.3 脾脏和胸腺指数 与正常大鼠比较,模型大鼠的胸腺指数下降(P<0.05),脾脏指数差异无统计学意义(P>0.05)。详见表2。
3.2 各组CD4+T、CD8+T淋巴细胞百分比比较
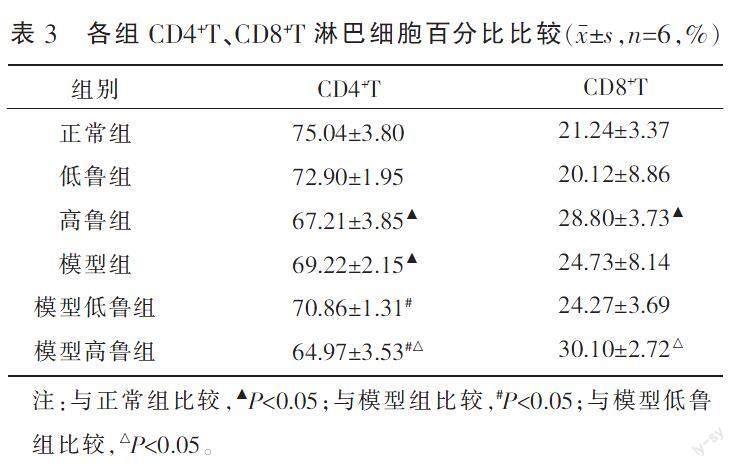
与正常组相比,高鲁组CD4+T淋巴细胞百分比下降(P<0.05),而CD8+T淋巴细胞百分比上升(P<0.05),模型组CD4+T淋巴细胞百分比下降(P<0.05);与模型组比较,模型低鲁组CD4+T淋巴细胞百分比上升(P<0.05),模型高鲁组CD4+T淋巴细胞比例下调(P<0.05);与模型低鲁组比较,模型高鲁组CD4+T百分比降低(P<0.05),CD8+T百分比升高(P<0.05)。详见表3、图1。
3.3 各组脾脏和胸腺指数比较
模型组胸腺指数比正常组下降(P<0.05);与模型组比较,模型高鲁组脾脏和胸腺指数均下降(P<0.05);与低鲁组比较,模型低鲁组胸腺指数明显下降(P<0.01);与高鲁组比较,模型高鲁组脾脏和胸腺指数均下降(P<0.05,P<0.01)。详见表4。
3.4 各组脾脏和胸腺病理形态学比较
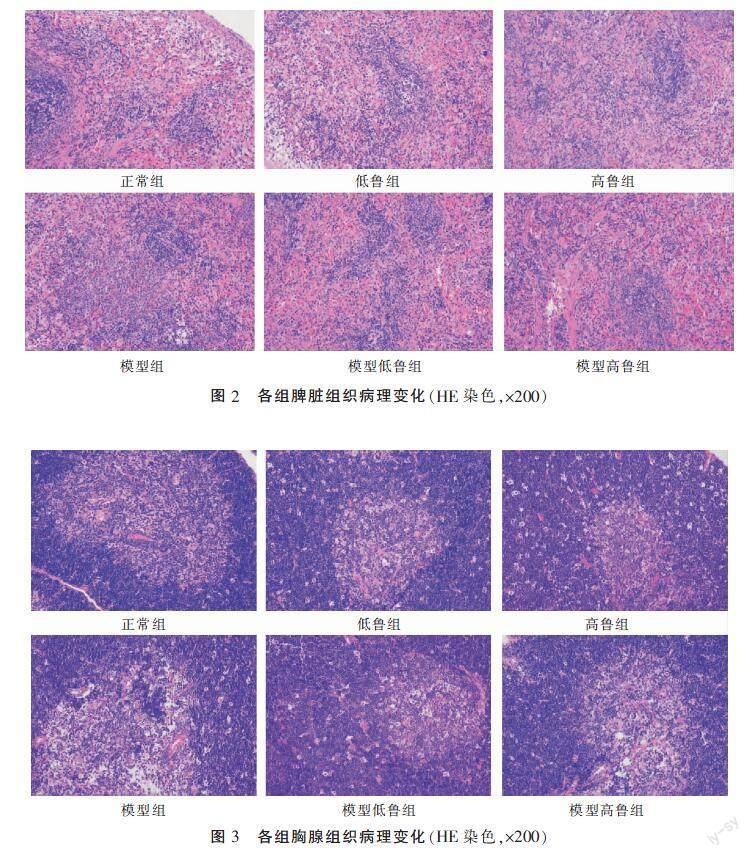
3.4.1 脾脏组织病理变化 正常组大鼠脾脏组织结构轮廓清晰,红髓和白髓界限明显,可见生发中心;与正常组比较,模型组、低鲁组、高鲁组红髓和白髓界限稍欠清晰;模型低鲁组结构稍欠清晰,部分脾小结结构紊乱,但红髓中性粒细胞未见明显增多;模型高鲁组脾脏组织结构重度异常,大量脾小结结构紊乱,红髓白髓边界不清,红髓中性粒细胞数量增多。详见图2。
3.4.2 胸腺组织病理变化 正常组大鼠胸腺组织结构正常,皮质和髓质结构清晰;模型组大鼠皮质和髓质结构界限不清,可见部分胸腺上皮细胞增生,髓质内见部分巨噬细胞浸润;低鲁组和高鲁组胸腺皮质较正常组增厚;模型低鲁组和模型高鲁组皮质和髓质结构界限不清,其中模型高鲁组皮质区大量胸腺上皮细胞增生,血管上皮细胞增生,血管壁增厚,髓质内见大量巨噬细胞浸润。详见图3。
3.5 各组血清IL-2、IFN-γ、IL-12、IL-4、IL-6、IL-10表达比较
与正常组比较,低鲁组IFN-γ表达下降(P<0.05),高鲁组、模型组IL-2、IFN-γ、IL-12表达均下降(P<0.05,P<0.01);与模型组比较,模型高鲁组IL-2、IFN-γ表达降低(P<0.05,P<0.01),IL-12也有下降趋势,但差异无统计学意义(P>0.05);与低鲁组比较,模型低鲁组IL-2、IFN-γ、IL-12表达下降(P<0.05,P<0.01);與高鲁组比较,模型高鲁组IL-2、IFN-γ、IL-12表达下降(P<0.05,P<0.01)。详见表5。
与正常组对比,低鲁组IL-10表达量增加(P<0.05),高鲁组中IL-6、IL-10表达量显著增加(P<0.05,P<0.01),模型组中IL-10表达量明显升高(P<0.01),其中IL-4、IL-6也有增加,但差异无统计学意义(P>0.05);与模型组比较,模型低鲁组IL-10表达量显著上升(P<0.01),模型高鲁组IL-6、IL-10表达量明显增加(P<0.05,P<0.01),其中IL-4也呈上升趋势,但差异无统计学意义(P>0.05);与低鲁组比,模型低鲁组IL-4、IL-6、IL-10表达升高(P<0.05,P<0.01);与高鲁组比,模型高鲁组IL-4、IL-6、IL-10表达升高(P<0.05,P<0.01)。详见表6。
3.6 各组脾脏组织JAK2、T-bet、STAT4、GATA3、STAT6蛋白表达量水平比较
与正常组比较,低鲁组和高鲁组的T-bet蛋白表达量减少(P<0.05),而STAT6蛋白表达量增加(P<0.05),模型组STAT6蛋白表达量增加(P<0.05);与模型组比较,模型高鲁组JAK2、T-bet、STAT4蛋白表达量显著减少(P<0.05,P<0.01),GATA3和STAT6蛋白表达量增加(P<0.05);与低鲁组比较,模型低鲁组GATA3和STAT6蛋白表达量增加(P<0.01);与高鲁组比较,模型高鲁组GATA3和STAT6蛋白表达量增加(P<0.05,P<0.01)。详见图4、表7。
4 讨论
环孢素通过影响T细胞接触的表面分子表达和细胞因子分泌,诱导T细胞反应方向的改变[24],它也能够特异性抑制T细胞中CD4+T的活化,作用于不同的细胞因子,例如影响IL-2、IFN-γ等细胞因子的表达[25]。环孢素诱导的免疫抑制大鼠,主要表现为CD4+T淋巴细胞占比减少,这与感染HIV引起的CD4+T淋巴细胞数量减少有高度相似性,较好地模拟了机体免疫缺陷状态。
T淋巴细胞是细胞免疫中的主要效应细胞[26]。研究发现[27],细胞因子对CD4+T细胞分化有重要的调控作用。IL-12、IFN-γ可以诱导CD4+T细胞分化为Th1细胞,Th1主要分泌IFN-γ、IL-2、TNF-β、IL-12等参与机体细胞免疫应答。通过IL-4的诱导,CD4+T细胞分化为Th2细胞,Th2分泌IL-4、IL-5、IL-6及IL-10等参与机体体液免疫应答。正常生理状态下,Th1/Th2之间基本处于相对平衡状态。当CD4+T淋巴细胞分化出现偏移,向Th1漂移或Th2漂移,使得Th1/Th2之间的动态平衡消失,导致机体免疫应答进入病理状态,从而影响相应疾病的发生与发展。此外,转录因子也是影响CD4+T细胞分化的重要因素之一,STAT转录因子的磷酸化及其向细胞核的传导是调节Th1/Th2细胞因子平衡的重要步骤[28-29]。研究表明[30-32],JAK/STAT信号通路与CD4+T淋巴细胞分化密切相关。因此,JAK/STAT信号通路相关检测可以在一定程度上反映体内和体外淋巴细胞亚群的功能性免疫反应状态[33]。
本研究结果显示,模型组CD4+T淋巴细胞百分比较正常组下降,模型组大鼠胸腺指数下降、胸腺病理结构异常,其脾脏结构轻微异常。在免疫抑制剂的作用下,胸腺比脾脏更容易受到损害,出现明显萎缩,胸腺功能障碍在器官特异性自身免疫的发展中起着至关重要的作用[34]。鲁索利替尼是JAK1/JAK2选择性抑制剂[35],通过鲁索利替尼干预免疫缺陷大鼠,可以在一定程度上抑制JAK/STAT通路,抑制相关炎症因子的表达,结合实验结果说明CD4+T细胞减少可能与JAK/STAT通路相关,因此,需进一步深入探究该疾病中CD4+T淋巴细胞具体分化方向。
本研究发现,模型组大鼠IL-4激活STAT6后,引起Th2方向的关键转录因子STAT6和IL-10细胞因子表达增加,相应地抑制Th1方向中细胞因子和转录因子的表达,导致Th1/Th2失衡,模型组大鼠CD4+T细胞向Th2漂移,导致免疫缺陷。与模型组比较,模型高鲁组转录因子GATA3、STAT6蛋白持续高表达,相应地抑制了转录因子T-bet、STAT4蛋白的表达;同时,模型高鲁组IL-2、IFN-γ表达显著降低;但IL-6、IL-10表达量明显增加。这表明导致免疫缺陷的机制可能是IL-12/STAT4通路表达受抑制,而Th2相关的细胞因子和蛋白表达亢进,使其具有向Th2亚型分化的优势,Th1/Th2失衡。
综上所述,本实验发现该疾病以CD4+T淋巴细胞减少为主要特征,CD4+T细胞亚群失调与JAK/STAT信号通路表达失衡有关,其机制可能与IL-12/STAT4通路表达下调和IL-4/STAT6通路表达上调有关,CD4+T淋巴细胞分化由Th1向Th2漂移,造成Th1/Th2失衡引发免疫缺陷。人體Th1/Th2的免疫平衡,在中医理论上即阴与阳平衡。阴与阳的对立制约、消长平衡,维持其阴平阳秘,阴阳之间保持动态平衡。在现代研究中,当Th1与Th2之间维持相对平衡,则机体可以维持正常免疫应答。尤如《素问·生气通天论》中所述:“阴平阳秘,精神乃治,阴阳离绝,精气乃绝。”阴与阳两者之间互相调节,阴阳平和,生命活动正常。在治疗方面,应保持Th1/Th2的动态平衡,从而调节免疫缺陷大鼠的免疫功能。因此,IL-4/STAT6与IL-12/STAT4通路可作为未来药物治疗的潜在靶点,以期纠正Th1/Th2失衡,改善免疫缺陷状态。
参考文献
[1]中华医学会感染病学分会艾滋病丙型肝炎学组, 中国疾病预防控制中心. 中国艾滋病诊疗指南(2021年版)[J]. 中国艾滋病性病, 2021, 27(11): 1182-1201.
[2] SARAVIA J, CHAPMAN N M, CHI H B. Helper T cell differentiation[J]. Cellular & Molecular Immunology, 2019, 16(7): 634-643.
[3] SORIANO-SARABIA N, BATESON R E, DAHL N P, et al. Quantitation of replication-competent HIV-1 in populations of resting CD4+T cells[J]. Journal of Virology, 2014, 88(24): 14070-14077.
[4] AMARAL A J, ANDRADE J, FOXALL R B, et al. miRNA profiling of human naive CD4 T cells links miR-34c-5p to cell activation and HIV replication[J]. The EMBO Journal, 2017, 36(3): 346-360.
[5] MURPHY K M, REINER S L. The lineage decisions of helper T cells[J]. Nature Reviews Immunology, 2002, 2(12): 933-944.
[6] KRUEGER P D, GOLDBERG M F, HONG S W, et al. Two sequential activation modules control the differentiation of protective T helper-1 (Th1) cells[J]. Immunity, 2021, 54(4): 687-701.
[7] FLOSS D M, KL CKER T, SCHR DER J, et al. Defining the functional binding sites of interleukin 12 receptor β1 and interleukin 23 receptor to Janus kinases[J]. Molecular Biology of the Cell, 2016, 27(14): 2301-2316.
[8] XIN P, XU X Y, DENG C J, et al. The role of JAK/STAT signaling pathway and its inhibitors in diseases[J]. International Immunopharmacology, 2020, 80: 106210.
[9] HU X Y, LI J, FU M R, et al. The JAK/STAT signaling pathway: From bench to clinic[J]. Signal Transduction and Targeted Therapy, 2021, 6(1): 402.
[10] 周 源, 第五永长, 王郁金, 等. 洗心汤对T2D合并AD小鼠模型中JAK2/STAT3通路和IDE蛋白表达的影响[J]. 湖南中医药大学学报, 2022, 42(5): 725-731.
[11] M?魻HNLE P, SCH?譈TZ S V, VAN DER HEIDE V, et al. MicroRNA-146a controls Th1-cell differentiation of human CD4+T lymphocytes by targeting PRKCε[J]. European Journal of Immunology, 2015, 45(1): 260-272.
[12] STARK J M, TIBBITT C A, COQUET J M. The metabolic requirements of Th2 cell differentiation[J]. Frontiers in Immunology, 2019, 10: 2318.
[13] ALTEN R, MISCHKEWITZ M, STEFANSKI A L, et al. Janus kinase inhibitors: State of the art in clinical use and future perspectives[J]. Zeitschrift Fur Rheumatologie, 2020, 79(3): 241-254.
[14] PUIGDEVALL L, MICHIELS C, STEWARDSON C, et al. JAK/STAT: Why choose a classical or an alternative pathway when you can have both [J]. Journal of Cellular and Molecular Medicine, 2022, 26(7): 1865-1875.
[15] SRIVASTAVA S, RASOOL M. Underpinning IL-6 biology and emphasizing selective JAK blockade as the potential alternate therapeutic intervention for rheumatoid arthritis[J]. Life Sciences, 2022, 298: 120516.
[16] THANGARAJ A, PERIYASAMY P, LIAO K, et al. HIV-1 TAT-mediated microglial activation: Role of mitochondrial dysfunction and defective mitophagy[J]. Autophagy, 2018, 14(9): 1596-1619.
[17]朱惠斌, 卢芳国, 黄顺玲, 等. 湘A1号、2号对免疫缺陷动物免疫保护作用的研究[J]. 中华中医药学刊, 2011, 29(4): 828-831.
[18] 余 曼, 刘晶晶, 彭 鑫, 等. 艾滋1号方对环孢素A(CsA)所致免疫低下模型小鼠的影响[J]. 时珍国医国药, 2021, 32(2): 305-307.
[19] LAN T J, LUO X, MO M Y, et al. Hydrolyzed seawater pearl tablet modulates the immunity via attenuating Th1/Th2 imbalance in an immunosuppressed mouse model[J]. Journal of Traditional Chinese Medicine, 2021, 41(3): 397-405.
[20] 肖 榮, 赵 澄, 张香港, 等. 湖南预防“新冠肺炎”2号方对免疫缺陷小鼠模型的免疫调节作用研究[J]. 湖南中医药大学学报, 2021, 41(3): 333-337.
[21] 张予晋, 李 玲, 杨胜辉, 等. 不同剂量环孢菌素A制备免疫缺陷小鼠模型的研究[J]. 湖南中医药大学学报, 2014, 34(11): 14-17, 65.
[22] 王鑫国. 中药药理学实验教程[M]. 2版. 北京: 中国中医药出版社, 2017: 8.
[23] 孙 哲. 鲁索利替尼对实验性自身免疫性脑脊髓炎小鼠炎性因子表达及调节性T细胞的影响[D]. 石家庄: 河北医科大学, 2016.
[24] LIDDICOAT A M, LAVELLE E C. Modulation of innate immunity by cyclosporine A[J]. Biochemical Pharmacology, 2019, 163: 472-480.
[25] FERNANDES J S, ARAUJO M I, DE ALMEIDA T V V S, et al. Impaired immunoregulatory network of the CD4+T lymphocytes in refractory asthma[J]. Clinical & Experimental Allergy, 2019, 49(5): 644-654.
[26] DONG C. Cytokine regulation and function in T cells[J]. Annual Review of Immunology, 2021, 39: 51-76.
[27] RUTERBUSCH M, PRUNER K B, SHEHATA L, et al. In vivo CD4+T cell differentiation and function: Revisiting the Th1/Th2 paradigm[J]. Annual Review of Immunology, 2020, 38: 705-725.
[28] MCWILLIAMS I L, RAJBHANDARI R, NOZELL S, et al. STAT4 controls GM-CSF production by both Th1 and Th17 cells during EAE[J]. Journal of Neuroinflammation, 2015, 12: 128.
[29] MAIER E, DUSCHL A, HOREJS-HOECK J. STAT6-dependent and-independent mechanisms in Th2 polarization[J]. European Journal of Immunology, 2012, 42(11): 2827-2833.
[30] WANG J F, WANG H, KANG L. LINC00870 regulates Th1/Th2 via the JAK/STAT pathway in peripheral blood mononuclear cells infected with Mycobacterium tuberculosis[J]. International Immunopharmacology, 2022, 102: 107188.
[31] WANG J L, LIU J, WANG M Y, et al. Levamisole suppresses CD4+T-cell proliferation and antigen-presenting cell activation in aplastic Anemia by regulating the JAK/STAT and TLR signaling pathways[J]. Frontiers in Immunology, 2022, 13: 907808.
[32] HAN J, ZHANG S W, JIANG B P, et al. Sesquiterpene lactones from Xanthium sibiricum Patrin alleviate asthma by modulating the Th1/Th2 balance in a murine model[J]. Phytomedicine, 2022, 99: 154032.
[33] WESSELING-ROZENDAAL Y, VAN DOORN A, WILLARD-GALLO K, et al. Characterization of immunoactive and immunotolerant CD4+T cells in breast cancer by measuring activity of signaling pathways that determine immune cell function[J]. Cancers, 2022, 14(3): 490.
[34] GEENEN V. History of the thymus: From an "accident of evolution" to the programming of immunological self-tolerance[J]. Medecine Sciences, 2017, 33(6/7): 653-663.
[35] KEENAN C, NICHOLS K E, ALBEITUNI S. Use of the JAK inhibitor ruxolitinib in the treatment of hemophagocytic lymphohistiocytosis[J]. Frontiers in Immunology, 2021, 12: 614704.
(本文編辑 周 旦)
