氧化苦参碱通过抑制HMGB1缓解坐骨神经慢性压迫性损伤神经性疼痛
2023-08-14黄翔,李晓宏,汤达承,陈盼
黄翔,李晓宏,汤达承,陈盼


〔摘要〕 目的 建立大鼠坐骨神經慢性压迫性损伤(chronic constriction injury, CCI)模型,探索氧化苦参碱(oxymatrine, OMT)对CCI大鼠神经疼痛的缓解作用。方法 30只大鼠随机分为Sham组、CCI组、OMT组,每组10只。OMT组大鼠于术后7 d内每2天鞘内注射OMT(1.2 mg/kg),CCI组和Sham组同一时间注射等体积的生理盐水。各组大鼠于术后第1、3、7、14、21天检测后足机械缩足反射阈值(mechanical withdrawal threshold, MWT)和热缩足反射潜伏期(paw withdrawal thermal latency, PWTL)。采用Western blot法检测大鼠脊髓组织中高迁移率族蛋白1(high mobility group box-1 protein, HMGB1)和Toll样受体4(Toll-like receptor 4, TLR4)表达情况,使用ELISA法检测大鼠脊髓组织中肿瘤坏死因子-?琢(tumor necrosis factor-?琢, TNF-?琢)和白细胞介素-1β(interleukin-1β, IL-1β)的表达情况。结果 CCI组大鼠表现出甩腿、舔足等明显的疼痛表现,提示造模成功。与Sham组比较,CCI组大鼠术后第7、14、21天的MWT显著降低(P<0.05),PWTL显著缩短(P<0.05)。与CCI组相比,OMT组大鼠术后第7、14、21天的MWT明显增加(P<0.05),PWTL显著升高(P<0.05)。与Sham组比较,CCI组大鼠脊髓组织中HMGB1、TLR4的蛋白表达水平及TNF-α、IL-β的含量显著上升(P<0.05);与CCI组比较,OMT组大鼠脊髓组织中HMGB1、TLR4的蛋白表达水平及TNF-α、IL-β的含量明显下降(P<0.05)。结论 OMT可能通过下调CCI大鼠脊髓组织中的HMGB1、TLR4、TNF-α及IL-β,缓解CCI大鼠的神经性疼痛。
〔关键词〕 神经性疼痛;氧化苦参碱;高迁移率族蛋白1;Toll样受体4;神经炎症;坐骨神经压迫
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.07.008
Oxymatrine relieves neuropathic pain in rats with chronic
constriction injury of sciatic nerve by inhibiting HMGB1
HUANG Xiang, LI Xiaohong*, TANG Dacheng, CHEN Pan
Department of Pain Management, the First People's Hospital of Foshan, Foshan, Guangdong 528000, China
〔Abstract〕 Objective To establish a rat model of chronic constriction injury (CCI) of the sciatic nerve, so as to explore the analgesic effects of oxymatrine (OMT) on neuropathic pain in CCI rats. Methods A total of 30 rats were randomly divided into Sham group, CCI group, and OMT group, with 10 rats in each group. The rats in OMT group were intrathecally injected with OMT (1.2 mg/kg) every 2 days within 7 d after surgery, while the rats in CCI group and Sham group were injected with the same volume of normal saline at the same time. The mechanical withdrawal threshold (MWT) and paw withdrawal thermal latency (PWTL) of rats in each group were measured on the 3rd, 7th, 14th, and 21st days after surgery. In addition, the expression levels of high mobility group box-1 protein (HMGB1) and Toll-like receptor 4 (TLR4) in the spinal cord tissue were determined by Western blot, and the expression levels of tumor necrosis factor-α (TNF-α) and interleukin-1β (IL-1β) in the spinal cord tissue were examined by ELISA. Results The rats in CCI group showed obvious pain manifesting as swinging legs and licking feet, suggesting successful modeling. Compared with Sham group, the rats in CCI group showed significantly lower MWT on the 7th, 14th, and 21st days after surgery (P<0.05), with significantly shorter PWTL (P<0.05). Compared with CCI group, MWT of the rats in OMT group was significantly higher on the 7th, 14th, and 21st days after surgery (P<0.05), with significantly longer PWTL (P<0.05). Compared with Sham group, the protein expression levels of HMGB1 and TLR4 as well as the content of TNF-α and IL-1β in the spinal cord tissue of rats in CCI group significantly increased (P<0.05). Compared with CCI group, the protein expression levels of HMGB1 and TLR4 as well as the content of TNF-α and IL-1β in the spinal cord tissue of rats in OMT group significantly decreased (P<0.05). Conclusion OMT may relieve neuropathic pain in CCI rats by down-regulating HMGB1, TLR4, TNF-α, and IL-β in the spinal cord tissue.
〔Keywords〕 neuropathic pain; oxymatrine; high mobility group box-1 protein; Toll-like receptor 4; neuroinflammation; constriction of the sciatic nerve
疼痛是机体组织受损或存在潜在性损伤造成,但是越来越多的研究表明疼痛是神经功能紊乱的表现[1]。神经炎症在神经性疼痛的发生和维持中起着至关重要的作用,趋化因子和趋化因子受体在外周和中枢神经系统中通过增强神经炎症介导慢性疼痛作用[2]。高迁移率族蛋白B1(high mobility group
box-1 protein, HMGB1)是一种高度保守的核蛋白,广泛分布于哺乳动物细胞中,其晚期具有促炎作用,是近年来危重医学研究的热点之一[3]。在多种神经疾病中都出现高表达的HMGB1,其会与晚期糖基化终末产物(receptor of advanced glycation endproducts, RAGE)以及Toll样受体(Toll-likereceptors, TLR)结合,促进核因子κB(nuclear factor-kappa B, NF-κB)核转录,激活CXC趋化因子受体-4(CXC chemokine receptor-4, CXCR4),从而促进多种炎症因子的释放[4]。激活的HMGB1与小胶质细胞的激活有关[5],抑制HMGB1/RAGE轴可减少小胶质细胞介导的神经炎症活动,抑制NF-κB信号通路的激活和炎症细胞因子如肿瘤坏死因子-?琢(tumor necrosis factor-?琢, TNF-?琢)和白细胞介素-1β(interleukin-1β, IL-1β)的表达[6]。氧化苦参碱(oxymatrine, OMT)是一种天然喹喔啉生物碱,具有抗炎作用。OMT可通过抑制TLR4/NF-κB信号通路缓解大鼠脑神经炎症[7]。但尚未见将OMT应用于神经性疼痛模型治疗的报道。大鼠坐骨神经慢性压迫性损伤(chronic constriction injury, CCI)模型是研究外周神经不完全损伤的病理性疼痛的动物模型[8]。因此,本研究建立大鼠CCI模型,并将OMT鞘内注射应用于大鼠CCI模型,旨在明确OMT缓解慢性神经病理性疼痛的分子机制。
1 材料与方法
1.1 实验动物与分组
30只SD雄性大鼠(200~250 g)由佛山市第一人民医院动物中心提供,获得佛山市第一人民医院动物管理伦理委员会批准(编号:C202212-3)。每笼5只,每天提供12 h/12 h的昼夜光照循环、充足的食物和水,保持环境湿度(50%~70%)及温度(20~23 ℃)恒定,动物适应性饲养1周。30只大鼠随机分为Sham组、CCI组(CCI+鞘内注射生理盐水)、OMT组(CCI+鞘内注射OMT),每组10只。Sham组大鼠仅暴露坐骨神经但不进行结扎。CCI组和OMT组大鼠进行CCI手术,术前禁食12 h,术后分别给予等体积的生理盐水或OMT。
1.2 主要试剂与仪器
OMT(上海西格玛奥德里奇贸易有限公司,批號:29436122);兔源性HMGB1抗体、兔源性TLR4抗体和兔源性GAPDH抗体(上海艾博抗贸易有限公司,批号分别为:AB18256、AB22048、AB192043);抗兔lgG-HRP(上海圣克鲁斯生物技术有限公司,批号:sc-2354);化学增强发光试剂盒(中国赛默飞世尔科技有限公司,批号:02551010);组织裂解液(上海碧云天生物技术有限公司,批号:P0013B)。
PE-10导管(美国健康医疗仪器国际公司,型号:188700);VonFrey纤维丝(美国Stoelting公司,型号:Aesthesio);热辐射测试仪器(美国IITC公司,型号:37370);电泳仪、电泳槽、TRANS-BLOT SD半干电转移系统(上海伯乐生命医学产品有限公司,型号分别为:7007010、1656001、1703940)。
1.3 神经病理性疼痛模型的建立与给药方法
大鼠禁食12 h后,进行CCI手术。大鼠腹腔注射10%水合氯醛麻醉,侧卧位放置于手术台上。于左侧股骨下方切开皮肤,暴露坐骨神经,在坐骨神经三叉分支以上的位置用4-0含铬羊肠线结扎坐骨神经,然后依次缝合肌肉及皮肤,再次进行消毒,并将大鼠放置于原饲养位置[8]。Sham组大鼠仅暴露坐骨神经但不进行结扎。将OMT样品使用无菌生理盐水配制成浓度为1 mg/50 μL的溶液,OMT组大鼠于术后7 d内每2天鞘内注射1.2 mg/kg的OMT[9],CCI组和Sham组大鼠于术后7 d内每2天鞘内注射等体积的生理盐水。
1.4 鞘内置管
鞘内置管用于给药。腹腔注射水合氯醛麻醉大鼠,掀开大鼠L6的硬脊膜,沿蛛网膜下腔向头端置入PE-10导管。注射利多卡因后,双侧后肢麻痹,进行鞘内植入。固定导管,随后封皮进行CCI手术。3组大鼠均进行鞘内置管。OMT组硬膜外注射OMT,相同给药时间CCI组与Sham组注射相同体积的生理盐水。
1.5 机械缩足反射阈值(mechanical withdrawal threshold, MWT)测定
分别于建模后的第1、3、7、14、21天检测大鼠的疼痛行为学指标,VonFrey法测定MWT,将大鼠放置于安静舒适的环境中,等待大鼠适应30 min之后,用VonFrey纤维丝刺激大鼠左侧后足足底,将VonFrey纤维丝弯曲并持续3~5 s,记录大鼠出现缩足、抬足、舔足行为时对应的VonFrey标号,反复测量3次,取平均值[10]。
1.6 热缩足反射潜伏期(paw withdrawal thermal latency, PWTL)测定
分别于建模后的第1、3、7、14、21天检测大鼠的疼痛行为学指标,使用热辐射测试仪测定PWTL。将大鼠放置于有机玻璃箱内,并将3 mm厚的玻璃板置于箱底。待大鼠适应30 min,用热痛仪照射大鼠术侧后足足底,记录大鼠出现缩足、抬足、舔足行为时照射的持续时间,重复测定3次,取平均值[10]。
1.7 Western blot法检测HMGB1、TLR4的蛋白表达水平
建模后的第7天,将大鼠麻醉之后,迅速断头处死,取出脊髓,迅速切除CCI损伤侧腰段脊髓背角(L4-6),立即放置于-80 ℃保存。将脊髓组织用液氮研磨,然后用组织裂解液冰上裂解15 min,4 ℃低温离心5 min(12 000 r/min,离心半径10 cm)。用BCA试剂盒测量提取的蛋白含量。将样品与5×上样缓冲液混合煮沸灭活。电泳实验:每孔50 μg 蛋白上样,90 min后,使用半干转仪将凝胶中的蛋白转移至PVDF膜,5%脱脂奶粉封闭。封闭结束后,对应的PVDF膜分别于4 ℃过夜孵育HMGB1(1∶300)、TLR4(1∶500)、GADPH(1∶300)一抗。接着与HPR偶联的特异性二抗工作液室温孵育1 h,二抗孵育结束后,TBST漂洗3次,每次10 min。将漂洗后的PVDF膜用ECL溶液浸润。将被滤纸吸尽液体的PVDF膜浸润于曝光液中,通过Bio-rad凝胶成像系统检测蛋白质。
1.8 ELISA法检测TNF-α、IL-β的含量
建模后的第7天,麻醉大鼠,迅速断头处死,取出脊髓,切除CCI损伤侧腰段脊髓背角(L4-6),将各组的脊髓组织加PBS研磨,4 ℃低温离心20 min,(800 r/min,离心半径10 cm),取上清液作为样品,按照试剂盒说明书进行ELISA分析,检测TNF-α和IL-β的含量。
1.9 统计学分析
采用SPSS 21.0和Graphpad 8对数据进行统计分析,数据以“x±s”表示,采用?字2检验。组间两两比较采用方差分析及t检验,P<0.05表示差异有统计学意义。
2 结果
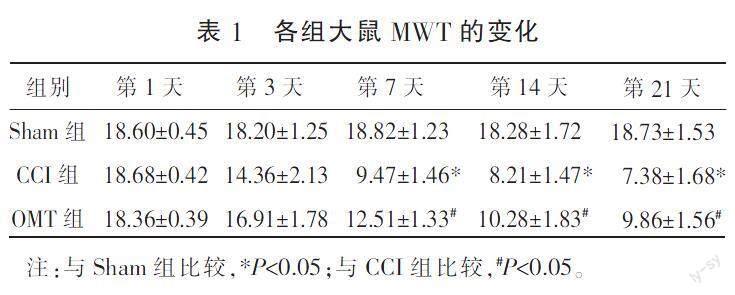
2.1 各组大鼠MWT比较
术后第7、14、21天,与Sham组比较,CCI组MWT降低(P<0.05);与CCI组比较,OMT组MWT升高(P<0.05)。详见表1。
2.2 各组大鼠PWTL比较
术后第7、14、21天,与Sham组比较,CCI组PWTL明显下降(P<0.05);与CCI组比较,OMT组PWTL均明显上升(P<0.05)。详见表2。
2.3 各组大鼠脊髓组织HMGB1和TLR4蛋白表达水平比较
与Sham组比较,CCI组HMGB1及TLR4蛋白表达水平显著上升(P<0.05);与CCI组比较,OMT组HMGB1及TLR4蛋白表达水平显著下降(P<0.05)。详见图1。
2.4 各组大鼠脊髓组织TNF-α、IL-β表达水平比较
与Sham组比较,CCI组TNF-α、IL-β表达水平显著上升(P<0.05);与CCI组比较,OMT组TNF-α、IL-β表达水平明显下降(P<0.05)。详见图2。
3 讨论
神经性疼痛是由于神经系统受损引发的慢性疼痛,表现为痛觉异常、自发性疼痛、痛觉过敏。前期研究使用哌替啶为阳性对照药,OMT剂量为1.2 mg/kg,实验表明OMT具有镇痛作用[11]。本文使用大鼠CCI模拟神经性疼痛,造模后大鼠出现包括舔足、抬足的明显缩足反应,大鼠第7、14、21天的MWT和PWTL均明显下降,该结果表明成功建立了神经性疼痛模型。术后7 d内每2天鞘内注射OMT给药,大鼠第7、14、21天的MWT和PWTL均明显上升。本文还检测了HMGB1和TLR4的蛋白表达变化以及炎症因子的水平,结果表明OMT抑制了HMGB1和TLR4的表达以及炎症因子水平。以上数据显示,OMT缓解了大鼠CCI引发的神经性疼痛。
内源性HMGB1来源于神经元、周围神经细胞或积聚于背根神经节或感觉神经的免疫细胞,参与神经性炎性成分造成的躯体和内脏疼痛。HMGB1在炎症疾病模型中被激活,与多种跨膜受体包括TLR2、TLR4和TLR9结合,从而提高NF-κB、p53等转录因子的DNA结合能力,最终引发强烈的炎症反应[12]。最近研究证明,HMGB1与慢性神经病理性疼痛也密切相关,抗HMGB1单克隆抗体在动物模型中已显示出可有效治疗多种中枢神经系统疾病,包括中风、脑外伤、帕金森病、癫痫和阿尔茨海默病的潜力[13]。拮抗HMGB1靶向受体有助于减少各种形式的顽固性疼痛,许多参与神经性疼痛发展的微小RNA通过下调CCI大鼠中的HMGB1和促炎因子来减轻神经性疼痛[14]。研究表明,HMGB1天然抑制剂甘草甜素可以抑制糖尿病性神经病大鼠中TLR4、NLRP3和CXCR4表达的增加,改善糖尿病性神经病大鼠机械和热痛阈值,阻止小胶质细胞中的组蛋白3乙酰化[15]。本研究发现CCI神经病理性疼痛中,HMGB1和TLR4高表达。鞘内注射OMT下调了HMGB1和TLR4的表达,同时抑制了炎症因子TNF-α和IL-β的分泌水平。结合HMGB1在神经性疼痛中的重要作用,猜测OMT可能是通过抑制HMGB1减轻大鼠慢性CCI的神经性疼痛。
苦参来源于豆科槐属植物苦参(Sophora flavescens Ait.)的干燥根,《本草纲目》对其的评价为“苦以味名,参以功名,槐以叶形名也”。苦参性寒,味苦,归心、肝、胃、大肠、膀胱经,具有清热燥湿、杀虫、利尿的功效[16]。OMT是中药苦参根部中提取的天然喹喔啉生物碱,具有一定的药理特性,包括免疫调节、抗炎、抗氧化和抗病毒作用[17]。对其神经保护作用方面的研究表明,OMT以浓度依赖方式降低TLR-4和NF-κB的水平,抑制有丝分裂原激活的蛋白激酶通路[18]。此外,OMT抑制1-甲基-4-苯基-1、2、3、6-四氫吡啶/1-甲基-4-苯基吡啶诱导的小胶质细胞活化和促炎细胞因子的释放,OMT下调组织蛋白酶D(cathepsin D, CathD)的表达,并抑制了HMGB1/TLR4/NF-κB信号通路的激活[19],提示OMT的神经保护作用具有CathD依赖性[20]。虽然OMT在帕金森病动物模型中的神经保护作用已经被证实,但关于神经性疼痛的研究较少。本文将OMT运用于大鼠CCI的神经性疼痛模型,发现OMT通过抑制HMGB1发挥了神经保护作用,从而缓解了大鼠神经性疼痛,为更好开发OMT在临床神经镇痛方面的应用提供了有力证据。
综上所述,OMT可下调CCI大鼠脊髓组织中HMGB1、TLR4、TNF-α、IL-β的蛋白表达,减轻神经病理性疼痛。本研究为神经病理性疼痛的治疗提供了新的治疗方案。
参考文献
[1] FINNERUP N B, KUNER R, JENSEN T S. Neuropathic pain: From mechanisms to treatment[J]. Physiological Reviews, 2021, 101(1): 259-301.
[2] JIANG B C, LIU T, GAO Y J. Chemokines in chronic pain: Cellular and molecular mechanisms and therapeutic potential[J]. Pharmacology & Therapeutics, 2020, 212: 107581.
[3] QIAN Q Q, ZHANG X, WANG Y W, et al. Pro-inflammatory role of high-mobility group box-1 on brain mast cells via the RAGE/NF-κB pathway[J]. Journal of Neurochemistry, 2019, 151(5): 595-607.
[4] ANGELOPOULOU E, PAUDEL Y N, PIPERI C. Exploring the role of high-mobility group box 1 (HMGB1) protein in the pathogenesis of Huntington's disease[J]. Journal of Molecular Medicine, 2020, 98(3): 325-334.
[5] XU B, LANG L M, LIAN S, et al. Neuroinflammation induced by secretion of acetylated HMGB1 from activated microglia in hippocampi of mice following chronic cold exposure[J]. Brain Research, 2020, 1726: 146495.
[6] HUANG M, GUO M Z, WANG K, et al. HMGB1 mediates paraquat-induced neuroinflammatory responses via activating RAGE signaling pathway[J]. Neurotoxicity Research, 2020, 37(4): 913-925.
[7] MAO J H, HU Y E, ZHOU A L, et al. Oxymatrine reduces neuroinflammation in rat brain: A signaling pathway[J]. Neural Regeneration Research, 2012, 7(30): 2333-2339.
[8] 师钰琪, 吴红艳, 朱春燕, 等. 从BDNF/TrkB信号通路探讨乌头汤对神经病理性疼痛模型小鼠脑神经元的保护作用[J]. 中国实验方剂学杂志, 2020, 26(7): 23-30.
[9] 吕晓强, 邓扬鸥, 杨 丽, 等. 氧化苦参碱镇痛作用的研究[C]// “新成果·新进展·新突破”中华中医药学会2013年学术年会, 第三次中华中医药科技成果论坛论文集. 北京: [出版者不详], 2013: 386-390.
[10] 赵 葛, 吴 军. 趋化因子受体CXCR3对神经病理性疼痛的行为学影响[J]. 中外医疗, 2020, 39(2): 32-34.
[11] 张明发, 沈雅琴. 氧化苦参碱的中枢抑制和神经保护作用研究进展[J]. 药物评价研究, 2018, 41(10): 1916-1923.
[12] LIU X, HUANG K, ZHANG R J, et al. Isochlorogenic acid A attenuates the progression of liver fibrosis through regulating HMGB1/TLR4/NF-κB signaling pathway[J]. Frontiers in Pharmacology, 2020, 11: 582.
[13] NISHIBORI M, MORI S J, TAKAHASHI H K. Anti-HMGB1 monoclonal antibody therapy for a wide range of CNS and PNS diseases[J]. Journal of Pharmacological Sciences, 2019, 140(1): 94-101.
[14] TIAN J, SONG T Y, WANG W L, et al. MiR-129-5p alleviates neuropathic pain through regulating HMGB1 expression in CCI rat models[J]. Journal of Molecular Neuroscience, 2020, 70(1): 84-93.
[15] ZHAN L Y, LEI S Q, ZHANG B H, et al. Overexpression of miR-381 relieves neuropathic pain development via targeting HMGB1 and CXCR4[J]. Biomedecine & Pharmacotherapie, 2018, 107: 818-823.
[16] 刘君如, 张 彦, 杨黎燕, 等. 苦参本草考证道地性与现代研究[J]. 中医药导报, 2021, 27(7): 78-81.
[17] 蔡 权, 范 恒. 液质联用测定复方苦参汤中苦参碱、氧化苦参碱的血药浓度变化[J]. 湖北中医药大学学报, 2019, 21(4): 42-45.
[18] LAN X, ZHAO J N, ZHANG Y, et al. Oxymatrine exerts organ- and tissue-protective effects by regulating inflammation, oxidative stress, apoptosis, and fibrosis: From bench to bedside[J]. Pharmacological Research, 2020, 151: 104541.
[19] GUAN B G, CHEN R C, ZHONG M L, et al. Protective effect of Oxymatrine against acute spinal cord injury in rats via modulating oxidative stress, inflammation and apoptosis[J]. Metabolic Brain Disease, 2020, 35(1): 149-157.
[20] GAN P, DING L D, HANG G H, et al. Oxymatrine attenuates dopaminergic neuronal damage and microglia-mediated neuroinflammation through cathepsin D-dependent HMGB1/TLR4/NF-κB pathway in parkinson's disease[J]. Frontiers in Pharmacology, 2020, 11: 776.
(本文編辑 周 旦)
