桃红四物汤对创伤性股骨头坏死大鼠组织形态学及VEGFR2、Dll4表达的影响
2023-08-14冯海波,王怡璇,姚金龙,熊辉
冯海波,王怡璇,姚金龙,熊辉



〔摘要〕 目的 通過观察桃红四物汤对创伤性股骨头坏死大鼠血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor 2, VEGFR2)、Delta样配体4(Delta-like 4, Dll4)蛋白表达的影响,探究其防治创伤性股骨头坏死的作用机制。方法 将44只大鼠采用随机数字表法分为正常组(10只)和造模组(34只)。造模组行创伤性股骨头坏死造模;8周后从正常组和造模组分别随机取2只进行对比检测造模是否成功。将造模成功的剩余32只大鼠按随机数字表法分为模型组及桃红四物汤低、中、高剂量组,每组8只;加上正常组剩余大鼠8只,共计5组。正常组和模型组予以生理盐水灌胃;桃红四物汤低、中、高剂量组分别予以9、18、36 g/kg桃红四物汤灌胃。持续4周后采集股骨头标本,采用micro-CT观察股骨头组织形态学,光镜下检测空骨陷窝率,免疫组织化学法测定VEGFR2和Dll4的蛋白表达水平。结果 与正常组对比,其余4组大鼠股骨头均有不同程度的骨质破坏、软骨面塌陷及空骨陷窝率升高(P<0.05);模型组和桃红四物汤低剂量组VEGFR2蛋白表达均下降(P<0.05);桃红四物汤中、高剂量组Dll4蛋白表达明显增加(P<0.05)。与模型组对比,桃红四物汤中、高剂量组大鼠股骨头软骨形态改善,组织空骨陷窝率下降(P<0.05);桃红四物汤低、中、高剂量组VEGFR2蛋白表达均升高(P<0.05);桃红四物汤中、高剂量组Dll4蛋白表达升高(P<0.05)。结论 桃红四物汤能有效降低创伤性股骨头坏死骨组织空骨陷窝、改善组织形态,可能与增加VEGFR2、Dll4蛋白的表达、激活VEGF/Notch信号通路有关。
〔关键词〕 桃红四物汤;组织形态学;创伤性股骨头坏死;血管内皮细胞生长因子受体2;Delta样配体4;血管重建
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.07.006
Effects of Taohong Siwu Decoction on histomorphology and expressions of VEGFR2 and Dll4 in rats with traumatic osteonecrosis of the femoral head
FENG Haibo1,2, WANG Yixuan2, YAO Jinlong1, XIONG Hui2*
1. The Second Hospital of Hunan University of Chinese Medicine, Changsha,
Hunan 410005, China; 2. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To observe the effects of Taohong Siwu Decoction (THSWD) on the expressions of vascular endothelial growth factor receptor 2 (VEGFR2)and Delta-like 4 (Dll4) proteins in rats with traumatic osteonecrosis of the femoral head (ONFH), so as to explore its mechanism of action in preventing and treating this disease. Methods Totally 44 rats were randomized into normal group (n=10) and modeling group (n=34) using the random number table method. Modeling group underwent traumatic ONFH modeling; after 8 weeks, 2 rats were randomly selected from normal group and 2 rats from modeling group, for comparative testing to determine whether the modeling was successful. The remaining 32 rats with successful modeling were randomly subdivided into model group and low-, medium-, and high-dose THSWD groups using the random number table method, with 8 rats in each group; with the 8 remaining rats from normal group, totally 5 groups were set. Normal group and model group were given normal saline by gavage; low-, medium-, and high-dose THSWD groups were given 9, 18, and 36 g/kg THSWD by gavage, respectively. After 4 weeks of continuous treatment, femoral head specimens were collected, and the morphology of femoral head tissues was observed using micro-CT; the rate of empty bone lacuna was checked by light microscopy; the expression levels of VEGFR2 and Dll4 proteins were measured using immunohistochemistry. Results Compared with normal group, the other four groups of rats showed varying degrees of bone destruction, cartilage surface collapse, and an increase in the rate of empty bone lacuna (P<0.05); the expression of VEGFR2 protein decreased in both model group and low-dose THSWD group (P<0.05); the expression of Dll4 protein was significantly higher in medium- and high-dose THSWD groups (P<0.05). Compared with model group, the morphology of the femoral head cartilage in medium- and high-dose THSWD groups improved, and the rate of empty bone lacunae in the tissue decreased (P<0.05); the expression of VEGFR2 protein increased in low-, medium-, and high-dose THSWD groups (P<0.05); the expression of Dll4 protein increased in medium- and high-dose THSWD groups (P<0.05). Conclusion THSWD can effectively reduce the empty bone lacunae of traumatic ONFH and improve the tissue morphology, which may be related to increasing the expressions of VEGFR2 and Dll4 proteins and activating the VEGF/Notch signaling pathway.
〔Keywords〕 Taohong Siwu Decoction; histomorphology; traumatic osteonecrosis of the femoral head; vascular endothelial growth factor receptor 2; Delta-like 4; vascular reconstruction
股骨头坏死(osteonecrosis of the femoral head, ONFH)是骨科临床常见的致残率高、治疗较为复杂的骨关节疾病[1]。目前,对于本病的发病机制尚未完全阐明,但根据病因主要分为激素性、酒精性和创伤性ONFH。随着生活节奏和交通的快速化,创伤性ONFH发病率不断升高,并逐渐年轻化[2]。目前,髋关节置换是本病的主要治疗方式,但存在创伤大、需二期翻修等风险[3]。因此,早期非手术保髋治疗ONFH尤为重要。创伤性ONFH的机制主要在于损伤局部血管、导致血运的破坏,因此,治疗的关键在于血液循环的重新建立。
桃红四物汤是中医经典活血方,具有活血化瘀的作用,临床运用广泛。研究发现,桃红四物汤具有促进坏死股骨头修复,改善股骨头局部血运,使坏死股骨头修复的功能,对ONFH临床疗效较好[4-5]。血管的通畅是血运重建的基础,因此,推测其机制可能与促进损伤血管的修复和血管新生相关。VEGF/Notch信號轴是调节血管新生的重要通路,其中血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor 2, VEGFR2)是血管内皮生长因子(vascular endothelial growth factor, VEGF)受体中与血管最相关的调控因子,VEGFR2水平上调,可促进血管新生[6]。Delta样配体4(Delta-like4, Dll4)是与血管新生和损伤血管修复最为相关的Notch配体,在血管生成中发挥重要作用[7]。本研究通过观察桃红四物汤对大鼠创伤性ONFH进程中VEGFR2及Dll4表达的影响,进一步探讨桃红四物汤治疗创伤性ONFH的作用机制。
1 材料与方法
1.1 实验动物
44只雄性健康SD大鼠(体质量180~200 g),由湖南中医药大学动物实验中心[许可证号:SYXK(湘)2019-0005]统一购置并分笼饲养于SPF级实验室,饲养温度24~26 ℃,湿度50%~70%,由动物实验中心人员进行专人饲养。实验动物伦理号:LL2019100906。
1.2 药物及试剂
苏木精染液、苏木精分化液(武汉赛维尔生物科技有限公司,批号:G1004、G1309);伊红染液(上海晶莱生物技术有限公司,批号:17372-87-1);Dll4(英国abcam公司,批号:ab176876);VEGFR2(北京博奥森生物技术公司,批号:Bs-1047R);PBS溶液(北京中杉金桥生物技术有限公司,批号:ZLI-9062)。
1.3 主要仪器
Micro-CT(美国Perkin Elmer公司,型号:Quantum FX);成像系统(日本Nikon公司,型号:Nikon DS-U3);台式冷冻离心机(湖南湘仪实验室仪器开发有限公司,型号:H1650R);电泳仪、转膜仪(中国北京六一生物科技有限公司,型号:DYY-6C、DYCZ-40D);电磁炉(荷兰Philips公司,型号:HD4925);包埋机(武汉俊杰电子有限公司,型号:JB-P5);旋转蒸发仪(上海一恒科学仪器有限公司,型号:RV-211M)。
1.4 动物分组
将44只雄性大鼠适应性喂养1周后,采用随机数字表法分为正常组(10只)和造模组(34只)。正常组不予特殊处理,造模组予以手术造模。8周后正常组和造模组分别随机取2只大鼠进行对比,检测造模是否成功。造模成功后,将剩余32只造模大鼠按随机数字表法分为模型组及桃红四物汤低、中、高剂量组,每组8只,正常组剩余大鼠8只,共计5组。
1.5 模型制备
参照PELED等[8]手术造模方式,具体步骤如下:根据常用标准配制大鼠麻醉所需戊巴比妥钠,然后用1 mL注射器予以腹腔注射麻醉,待大鼠麻醉满意后,用固定器将大鼠俯卧位固定于保温操作台上,在备皮处(手术区域)用聚维酮碘消毒。手术切口以大鼠大转子为中心,沿大腿方向纵向依次切开皮肤、皮下组织,分离臀中肌。在保护好神经血管的前提下切断圆韧带,使髋关节脱位、股骨头充分暴露;将股骨颈基底骨膜用尖刀充分刮离,并切除关节囊的折返纤维,然后将股骨头重新复位,复位后用生理盐水冲洗伤口后逐层缝合。术后予以青霉素5万U/d,肌内注射,连续3 d,防止伤口感染。注意在鼠笼上方放置鼠粮,以便大鼠只有在保持站立的情况下才能进食水。通过micro-CT见大鼠股骨头软骨面改变、软骨下骨出现坏死、骨小梁稀疏甚至断裂等即为造模成功[9]。
1.6 桃红四物汤制备及给药剂量
桃红四物汤的配比根据《医宗金鉴》中的比例换成现代计量:桃仁20 g、红花10 g、生地黄20 g、当归20 g、赤芍20 g、川芎10 g。中药材由湖南中医药大学第二附属医院药剂科一次购进,采用传统煎煮后,用蒸发仪浓缩成含生药2 g/mL的汤剂,并封包处理。以大鼠200 g为中位数,采用人与动物体表面积换算[10]确定大鼠具体给药剂量,桃红四物汤的低、中、高剂量分别为9、18、36 g/kg。
1.7 干预方法
正常组大鼠予以常规喂养+生理盐水灌胃;模型组在造模成功后予以常规饲料喂养+生理盐水灌胃;桃红四物汤低、中、高剂量组予以正常喂养并分别予以桃红四物汤9、18、36 g/kg的标准进行灌胃。持续4周后采集股骨头标本。
1.8 观察指标
1.8.1 大体组织形态学观察 将所截取的股骨头标本用专用试管进行存放固定,然后用micro-CT对股骨头及近端股骨颈进行扫描,观察股骨头大体组织形态学,主要包括股骨头整体外观、关节软骨面塌陷情况。X线扫描参数:电压90 kV,电流80 ?滋A,像素尺寸90 ?滋m,高分辨率扫描模式。
1.8.2 空骨陷窝率检测 将股骨头经4%多聚甲醛固定后,在用EDTA脱钙,持续3~4周。脱钙完全后常规脱水、透明、浸蜡、包埋,制作成厚度约4 μm的切片。在200倍镜下,每张切片随机选取5个视野,记录出空骨陷窝和总骨陷窝,并计算出平均值。平均空骨陷窝数与平均总骨陷窝数的比值用百分比率表示,即为空骨陷窝率[11]。
1.8.3 大鼠股骨头VEGFR2、Dll4蛋白表达水平检测 取出大鼠股骨头标本后,用多聚甲醛液固定,采用免疫组织化学法进行样品制备、抗原修复、背景封闭等步骤,测定VEGFR2、Dll4蛋白的平均光密度。首先进行石蜡切片脱蜡、抗原修复、孵育;然后将切片进行DAB显色,显色时间在显微镜下控制,阳性为棕黄色;再用苏木精复染细胞核,苏木精返蓝液返蓝;最后进行脱水封片,显微镜检查并采集图像进行分析。
1.9 统计学方法
所有数据采用SPSS 24.0统计软件处理,满足正态性、方差齐性时,组间比较采用单因素方差分析,多重比较采用LSD法;方差不齐时,采用Dunnett's T3检验;当数据不满足正态性时,采用秩和检验,P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠大体组织形态学观察
正常组大鼠股骨头软骨面光滑,形态结构完整,未见塌陷;模型组股骨头可见骨质破坏、软骨面塌陷明显;桃红四物汤低剂量组大鼠股骨头软骨面可见部分塌陷、骨质破坏较明显;桃红四物汤中剂量组大鼠股骨头形态结构轻度变形、软骨面可见少部分塌陷和毛糙;桃红四物汤高剂量组大鼠股骨头形态稍改变,关节面欠规整,少部分软骨面塌陷。详见图1。
2.2 各组大鼠股骨头空骨陷窝率比较
与正常组比较,其余各组大鼠空骨陷窝率升高(P<0.05)。与模型组比较,桃红四物汤中、高剂量组空骨陷窝率下降(P<0.05)。与桃红四物汤低剂量组比较,桃红四物汤中、高剂量组空骨陷窝率降低(P<0.05)。桃红四物汤中、高剂量组空骨陷窝率比较,差异无统计学意义(P>0.05)。详见表1。
2.3 各组大鼠股骨头VEGFR2、Dll4蛋白表达比较
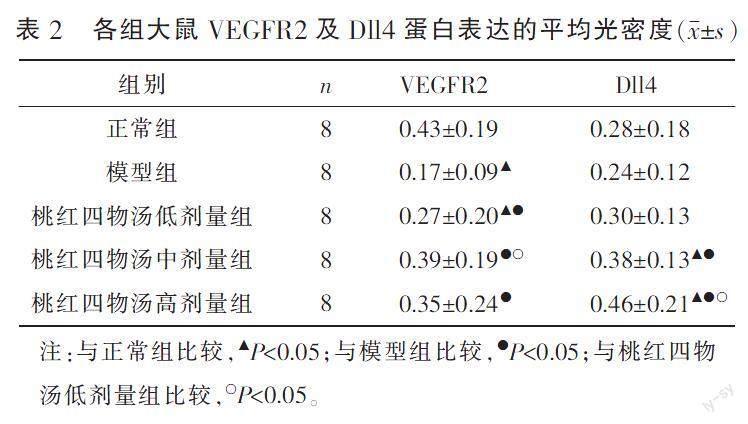
与正常组比较,模型组和桃红四物汤低剂量组VEGFR2蛋白表达均下降(P<0.05);桃红四物汤中、高剂量组Dll4蛋白表达明显升高(P<0.05)。与模型组比较,桃红四物汤低、中、高剂量组VEGFR2蛋白表达均升高(P<0.05);桃红四物汤中、高剂量组Dll4蛋白表达明显升高(P<0.05)。与桃红四物汤低剂量组比较,桃红四物汤中剂量组VEGFR2蛋白表达明显升高(P<0.05);桃红四物汤高剂量组Dll4蛋白表达明显升高(P<0.05)。桃红四物汤中、高剂量组VEGFR2、Dll4蛋白表达比较,差异无统计学意义(P>0.05)。详见表2、图2—3。
3 讨论
创伤性ONFH是临床上的常见骨科疾病,其发病机制主要是由于创伤损伤了营养股骨头的血管,导致血液循环的中断或不畅,从而使骨代谢出现异常并进一步形成ONFH;多见于髋周骨折、脱位等损伤,以股骨颈骨折和髋关节脱位最为常见[12]。ONFH的治疗主要在于抑制坏死股骨头的进一步恶化和促进骨组织新生重建,这两方面皆离不开血运[13]。因此,血液循环的恢复离不开血管的运载,血管的重建和修复是保守治疗的关键。
中医学中,没有“股骨头坏死”的病名;但根据发病的部位及临床症状与“髋痹”“骨痹”“骨痿”“骨蚀”等疾病相对应。历代不同医家认为[14],其发病机制主要与各种致病因素导致人体血瘀气滞、瘀血阻络、正气亏虚有关,其中瘀血阻络是關键因素。现代众多医家也主张“从瘀论治”,活血化瘀的治则应贯穿在本病治疗的全过程[15]。桃红四物汤是中医活血化瘀的经典方,广泛应用于血瘀病症,在临床上对ONFH的治疗也有肯定的疗效[16]。林智军等[17]在临床运用桃四物汤加减治疗ONFH患者,发现能有效减轻Ⅰ、Ⅱ期ONFH患者的临床症状。高玉龙等[18]在临床中采用手术联合桃红四物汤加减治疗ONFH,发现不仅可有效降低炎症因子水平,而且可有效降低全血黏度(vhole blood viscosity, WBV)和血浆黏度(plasma viscosity, PV)。课题组前期临床研究发现[19],桃红四物汤对创伤性ONFH的髋关节功能有明显的改善作用。本实验研究显示,micro-CT可见中、高剂量的桃红四物汤能有效改善创伤性ONFH大鼠股骨头塌陷,降低骨组织空骨陷窝率,进一步证实了桃红四物汤对创伤性ONFH的作用。
有研究发现,桃红四物汤治疗ONFH的机制可能与其调控炎性因子和凝血因子表达、改善血液流变学(hemorheology, HR)特性、促进血管修复或新生等有关[20-22]。VEGF是一种具有调控内皮细胞生长及促进血管生成和重塑的特异性生长因子[23],VEGF表达的上调在血管新生中发挥重要的作用[24]。赵建涛等[25]研究证实,心肌组织VEGF、b-FGF表达的上调,能促进血管新生,改善心室重构,从而改善急性心肌梗死大鼠心功能。人体中的VEGF主要有VEGF-A、VEGF-B、VEGF-C、VEGF-D以及PLGF 5个亚型;有VEGFR1、VEGFR2、VEGFR3 3种受体[26]。VEGFR2作为重要的血管生长因子受体之一,与VEGF结合后发生磷酸化,p-VEGFR2继而调控下游信号通路,在血管新生及重塑过程中发挥着重要的调控作用[27-28]。研究发现,机体对血管内皮生长增殖与机体血管形成的调控,主要是通过相关的细胞因子调控血管内皮细胞表面受体VEGFR2的活化及表达,进而抑制或激活其相关的下游信号传导通路,通过影响增殖、迁移等途径达到调控作用[29-30]。宋宇可等[31]实验研究发现,血管生成数和长度的增长与VEGF、VEGFR-2表达的上调密切相关。栾冰等[32]在研究中发现,化瘀通络中药单体的主要成分可通过抑制VEGFR2/Akt/ERK1/2信号通路调节血管新生,进一步印证了VEGFR2在血管新生中的作用。本实验研究发现,与模型组比较,桃红四物汤低、中、高剂量组的VEGFR2蛋白表达明显升高(P<0.05);与桃红四物汤低剂量组比较,桃红四物汤中剂量组VEGFR2蛋白的表达明显升高(P<0.05);桃红四物汤低、高剂量组的VEGFR2蛋白表达差异无统计学意义(P>0.05);说明桃红四物汤能提高VEGFR2蛋白表达水平,但并不是浓度越高越好,以中剂量桃红四物汤为最佳。
Notch信号通路由Notch受体、配体及下游信号分子组成。哺乳动物中有Notch1、Notch2、Notch3、Notch4共4个Notch受体和Deltalike1、Deltalike3、Deltalike4,Jagged1、Jagged2 5个配体,其中Notch1和Dll4与损伤血管的修复和血管新生关系最为密切[33-34]。有研究发现,基因敲除小鼠Dll4比敲除Notch1会出现更加严重的血管缺陷;在血管新生过程中,Notch1受体必须与配体Dll4相结合才能激活,发挥Notch信号通路的作用[35]。有研究证明[36],动脉内皮细胞上血管内皮生长因子可诱导Notch1及其配体Dll4的表达来促进损伤内皮修复,若Notch信号通路被阻断,血管内皮细胞将停止增殖。LI等[37]研究发现,宣痹通瘀方可通过促进Dll4表达,从而促进心肌缺血大鼠血管生成。HE等[38]研究发现,锦鸡儿总黄酮通过促进脑组织中Dll4和VEGF的表达,促进大脑中动脉闭塞大鼠的局部血管生成,改善局部血循环,使缺血性脑卒中症状改善并使梗死面积减少。HULTGREN等[39]研究发现,通过Dll4-Notch-VEGFR2轴可以调节内皮细胞活化和血管生成。Dll4作为Notch信号通路的配体之一,在血管修复和新生过程中起着十分重要的作用。本研究结果显示,低、中、高剂量的桃红四物汤均具有促进股骨头Dll4蛋白表达的作用,并随着药物浓度的提升不断增强;与低剂量组比较,桃红四物汤高剂量组Dll4蛋白表达明显升高,且差异有统计学意义(P<0.05);但桃红四物汤中、高剂量组之间的差异无统计学意义(P>0.05),表明Dll4蛋白表达并不是随着药物浓度的升高而无限增加。
综上所述,经典活血方桃红四物汤可有效改善创伤性ONFH形态,有效降低股骨头空骨陷窝率;桃红四物汤中、高剂量组可明显增加股骨头VEGFR2和Dll4蛋白的表达,与药物浓度有一定的相关性,但不是随着浓度升高而无限增加。因此,推测中、高剂量的桃红四物汤能有效降低股骨头组织空骨陷窝、改善组织形态,可能与增加VEGFR2、Dll4蛋白的表达,激活VEGF/Notch信号通路有关,但是否具有靶向作用,需进一步深入研究。
参考文献
[1] 任忠陆, 齐 琳. 股骨头坏死中医药治疗的研究新进展[J]. 现代中西医结合杂志, 2022, 31(10): 1455-1460.
[2] TAN B, LI W L, ZENG P, et al. Epidemiological study based on China osteonecrosis of the femoral head database[J]. Orthopaedic Surgery, 2021, 13(1): 153-160.
[3] 杨 飞, 王国栋, 马 辉, 等. 全髋关节置换术后翻修的原因分析[J]. 中国骨与关节损伤杂志, 2020, 35(6): 561-564.
[4] 石淇允, 李无阴, 张 颖, 等. 桃红四物汤加减治疗股骨头坏死的研究进展[J]. 上海中医药杂志, 2021, 55(4): 97-100.
[5] 王 雷, 陈 坤. 基于网络药理学分析桃红四物汤治疗股骨头坏死的机制[J]. 实用临床医药杂志, 2021, 25(2): 10-15, 19.
[6] 张同威, 鄭文杰, 刘 岩, 等. 原花青素对烫伤大鼠创面愈合及VEGF/VEGFR表达的影响[J]. 广西医科大学学报, 2022, 39(1): 74-80.
[7] L?譫PEZ-GUERRA M, XARGAY-TORRENT S, FUENTES P, et al. Specific NOTCH1 antibody targets DLL4-induced proliferation, migration, and angiogenesis in NOTCH1-mutated CLL cells[J]. Oncogene, 2020, 39(6): 1185-1197.
[8] PELED E, BEJAR J, ZINMAN C, et al. Prevention of distortion of vascular deprivation-induced osteonecrosis of the rat femoral head by treatment with alendronate[J]. Archives of Orthopaedic and Trauma Surgery, 2009, 129(2): 275-279.
[9] 楼鹏强, 魏 巍, 侯德才. 股骨头坏死动物模型评价方法的优缺点及展望[J]. 中国组织工程研究, 2021, 25(32): 5210-5214.
[10] 章元沛. 药理学实验[M]. 2版. 北京: 人民卫生出版社, 1996: 238.
[11] 李慧英, 孟东方, 阮志磊. 骨碎补总黄酮对激素性股骨头坏死血钙、血磷及空骨陷窝率的影响[J]. 中华中医药杂志, 2016, 31(12): 5352-5354.
[12] KONARSKI W, POBO Y T, LIWCZY SKI A, et al. Avascular necrosis of femoral head-overview and current state of the art[J]. International Journal of Environmental Research and Public Health, 2022, 19(12): 7348.
[13] 秦宇星, 任前贵, 李子龙, 等. 骨微血管内皮细胞在股骨头坏死中的作用机制及前景[J]. 中国组织工程研究, 2023, 27(6): 955-961.
[14] 张 颖, 张蕾蕾, 孙瑞波, 等. 补肾活血法对人骨髓间充质干细胞成骨能力的影响及miR-93-5p对其的抑制作用[J]. 中华中医药杂志, 2018, 33(2): 667-671.
[15] 史嵩海, 赵 欢, 张金培. 李军教授应用桃红四物汤临床经验总结[J]. 环球中医药, 2018, 11(9): 1462-1465.
[16] 康斯文, 侯德才. 桃红四物汤对股骨头坏死患者BGP、BAP水平及血液流变学影响[J]. 辽宁中医药大学学报, 2021, 23(3): 139-142.
[17] 林智军, 李玉茂, 谢晓勇, 等. 桃红四物汤加减治疗对气滞血瘀型股骨头坏死骨修复及血液流变学的影响[J]. 世界中医药, 2018, 13(1): 105-108.
[18] 高玉龙, 陶慧君. 桃红四物汤加减在早期股骨头坏死术后的应用效果分析[J]. 中国烧伤创疡杂志, 2022, 34(5): 352-356, 360.
[19] 姚金龙, 冯海波, 孙绍裘. 桃红四物汤治疗创伤性股骨头坏死临床疗效的观察[J]. 中国医药科学, 2019, 9(21): 9-12, 59.
[20] 王小斌, 蒋红心, 屈长宏, 等. 桃红四物汤干预外周血内皮祖细胞数量与功能增加的时间剂量效应[J]. 中国组织工程研究, 2019, 23(9): 1354-1358.
[21] 柳景红, 刘登义, 陈振中, 等. 桃红四物汤对急性深静脉血栓模型大鼠血清IL-6和TNF-α水平的影响[J]. 湖南中医药大学学报, 2019, 39(1): 32-34.
[22] 周占国, 郭浩山, 关 涛, 等. 股骨头坏死病因的相关因素分析[J]. 中医正骨, 2020, 32(1): 7-10.
[23] ALVES N, ZAROR C, DEL SOL M, et al. Effects of laser photobiomodulation on TGF-?茁 and VEGF expression in burn wound: Systematic review and meta-analysis in the animal model[J]. International Journal of Morphology, 2022, 40(1): 194-203.
[24] 魏 英, 王鈺莹, 姚观平, 等. 加味四物汤促进血管新生改善急性心肌梗死大鼠心功能[J]. 中国医院药学杂志, 2022, 42(6): 612-616.
[25] 赵建涛, 黄 佳, 罗晓玲, 等. 芪仙通络方对脑梗死大鼠血管新生及VEGF表达的影响[J]. 中医药临床杂志, 2022, 34(2): 318-323.
[26] LIU T T, LI Y H, SU H, et al. Nuclear localization of the tyrosine kinase BMX mediates VEGFR2 expression[J]. Journal of Cellular and Molecular Medicine, 2020, 24(1): 126-138.
[27] 王师英, 孙博云, 林 江, 等. VEGFR2在血管新生与重塑中的调控作用[J]. 中国老年学杂志, 2017, 37(19): 4924-4927.
[28] DING J, JIA W, CUI Y G, et al. Anti-angiogenic effect of a chemically sulfated polysaccharide from Phellinus ribis by inhibiting VEGF/VEGFR pathway[J]. International Journal of Biological Macromolecules, 2020, 154: 72-81.
[29] STEPANOVA V, JAYARAMAN P S, ZAITSEV S V, et al. Urokinase-type plasminogen activator (uPA) promotes angiogenesis by attenuating proline-rich homeodomain protein (PRH) transcription factor activity and de-repressing vascular endothelial growth factor (VEGF) receptor expression[J]. The Journal of Biological Chemistry, 2016, 291(29): 15029-15045.
[30] NAGARKOTI S, KIM Y M, ASH D, et al. Protein disulfide isomerase A1 as a novel redox sensor in VEGFR2 signaling and angiogenesis[J]. Angiogenesis, 2023, 26(1): 77-96.
[31] 宋宇可, 叶利群, 黄钟威, 等. 滋肾活血方联合低分子肝素对血管内皮细胞VEGF、VEGFR-2、ERK和血管生成的影响[J]. 中国现代医生, 2022, 60(3): 59-62, 66, 197.
[32] 栾 冰, 袁 蓉, 信琪琪, 等. 化瘀通络中药单体对VEGF诱导的人脐静脉内皮细胞血管新生和炎症反应的影响[J]. 中国中药杂志, 2022, 47(3): 737-744.
[33] 姚兴璋, 刘 涛, 何志军, 等. 消肿止痛合剂对大鼠缺血皮瓣血管再生及VEGF-Dll4/Notch信号通路的影响[J]. 暨南大学学报(自然科学与医学版), 2021, 42(2): 164-171.
[34] XIA S, MENDEN H L, TOWNLEY N, et al. Delta-like 4 is required for pulmonary vascular arborization and alveolarization in the developing lung[J]. JCI Insight, 2021, 6(7): e134170.
[35] LIEBLER S S, FELDNER A, ADAM M G, et al. No evidence for a functional role of bi-directional Notch signaling during angiogenesis[J]. PLoS One, 2012, 7(12): e53074.
[36] QI C Y, LIN Y T, LIN D S. The effect of Shu Xue Tong treatment on random skin flap survival via the VEGF-Notch/Dll4 signaling pathway[J]. Journal of Investigative Surgery, 2020, 33(7): 615-620.
[37] LI S D, DONG J R, TA G, et al. Xuan Bi Tong Yu Fang promotes angiogenesis via VEGF-Notch1/Dll4 pathway in myocardial ischemic rats[J]. Evidence-Based Complementary and Alternative Medicine, 2020, 2020: 5041629.
[38] HE Q S, LI S R, LI L L, et al. Total flavonoids in Caragana (TFC) promotes angiogenesis and enhances cerebral perfusion in a rat model of ischemic stroke[J]. Frontiers in Neuroscience, 2018, 12: 635.
[39] HULTGREN N W, FANG J S, ZIEGLER M E, et al. Slug regulates the Dll4-Notch-VEGFR2 axis to control endothelial cell activation and angiogenesis[J]. Nature Communications, 2020, 11(1): 5400.
(本文編辑 周 旦)
