西黄胶囊调控IL-6/JAK2/STAT3信号通路促进非哺乳期乳腺炎大鼠模型创面愈合的作用机制研究
2023-08-14王月,刘丽芳,周亮,胡金辉
王月,刘丽芳,周亮,胡金辉




〔摘要〕 目的 觀察西黄胶囊对非哺乳期乳腺炎大鼠模型创面愈合及白细胞介素-6(interleukin-6, IL-6)/非受体型酪氨酸蛋白激酶2(Janus kinase 2, JAK2)/信号转导及转录激活蛋白3(signal transducer and activator of transcription 3, STAT3)信号通路的影响。方法 复制非哺乳期乳腺炎大鼠模型,随机分为模型对照组、阳性药物组、中药治疗组、联合用药组,每组10只,另选取10只同批次SPF级健康SD大鼠作为假手术组。干预后观察并评估各组大鼠的创面愈合情况及乳腺炎症指数,HE染色法观察各组大鼠乳腺组织的病理改变;免疫组织化学法检测各组大鼠乳腺组织B淋巴细胞瘤-2基因关联X蛋白(B-cell lymphoma-2-associated X, BAX)、B淋巴细胞瘤-2基因(B-cell lymphoma-2, Bcl-2)的平均光密度值;Western blot法及RT-PCR法检测各组大鼠乳腺组织IL-6、JAK2、STAT3、人胱天蛋白酶9(Caspase-9)蛋白及mRNA的表达水平。结果 与假手术组大鼠比较,模型对照组大鼠的创面愈合率明显降低(P<0.05),而乳腺炎症指数,乳腺组织BAX、Bcl-2平均光密度值,IL-6、JAK2、STAT3、Caspase-9蛋白及mRNA的表达水平显著升高(P<0.05)。HE染色可见模型对照组大鼠乳腺腺叶存在明显的肉芽肿变性,周围充斥大量炎症细胞,阳性药物组、中药治疗组、联合用药组大鼠的病理情况存在不同程度的缓解,炎性细胞浸润及肉芽肿组织明显减少,“空泡样”坏死存在不同程度的愈合。与模型对照组比较,阳性药物组、中药治疗组、联合用药组的创面愈合率、Bcl-2光密度值均明显升高(P<0.05);其中联合用药组的创面愈合率、Bcl-2光密度值明显高于阳性药物组及中药治疗组(P<0.05);阳性药物组的创面愈合率高于中药治疗组(P<0.05),Bcl-2光密度值与中药治疗组比较差异无统计学意义(P>0.05)。与模型对照组比较,阳性药物组、中药治疗组、联合用药组的BAX光密度值、乳腺炎症指数均明显下降(P<0.05);其中联合用药组的BAX光密度值、乳腺炎症指数明显低于阳性药物组及中药治疗组(P<0.05);阳性药物组的乳腺炎症指数低于中药治疗组(P<0.05),BAX光密度值与中药治疗组比较差异无统计学意义(P>0.05)。与模型对照组比较,阳性药物组、中药治疗组、联合用药组的IL-6、JAK2、STAT3、Caspase-9蛋白及mRNA的表达水平均明显降低(P<0.05);其中联合用药组上述蛋白及mRNA表达水平明显低于阳性药物组及中药治疗组(P<0.05),而阳性药物组的上述蛋白及mRNA表达水平均明显高于中药治疗组(P<0.05)。结论 西黄胶囊能有效促进非哺乳期乳腺炎大鼠模型的乳腺组织创面愈合,抑制乳腺组织细胞凋亡及炎症反应,其作用机制可能与西黄胶囊抑制IL-6/JAK2/STAT3信号通路相关。
〔关键词〕 非哺乳期乳腺炎;西黄胶囊;IL-6/JAK2/STAT3信号通路;创面修复;作用机制
〔中图分类号〕R285 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.07.004
Mechanism of action for Xihuang Capsule in promoting wound healing in non-lactational mastitis rat model by regulating IL-6/JAK2/STAT3 signaling pathway
WANG Yue, LIU Lifang, ZHOU Liang, HU Jinhui*
The First Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China
〔Abstract〕 Objective To observe the effects of Xihuang Capsule on wound healing and the signaling pathway of interleukin-6 (IL-6)/Janus kinase 2 (JAK2)/signal transducer and activator of transcription 3 (STAT3) in non-lactational mastitis rat model. Methods The non-lactational mastitis rat model was duplicated and randomly divided into model control group, positive drug group, Chinese medicines group, and drug combination group, with 10 rats in each group. Another 10 SPF grade healthy SD rats in the same batch were selected as sham-operated group. After intervention, the wound healing condition and breast inflammation index of rats were observed and evaluated in each group, and histopathological changes of breast tissue of rats in each group were observed by HE staining. Immunohistochemical method was used to determine the average optical density of B-cell lymphoma-2 gene associated X protein (BAX) and B-cell lymphoma-2 gene (Bcl-2) in breast tissues of rats in each group. Western blot and RT-PCR were used to examine the expression levels of IL-6, JAK2, STAT3, human Caspase-9 protein, and mRNA in breast tissue of rats in each group. Results Compared with the rats in sham-operated group, the wound healing rate of rats in model control group was significantly lower (P<0.05), while the breast inflammation index, the average optical density of BAX and Bcl-2 in the breast tissue, and the expression levels of IL-6, JAK2, STAT3, Caspase-9 protein, and mRNA were significantly higher (P<0.05). HE staining showed that there was obvious granuloma degeneration in the mammary gland lobes of rats in model control group, surrounded by numerous inflammatory cells. The pathological condition of rats in positive drug group, Chinese medicines group, and drug combination group were alleviated to varying degrees. There was a significant decrease in inflammatory cell infiltration and granuloma tissue and the "vacuolar" necrosis was healed to varying degrees. Compared with model control group, the wound healing rate and Bcl-2 optical density of positive drug group, Chinese medicines treatment group, and drug combination group increased significantly (P<0.05). The wound healing rate and Bcl-2 optical density of drug combination group were significantly higher than those of positive drug group and Chinese medicines group (P<0.05). The wound healing rate of positive drug group was higher than that of Chinese medicines group (P<0.05), and there was no statistically significant difference in Bcl-2 optical density compared with Chinese medicines group (P>0.05). Compared with model control group, the BAX optical density and breast inflammation index of positive drug group, Chinese medicines group, and drug combination group decreased significantly (P<0.05). The BAX optical density and breast inflammation index of drug combination group were significantly lower than those of positive drug group and Chinese medicines group (P<0.05); the breast inflammation index of positive drug group was lower than that of Chinese medicines group (P<0.05) and the BAX optical density showed no statistical significance compared with that of Chinese medicines group (P>0.05). Compared with model control group, the expression levels of IL-6, JAK2, STAT3, Caspase-9 protein, and mRNA in positive drug group, Chinese medicines group, and drug combination group reduced significantly (P<0.05). The expression levels of the aforementioned proteins and mRNA in drug combination group were significantly lower than those in positive drug group and Chinese medicines group (P<0.05), while the expression levels of the aforementioned proteins and mRNA in positive drug group were significantly higher than those in Chinese medicines group (P<0.05). Conclusion Xihuang Capsule can effectively promote the wound healing of breast tissue in non-lactational mastitis rat model, and inhibit the apoptosis and inflammatory response of breast histiocyte. Its mechanism of action may be related to the inhibition of IL-6/JAK2/STAT3 signaling pathway by Xihuang Capsule.
〔Keywords〕 non-lactational mastitis; Xihuang Capsule; IL-6/JAK2/STAT3 signaling pathway; wound healing; mechanism of action
非哺乳期乳腺炎(non-puerperal mastitis, NPM)多指女性在非妊娠期、哺乳期发病的乳房慢性炎症[1-2]。肉芽肿性乳腺炎(granulomatous lobular mastitis, GLM)是NPM中最常见的临床类型。NPM往往反复发作,迁延不愈,并在乳房皮肤形成大量瘘管窦道,严重破坏患者的乳房外观[3]。目前,医学界治疗NPM仍无标准的临床指南和治疗方案,NPM在酿脓期后进行手术切开排脓治疗往往会造成更多的病理性窦道及瘘管,手术治疗带来的创伤、恐惧心理、乳房外形损伤、术后瘢痕形成严重降低了患者的生活质量[4]。现阶段,NPM是医学界颇为棘手的难题,是研究者亟须攻克的临床重点,查阅现有文献总结本病的治疗关键,包括调控乳腺局部炎性反应、改善局部症状、提升免疫功能[5-6]。在NPM发病机制的相关研究上,有学者提出了研究结论,但仍存在较大争议,临床疗效欠佳[7]。因此,寻求有效治疗NPM、保护乳房外形、减少患者身心痛苦的治疗手段意义重大。
NPM相当于中医学“粉刺性乳痈”[8],诸多医家对本病的病因病机及发展预后多有论述,一般认为痰瘀郁结、热盛肉腐是NPM的病机。西黄胶囊由牛黄、麝香、乳香、没药等药物组成,方简力专,具有清热结、通瘀滞、消肿止痛的功效[9]。目前,西黄胶囊治疗NPM的临床研究较多,但其治疗NPM的基础研究鲜见报道。本实验研究以前期预实验为基础,通过构建NPM大鼠模型,探讨西黄胶囊对NPM大鼠模型创面愈合的影响及作用机制。
1 材料与方法
1.1 动物
50只SPF级雌性SD大鼠,6~7周龄,体质量180~200 g,购自湖南斯莱克景达实验动物有限公司,动物许可证号:SCXK(湘)2019-0004,合格证号:43072663411384024。适应性喂养1周,自由摄食,环境温度24~26 ℃,相对湿度50%~60%,实验全程按照动物伦理学标准进行(伦理批准号:LL2021009)。
1.2 主要药物与试剂
西黄胶囊(石家庄东方药业股份有限公司,批号:20220317);醋酸泼尼松龙片(天津信谊津津药业有限公司,批号:2022062304);白细胞介素-6(interleukin-6, IL-6)、非受体型酪氨酸蛋白激酶2(Janus kinase 2, JAK2)、信号转导及转录激活蛋白3(signal transducer and activator of transcription 3, STAT3)、B淋巴细胞瘤-2基因关联X蛋白(B-cell lymphoma-2-associated X, BAX)、B淋巴细胞瘤-2基因(B-cell lymphoma-2, Bcl-2)、人胱天蛋白酶9(Caspase-9)抗体(美国proteintech公司,批号分别为21865-1-AP、66466-1-Ig、10253-2-AP、10380-1-AP、50599-2-Ig、12789-1-AP);HRP山羊抗小鼠IgG二抗(美国Proteintech公司,批号:SA00001-1);PBS缓冲液(美国Hyclone公司,批号:803344098)。
1.3 主要仪器
电镜(德国徕卡公司,型号:8344-II);荧光PCR板、荧光定量RCP仪(美国Thermo公司,型号分别为66347-A、PIKOREAL96);电动摇床(海门市其林贝尔仪器制造有限公司,型号:TS-92);水平琼脂糖电泳槽、电泳仪、转膜仪(北京六一仪器厂,型号分别为JK3056、DYY-2C、DYCZ-40D);其余实验试剂及仪器均由实验室提供。
1.4 NPM大鼠模型的建立与分组
参考YU等[10]的NPM大鼠模型建立方法。术中取人体新鲜NPM病变组织与生理盐水按1∶3比例,3 000 r/min(半径16 cm)离心,离心后与弗氏完全佐试剂按1∶1比例混合备用。将制备好的组织匀浆(0.04 mL)于大鼠第3、第4对乳房进行注射包埋,1周后进行大鼠乳腺组织局部观察,随机处死2只大鼠,取第3、第4对乳腺组织,进行病理切片观察,镜下出现特征性的脂质空泡周围伴多种炎症细胞浸润,形成肉芽肿性炎症或微脓肿时,即可确认造模成功。
1.5 动物分组与给药
随机选取40只已成模的NPM大鼠模型分为模型对照组、阳性药物组(醋酸泼尼松龙组)、中药治疗组(西黄胶囊组)、联合用药组(醋酸泼尼松龙+西黄胶囊组),每组10只。另选取10只SPF级SD大鼠作为假手术组。
假手术组与模型对照组均予2 mL的生理盐水灌胃1次/d;中药治疗组大鼠予西黄胶囊人等效剂量溶于2 mL生理盐水进行灌胃,给药剂量0.072 g/(kg·d),1次/d;阳性药物组予醋酸泼尼松龙片人等效剂量溶于2 mL生理盐水灌胃,给药剂量0.001 8 g/(kg·d),1次/d;联合用药组予醋酸泼尼松龙片+西黄胶囊浸膏灌胃,剂量同前,1次/d。均连续干预14 d。
1.6 指标观察
1.6.1 创面愈合率测定 于干预1、2、3周后,采用Image PLUS 6.0软件测量各组大鼠乳腺存在瘺管窦道的创面面积,计算创面愈合率。创面愈合率=(初始创面测量面积-处死前创面测量面积)/初始创面测量面积×100%。
1.6.2 组织病理学检测 随机选取各组大鼠乳腺瘘管窦道组织,于4%多聚甲醛固定48 h后脱水、包埋,采用HE染色法观察各组大鼠瘘管窦道的组织病理情况。
1.6.3 乳腺炎症指数 参考周瑶等[11]评价NPM大鼠模型乳腺炎症指数的方法对各组大鼠的乳腺炎症指数进行评价。详见表1。
1.6.4 免疫组织化学染色 根据试剂说明书步骤进行操作,具体为:选取各组大鼠的乳腺瘘管窦道组织,将脱蜡后进行封闭,添加一抗、二抗,DAB显色,进一步脱水、封片,随机选取5个视野进行分析,分析软件及版本号为Image pro Plus 6.0,平均光密度值(average optical density value, AOD)作为蛋白阳性表达水平。
1.6.5 Western blot检测大鼠乳腺瘘管窦道组织IL-6、JAK2、STAT3、Caspase-9表达水平 提取各组大鼠乳腺组织总蛋白,经凝胶电泳后将蛋白置于PVDF膜,5%脱脂奶粉完全封闭孵育60 min,添加一抗抗体IL-6、JAK2、STAT3、Caspase-9,4 ℃环境下静置12 h,弃去一抗,TBST洗膜3次,每次5 min。室温孵育二抗2 h,洗涤后弃去二抗,TBST洗膜3次,每次5 min。显色后以GAPDH作为内参,计算各蛋白的灰度比值。
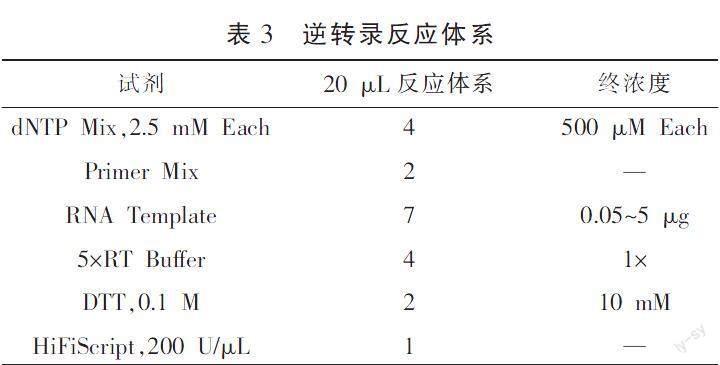
1.6.6 RT-PCR检测大鼠乳腺瘘管窦道组织IL-6、JAK2、STAT3、Caspase-9 mRNA表达水平 提取大鼠乳腺组织总RNA,逆转录为cDNA,特异性扩增IL-6、JAK2、STAT3、Caspase-9,GAPDH为内参,反应条件为95 ℃,10 min变性;95 ℃,15 s;60 ℃,60 s;40次循环。采用2-△△Ct方法计算各蛋白的mRNA表达量,引物序列详见表2,逆转录反应体系详见表3。
1.7 统计学处理
采用SPSS 22.0软件对实验数据进行统计处理与分析。采用“x±s”描述计量资料。组间比较采用多样本单因素方差分析,多次重复比较采用重复测量的方差分析,两两样本比较采用LSD-t检验。以P<0.05作为差異有统计学意义。
2 结果
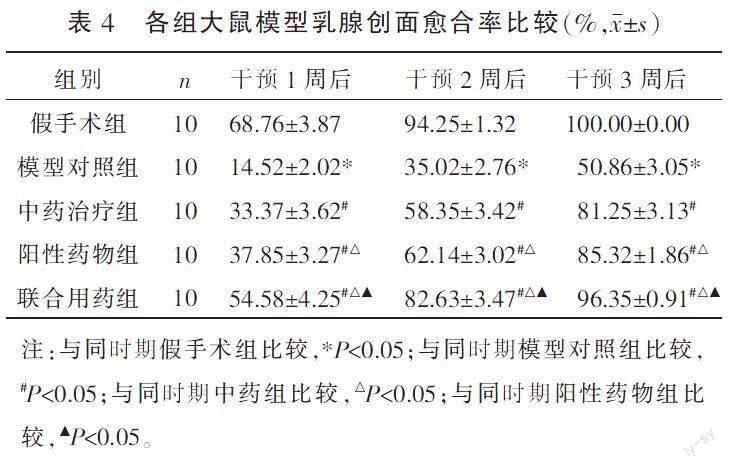
2.1 各组大鼠模型乳腺创面愈合率比较
假手术组大鼠乳腺创面在第3周已完全愈合。与假手术组大鼠比较,模型对照组大鼠的创面愈合率显著降低(P<0.05);与模型对照组比较,阳性药物组、中药治疗组、联合用药组的创面愈合率均明显升高(P<0.05),其中联合用药组创面愈合率明显高于阳性药物组及中药治疗组(P<0.05),阳性药物组创面愈合率高于中药治疗组(P<0.05)。详见表4。
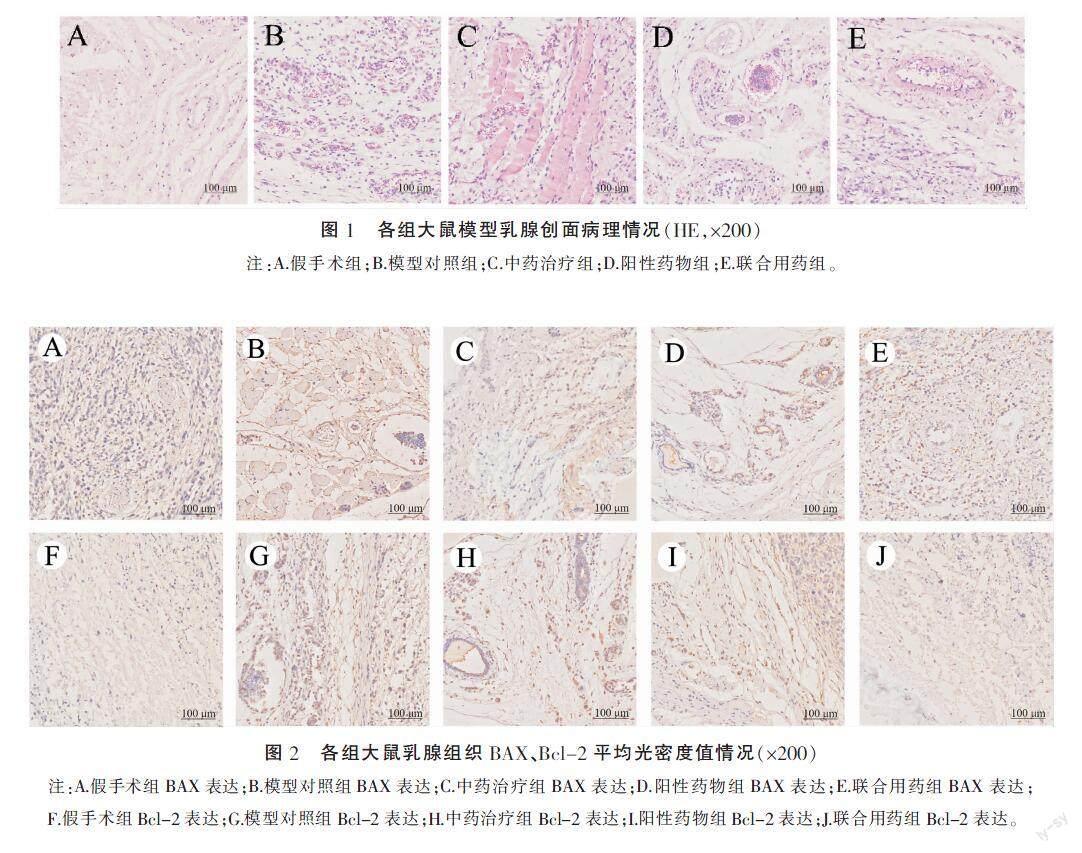
2.2 各组大鼠模型乳腺创面病理情况
HE染色结果显示,模型对照组与假手术组对比,大鼠乳腺腺叶存在明显的肉芽肿变性,周围充斥大量炎症细胞;阳性药物组、中药治疗组、联合用药组大鼠的病理情况存在不同程度的缓解,炎性细胞浸润及肉芽肿组织明显减少,“空泡样”坏死存在不同程度的愈合。详见图1。
2.3 各组大鼠乳腺炎症指数及凋亡相关蛋白表达水平比较
与假手术组大鼠比较,模型对照组大鼠乳腺组织BAX、Bcl-2 AOD值,乳腺炎症指数显著升高(P<0.05);与模型对照组比较,阳性药物组、中药治疗组、联合用药组的Bcl-2 AOD值均明显升高(P<0.05),其中联合用药组Bcl-2 AOD值明显高于阳性药物组及中药治疗组(P<0.05),阳性药物组与中药治疗组比较无明显差异(P>0.05);与模型对照组比较,阳性药物组、中药治疗组、联合用药组的BAX AOD值均明显下降(P<0.05),其中联合用药组BAX AOD值明显低于阳性药物组及中药治疗组(P<0.05),阳性药物组与中药治疗组比较无明显差异(P>0.05);与模型对照组比较,阳性药物组、中药治疗组、联合用药组的乳腺炎症指数均明显下降(P<0.05),其中联合用药组乳腺炎症指数明显低于阳性药物组及中药治疗组(P<0.05),阳性药物组乳腺炎症指数低于中药治疗组(P<0.05)。详见表5、图2。
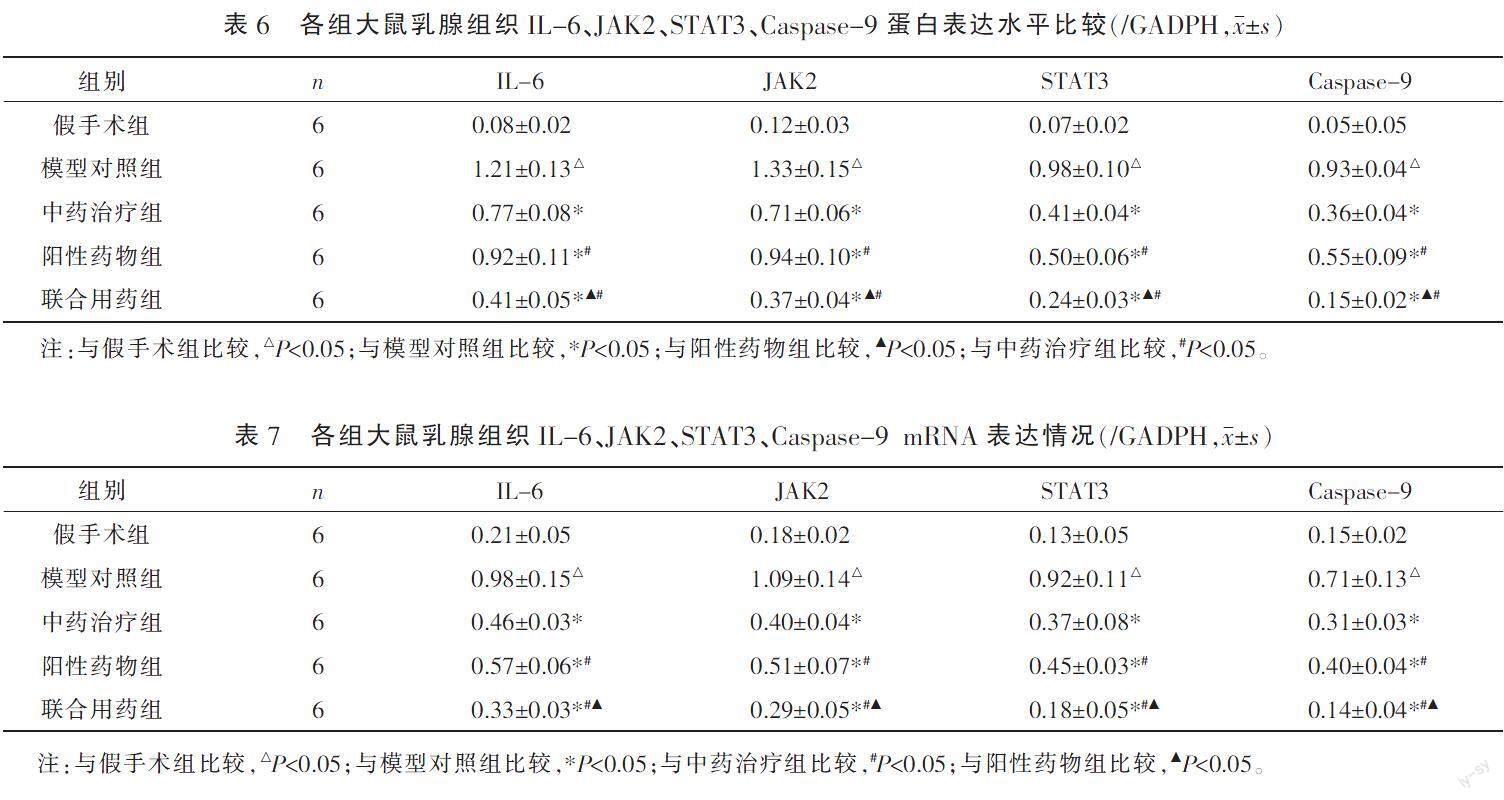
2.4 各组大鼠乳腺组织IL-6、JAK2、STAT3、Caspase-9蛋白及mRNA的表达水平比较
与假手术组大鼠比较,模型对照组大鼠IL-6、JAK2、STAT3、Caspase-9蛋白及mRNA的表达水平显著升高(P<0.05);与模型对照组比较,阳性药物组、中药治疗组、联合用药组的IL-6、JAK2、STAT3、Caspase-9蛋白及mRNA的表达水平均明显降低(P<0.05),其中联合用药组上述蛋白及mRNA表达水平明显低于阳性药物组及中药治疗组(P<0.05),而阳性药物组的IL-6、JAK2、STAT3、Caspase-9蛋白及mRNA的表达水平均明显高于中药治疗组(P<0.05)。详见表6—7、图3。
3 讨论
目前,NPM的发生、发展及治疗相关机制仍未完全阐明。现代医学认为,NPM的发生受自身免疫功能异常、反复发生的炎症感染、泌乳素异常分泌、基因多态性、外来损伤等因素影响,同时与体内的多个信号通路及生物学过程调控的生理病理改变密切相关[12-13]。在治疗上多采取手术治疗、抗感染治疗、激素治疗、免疫治疗等方式,但往往临床效果欠佳。KONG等[14]研究表明,NPM的发生与炎症因子IL-6密切相关,由其作为启动子的JAK2/STAT3信号通路目前已被证实是调控女性泌乳素增高的关键信号通路,同时LIU等[15]认为其可能是导致NPM发生、发展的重要信号通路。
通常认为,IL-6/JAK2/STAT3信号转导途径是细胞内调控转录的关键通路。IL-6作为炎性应激的启动子激活JAK2蛋白,其能够激活细胞内的STAT3蛋白促进泌乳素的分泌,同时使得促炎因子积聚在乳腺部位,STAT3蛋白激活后,其磷酸化水平增加,发生活化并进入细胞核,入核后的STAT3能够启动基因Caspase-9、BAX等凋亡基因的表达,并促进IL-6蛋白的表达,前者介导细胞凋亡水平加快,后者介导炎性反应加剧,二者之间往往形成恶性循环,Caspase-9、BAX等凋亡基因可促进炎性反应,反之亦然,导致大量的炎性物质释放至细胞外,造成强烈的炎性反应[16-18]。ZHANG等[19]研究证实,IL-6/JAK2/STAT3信号通路的激活机制属于级联反应,一旦该信号通路过度激活,促进局部的炎性反应及自身免疫抵抗,从而发生超量的免疫、炎性反应及局部损伤。在临床中,NPM患者往往在乳房局部发生非乳房部位的结节性红斑、关节炎等表现。由此可见,IL-6/JAK2/STAT3信号通路介导的炎症以及自身免疫应答反应是NPM发生、发展的两大重要因素。在本研究动物模型的选择上,由于目前临床上多数NPM患者在病理上可发现肉芽肿[20],因此,选取人NPM组织和弗氏完全佐试剂混合匀浆后进行造模的方法构建NPM大鼠模型,造模成功率较高,存在较好的创新性,值得进一步推广,亦将在接下来的研究中继续使用。
中医学认为,NPM多属于“粉刺性乳痈”范畴,清代名医叶桂在《临证指南医案·卷九》中提出:“(女子)乳房以肝为先天”,肝气郁结,拂郁难解,日久痰瘀结聚乳房局部,加之脾胃湿热,热盛肉腐,肿块难消,形成难脓、难溃、难敛之有形包块,日久迁延,颇为棘手,患者痛苦不堪。古今医家多从清热、化痰、散瘀等治法着手,可起到较显著的临床疗效。西黄胶囊是中医外科经典方剂西黄丸的胶囊剂型,其由牛黄、麝香、乳香、没药等药物组成,方简力专,能清热结、通瘀滞、消肿止痛。顾媛媛等[21]研究证实,西黄丸具有改善局部内环境免疫稳态、缓解炎性反应的功能。目前有关西黄胶囊治疗NPM的药效机制研究及基础研究较为少见,多数研究属于个案分析及临床观察,因此本研究具有较高的创新性。
本研究結果显示,西黄胶囊能有效促进NPM大鼠模型创面愈合,调控BAX、Bcl-2等凋亡因子改善局部病理情况,抑制局部炎性反应程度,同时降低NPM大鼠模型乳腺组织IL-6、JAK2、STAT3、Caspase-9蛋白及mRNA表达水平,其中联合用药组效果最佳,凸显出中西医结合治疗NPM的“协同增效”作用。研究IL-6/JAK2/STAT3信号通路在NPM的具体作用机制,为本病治疗提供了新的思路及方法,是较为值得去尝试的重要研究方向之一。综上所述,西黄胶囊能有效促进NPM大鼠模型的乳腺组织创面愈合,抑制乳腺组织细胞凋亡及炎症反应,其作用机制可能与西黄胶囊抑制IL-6/JAK2/STAT3信号通路相关。
参考文献
[1] ZHANG L N, HU J N, GUYS N, et al. Diffusion-weighted imaging in relation to morphology on dynamic contrast enhancement MRI: The diagnostic value of characterizing non-puerperal mastitis[J]. European Radiology, 2018, 28(3): 992-999.
[2] ZHOU F, SHANG X C, TIAN X S, et al. Clinical practice guidelines for diagnosis and treatment of patients with non-puerperal mastitis: Chinese Society of Breast Surgery (CSBrS) practice guideline 2021[J]. Chinese Medical Journal, 2021, 134(15): 1765-1767.
[3] TSAI M J, HUANG W C, WANG J T, et al. Factors associated with treatment duration and recurrence rate of complicated mastitis[J]. Journal of Microbiology, Immunology and Infection, 2020, 53(6): 875-881.
[4] LI X Q, WU H L, YUAN J P, et al. Bacteria associated with granulomatous lobular mastitis and the potential for personalized therapy[J]. Journal of Investigative Surgery, 2022, 35(1): 164-170.
[5] AYDIN I, KESICIOGLU T, VURAL S, et al. Idiopathic granulomatous lobular mastitis: An imitation of breast carcinoma[J]. Cureus, 2021, 13(5): e15206.
[6] LEI Q R, YANG X, MIAO C M, et al. Relationship between granulomatous lobular mastitis and methylene tetrahydrofolate reductase gene polymorphism[J]. World Journal of Clinical Cases, 2020, 8(18): 4017-4021.
[7] YIN L, AGYEKUM E A, ZHANG Q, et al. Gynecomastia with rare granulomatous lobular mastitis: A case report and literature review[J]. The Journal of International Medical Research, 2022, 50(1): 3000605221075815.
[8] 刘 慧, 李 鑫, 周 亮, 等. 九华膏治疗溃后期非哺乳期乳腺炎临床研究[J]. 湖南中医药大学学报, 2022, 42(6): 1004-1008.
[9] 戴 旭, 解茂阳. 基于网络药理学及实验验证探讨西黄胶囊治疗肉芽肿性乳腺炎的作用机制[J]. 中国医院药学杂志, 2022, 42(9): 889-895.
[10] YU J J, BAO S L, YU S L, et al. Mouse model of plasma cell mastitis[J]. Journal of Translational Medicine, 2012, 10(Suppl 1): S11.
[11] 周 瑶, 刘丽芳, 柳佳璐, 等. 柴胡清肝汤干预NLRP3/IL-1β通路治疗肉芽肿性小叶性乳腺炎模型大鼠的作用机制[J]. 中国实验方剂学杂志, 2022, 28(15): 1-7.
[12] TARIQ H, MENON P D, FAN H X, et al. Detection of Cory?鄄
nebacterium kroppenstedtii in granulomatous lobular mastitis using real-time polymerase chain reaction and Sanger sequencing on formalin-fixed, paraffin-embedded tissues[J]. Archives of Pathology & Laboratory Medicine, 2022, 146(6): 749-754.
[13] LUO W, XU B, WANG L, et al. Clinical characteristics and predictive factors of erythema nodosum in granulomatous lobular mastitis[J]. The Australasian Journal of Dermatology, 2021, 62(3): 342-346.
[14] KONG C, ZHANG C J, WU Y Q, et al. The expression and meaning of CD68, CD163, CD57, and IgG4 in granulomatous lobular mastitis[J]. Gland Surgery, 2020, 9(4): 936-949.
[15] LIU Y, SUN Y S, ZHOU Y H, et al. Sinomenine hydrochloride inhibits the progression of plasma cell mastitis by regulating IL-6/JAK2/STAT3 pathway[J]. International Immunopharmacology, 2020, 81: 106025.
[16] LIU Y, ZHANG J, ZHOU Y H, et al. Activation of the IL-6/JAK2/STAT3 pathway induces plasma cell mastitis in mice[J]. Cytokine, 2018, 110: 150-158.
[17] BACK D B, CHOI B R, HAN J S, et al. Characterization of tauopathy in a rat model of post-stroke dementia combining acute infarct and chronic cerebral hypoperfusion[J]. International Journal of Molecular Sciences, 2020, 21(18): 6929.
[18] EL-SHERBINY M, EL-SAYED R M, HELAL M A, et al. Nifuroxazide mitigates angiogenesis in ehlrich's solid carcinoma: Molecular docking, bioinformatic and experimental studies on inhibition of IL-6/Jak2/Stat3 signaling[J]. Molecules, 2021, 26(22): 6858.
[19] ZHANG F L, ZHAO P, QIAN Z M, et al. Central nervous system inflammation induced by lipopolysaccharide up-regulates hepatic hepcidin expression by activating the IL-6/JAK2/STAT3 pathway in mice[J]. Frontiers in Nutrition, 2021, 8: 649640.
[20] SHE D T, WONG L J, BAIK S H, et al. SIRT2 inhibition confers neuroprotection by downregulation of FOXO3a and MAPK signaling pathways in ischemic stroke[J]. Molecular Neurobiology, 2018, 55(12): 9188-9203.
[21] 顧媛媛, 孙 阳, 韩玉生, 等. 西黄丸的化学成分分析及其抗肿瘤药理作用研究进展[J]. 中华中医药学刊, 2021, 39(3): 30-33.
(本文编辑 匡静之)
