壮通饮对脑缺血再灌注小鼠神经细胞损伤的影响及其作用机制
2023-08-14杨鑫勇,王凯华,刘丹宁,王亚南,周嫦艳
杨鑫勇,王凯华,刘丹宁,王亚南,周嫦艳


〔摘要〕 目的 探討壮通饮对脑缺血再灌注小鼠神经细胞损伤的影响及其作用机制。方法 采用线栓大脑中动脉栓塞法诱导建立小鼠脑缺血再灌注模型,造模成功后的6~7周龄雄性C57BL6J小鼠随机分为模型组、壮通饮组、阿司匹林组、壮通饮联合阿司匹林组,各组再随机分为1、3、7 d时点组,另设不造模的空白组和假手术组,每组10只,按照分组灌胃给药至相应时点。记录各组每日体质量及Zea Longa评分,采用TTC染色法测定脑缺血小鼠的脑梗死体积百分比;HE染色观测缺血病理改变情况,TUNEL染色比较神经细胞凋亡情况,透射电镜观测神经细胞线粒体结构改变及自噬情况,Western blot以及RT-PCR技术分析P62、LC3Ⅱ/LC3Ⅰ、Bc1-2/腺病毒E1B19kD相互作用蛋白3(Bc1-2/adenovirusE1B 19kDa interacting protein3, BNIP3)、β-actin蛋白或基因表达情况。结果 与空白组、假手术组相比,模型组体质量明显下降(P<0.05),TTC染色可见脑组织缺血梗死,出现神经细胞凋亡及线粒体损伤。与模型组相比,各给药组体质量升高(P<0.05),行为学评分降低(P<0.05),梗死体积降低,且持续减小(P<0.05);神经细胞凋亡率降低(P<0.05)。模型组线粒体结构损伤明显较重,在1 d时各给药组即可观测到较多线粒体自噬小体,而模型组在3 d时才可观测到,在7 d时各给药组大多数线粒体结构完整,可见被溶酶体消化完成的脂滴,而模型组可见自噬小体与自噬溶酶体同时存在。与模型组比较,各给药组P62蛋白表达在1 d时降低,3、7 d时升高(P<0.05);LC3Ⅱ/LC3Ⅰ的蛋白比值以及P62、BNIP3的基因表达水平在1 d时升高,7 d时降低(P<0.05)。在各给药组中,壮通饮联合阿司匹林组各项指标均优于其他给药组及模型组(P<0.05)。结论 壮通饮能够减轻脑缺血再灌注小鼠的神经细胞损伤,这可能与促进神经细胞发生线粒体自噬,维持细胞内线粒体稳态有关。
〔关键词〕 壮通饮;脑梗死;缺血再灌注;神经功能;线粒体自噬
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.07.002
Effects of Zhuangtong Drink on cerebral ischemia-reperfusion-induced nerve cell injury in mice and its mechanism
YANG Xinyong1,2, WANG Kaihua2*, LIU Danning1,2, WANG Yanan1,2, ZHOU Changyan1,2
1. Graduate School, Guangxi University of Chinese Medicine, Nanning, Guangxi 530200, China; 2. International Zhuang
Medicine Hospital of Guangxi University of Chinese Medicine, Nanning, Guangxi 530200, China
〔Abstract〕 Objective To investigate the effects of Zhuangtong Drink on nerve cell injury induced by cerebral ischemia-reperfusion in mice and its mechanism. Methods The model of cerebral ischemia-reperfusion in mice was established by thread embolism induced middle cerebral artery occlusion (MCAO). Six to seven-week-old male C57BL6J mice were randomly divided into model group and treatment groups including Zhuangtong Drink group, aspirin group and Zhuangtong Drink combined with aspirin group after modeling. Each group was randomly subdivided into 1 d, 3 d, and 7 d groups. In addition, blank group and sham-operated group without modeling were also set up, 10 mice per group. The corresponding drugs were administered by gavage in the groups to the corresponding time points. The daily body weight and Zea Longa scores of each group were recorded; The percentage of cerebral infarction volume in mice with cerebral ischemia was measured by TTC staining; the ischemic pathological changes, neuronal apoptosis, and structural changes and autophagy of nerve cell mitochondria were observed by HE staining, TUNEL staining, and transmission electron microscope, respectively; the protein or gene expressions of P62, LC3 II/LC3 Ⅰ, Bc1-2/adenovirusE1B 19kDa interacting protein3(BNIP3) and β-actin were analyzed by Western blot and RT-PCR techniques. Results Compared with blank group and sham-operated group, the body weight of mice in model group decreased significantly (P<0.05), and the behavioral scores increased (P<0.05); TTC staining showed cerebral ischemic infarction, neuronal apoptosis and mitochondrial injury. Compared with model group, the body weight of mice in treatment groups increased (P<0.05); the behavioral scores, mortality rates, as well as the rate of neuronal apoptosis decreased (P<0.05); the infarction volume was reduced and continued to be lowered (P<0.05). The structural damages of mitochondria in mice of model group were obviously more severe. More mitophagosomes could be observed in treatment groups on the 1st day, while in model group on the 3rd day. Most of the mitochondria in treatment groups were intact on the 7th day, and the lipid droplets digested by lysosomes could be seen, while in model group, autophagosomes and autolysosomes coexisted. Compared with model group, the expression of P62 protein in each treatment group decreased on the 1st day and increased on the 3rd and 7th day (P<0.05), while LC3 II/LC3 Ⅰ ratio and the gene expression levels of P62 and BNIP3 increased on the 1st day and decreased on the 3rd and 7th day (P<0.05). Among treatment groups, the indexes of Zhuangtong Drink combined with aspirin group were better than other treatment groups and model group (P<0.05). Conclusion Zhuangtong Drink can relieve the injury of nerve cells in cerebral ischemia-reperfusion mice, which may be related to the promotion of nerve cell mitophagy and the maintenance of intracellular mitochondrial homeostasis.
〔Keywords〕 Zhuangtong Drink; cerebral infarction; ischemia-reperfusion; neurological function; mitophagy
缺血性脑血管病是最常见的脑血管病,约占全部脑血管疾病的75%,具有高发病率、高死亡率、高致残率、高复发率等特点[1]。目前,有效治疗方法包括溶栓治疗、血管内治疗等急性治疗措施,但受到时间窗和出血转化风险的限制,且有缺血再灌注损伤的风险。因此,寻找有效的脑神经保护药物对保护缺血脑组织的功能具有十分重要的意义。
壮医认为,头脑为“巧坞”,脑梗死是瘀血堵塞三道、两路,而致“巧坞”失养所致[2]。治疗上,壮医注重疏三道通两路,调治“巧坞”。壮通饮由扶芳藤、黄花倒水莲、参三七3味特色壮药组成。扶芳藤味辛,性平,能通龙路、火路,能舒筋通络,止血消瘀。黄花倒水莲味甘,性微温,能祛湿解毒,补虚,活血止血。参三七味甘、温、微苦,能通龙路,能止血消肿,化瘀止痛。壮通饮有通龙路、火路之功,能舒筋通络、活血止血消瘀,在脑梗死的临床治疗上具有显著疗效[3]。
线粒体是缺血后神经细胞死亡的关键靶区,是神经细胞存活的关键因素。线粒体自噬是一种特殊的自噬类型,可以选择性地清除受损线粒体,其在应激状态中(如缺氧、钙超载等)起着至关重要的作用[4]。在缺血再灌注病理过程中,细胞可以通过激活自噬途径,清除受损的线粒体和过量产生的活性氧化物(reactive oxygen species, ROS),维持细胞内线粒体功能的稳定,从而抑制线粒体依赖的调亡[5]。提示线粒体自噬是缺血再灌注病理过程中重要的内源性保护机制,是脑梗死治疗的潜在靶点。本研究通过动物实验,探索壮通饮与线粒体自噬的联系,以期为脑缺血治疗提供新思路及新药物。
1 材料
1.1 动物
使用196只SPF(specific pathogen free)级同遗传背景雄性C57BL6J小鼠,6~7周龄,体质量19.4~21.4 g,由湖南斯莱克景达实验动物有限公司提供,动物生产许可证号:SCXK(湘)2019-0004,动物质量合格证号:430727211101254174。所有实验动物均饲养于广西中医药大学科学实验中心SPF级动物房中。饲养条件:5只1笼,温度22 ℃,湿度50%,自由饮水、进食,有实验人员操作时开启日光灯,其余时间关闭日光灯,于8:00至17:00开启动物照明灯光。本实验经本校伦理委员会批准,符合3R原则,伦理编号:DW20210410-074。本实验共使用小鼠196只,死亡36只,死亡原因多为蛛网膜下腔出血及病情过重,实际纳入实验160只,总体死亡率为18.37%。
1.2 药物制备
壮通饮方剂临床每日使用剂量:扶芳藤30 g,黄花倒水莲20 g,三七10 g。根据《中药药理研究方法学》[6]提供的实验动物剂量换算方法,按照成人体质量60 kg计算,小鼠给药量:扶芳藤4.55 g/(kg·d)、黄花倒水莲3.03 g/(kg·d)、参三七1.52 g/(kg·d)。第一次煎煮取10倍体积的纯水,浸泡30 min后,煮至沸腾后续煮1 h,取溶液待用。第二次煎煮取8倍体积纯水复煎,煮至沸腾后续煮30 min,取药液与第一次药液混合后使用300目滤网过滤,将过滤后的药液至于60 ℃水浴锅中,浓缩药液至200 mL,每毫升含生药0.91 g。按照0.1 mL/10 g灌胃体积灌胃给药。
阿司匹林按照成人剂量100 mg/d(成人体质量按60 kg计算)换算成小鼠给药剂量为:13 mg/kg,使用万分之一天平称取7.5 mg每管分装于10 mL离心管中,每次给药前加入纯水5 mL,每毫升含药1.5 mg,制备成0.1 mL/10 g给药浓度的阿司匹林溶液。
1.3 主要仪器及试剂
造模用线栓(型号:L1800)购自州佳灵生物技术有限公司。兽用青霉素钠(批号:190301)购自华北制药集团有限责任公司。扶芳藤(批号:20210901)、黄花倒水莲(批号:20211101)、三七(批号:20210701)购自仙茱中药科技有限公司。阿司匹林(批号:A104180)购自上海阿拉丁生化科技股份有限公司。戊巴比妥钠(批号:11715)购自美国Sigma-Aldrich LLC.公司。TTC染液(批号:DK0005)购自北京雷根生物技术有限公司。Gluta电镜固定液(批号:P1126)、RIPA强效裂解液(批号:R0010)、BCA蛋白浓度测定试剂盒(批号:PC0020)、脱脂奶粉(批号:D8340)均购自北京索莱宝科技有限公司。快速制胶试剂盒(批号:PG213)、三色预染蛋白maker(批号:WJ103)、超灵敏化学发光液(批号:SQ101)均购自上海雅酶生物医药科技有限公司。LC3抗体(批号:14600-1-AP)购自PTG。CytC(批号:4280S)、β-actin(批号:3700S)抗体购自美国Cell Signaling Technology公司。P62抗体(批号:A7758)购自武汉博士德生物工程有限公司。羊抗兔二抗(批号:31234)购自赛默飞世尔科技(中国)有限公司。解剖显微镜(型号:MSD203)、摇臂显微镜(型号:ST6024-B1)由科学实验中心动物房提供。万分之一电子天平(型号:PL203)购自梅特勒-托利多仪器(上海)有限公司。TUNEL试剂盒(批号:11684817910)、PCR仪(型号:LC96)购自上海罗氏制药有限公司。电泳仪(型号:PowerPacTMHC)、化学发光成像仪(型号:732BR2019)购自伯乐生命医学产品(上海)有限公司。
2 方法
2.1 动物造模
2.1.1 造模方法 参考Zea Longa改良的线栓法对C57BL6J小鼠进行大脑中动脉缺血再灌注的造模[7]。随机选择6~7周龄实验小鼠,术前24 h禁食不禁水,麻醉备皮后仰卧置于37 ℃恒温垫上,于颈后垫一棉签以更好地暴露术口,在摇臂显微镜下操作,正中切口,小心暴露左侧颈总动脉(common carotid artery, CCA),沿CCA向上继续分离颈外动脉(external carotid artery, ECA)、颈内动脉(internal carotid artery, ICA),术中注意避免触及迷走神经。两次结扎ECA后在结扎处中间剪断,使用动脉夹夹闭CCA和ICA,夹持住ECA残端,使用0.5 mL注射器楔形面紧贴血管,与ECA上滑刺一小缺口,将线栓送入缺口处后,稍用力向外(以颈部正中为内)牵拉ECA残端,以避免线栓误入翼腭动脉(pterygopalatine artery, PPA),松开ICA上的血管夹,将线栓缓缓向里推送,至线栓黑色标记处接近分岔处,稍微感受到阻力时,立即停止插入线栓,结扎线栓入口处,清理并整理伤口,俯卧位置于恒温垫上。梗死1 h后,再次暴露CCA,取出線栓,拉紧结扎线,确认无出血后缝合伤口。
2.1.2 成模的判断及造模后的护理 动物苏醒后,具有以下4项体征则表示模型制作成功[8]:(1)提尾时右前肢内收屈曲(即提尾悬空实验阳性);(2)左眼Horner征;(3)爬行时向右划圈;(4)站立时向右侧倾倒。
小鼠脑缺血再灌注损伤造模难度较大,文献报道的死亡率较高,本实验在造模过程中全程使用摇臂显微镜以充分暴露术野,在插入线栓时向外稍用力牵拉ECA残端,以防止误插入PPA,推送线栓时稍看到线栓弯曲即停止,以避免蛛网膜下腔出血,采用取出线栓后再次结扎血管再缝合皮肤的办法,以防止拔栓后出血。术后立即予生理盐水以补充体液流失并消毒伤口。苏醒后每日常规消毒、抗感染、补充能量并严格控制环境温度。使用此饲养和护理方案,能够明显提升模型小鼠的成活率,预实验小鼠成活率为93.33%。
2.1.3 分组与给药方法 随机挑选出空白组与假手术组后,将造模成功的小鼠随机分为模型组、壮通饮组、阿司匹林组、壮通饮联合阿司匹林组,每个给药组再随机分为1、3、7时点组,每时点每组10只。实验过程中每天10:00给予每只小鼠10%葡萄糖水0.2 mL/10 g灌胃,16:00给予聚维酮碘擦拭伤口消毒,并腹腔注射兽用青霉素钠4万单位。20:00按分组以0.1 mL/10 g的灌胃体积灌胃给药,空白组不给药,假手术组及模型组予生理盐水两次,壮通饮组予壮通饮溶液1次及生理盐水1次,阿司匹林组予阿司匹林溶液1次及生理盐水1次,壮通饮联合阿司匹林组予壮通饮溶液1次及阿司匹林溶液1次。
2.2 神经功能评估
各组实验动物在造模成功后8 h以及此后每天参照Zea Longa 5分评分法[7]进行神经功能缺损评分,评分者为3人,每人独立评分后汇总,求其平均值作为该小鼠神经功能得分。
2.3 脑梗死体积百分比测定
到达相应各组时间点后随机选取5只小鼠,采用TTC染色法测定脑梗死体积百分比。小鼠麻醉后心脏灌注冰生理盐水,而后快速断头取脑,去除嗅脑、小脑和低位脑干,置于-20 ℃冰箱中冷冻20 min,从额极开始,每隔2 mm切1片。将切片置于2% TTC染液中,置于37 ℃温箱30 min,每隔10 min翻面1次。染色结束后,将切片放置于多聚甲醛溶液中,固定24 h后,白光下拍照。拍照结果用Image-pro plus6.0扫描并计算脑梗死体积百分比。校正脑梗死体积百分比=[总梗死体积-(梗死侧半球体积-梗死对侧半球体积)]/梗死对侧半球体积×100%[9]。
2.4 HE染色
小鼠麻醉后心脏灌注冰生理盐水,而后快速断头取脑,将梗死侧脑组织保存于多聚甲醛溶液中静置24 h后,制成石蜡块。制作成石蜡切片后将其依次放入二甲苯、无水乙醇中,而后将切片放入苏木素染液染3~5 min,再用分化液分化,返蓝液返蓝,每个步骤后都使用纯水冲洗切片。将切片入梯度乙醇脱水,入伊红染液中染色5 min。将切片依次放入无水乙醇、二甲苯中使其透明,中性树胶封片。使用显微镜镜检,采集图像进行分析。
2.5 TUNEL法检测小鼠神经细胞凋亡
将制好的石蜡切片依次放入二甲苯、梯度乙醇中脱水,按照TUNEL试剂说明书依次进行操作,将最终的切片于尼康倒置荧光显微镜下观察并采集图像。随机选择5个视野,计算凋亡细胞核(绿色荧光)与细胞核总数(蓝色荧光)的百分比。即TUNEL指数=(凋亡细胞数/总细胞数)×100%。
2.6 透射电镜观测线粒体结构
小鼠麻醉后心脏灌注冰生理盐水,而后快速断头取脑,避免牵拉与挤压,剪下相对小的梗死侧脑组织置于戊二醛电镜固定液中室温固定20 min,使组织变硬后修剪成1 mm×1 mm×1 mm大小的组织块,置于充足电镜固定液中4 ℃固定2 h,室温固定、脱水、包埋后使用超薄切片机切制成60~80 nm的超薄切片。铀铅双染色后,透射电子显微镜下观察神经细胞的线粒体结构,采集图像,分析结果。
2.7 免疫印迹技术检测梗死侧P62、LC3Ⅱ/LC3Ⅰ情况
小鼠麻醉后心脏灌注冰生理盐水,而后快速断头取脑,取梗死侧大脑皮层组织,使用液氮转移至-80 ℃冰箱中保存。取出组织样本,提取总蛋白后使用BCA法测定总蛋白浓度,使用雅酶预制胶试剂盒制作12.5%电泳胶,以75 V/0.5 h-110 V/1.0 h条件电泳,200 mA/1 h条件转膜,一抗4 ℃孵育过夜,二抗常温孵育1 h,使用雅酶ECL超敏化学发光液显影,以β-actin为内参对照进行条带的数据标准化,使用Image lab对条带信号进行分析。
2.8 RT-PCR检测梗死侧P62、Bc1-2/腺病毒E1B19kD相互作用蛋白3(Bc1-2/adenovirusE1B 19kDa interacting protein3, BNIP3)的表达
取出保存在-80 ℃中的组织样本,使用Promega RNA提取试剂盒,按说明书逐步进行总RNA的提取,变性后使用Roche试剂盒进行逆转录及上机,以β-actin为内参,在Roche LC96 PCR仪上扩增进行反应,引物序列详见表1。记录ct值作为统计参数,用比较2-△△CT法计算mRNA相对表达水平。
2.9 统计学处理
实验结果采用SPSS 25.0统计软件分析处理。所有数据均以“x±s”表示,多组间比较采用单因素方差分析,两两比较采用Dunnett-t法或S-N-K法,以P<0.05表示差异有统计学意义。
3 结果
3.1 壮通饮对小鼠体质量及行为学评分的影响
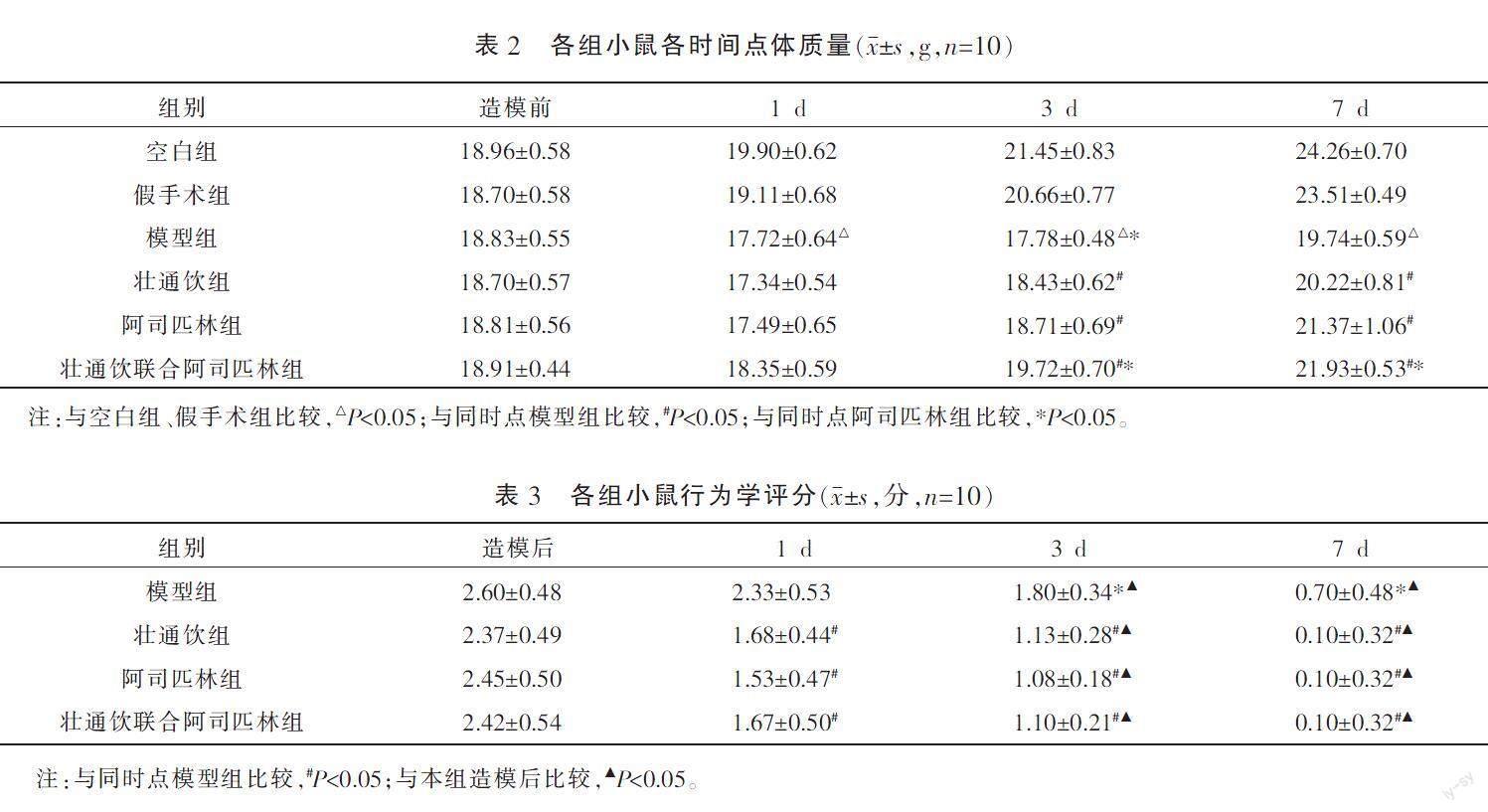
造模前,各组小鼠体质量比较,差异无统计学意义(P>0.05)。与同时点空白组、假手术组比较,模型组小鼠在1、3、7 d时体质量均下降(P<0.05)。与同时点模型组比较,给药组小鼠在3、7 d时体质量均上升(P<0.05)。与同时点阿司匹林组比较,壮通饮联合阿司匹林组小鼠在3、7 d时的體质量均上升(P<0.05)。详见表2。
各组造模后Zea Longa评分比较,差异无统计学意义(P>0.05)。与同时点模型组比较,给药组小鼠在1、3、7 d时Zea Longa评分均下降(P<0.05)。给药组各时点组间比较,差异无统计学意义(P>0.05)。各组3、7 d时的Zea Longa评分均较造模后下降(P<0.05)。详见表3。
3.2 壮通饮对小鼠脑梗死体积百分比的影响
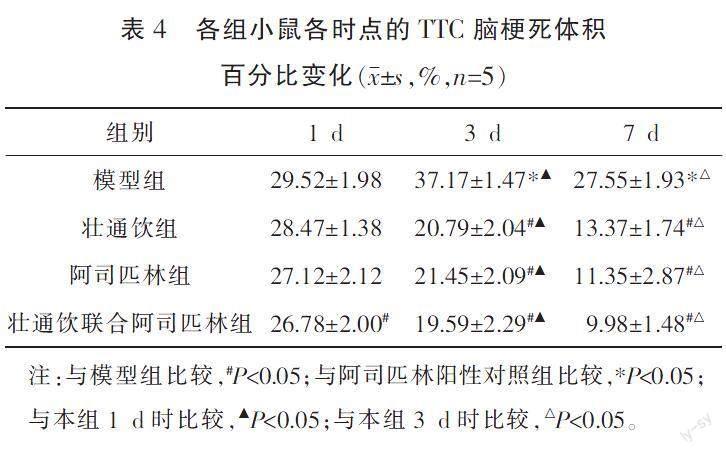
与模型组比较,在1 d时,壮通饮联合阿司匹林组脑梗死体积百分比下降,在3、7 d时,给药组脑梗死体积百分比均下降(P<0.05)。与模型组1 d时比较,同组3 d时升高,7 d时下降(P<0.05)。给药组脑梗死体积百分比与同组前一时间点比较,均下降(P<0.05)。给药组脑梗死体积百分比同时点组间比较,差异均无统计学意义(P>0.05)。详见表4。
3.3 壮通饮对小鼠病理改变及神经细胞凋亡率的影响
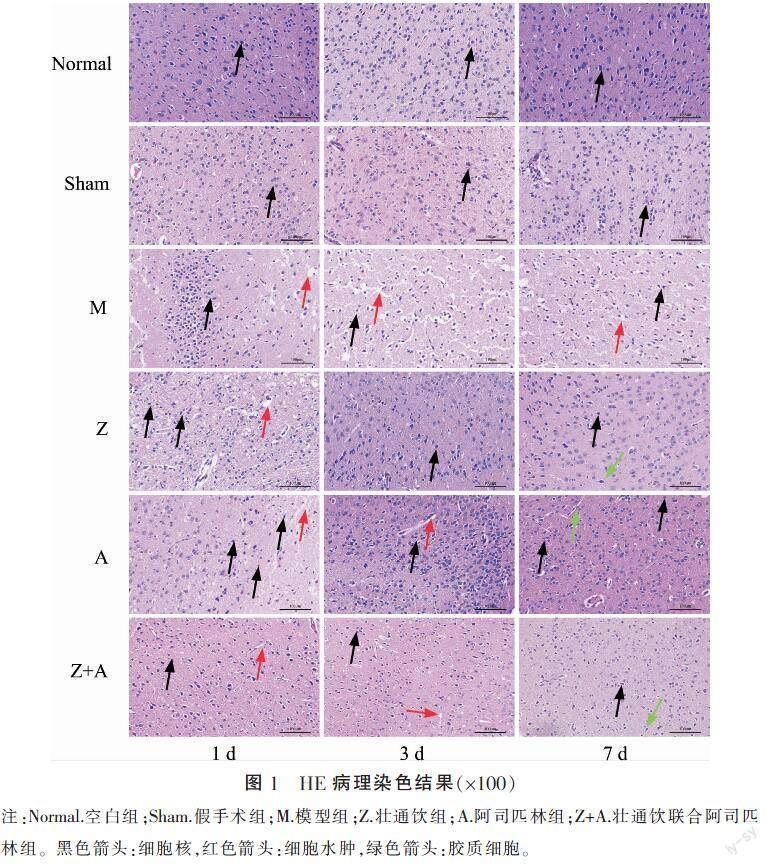
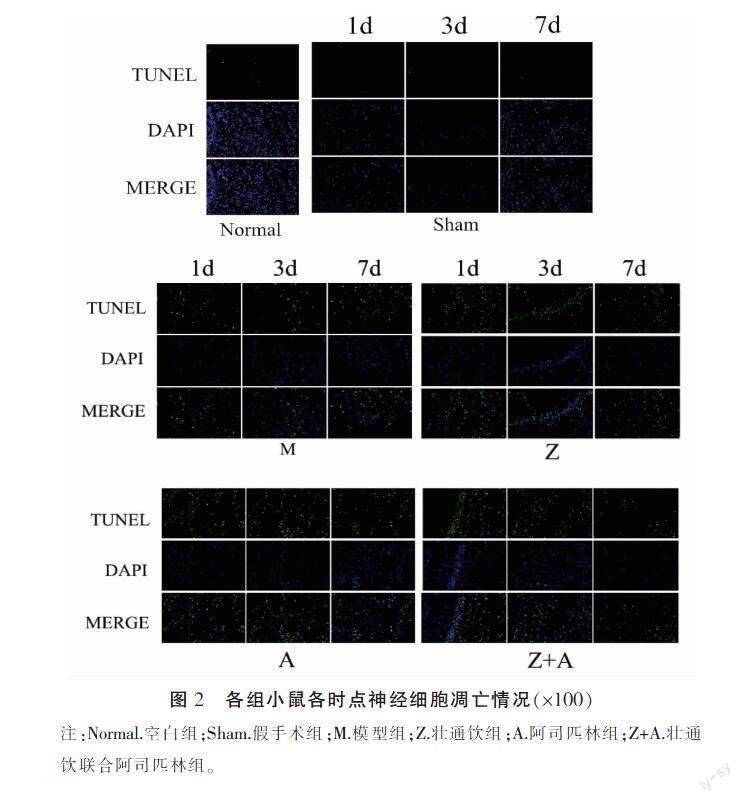
HE染色结果如图1所示。与空白组及假手术组比较,造模组、给药组在1 d时均呈中度异常,其后给药组病理改变均得到缓解,至7 d时脑组织结构轻度异常,少量神经元变性,被胶质细胞吞噬,给药组之间未见明显差异。模型组病理改变在3 d时加重,在7 d时缓解。TUNEL凋亡结果详见图2、表5。与空白组、假手术组比较,模型组神经细胞凋亡率升高(P<0.01)。与模型组比较,在1 d时,壮通饮联合阿司匹林组神经细胞凋亡率下降,在3、7 d时,给药组的神经细胞凋亡率均下降(P<0.05)。与本组1 d时比较,模型组在3 d时神经细胞凋亡率升高,在7 d时神经细胞凋亡率下降,给药组在3、7 d时均下降(P<0.05)。与本组3 d时比较,给药组在7 d时神经细胞凋亡率均下降(P<0.05)。给药组各时点比较,差异无统计学意义(P>0.05)。
3.4 壮通饮对小鼠神经细胞线粒体结构的影响
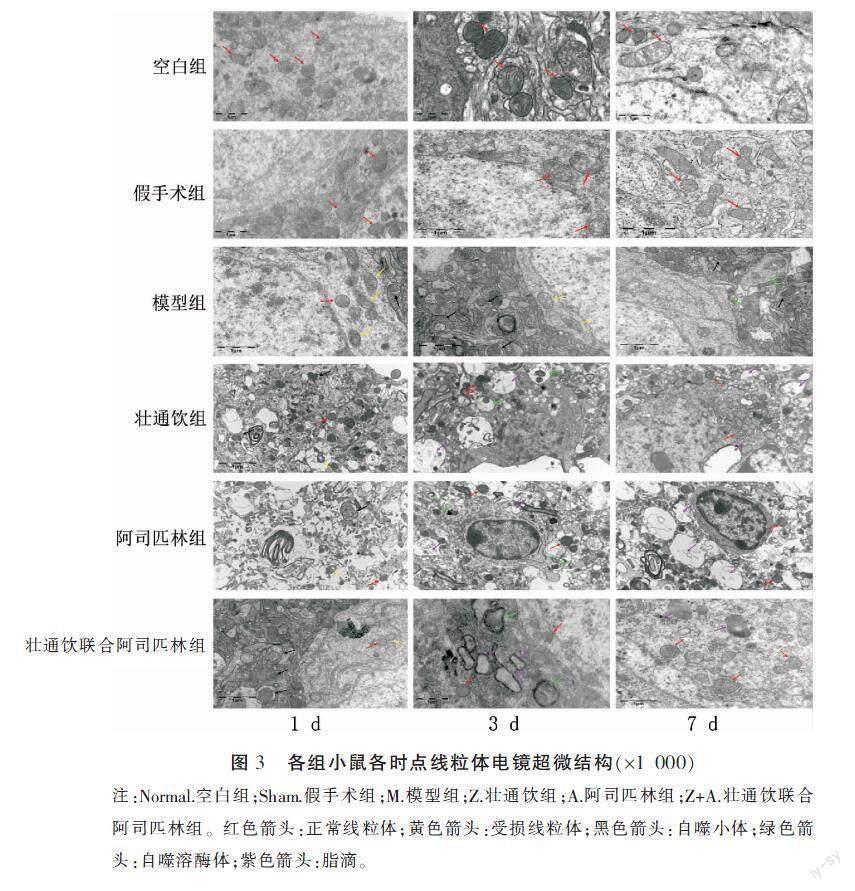
本实验中线粒体电镜超微结构显示,空白组、假手术组神经元细胞线粒体结构尚可,膜完整,嵴平行排列,偶见个别膜内基质变淡、嵴减少,未见典型自噬小体及自噬溶酶体形成。在各造模组中可观测到线粒体肿胀、空泡变性和嵴消失等损伤现象。模型组线粒体受损程度明显较给药组严重,在1 d时可见较多受损线粒体,仅偶见线粒体自噬小体存在,在3 d时可见较多线粒体自噬小体,在7 d时可见自噬小体及自噬溶酶体存在。各给药组在电镜结果上未见明显差异,均在1 d时可观测到线粒体自噬小体较模型组多,在3 d时可见自噬溶酶体及脂滴,在7 d时大多数线粒体结构完整,可见被溶酶体消化完成的脂滴,壮通饮联合阿司匹林组的神经元细胞在第7天时已未见明显损伤。详见图3。
3.5 壮通饮对MCAO小鼠P62、LC3Ⅱ、LC3Ⅰ、BNIP3表达的影响
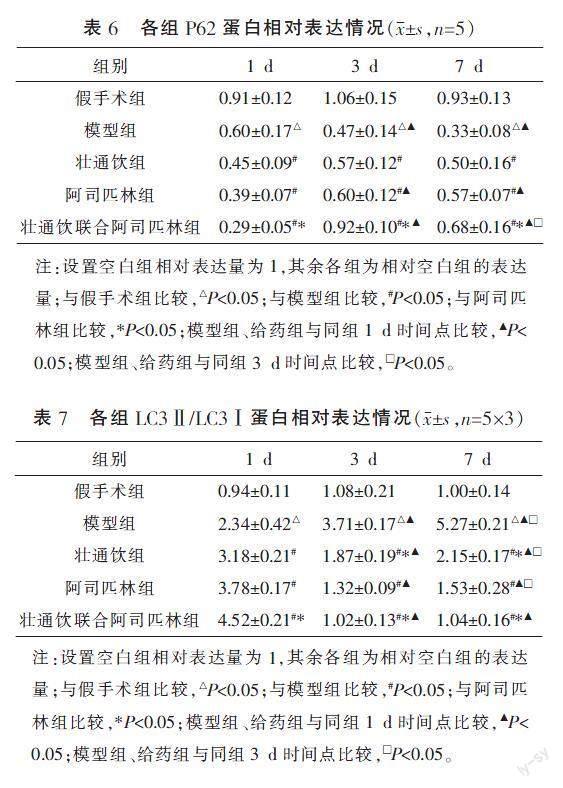
与假手术组比较,同时点模型组P62蛋白表达下降(P<0.05)。与模型组比较,给药组的P62蛋白表达均在1 d时降低,在3、7 d时升高(P<0.05)。与阿司匹林组比较,壮通饮联合阿司匹林组的P62蛋白表达在1 d时降低,在3、7 d时升高(P<0.05)。与本组1 d时比较,壮通饮组在3、7 d时的表达差异无统计学意义,而阿司匹林组、壮通饮联合阿司匹林组P62蛋白表达升高(P<0.05)。与本组3 d时相比,壮通饮联合阿司匹林组在7 d时P62蛋白表达降低(P<0.05)。详见图4、表6。
与假手术组比较,同时点模型组LC3Ⅱ/LC3Ⅰ蛋白比值上升(P<0.05)。与模型组比较,给药组LC3Ⅱ/LC3Ⅰ蛋白比值均在1 d时上升,在3 d时下降(P<0.05)。与阿司匹林组比较,壮通饮联合阿司匹林组LC3Ⅱ/LC3Ⅰ蛋白比值在1 d时升高,在3、7 d时降低(P<0.05)。与本组1 d时比较,在3、7 d时模型组蛋白比值均上升,各给药组蛋白比值均下降(P<0.05)。与本组3 d时比较,除假手术组、壮通饮联合阿司匹林组外,其余各组蛋白比值均上升(P<0.05)。详见图4、表7。
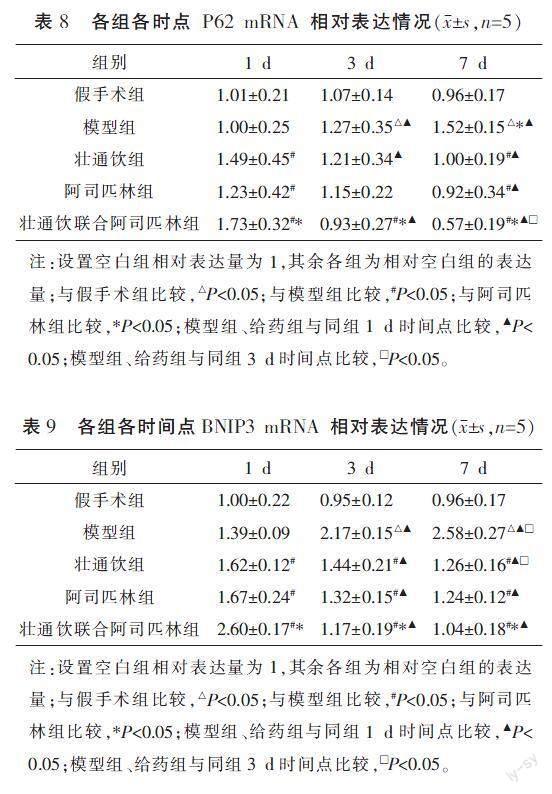
与同时点假手术组比较,模型组P62 mRNA、BNIP3 mRNA表达在3、7 d时升高(P<0.05)。与模型组比较,给药组P62 mRNA、BNIP3 mRNA表达均在1 d时升高,在7 d时降低(P<0.05)。与阿司匹林组比较,壮通饮联合阿司匹林组P62 mRNA、BNIP3 mRNA表达在1 d时升高,在3、7 d时降低(P<0.05)。与同组1 d时比较,7 d时模型组P62 mRNA、BNIP3 mRNA表达均上升,给药组P62 mRNA、BNIP3 mRNA表达均下降(P<0.05)。详见表8—9。
4 讨论
脑梗死,在壮医学中称为“麻邦”,是由各种原因导致三道两路不通,三气不能同步,气血上逆冲击“巧坞”,致使“巧坞”功能失调所致。壮通饮由扶芳藤、黄花倒水莲、参三七组成,是壮医治疗脑梗死的经验方[10]。前期研究证实,壮通饮能够减轻缺氧/复氧细胞屏障的损伤[11],能够保护糖氧剥夺诱导的星形胶质细胞损伤[12],可以促进脑梗死后内源性神经干细胞的增殖分化,新分化的神经元细胞有正常的兴奋性,表明其能够发挥正常的神经功能[13]。本研究采用TTC染色法探讨壮通饮对脑缺血再灌注小鼠脑梗死面积的影响,结果表明壮通饮能够显著减轻小鼠脑梗死体积,结合TUNEL染色、HE染色结果,提示壮通饮在脑卒中早期具有神经保护和抗细胞凋亡作用,这与此前报道相一致[11-12]。再灌注后,与模型组比较,壮通饮组、阿司匹林组体质量上升,神经系统行为学改善,提示壮通饮能够有效缓解脑组织缺血缺氧损伤。
线粒体是细胞的能量代谢中心,被称为细胞的“动力工厂”,参与细胞多种生命活动,发挥重要作用[14]。线粒体自噬是指通过自噬途径清除受损线粒体,或为降低耗氧量选择性地清除部分线粒体,维持线粒体稳态的过程[15]。在缺血性脑卒中过程中,细胞受缺血缺氧刺激,首先累及的亚细胞器就是线粒体,线粒体发生损伤,可以通过诱发线粒体自噬以清除受损的线粒體,降低细胞需氧量,以保护神经细胞,避免神经细胞凋亡[4-5]。因此,在细胞的缺血缺氧损伤仍然处于可承受的范围时,细胞可以通过激活线粒体自噬途径完成细胞的自我修复及时止损[16],干预线粒体自噬可能是缺血性脑卒中的一种有效治疗策略[17],相关研究也证明保护线粒体能够改善MCAO大鼠的认知功能[18]。P62蛋白是一种重要的选择性自噬接头蛋白[19],经P62-LC3途径进入自噬-溶酶体系统被降解,从而清除蛋白聚合物和受损的细胞器[20]。BNIP3是一种促凋亡蛋白[21],仅在脑组织与平滑肌中极低水平表达,当脑组织遭受缺血缺氧刺激时,其表达量升高。其定位于线粒体外膜并能引起细胞凋亡,与诱导线粒体自噬关系密切[22]。P62蛋白表达的降低以及LC3Ⅱ/LC3Ⅰ蛋白水平的升高,BNIP3 mRNA表达水平的升高,电镜观测到的线粒体自噬小体,提示着细胞处于线粒体自噬状态。由于P62蛋白的降低是由于自噬过程中被降解,而不是表达被抑制,因此,其mRNA表达的升高进一步说明大量的P62被降解,也印证了细胞处于线粒体自噬状态。当电镜观测到线粒体自噬溶酶体时,表面此时已处于自噬后期,溶酶体包裹线粒体进行消化降解,当观测到脂滴时,表明自噬已结束,受损线粒体已被清除。
基于此,在本实验中,模型组的线粒体损伤较重,可观测到线粒体肿胀、空泡变性和嵴消失等损伤现象,且其在缺血再灌注造模后第1天时,并未发生或仅少量发生线粒体自噬现象,在第3、第7天时有较多线粒体自噬现象发生,且第7天时自噬中期、自噬后期同时存在。各给药组均在第1天时即有较高的线粒体自噬程度,第3天时已处于自噬后期,第7天时线粒体自噬已基本结束。结合Western blot及RT-PCR结果显示,壮通饮、阿司匹林阳性对照干预能够促进线粒体自噬的发生,且壮通饮联合阿司匹林组对线粒体自噬的调控水平更高。
缺血性脑卒中发病率、死亡率、致残率、复发率高,严重影响患者的生活,加重社会负担。本研究发现,缺血再灌注后前3天小鼠处于缺血病理加重状态,考虑与脑缺血再灌注损伤后3~5 d处于脑水肿高峰期的病理过程以及再灌注损伤引起钙离子超载、自由基大量产生的病理改变有关。缺血再灌注后,神经细胞的线粒体自噬即被激活,但前3天时的激活程度不足以有效清除受损的线粒体,维持细胞内线粒体稳态,从而无法遏制细胞损伤加重,3天以后线粒体自噬水平被进一步激活,受損线粒体得以有效清除,死亡的细胞被吞噬清理,剩下的神经细胞内线粒体稳态得以恢复,再灌注损伤得到代偿减轻。而壮医经验方壮通饮,能够缓解缺血再灌注后的神经功能缺损,减少梗死面积,减少神经细胞凋亡,并能在脑缺血再灌注后第1天时即较高水平的促进缺血缺氧神经细胞的线粒体自噬,使受损的细胞器第1时间得到有效清除,维持细胞内线粒体稳态,挽救受损的神经细胞,减轻再灌注损伤。表明壮通饮可能是通过促进线粒体自噬途径保护神经细胞,且阿司匹林联用壮通饮能够取得更好的疗效。
壮通饮能够缓解脑缺血再灌注模型小鼠脑缺血再灌注后的体质量下降及运动神经功能缺损症状,提高存活率,减少神经细胞凋亡,减轻病理改变,减小梗死面积,这可能与促进神经细胞发生线粒体自噬,维持细胞内线粒体稳态有关。壮通饮与阿司匹林组之间未见明显差异,而壮通饮联合阿司匹林组疗效稍优于单独使用壮通饮或阿司匹林,临床上值得考虑在基础治疗上加用壮通饮以协助患者获得最大治疗收益。
参考文献
[1] 刘林娜, 田寿春. 急性及进展性脑梗死急诊治疗现状与趋势[J]. 医学理论与实践, 2020, 33(13): 2096-2097, 2078.
[2] 黄汉儒. 壮医理论体系概述[J]. 中国中医基础医学杂志, 1996, 2(6): 3-7.
[3] 李 岩, 覃启京, 梁慧荟, 等. 西药联合壮医壮通饮治疗缺血性中风38例临床观察[J]. 中国民族民间医药, 2020, 29(22): 103-106, 115.
[4] 颜思阳, 杨仁义, 刘利娟, 等. 基于“STAT3/miR-17”反馈环探讨活血荣络方对脑缺血再灌注损伤模型大鼠的保护作用机制[J]. 湖南中医药大学学报, 2021, 41(4): 489-497.
[5] 向 菲, 李明航, 徐 露, 等. 白藜芦醇通过促进线粒体自噬减轻小鼠脑缺血/再灌注损伤的实验研究[J]. 中国药理学通报, 2019, 35(6): 815-821.
[6] 陈 奇. 中药药理研究方法学[M]. 北京: 人民卫生出版社, 2011: 28, 1261-1263.
[7] LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91.
[8] BEDERSON J B, PITTS L H, TSUJI M, et al. Rat middle cerebral artery occlusion: Evaluation of the model and development of a neurologic examination[J]. Stroke, 1986, 17(3): 472-476.
[9] 向 菲. 白藜芦醇对脑缺血再灌注损伤中线粒体的保护作用及相关机制研究[D]. 重庆: 重庆医科大学, 2019.
[10] 刘燕平, 黄岑汉. 壮医经验方壮通饮组成药物现代研究进展[J]. 中国中医药信息杂志, 2012, 19(6): 111-112.
[11] 李 岩, 王凯华, 朱 亮, 等. 壮通饮对缺氧/复氧诱导的HUVEC/U251细胞屏障损伤的影响[J]. 中国病理生理杂志, 2022, 38(1): 80-86.
[12] 李 岩, 覃启京, 梁慧荟, 等. 壮通饮抑制NADPH氧化酶2对糖氧剥夺诱导星形胶质细胞损伤的保护作用[J]. 亚太传统医药, 2020, 16(9): 17-21.
[13] 陈晓锋, 韦柳艳, 何尉娜, 等. 壮通饮对脑梗死大鼠内源性神经干细胞的影响[J]. 中西医结合心脑血管病杂志, 2018, 16(4): 408-411.
[14] PFANNER N, WARSCHEID B, WIEDEMANN N. Mitochondrial proteins: From biogenesis to functional networks[J]. Nature Reviews Molecular Cell Biology, 2019, 20(5): 267-284.
[15] YANG J L, MUKDA S, CHEN S D. Diverse roles of mitochondria in ischemic stroke[J]. Redox Biology, 2018, 16: 263-275.
[16] 张润芳, 叶青青, 冯 硕, 等. 线粒体自噬保护缺血性脑损伤的作用及相关中药研究现状[J]. 中国临床药理学杂志, 2021, 37(22): 3176-3179.
[17] ANZELL A R, MAIZY R, PRZYKLENK K, et al. Mitochondrial quality control and disease: Insights into ischemia-reperfusion injury[J]. Molecular Neurobiology, 2018, 55(3): 2547-2564.
[18] 方 雪, 邵 衛, 许慧芳, 等. 基于2-Cl-MGV-1/BDNF-TrkB通路探讨脑梗死后认知功能改善的研究[J]. 实用医学杂志, 2023, 39(7): 819-826.
[19] ABUDU Y P, SHRESTHA B K, ZHANG W X, et al. SAMM50 acts with p62 in piecemeal basal- and OXPHOS-induced mitophagy of SAM and MICOS components[J]. The Journal of Cell Biology, 2021, 220(8): e202009092.
[20] ELBIALY A. In vivo autophagy quantification: Measuring LC3 and P62 puncta in 3D image system from zebrafish larvae[J]. Journal of Cellular Biochemistry, 2021, 122(10): 1435-1444.
[21] THAYYULLATHIL F, CHERATTA A R, PALLICHANKANDY S, et al. Par-4 regulates autophagic cell death in human cancer cells via upregulating p53 and BNIP3[J]. Biochimica et Biophysica Acta Molecular Cell Research, 2020, 1867(7): 118692.
[22] GAO A B, JIANG J Y, XIE F, et al. Bnip3 in mitophagy: Novel insights and potential therapeutic target for diseases of secondary mitochondrial dysfunction[J]. International Journal of Clinical Chemistry, 2020, 506: 72-83.
