基于JAK2/STAT3信号通路探讨对叶百部总生物碱对人结肠癌HT-29细胞增殖、凋亡的影响▲
2023-08-14杨雅钧许立拔王孝勋黎燕兰
杨雅钧 许立拔 王孝勋 黄 珍 黎燕兰
(广西中医药大学1 药学院,2 壮瑶药重点实验室,广西南宁市 530200)
结肠癌具有高发病率、高致死率等特点,2020年,其新发病例数和死亡病例数分别位居全球第三、第二[1-2],严重威胁患者的生命健康。大部分结肠癌患者确诊时已处于疾病中晚期,目前该病的治疗手段以手术为主,化疗、放疗等为辅,但治疗费用高,毒副作用大,患者预后欠佳[3-5]。中药及其活性成分具有多靶点、低毒副作用、整体调节等特点,成为目前结肠癌新药探索开发的研究热点。
对叶百部总生物碱被认为是对叶百部的主要活性成分,通常为具有吡咯或吡啶并氮杂卓母核结构的生物碱。多项研究表明,对叶百部总生物碱具有镇咳、平喘、抗氧化、抗菌、抗肿瘤等作用[6-10]。本课题组在前期研究中发现,对叶百部总生物碱对肺癌细胞、肝癌细胞等多种恶性肿瘤细胞均有抑制增殖和促凋亡作用,其机制与抑制B细胞淋巴瘤-2(B cell lymphoma 2,Bcl-2)蛋白表达和促进Bcl-2相关性X蛋白、cleaved Caspase-3蛋白表达有关[10-11],但尚未见有研究报告其对Janus激酶2(Janus kinase 2,JAK2)/信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)信号通路的作用。JAK2/STAT3信号通路与多种恶性肿瘤的发生和发展关系密切[12]。本研究基于JAK2/STAT3信号通路,探讨对叶百部总生物碱对人结肠癌HT-29细胞增殖、凋亡的影响,为深入研究对叶百部总生物碱在结肠癌治疗中的临床应用价值提供理论依据。
1 材料与方法
1.1 细胞与药品 人结肠癌HT-29细胞购自武汉普诺赛生命科技有限公司(编号:CL-0118)。对叶百部总生物碱由广西中医药大学壮瑶药重点实验室制备(批号:20210315),酸性染料比色法分析结果提示对叶百部总生物碱的质量百分比为86.22%。
1.2 主要试剂及仪器 含青霉素/链霉素双抗McCoy′s 5A培养基(武汉普诺赛生命科技有限公司,批号:WH1122G131),胎牛血清(浙江天杭生物科技股份有限公司,批号:22040701),二甲基亚砜[dimethyl sulfoxide,DMSO;阿拉丁试剂(上海)有限公司,批号:401F035];四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)、Hochest 33258、1×PBS缓冲液(北京索莱宝科技有限公司,批号:M8180、C0020、20210930),胰蛋白酶-乙二胺四乙酸(Gibco公司,批号:2016976),结晶紫染色液、Annexin Ⅴ-FITC/PI双染细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司,批号:20220511、20210527),山羊抗兔二抗(北京中杉金桥生物技术有限公司,批号:ZB2305),JAK2抗体、磷酸化JAK2(phosphorylated JAK2,p-JAK2)抗体、STAT3抗体、磷酸化STAT3(phosphorylated STAT3,p-STAT3)抗体、β-actin抗体(Affinity Biosciences公司,批号:AF6022、AF3024、AF6294、AF3293、AF7018)。C170型CO2培养箱(BINDER GmbH),185424R型冷冻离心机(Eppendorf公司),Epoch2型全波长酶标仪(Bio Tek公司),SW-CJ-2FD型洁净工作台(苏州安泰空气技术有限公司),Eclipse Ni-U型正置荧光生物显微镜(Nikon公司),JIMBIO FIL流式细胞计数仪(江苏卓微生物科技有限公司),DYCZ-24DN型电泳仪(北京六一生物科技有限公司),WSE-4040型半干转膜仪(ATTO公司),TS-8型转移脱色摇床(海门市其林贝尔仪器制造有限公司)。
1.3 细胞培养及含药培养液的制备 (1)使用完全培养液(含10%胎牛血清+1%青霉素/链霉素双抗+89% McCoy′s 5A培养液)在饱和湿度、37 ℃、含5%CO2的CO2培养箱内常规培养HT-29细胞,培养至融合度约80%时进行传代,传代2次后用于后续实验。将细胞分为55 μg/mL组、150 μg/mL组和250 μg/mL组进行实验。(2)在对叶百部总生物碱中添加DMSO制备成供试储存液(浓度为250 mg/mL),-20 ℃冷冻保存;使用时,取供试储存液融溶后,添加完全培养液配制成所需浓度的含药培养液(DMSO终质量百分比不超过0.1%)。
1.4 MTT法检测细胞增殖抑制率 将HT-29细胞接种于96孔板,接种密度为100 μL/孔、5×104个/mL,在饱和湿度、37 ℃、含5%CO2的CO2培养箱中培养24 h后,吸弃原培养液,在相应孔中分别添加200 μL不同浓度(接触细胞终浓度为55 μg/mL、150 μg/mL和250 μg/mL)的含对叶百部总生物碱新鲜培养液,另设空白组(含细胞),仅添加200 μL完全培养基。分别继续培养24 h、48 h和72 h后,加入5 mg/mL的MTT溶液(20 μL/孔)。继续孵育4 h后,吸弃孔中液体,添加DMSO(150 μL/孔),震荡促溶10 min,使用全波长酶标仪测定各孔在570 nm波长处的吸光度值,并计算细胞增殖抑制率[10]。细胞增殖抑制率=(空白组吸光度值-给药组吸光度值)/空白组吸光度值×100%。实验重复6次。
1.5 Hoechst 33258 染色法观察细胞凋亡情况 于6 孔板内置入无菌盖玻片并接种HT-29细胞,接种密度为2 mL/孔、3×105个/mL,在饱和湿度、37℃、含5% CO2的CO2培养箱中培养24 h后,吸弃原培养液,在相应孔中分别添加2 mL不同浓度(接触细胞终浓度为55 μg/mL、150 μg/mL和250 μg/mL)的含对叶百部总生物碱新鲜培养液,另设空白组(含细胞),仅添加2 mL完全培养基。继续培养48 h后,吸弃孔中液体,使用PBS 洗涤3次,4%多聚甲醛固定15 min,吸弃孔中液体,再用PBS洗涤3次,锡箔纸包裹,添加Hochest 33258染色液(500 μL/孔)进行染色。10 min后,吸弃孔中液体,使用PBS洗涤3次,取出盖玻片覆盖于载玻片上,用抗荧光淬灭封片液封片,在正置荧光生物显微镜下观察HT-29细胞的细胞核形态。细胞核出现染色质浓缩、核固缩、染色质碎裂和凋亡小体等,细胞核亮蓝色强荧光反应,则判定为凋亡细胞。在200倍镜下拍照获取约1 000个细胞的连续视野,打印视野照片,每张玻片人工连续计数1 000个细胞,记录1 000个细胞中凋亡细胞的数目,计算细胞凋亡率,细胞凋亡率=(凋亡细胞数目/1 000)×100%[9]。实验重复6次。
1.6 流式细胞术检测细胞凋亡率 将HT-29细胞接种于6孔板,接种密度为2 mL/孔、2.5×105个/mL,在饱和湿度、37 ℃、含5% CO2的CO2培养箱中培养24 h后,吸弃原培养液,在相应孔中分别添加2 mL不同浓度(接触细胞终浓度为55 μg/mL、150 μg/mL和250 μg/mL)的含对叶百部总生物碱新鲜培养液,另设空白组(含细胞),仅添加2 mL完全培养基。继续培养48 h后,吸弃孔中液体,加入0.5 mL 0.25%胰酶消化,再加入2 mL完全培养液终止消化,吹打助悬,收集细胞,20 ℃下1 200 r/min离心5 min,弃去上清液,加适量1×Binding Buffer重悬,调整细胞浓度约为5×105个/mL。取100 μL细胞悬液置于2 mL EP管,加5 μL Annexin Ⅴ-FITC室温孵育15 min,添加400 μL 1×Binding Buffer混匀,使用200目尼龙网过滤后收集到流式管中,上机前加入5 μL PI混匀,室温、避光静置10 min,1 h内完成流式细胞仪的上机检测,并使用FlowJo软件分析细胞凋亡率[13]。实验重复3次。
1.7 Western blot检测JAK2、p-JAK2、STAT3和p-STAT3蛋白表达水平 将HT-29细胞接种于25 cm2培养瓶,接种密度为3 mL/瓶、1×106个/mL,在饱和湿度、37 ℃、含5% CO2的CO2培养箱中培养至细胞融合度约80%时,吸弃原培养液,在相应瓶中分别添加2 mL不同浓度(接触细胞终浓度为55 μg/mL、150 μg/mL和250 μg/mL)的含对叶百部总生物碱新鲜培养液,另设空白组(含细胞),仅添加2 mL完全培养基。继续培养48 h后,加入0.5 mL 0.25%胰酶消化,然后加入2 mL完全培养液终止消化,吹打助悬,收集细胞,在20 ℃下1 200 r/min离心5 min,弃去上清液,加入适量含有蛋白酶抑制剂的RIPA裂解液,充分混匀,冰上裂解30 min,4 ℃下12 000 r/min离心10 min,取上清液备用。采用二喹啉甲酸法测定蛋白浓度后,加入4×蛋白上样缓冲液,轻轻混匀,95 ℃变性10 min。取适量蛋白样品在50 V电压下进行SDS-PAGE分离,转膜转移至PVDF膜上,使用封闭液封闭2 h,加入1 μL一抗,分别为JAK2抗体(1 ∶1 200)、p-JAK2抗体(1 ∶800)、STAT3抗体(1 ∶1 000)、p-STAT3抗体(1 ∶1 000)和β-actin抗体(1 ∶8 000),4 ℃孵育过夜,室温下避光用TBST洗膜3次,分别加入1 μL山羊抗兔二抗(1 ∶3 000),室温孵育90 min,TBST清洗3次,加入 ECL 试剂显影,将胶片扫描后,利用ImageJ软件测定条带灰度值,以β-actin为内参,计算目的蛋白的相对表达水平[12]。目的蛋白的相对表达水平=目的蛋白灰度值/内参蛋白灰度值。实验重复4次。
1.8 统计学分析 采用SPSS 20.0软件进行统计学分析。计量资料以(x±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 不同浓度对叶百部总生物碱对HT-29细胞增殖抑制率的影响 与空白组相比,干预24 h、48 h、72 h后,55 μg/mL组、150 μg/mL组、250 μg/mL组HT-29细胞的增殖抑制率均增加,且55 μg/mL组、150 μg/mL组、250 μg/mL组HT-29细胞的增殖抑制率依次升高(均P<0.05),见表1。
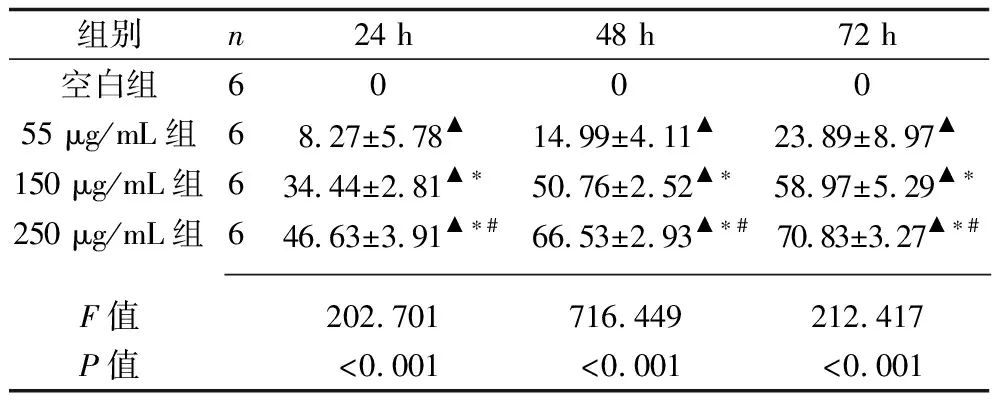
表1 4组HT-29细胞增殖抑制率的比较(x±s,%)
2.2 不同浓度对叶百部总生物碱对HT-29细胞凋亡的影响 Hoechst 33258 染色法结果显示,空白组HT-29细胞的细胞核数目多,排列整齐有序,蓝染呈弱荧光反应,偶见细胞核亮蓝色强荧光反应;经对叶百部总生物碱处理48 h后,55 μg/mL组、150 μg/mL组、250 μg/mL组HT-29细胞的染色质浓缩、细胞核固缩、呈亮蓝色强荧光反应的细胞数目增多,由染色质碎裂形成的凋亡小体数目增多。与空白组比较,55 μg/mL组、150 μg/mL组、250 μg/mL组HT-29细胞的凋亡细胞数和细胞凋亡率增加,且55 μg/mL组、150 μg/mL组、250 μg/mL组HT-29细胞的凋亡细胞数和细胞凋亡率依次升高(均P<0.05),见表2、图1。

图1 4组HT-29细胞的细胞核形态变化图(Hoechst 33258染色,×200)
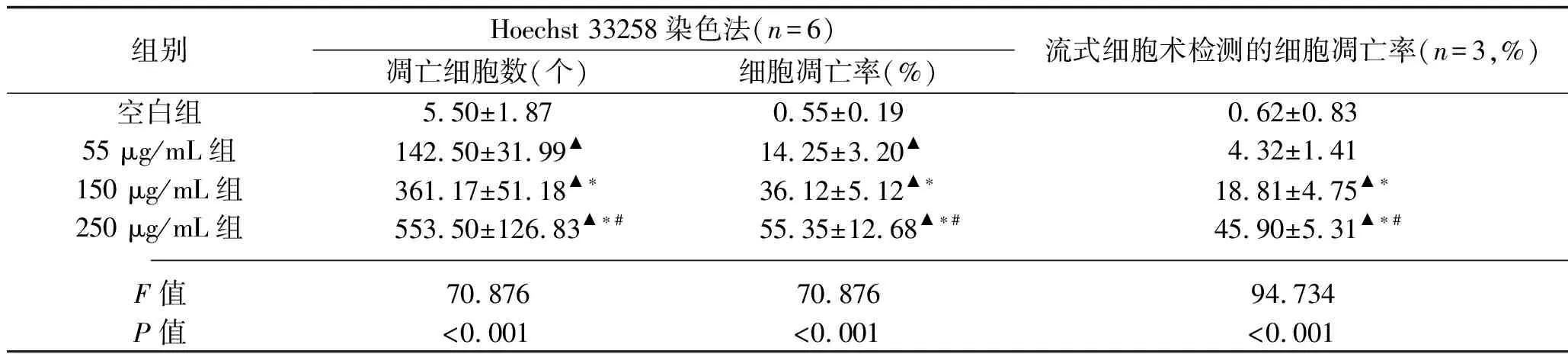
表2 4组HT-29细胞凋亡情况的比较(x±s)
流式细胞术检测结果显示,与空白组比较,150 μg/mL组、250 μg/mL组的细胞凋亡率均增加,55 μg/mL组、150 μg/mL组、250 μg/mL组的细胞凋亡率依次升高(均P<0.05),见表2、图2。

图2 流式细胞术检测4组HT-29细胞凋亡率的结果图
2.3 不同浓度对叶百部总生物碱对HT-29细胞JAK2/STAT3信号通路相关蛋白相对表达水平的影响 与空白组比较,55 μg/mL组、150 μg/mL组、250 μg/mL组的p-JAK2蛋白和p-STAT3蛋白表达水平均下调,55 μg/mL组、150 μg/mL组、250 μg/mL组的p-JAK2蛋白和p-STAT3蛋白表达水平依次下降(均P<0.05),见表3及图3。
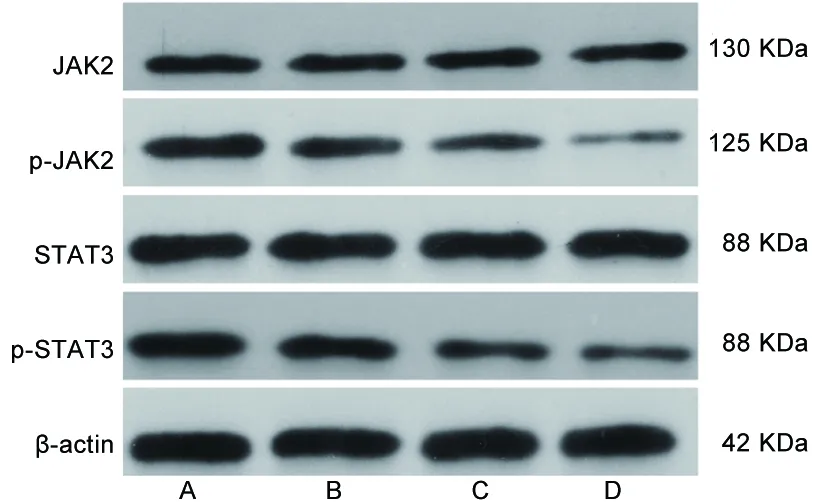
图3 4组HT-29细胞JAK2/STAT3信号通路相关蛋白的电泳图
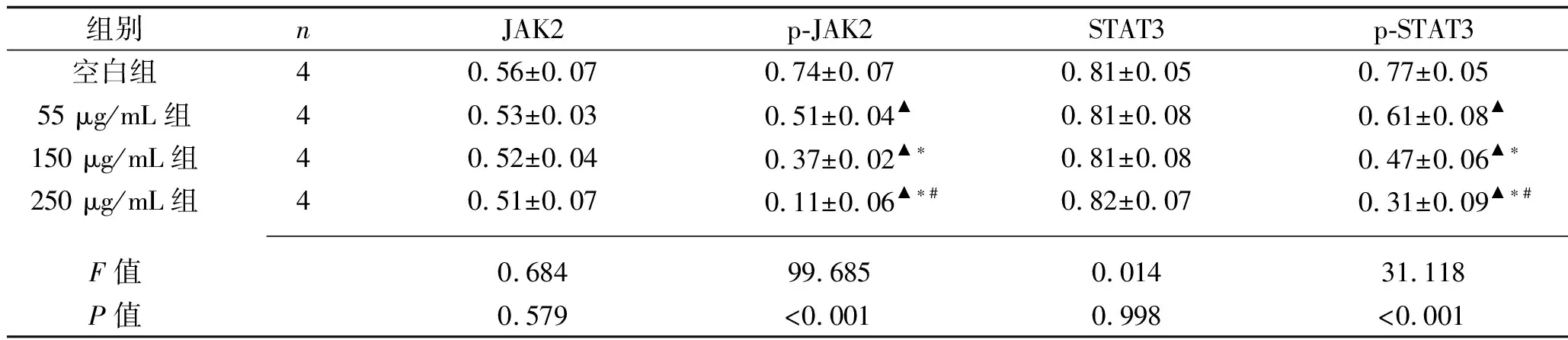
表3 4组HT-29细胞JAK2/STAT3信号通路相关蛋白相对表达水平的比较(x±s)
3 讨 论
肿瘤细胞的异常增殖和凋亡减少是其恶性发展的基础,故肿瘤治疗的关键是抑制其增殖和促进其凋亡[10,14]。本研究结果显示,经对叶百部总生物碱干预后,HT-29细胞增殖抑制率增高,且55 μg/mL组、150 μg/mL组、250 μg/mL组HT-29细胞的增殖抑制率依次升高;Hoechst 33258染色法结果显示,经对叶百部总生物碱干预后,具有染色质浓缩、核固缩、染色质碎裂和凋亡小体等典型凋亡形态的细胞数目明显增加,流式细胞检测术亦显示经对叶百部总生物碱干预后,细胞凋亡率有所提高,且55 μg/mL组、150 μg/mL组、250 μg/mL组HT-29细胞的凋亡数及凋亡率均依次升高。以上结果说明对叶百部总生物碱可影响人结肠癌HT-29细胞的恶性生物学功能,抑制其异常增殖并诱导其凋亡,且具有一定的浓度依赖性。
结肠是机体消化系统的重要组成部分,具有收纳污浊、燥化排便的作用,其不分泌消化酶,无消化功能,主要的功能是吸收水分和钠,因此成为多种细菌的藏纳之地。正常情况下,结肠内有益菌和有害菌菌群和谐共生,但当机体免疫力低下时,菌群失调,导致有害菌过度繁殖,有害菌代谢产物如脂多糖等产生过多,结肠黏膜被破坏而发生炎症反应,促炎因子如白细胞介素1β、白细胞介素6和肿瘤坏死因子α等过度表达,JAK2/STAT3 信号通路被激活[15]。而JAK2/STAT3信号通路是“炎-癌转变”的重要信号轴,与多种恶性肿瘤的发生及发展关系密切[16-17]。JAK2是非受体型酪氨酸蛋白激酶家族中的一员,其过度磷酸化可影响人结肠癌细胞的多种生物变异过程[15]。JAK2/STAT3信号通路的激活主要表现为细胞核内p-JAK2蛋白和p-STAT3蛋白水平升高,可直接促进多种恶性肿瘤细胞的增殖,并调控其他侵袭基因的表达[18-19]。本研究结果显示,人结肠癌HT-29细胞中p-JAK2蛋白和p-STAT3蛋白呈高表达,即存在JAK2蛋白和STAT3蛋白的过度活化;给予对叶百部总生物碱干预后,结肠癌HT-29细胞的p-JAK2蛋白和p-STAT3蛋白表达水平降低,但JAK2蛋白和STAT3蛋白表达水平无明显变化。这说明对叶百部总生物碱对人结肠癌细胞的干预作用可能是通过抑制JAK2蛋白和STAT3蛋白活化来实现的。
综上所述,对叶百部总生物碱可抑制人结肠癌HT-29细胞增殖,并促进其凋亡,且具有一定的浓度依赖性,其可能通过抑制JAK2/STAT3信号通路相关蛋白的活化而发挥作用。但对叶百部总生物碱的有效抑癌成分和其他抗结肠癌作用机制尚不明确,后续仍需进一步研究和探索。
