桑葚花色苷对小鼠的抗疲劳作用
2023-08-13黄徐英
杨 舒,黄徐英,屠 寒,刘 忠,柳 鑫
(武汉市第四医院药剂科,湖北武汉 430034)
随着经济水平的快速提升,社会竞争愈趋激烈,超长时间、高强度、大负荷的工作节奏使疲劳逐渐成为普遍的社会健康问题。疲劳是亚健康的主要表现之一,常伴随身体乏力、肌肉酸痛、内分泌紊乱、免疫力下降等症状,严重影响人们的工作效率和生活质量。诸多研究表明,疲劳的产生与体内积累过量的自由基,导致氧化和抗氧化系统失衡密切相关[1-2]。因此,诸多学者开发了多糖、多酚、黄酮等抗氧化成分,以清除体内自由基,减少机体氧化损伤,改善机体的生理机能,缓解机体疲劳[3]。从药食两用的桑葚资源挖掘开发安全性高、资源丰富、抗疲劳功效显著的产品,已逐渐成为当前国内学者的研究热点,如桑葚多糖[4]、桑椹果醋[5]、襄荷桑葚复合饮料[6]等。
桑葚(Mulberry),是桑科桑树(Morus albaLinn.)的聚花果,又名乌葚、桑果等;因口味酸甜可口,色泽鲜亮,有“民间圣果”的美誉,备受消费者的信赖与喜爱。桑葚中含丰富的花色苷、维生素、氨基酸、多糖等活性成分,具有极高的食用价值和营养价值[7-8]。作为中药资源入药历史悠久,桑葚收录于《唐本草》、《本草纲目》等中药典籍,具有滋阴补血、生津润燥的功效[9]。花色苷是桑葚中一类重要的多酚成分,常作为天然色素、营养成分、活性成分等功能因子,用于食品、化妆品和药品等,如矢车菊素-3-O-葡萄糖苷、矢车菊素-3-芸香糖苷和飞燕草素-3-O-葡萄糖苷等[7]。因吡喃环存在未配对电子,花色苷具有超强的抗氧化活性[10]。同时,桑葚花色苷还可抗脂质氧化、抗衰老等,预防视疲劳、糖尿病、肥胖等[11-12]。因此,桑葚花色苷富有营养保健价值,极具抗疲劳的潜力。然而,桑葚极易腐败,易造成较大的资源浪费。在桑葚抗疲劳的报道中,关于桑葚花色苷抗疲劳作用的研究较少,其资源价值未被充分开发利用。本研究采用AB-8 大孔树脂、HPLC 分别制备、分析桑葚花色苷提取物,并通过研究桑葚花色苷体内外的抗氧化活性,以探讨桑葚花色苷抗疲劳的作用机制,为进一步开发桑葚资源及其营养保健价值提供理论依据。
1 材料与方法
1.1 材料与仪器
桑葚鲜果(Mulberry) 2019 年5 月购自湖北省武汉市江岸区水果批发市场,清洁级C57BL6J 雄性小鼠 60 只,7 周,体重(20.8±1.03) g,北京维通利华实验动物技术有限公司,合格证号SCXK(京)2019-0008;小鼠分笼饲养,自由摄食和饮水,饲养温度22~24 ℃,相对湿度为40%~60%;乳酸(Lac)、尿素氮(BUN)、活性氧(ROS)试剂盒 南京建成生物工程有限公司;乳酸脱氢酶(LDH)、肌酸激酶(CK)、超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、8-羟基脱氧鸟苷(8-OHdG)试剂盒 上海臻科生物科技有限公司;TRIzol 试剂北京百奥莱博科技有限公司;引物、实时荧光定量聚合酶链式反应试剂盒 杭州联科美讯生物医药技术有限公司;矢车菊素-3-O-葡萄糖(C3G,纯度≥98%)、天竺葵素-3-O-葡萄糖苷(P3G,纯度≥98%)、飞燕草素-3-O-葡萄糖苷(D3G,纯度≥98%) 上海源叶生物科技有限公司;甲醇(色谱纯)、甲酸(色谱纯) 北京市通广精细化工公司;磷酸缓冲盐水溶液、蒸馏水自制。
多功能酶标仪(Spectramax i3x)、高速冷冻离心机(Sorvall ST16R)、流式细胞仪(Attune NxT) 赛默飞世尔科技有限公司;高效液相色谱仪(Agilent 1260) 安捷伦科技有限公司;电子精密天平(New Classic ME) 瑞士梅特勒-托利多集团;电泳槽(Mini-PROTEAN® Tetra) 伯乐生命医学产品有限公司;实验室超纯水机(Direct-Q3) 美国默克集团;超净台(SW-CJ-2FD) 上海涵今仪器仪表有限公司;实验室超低温冰箱(DW-HL340) 中科美菱低温科技股份有限公司。
1.2 实验方法
1.2.1 桑葚花色苷馏分制备 将桑葚鲜果清洗除杂后,加入4 倍体积的60%乙醇溶液(含0.05%醋酸)提取,碾碎成浆液,过滤,得滤液;滤液7000 r/min 离心10 min,取上清液,冻干,作桑葚粗提物(冻干粉)备用;取冻干粉加水溶解,配制成100 mg/mL 水溶液,作桑葚溶液(MY)冷藏备用。将AB-8 大孔树脂(2.6 cm×60 cm)活化,垂直装柱,径高比为1:15,备用;桑葚溶液(MY)上样,静置30 min;随后依次用3 倍柱体积水、40%、60%、80%乙醇依次洗脱,流速3 BV/h,每瓶20 mL收集洗脱液,备用[7,13]。
分别精密称取适量的C3G、P3G、D3G 标准品,配制成混合标品溶液,各成分浓度为1.0 mg/mL;精密吸取不同体积的混合标品溶液,梯度稀释,制备不同浓度混合标品溶液(0.05、0.1、0.2、0.4、0.6、0.8 mg/mL)进行HPLC 分析,绘制C3G、P3G、D3G浓度与吸收峰面积的标准曲线回归方程。
HPLC 测定桑葚花色苷色谱条件[14]:Kromasil 100-5C18色谱柱(5 μm, 250×4.6 mm);流动相为0.1%甲酸水溶液(A)和甲醇(B);梯度洗脱程序为0~5 min 93%→90% A,5~10 min 90%→80% A,10~15 min 80%→75% A,15~20 min 75%→65%%,20~25 min 65%→65% A,25~30 min 65%→60% A,30~32 min 60%→92% A,32~35 min 92%→92% A;流速、柱温、进样量分别设置为1.0 mL/min、25 ℃、525 nm 和10 μL。
通过上述HPLC 色谱条件,分析桑葚洗脱液中花色苷(C3G、P3G、D3G)含量,合并馏分,浓缩、冷冻干燥,获得桑葚花色苷提取物,用于小鼠实验。
1.2.2 抗氧化活性测定 采用DPPH 自由基清除率法[15],取1.2.1 项下纯化前后的桑葚花色苷提取物,配制成水溶液,维生素C 作为阳性药物组,浓度设置为10 μg/mL,分析各提取物抗氧化活性。
1.2.3 实验动物分组、给药与饲养 小鼠(60 只)经适应性饲养后,随机分为安静组、有氧运动组、模型组、低剂量组、中剂量组、高剂量组,共6 组,每组10 只。低、中、高剂量组小鼠用桑葚花色苷馏分灌胃给药,根据课题组前期预实验结果,剂量分别设置为100、200、400 mg/kg,其它组小鼠灌胃等体积的生理盐水。
安静组小鼠正常饲养;有氧运动组小鼠每天游泳10 min,随即吸干皮肤水分正常饲养;模型组和低、中、高剂量组小鼠每天进行负重游泳运动力竭实验,饲养周期4 周。本实验通过湖北中医药大学伦理委员会审批(批号:HUCMS202111089),实验操作符合国家制定的实验动物管理和使用指南。
1.2.4 负重游泳力竭实验 在给药30 min 后,模型组和低、中、高剂量组小鼠尾部系上5%体质量的铅丝,依次放入游泳箱(水深30 cm、水温24±2 ℃)中进行负重游泳实验。当小鼠头部沉浸入水10 s,无法浮出水面,即为小鼠力竭时间。每间隔1 周,记录小鼠负重游泳力竭时间[16]。
1.2.5 小鼠血清及组织样本收集 在末次训练结束30 min 后,采用2%戊巴比妥钠溶液麻醉小鼠,摘眼球取血,置于抗凝管中7000 r/min 离心10 min,得上清液,储藏备用。
颈椎脱臼处死小鼠,取小鼠腿部骨骼肌,用4 ℃生理盐水漂洗,吸水纸吸干表面水分,置于-80 ℃冰箱中冻存,储藏备用。
1.2.6 血清生化指标测定 取上述血清,参照各试剂盒说明书,测定血清中Lac、BUN 的含量,LDH、CK 的酶活力。
1.2.7 小鼠骨骼肌氧化应激指标测定 取上述骨骼肌,参照各试剂盒说明书,测定骨骼肌中ROS 和MDA、8-OHdG 含量、SOD 和GSH-Px 的酶活力。
1.2.8 小鼠骨骼肌mRNA 相对表达水平测定 取适量骨骼肌组织匀浆碾碎后,采用TRIZOL 法提取骨骼肌组织总RNA[17]。通过紫外-分光光度测定OD260/OD280比值(1.8~2.0),确定总RNA 浓度。随后按照反转录试剂盒说明书进行逆转录,以其cDNA 产物测定Nrf2 和HO-1 mRNA 转录表达水平(表1)。选取β-actin 作为内参,以Nrf2 和HO-1 mRNA 与βactin 表达含量比值作为该因子相对表达水平。
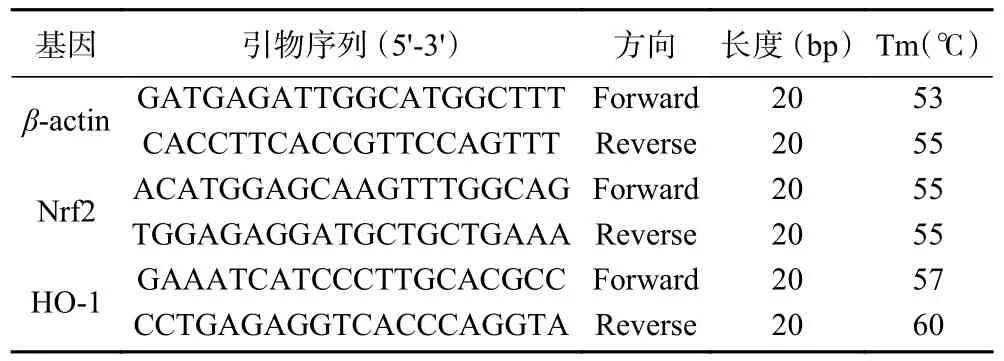
表1 Nrf2、HO-1 和β-actin 的引物序列Table 1 Primer sequence of Nrf2, HO-1 and β-actin
1.3 数据处理
2 结果与分析
2.1 桑葚花色苷的制备与分析
C3G、P3G、D3G 是桑葚主要的抗氧化活性成分,极具抗疲劳潜力[2,7,17]。对纯化前后桑葚提取物中C3G、P3G、D3G 的含量及其抗氧化活性进行了分析,C3G、P3G、D3G 的标准曲线如表2 所示,其HPLC 图谱如图1 所示。经大孔树脂分离纯化后,桑葚花色苷中杂质峰明显较少或降低,其C3G、P3G、D3G 含量分别为9.1%、20.9%、7.6%。与桑葚粗提物比较,纯化后桑葚花色苷中C3G、P3G、D3G 的含量分别增加了193.5%、190.3%、171.4%。DPPH 自由基清除实验表明,桑葚粗提物、纯化后桑葚花色苷、维生素C 的DPPH 自由基清除率分别为46.1%、88.4%、90.6%。桑葚花色苷具有良好的抗氧化活性,远优于桑葚粗提物的抗氧化活性。可能原因是,在花色苷提取过程中,大量的蛋白质、氨基酸、多糖等杂质成分亦被提取,降低了桑葚粗提物中花色苷的含量,从而影响了花色苷的抗氧化活性[18]。因此,通过高效的精制方式处理桑葚粗提物以减少杂质,提升花色苷的含量,以增强其抗氧化活性,是挖掘桑葚花色苷抗疲劳潜力的必要步骤。
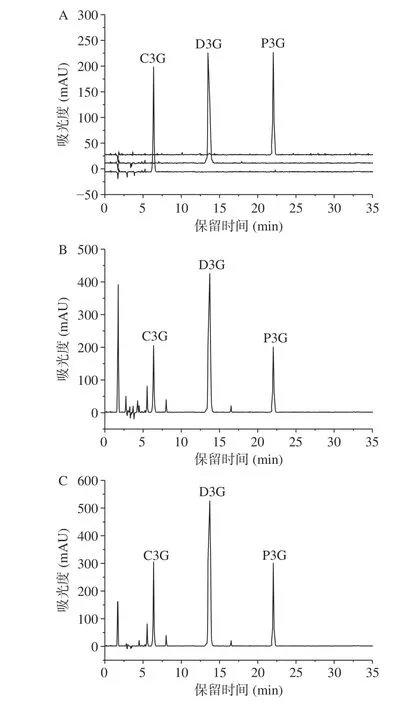
图1 桑葚花色苷提取物色谱图Fig.1 HPLC chromatogram of mulberry anthocyanin extract
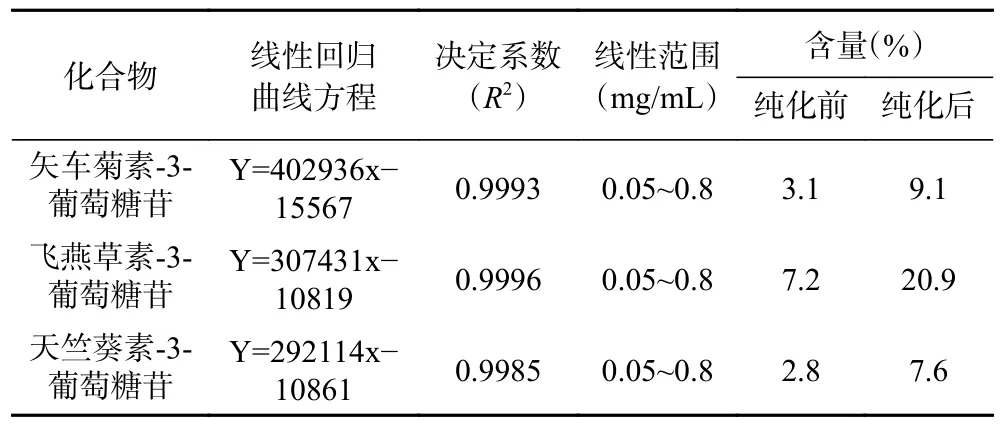
表2 C3G、P3G、D3G 含量测定的标准曲线方程与含量Table 2 Standard curve equation and the content of C3G, P3G, D3G
2.2 桑葚花色苷对小鼠负重游泳时间的影响
过量运动后,机体能量供应和代谢能力不足,出现身体乏力、肌肉酸痛等疲劳症状,使得机体运动能力、耐力下降等。负重游泳实验常用于评价食品药品的抗疲劳作用,力竭运动时间的长短客观、直接的反映了运动能力[19-20]。由表3 可知,模型组小鼠的游泳力竭时间呈现先增加后逐渐降低的趋势。第1 周小鼠适量的运动,增强了机体运动能力与忍耐力,从而延长了游泳力竭时间。然而,第2 周开始,小鼠游泳的运动量倍增,超过了身体负荷,从而产生疲劳导致力竭时间降低。在末次给药后,低、中、高剂量组小鼠的游泳力竭时间分别为13.85±1.23、15.91±1.15、19.48±1.04 min。与模型组比较,低、中、高剂量组小鼠的游泳力竭时间分别延长了94.5%、125.6%、176.3%(P<0.05),且与桑葚花色苷存在剂量依赖关系。同桑葚多糖抗疲劳研究的结果一致[4],上述研究结果表明了桑葚花色苷作为桑葚的重要活性成分,可有效提高小鼠的运动耐力,延长小鼠运动时间,具有显著的抗疲劳作用。
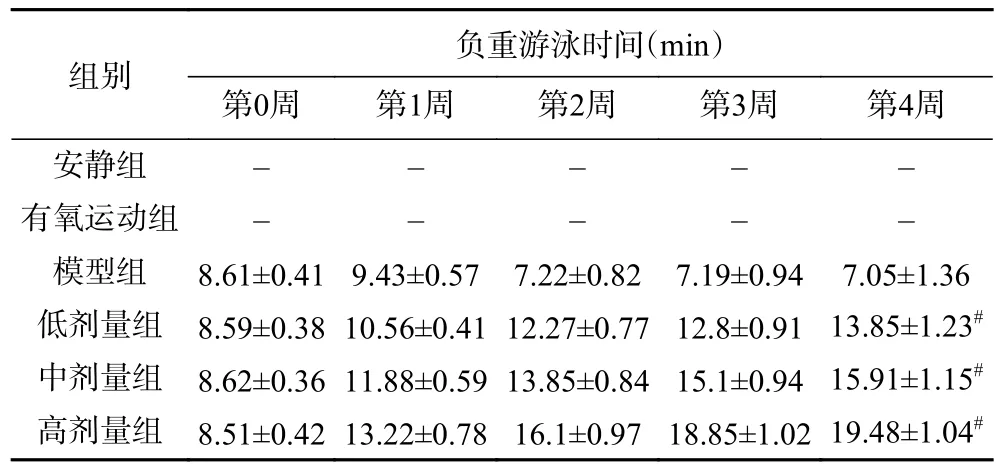
表3 桑葚花色苷对小鼠负重游泳时间的影响Table 3 Effect of mulberry anthocyanin on the loading swimming time of mice
2.3 桑葚花色苷对能量代谢的影响
Lac、BUN 分别是糖、蛋白质代谢的产物,其水平的高低反应机体糖类、蛋白质的消耗程度,客观体现疲劳积累程度[21]。由图2 可知,与安静组比较,有氧运动组小鼠血清中Lac、BUN 含量无显著性差异(P>0.05)。与有氧运动组比较,模型组小鼠血清中Lac、BUN 含量分别显著升高了102.3%、64.6%(P<0.05)。在正常的情况下,机体内的Lac、BUN 均处于动态平衡的状态。有氧运动过程中,肌肉组织的糖原、蛋白质等物质代谢加快,以补充机体能量的消耗。Lac、BUN 的生成速率小于其分解或排出的速率。因此,有氧运动组小鼠体内的Lac、BUN 水平较低,未产生相关的疲劳症状。然而,当运动过度时,体内糖和蛋白质分解迅速加快。同时,机体处于缺氧状态,大量的Lac、BUN 无法分解,堆积于体内,破坏体内酸碱平衡,从而使得模型组小鼠体内Lac、BUN 浓度迅速升高,产生疲劳症状[22]。
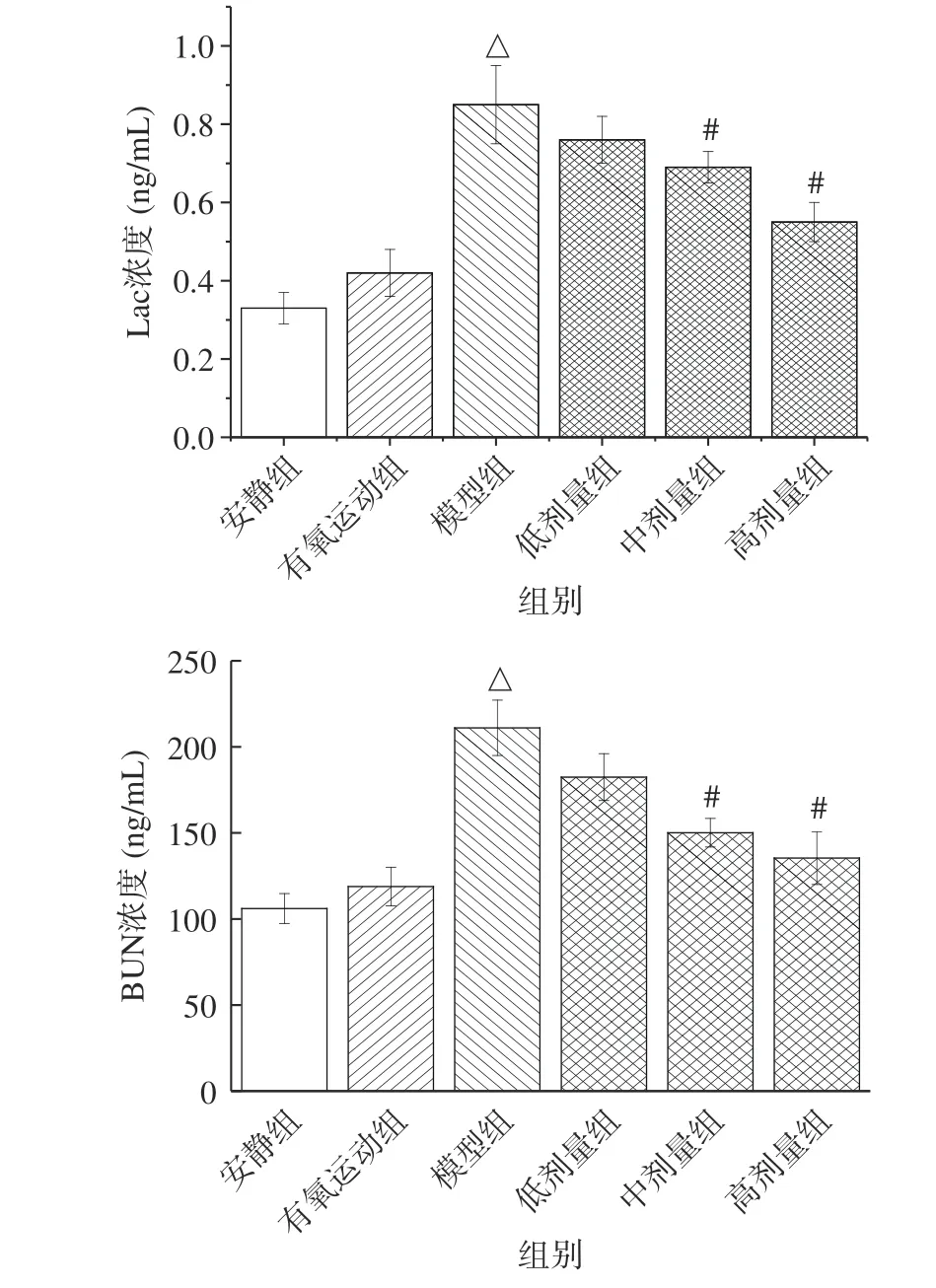
图2 桑葚花色苷对小鼠血清中Lac、BUN 浓度的影响Fig.2 Effect of mulberry anthocyanin on the concentration of Lac、BUN in serum of mice
低、中、高剂量组小鼠的清中Lac、BUN 浓度依次降低,与桑葚花色苷存在剂量依赖关系。与模型组比较,低剂量组Lac 和BUN 浓度无显著性差异(P>0.05);中、高剂量组Lac 浓度分别显著降低了18.8%、35.3%(P<0.05),BUN 浓度分别显著降低了28.9%、36.4%(P<0.05)。高剂量组BUN 浓度与有氧运动组无显著性差异(P>0.05)。上述研究与百香果、胡萝卜花色苷抗疲劳的研究结果一致[23-24],可能由于低剂量的桑葚花色苷总量太低,而花色苷结构不稳定,导致机体吸收的桑葚花色苷较少,无法发挥显著的功效[25]。随着剂量的增加,桑奢花色苷逐渐被吸收,减少了运动中糖类和蛋白质分解,使得Lac、BUN 浓度降低。因此,桑葚花色苷可改善体内糖类、蛋白质和氨基酸的分解代谢,减少代谢产物的堆积,发挥抗疲劳作用。
2.4 桑葚花色苷对运动损伤的影响
LDH 是糖酵解的关键酶,催化乳酸氧化成丙酮酸。CK 是促进能量代谢的酶,与细胞内能量运转密切相关。LDH、CK 常存在于肌肉组织中,其活性作为运动损伤程度的指标,反映机体对运动负荷的适应能力[23]。由图3 可知,与安静对照组比较,有氧运动组小鼠血清中CK 和LDH 活性无显著性差异(P>0.05)。与有氧运动组比较,模型组小鼠血清中CK和LDH 活性显著升高了26.9%、42.2%(P<0.05)。有氧运动的强度较低,机体的负荷较小,不易造成运动损伤。当过度运动时,对骨骼肌造成了损伤,使得细胞膜通透性增强,LDH 和CK 易渗透至血液中,并大量的积累。因此,有氧运动组小鼠血清中LDH 和CK 活力较低,模型组小鼠血清中CK 和LDH 活性则快速升高[25]。
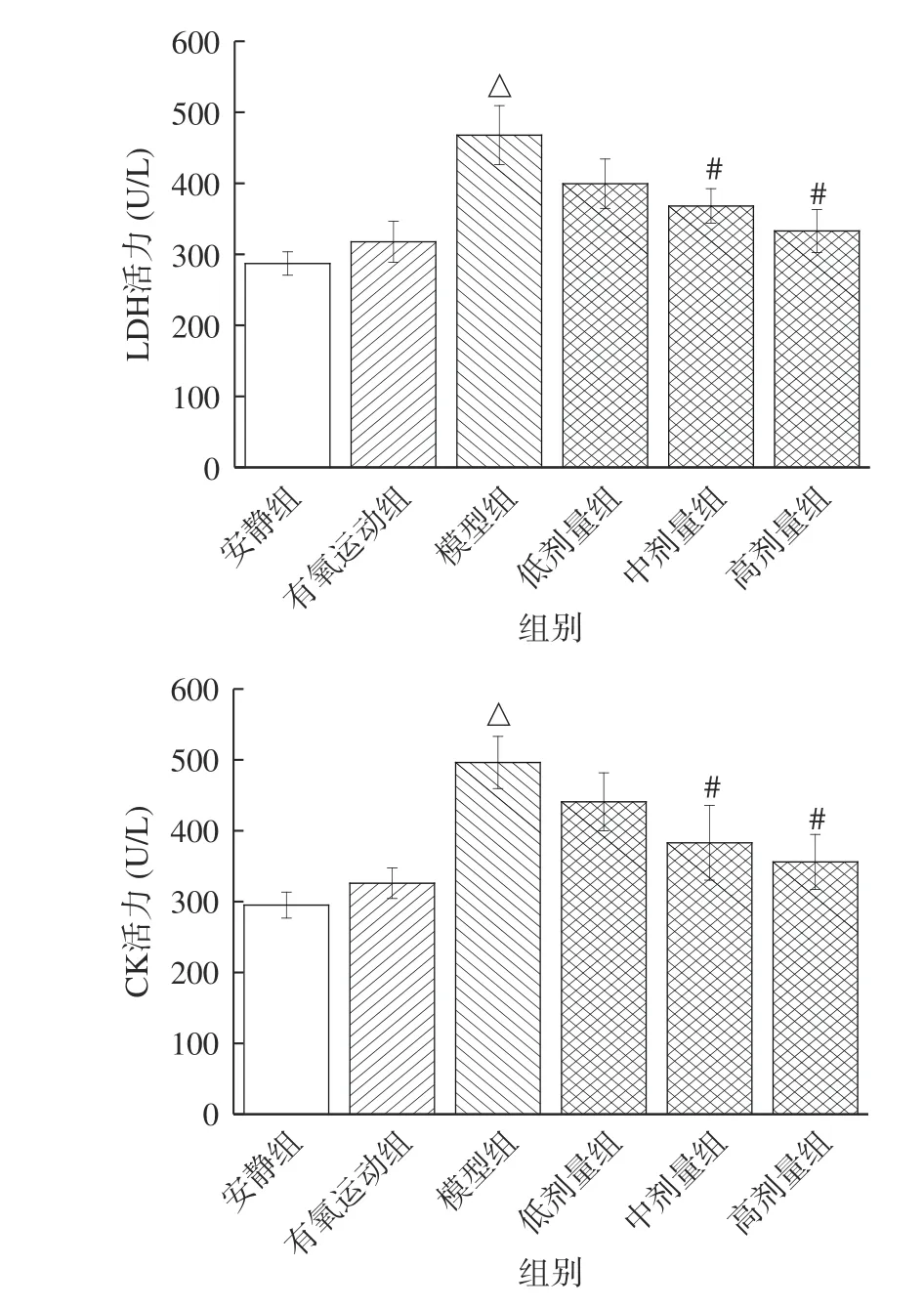
图3 桑葚花色苷对小鼠血清中LDH 和CK 活力的影响Fig.3 Effect of mulberry anthocyanin on the activity of LDH and CK in serum of mice
低、中、高剂量组小鼠的清中CK 和LDH 活性均依次降低,与桑葚花色苷存在剂量依赖关系。与模型组比较,中、高剂量组LDH 活性分别显著降低了21.2%、28.9%,CK 活性分别显著降低了22.9%、28.2%(P<0.05)。高剂量组LDH、CK 活性与有氧运动组无显著性差异(P>0.05)。机体疲劳、运动损伤等与氧化应激密切相关,通过抗氧化、抗炎、抗凋亡等方式可改善氧化应激,减轻氧化损伤,预防疲劳[26]。桑葚花色苷具有良好的体内外抗氧化活性,有助于改善机体氧化应激能力,预防心血管疾病、保护视网膜、保护神经细胞等[27]。因此,剂量组肌肉组织损伤减轻,细胞膜通透性降低,渗透至血液中LDH 和CK的活性降低。综合上述结果表明,桑葚花色苷可能是通过改善机体氧化应激能力,从而预防运动损伤,发挥抗疲劳的作用。
2.5 桑葚花色苷对氧化因子的影响
ROS 是一类有超强氧化性的自由基,易攻击细胞膜、脂质、蛋白质和DNA 等,导致氧化应激损伤。因此,通过抑制ROS 的产生或积累,可改善氧化应激损伤,有利于缓解疲劳[16]。由图4 可知,与安静组比较,有氧运动组、模型组小鼠骨骼肌ROS 含量显著升高(P<0.05)。在运动过程中,肌肉组织的血流量增加,以满足机体的氧气消耗,会伴随大量自由基的产生与清除。然而,当过度运动时,机体抗氧化和氧化系统失衡,从而使得模型组小鼠体内ROS 大量堆积而显著升高(P<0.05),导致肌肉组织稳态紊乱,造成氧化应激损伤和疲劳[16]。
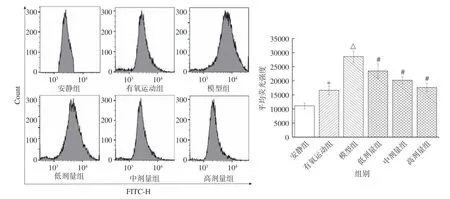
图4 桑葚花色苷对小鼠骨骼肌中ROS 含量的影响Fig.4 Effect of mulberry anthocyanin on the content of ROS in skeletal muscle of mice
低、中、高剂量组小鼠的骨骼肌ROS 含量依次降低,与桑葚花色苷存在剂量依赖关系。与模型组比较,低、中、高剂量组ROS 含量分别降低了20.6%、43.3%、54.4%,且存在显著性差异(P<0.05)。高剂量组ROS 含量与有氧运动组无显著性差异(P>0.05)。诸多桑葚花色苷抗氧化活性研究结果表明,桑葚花色苷可清除自由基,具有良好的抗氧化效果[9,28]。综合上述结果表明,桑葚花色苷作为抗氧剂,可抑制体内ROS 氧化因子的产生或积累,改善氧化应激,发挥抗疲劳的作用。
2.6 桑葚花色苷对氧化应激的影响
SOD 和GSH-Px 是机体内重要的酶系抗氧化剂和自由基清清除剂,可催化自由基转化为过氧化氢,阻断自由基引发的组织损伤,从而发挥抗氧化功能[29]。MDA、8-OHdG 作为体内氧化能力的标志物,是脂质、DNA 分别与自由基反应的产物[29]。由图5可知,与安静组小鼠相比,有氧运动组小鼠骨骼肌SOD 和GSH-Px 活性、MDA 和8-OHdG 含量无显著性差异(P>0.05)。与有氧运动组比较,模型组小鼠骨骼肌SOD、GSH-Px 活性显著降低(P<0.05),MDA 和8-OHdG 含量显著升高(P<0.05)。在运动过程中,机体内产生并堆积了大量的自由基,同时调节体内抗氧化体系活性,以改善机体的氧化应激能力,保护细胞组织[30]。因此,有氧运动组小鼠SOD、GSH-Px 活性显著升高,MDA、8-OHdG 含量基本不变。然而,过度运动破坏了模型组小鼠体内氧化平衡体系,消耗大量的SOD、GSH-Px 抗氧剂,使其活性降低。另外,大量自由基在体内堆积,使得脂质、DNA 过氧化反应增加,对机体造成氧化应激损伤,模型组小鼠MDA、8-OHdG 含量升高[30]。
低、中、高剂量组小鼠的骨骼肌SOD、GSHPx 活性依次升高,MDA 和8-OHdG 含量依次降低,且与桑葚花色苷存在剂量依赖关系。与模型组比较,高剂量组小鼠SOD、GSH-Px 活性显著升高了27.8%、51.4%(P<0.05);中、高剂量组MDA 含量分别显著降低了26.3%、40.1%,8-OHdG 含量分别显著降低了23.6%、52.5%(P<0.05)。高剂量组MDA 和8-OHdG 含量与有氧运动组无显著性差异(P>0.05)。上述研究结果与百香果、胡萝卜花色苷抗疲劳的研究结果一致[23-24],桑葚花色苷作为良好的抗氧剂,有助于清除体内自由基,阻止MDA 和8-OHdG 的生成,减小细胞氧化损伤程度,发挥抗疲劳作用[25]。同时,随着桑葚花色苷剂量的增加,SOD 和GSH-Px 的消耗减少,维护了机体的稳态平衡。因此,桑葚花色苷可通过清除自由基,减少脂质过氧化和DNA 损伤,提高骨骼肌SOD、GSH-Px 抗氧化活性,改善机体氧化应激损伤,发挥抗疲劳的作用。
2.7 桑葚花色苷对小鼠骨骼肌Nrf2 和HO-1 相对表达水平的影响
核因子E2 相关因子2(Nrf2)可激活下游多个抗氧化因子和GSH 氧化还原系统,是增强细胞抗氧化应激作用的调节因子,参与细胞物质与能量代谢、细胞氧化应激等,有助于缓解机体疲劳[30]。血红素氧合酶1(HO-1)是抗炎、抗氧化、具有神经保护作用的诱导酶,作为抗氧化因子,在抗氧化损伤中具有重要的作用[31]。因此,Nrf2、HO-1 是重要的抗疲劳分子靶点。由图6 可知,与安静组比较,有氧运动组小鼠骨骼肌Nrf2 和HO-1 mRNA 相对表达水平无显著性差异(P>0.05)。与有氧运动组比较,模型组小鼠骨骼肌Nrf2 和HO-1 mRNA 相对表达水平显著降低(P<0.05)。在非运动状态下,Nrf2 常与其负调节因子Keap1 形成二聚体,从而抑制Nrf2 的表达。然而,在运动过程中,机体产生了大量的ROS,使得Keap1 结构加速解偶联,从而刺激Nrf2 的转移和表达,激活下游HO-1 相关的抗氧化应答过程,以清除ROS。Nrf2 和HO-1 表达的调节作用存在一定剂量效应,过度运动使机体抗氧化和氧化体系失衡;过量的ROS 加剧了细胞损伤或凋亡,一定程度抑制了Nrf2 和HO-1 mRNA 的表达[32]。因此,模型组小鼠Nrf2、HO-1mRNA 相对表达水平降低。
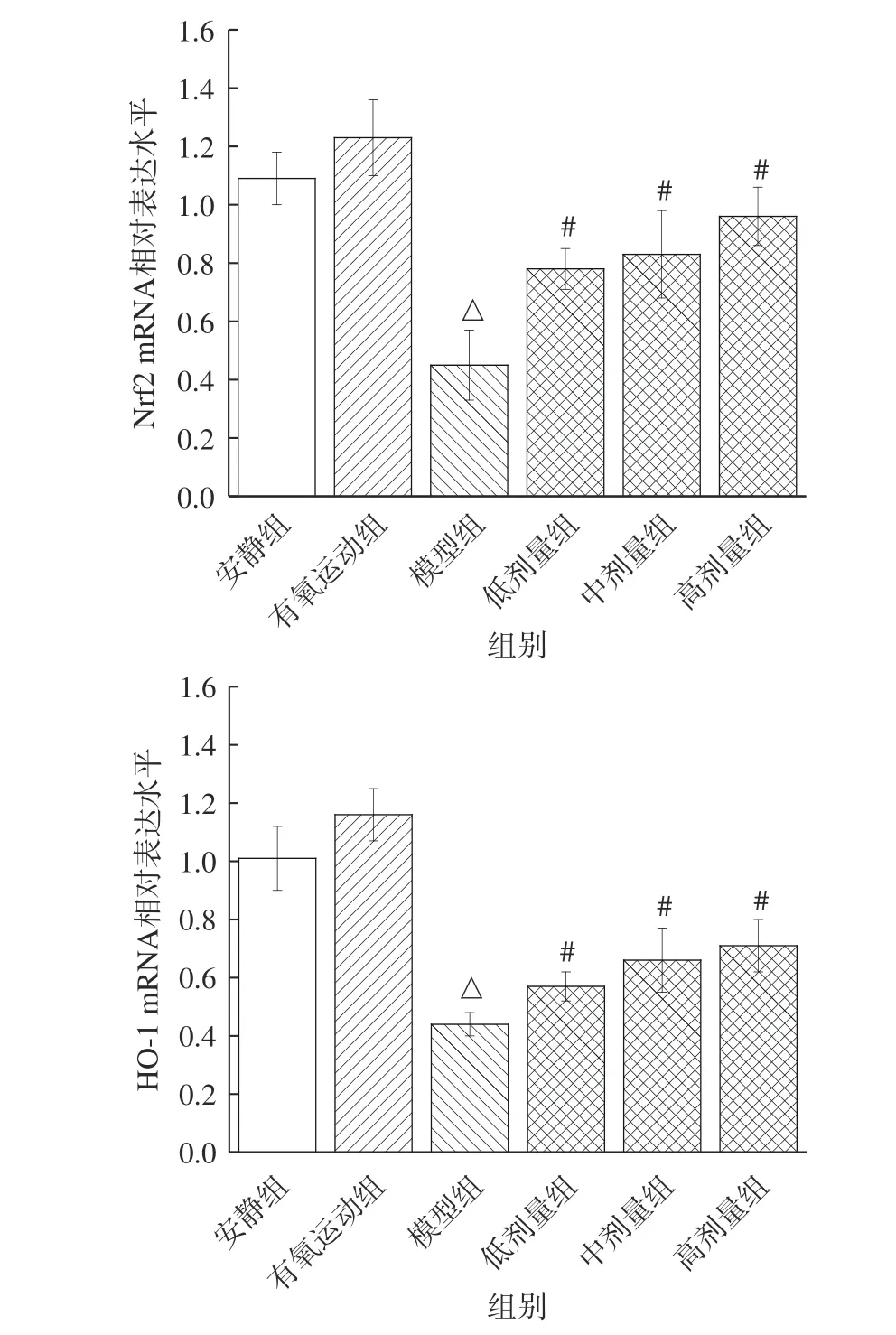
图6 桑葚花色苷对小鼠骨骼肌Nrf2 和HO-1 mRNA相对表达水平的影响Fig.6 Effect of mulberry anthocyanin on the relative expression levels of Nrf2 and HO-1 mRNA in skeletal muscle of mice
低、中、高剂量组小鼠骨骼肌Nrf2 和HO-1 mRNA 相对表达水平含量依次升高,与桑葚花色苷存在剂量依赖关系。与模型组比较,低、中、高剂量组Nrf2 mRNA 相对表达水平分别显著升高了73.3%、84.4%、113.3%(P<0.05),HO-1 mRNA 分别显著升高了29.5%、50.1%、61.4%(P<0.05)。可能原因是,体内ROS 刺激了Nrf2 的转移和表达,激活了下游HO-1 相关的抗氧化应答过程。同时,桑葚花色苷作为良好的抗氧剂,有助于清除体内自由基,减少细胞的氧化损伤,保护了细胞[25]。因此,剂量组小鼠Nrf2、HO-1 mRNA 相对表达水平升高。矢车菊素-3-O-葡萄糖苷可通过激活Nrf2/HO-1 信号通路保护ROS 介导的细胞损伤[33];蓝莓花青素可通过调节Nrf2/HO-1 信号传导改善视网膜氧化应激和炎症[34];花青素作为抗氧剂,通过PI3K/Akt/Nrf2/HO-1 途径降低HT22 细胞中神经毒性而保护神经细胞[35]。诸多研究表明花色苷可通过激活Nrf2/HO-1 信号通路,增加Nrf2 和HO-1 蛋白表达,增强细胞抗氧化应激的能力,以保护细胞。综合上述研究结果表明,桑葚花色苷可通过促进Nrf2/HO-1 的表达,增强机体抗氧化作用,改善氧化应激能力,发挥抗疲劳的作用机制。
3 结论
经过大孔树脂纯化后,桑葚花色苷中C3G、P3G、D3G 含量达到9.1%、20.9%、7.6%,显示出良好的抗氧化活性。随着给药时间的增加,桑葚花色苷表现出良好的抗疲劳作用。在末次给药后,与模型组比较,低、中、高剂量组小鼠的游泳力竭时间分别延长了94.5%、125.6%、176.3%(P<0.05)。血清和骨骼肌生化指标分析显示,桑葚花色苷可改善体内物质和能量代谢,减少Lac、BUN 等代谢物的堆积,降低LDH、CK 活性;并通过清除自由基,提高SOD 和GSH-Px 的活力,减少脂质过氧化和DNA 损伤,改善机体氧化应激损伤,提升运动耐力,从而发挥抗疲劳作用。其中,高剂量组BUN 浓度、LDH 和CK 活性、MDA 和8-OHdG 含量,与有氧运动组无显著性差异(P>0.05)。Nrf2/HO-1 mRNA 表达的增加,表明桑葚花色苷可通过调控Nrf2/HO-1 信号通路,改善氧化应激能力,增强机体抗氧化作用,以发挥抗疲劳的作用机制。以上研究初步确定了桑葚花色苷具有良好的抗疲劳作用,与其抗氧化能力、调控Nrf2/HO-1 信号通路的作用机制密切相关,为进一步深度开发桑葚资源及其应用提供了理论依据。然而,高纯度桑葚花色苷单体的抗疲劳能力、具体的作用蛋白靶点仍需探索。
