酸枣仁不同极性部位成分含量与抗氧化活性及其相关性分析
2023-08-13周文文徐志佳肖凤琴杨亦柳李光哲严铭铭
周文文,刘 晖,徐志佳,肖凤琴,李 波,杨亦柳,李光哲, ,严铭铭,2,
(1.长春中医药大学,吉林长春 130117;2.吉林省中药保健食品科技创新中心,吉林长春 130117)
氧化应激(Oxidative stress,OS)是指各种因素造成的活性氧(Reactive oxygen species,ROS)生成过量或降解减少,导致体内氧化与抗氧化作用失衡,具体表现为当机体处于氧化应激态时,体内产生大量的自由基,如超氧化物自由基(O2-·)、羟自由基(·OH)、一氧化氮自由基(·NO)、单线态氧(1O2)和过氧化氢(H2O2)等,攻击脂质、蛋白质和DNA 等生物大分子[1]。研究发现长时间处于氧化应激会造成机体氧化损伤[2],最终诱导炎症的产生,导致各类慢性疾病及神经退行性疾病的发生和恶化[3]。
酸枣仁是鼠李科植物酸枣的干燥成熟种子,味酸、甘,平,微温,具有养肝宁心,镇定安神,敛汗生津等作用[4]。研究发现,酸枣仁在改善睡眠、抗抑郁、增强免疫力、改善记忆、抗氧化方面具有良好的药理活性[5],临床上常被用于治疗失眠等中枢神经系统疾病。现代研究表明酸枣仁中富含有多种有效活性成分,包括黄酮类、皂苷类、脂肪酸、生物碱以及其他生物物质等120 多种成分[6],其中黄酮类[7]、皂苷类[8]、酚酸类[9]是酸枣仁发挥抗氧化活性的主要物质基础,可通过清除自由基、提高抗氧化酶活性等途径发挥一定的抗氧化作用,进而发挥疾病预防以及治疗作用[10]。同时,酸枣中矿物质、多糖、膳食纤维的含量也非常丰富,有很高的食用价值。酸枣仁因其具有良好的食品功能特性被广泛应用于功能性食品的研究与开发中[11],如酸枣仁果汁饮品等[12],属于药食同源资源。
目前,临床对于酸枣仁抗氧化活性的研究多基于酸枣仁单体,有关酸枣仁不同极性部位抗氧化活性的研究内容较少,且对于酸枣仁不同极性部位成分含量对其抗氧化活性的影响尚未见研究报道。因此本研究通过运用偏最小二乘回归分析法(PLS)对酸枣仁不同极性部位的成分含量及抗氧化活性进行研究,解释其内在的相关性,旨在筛选出最佳活性部位,明确酸枣仁发挥抗氧化作用的物质基础。为酸枣仁抗氧化产品的开发利用提供科学依据。
1 材料与方法
1.1 材料与仪器
酸枣仁药材饮片(产地:山西、批号:50918006、执行标准:《中国药典》2020 年版一部、生产企业:河北仁心药业有限公司) 吉林省仙草医药药材有限公司;石油醚、三氯甲烷、乙酸乙酯、正丁醇、H2O2、过硫酸钾 分析纯,北京化工厂;没食子酸(批号:110831-200302)、芦丁(批号:100080-200707)、酸枣仁皂苷A(批号:110734-201713)、斯皮诺素(批号:111869-201704)标准品 上海源叶生物科技有限公司;DPPH、ABTS 上海麦克林生化科技有限公司;DME/F-12 1:1(1X)培养基、FBS(胎牛血清)、P/S(青链霉素双抗溶液)、0.25%胰蛋白酶溶液、二甲基亚砜、1×PBS(磷酸盐缓冲液) 美国Gibco 公司;人神经母细胞瘤细胞(SH-SY5Y) 武汉普诺赛生命科技有限公司;其他试剂 均为国产分析纯。
AB265-S 型电子分析天平 梅特勒-托利多仪器(上海)有限公司;DT2000 电子天平 美国奥豪斯仪器有限公司;KQ-250B 型超声波清洗器 江苏省昆山市超声仪器有限公司;HH-6 型数显恒温水浴锅金坛市佳美仪器有限公司;DZF-6053 真空干燥箱上海市一恒科学仪器有限公司;DZTW 型电子调温电热套 北京市光明医疗仪器有限公司;UV-1700型紫外分光光度计 日本岛津有限公司;Infinite M200PRO 型全自动酶标仪 瑞士Tecan 有限公司;CO2培养箱 美国Thermo 有限公司;SHIMADZU 2010A 型高效液相色谱仪 日本岛津有限公司;Alltech ELSD 6000 型蒸发光散射检测器 美国奥泰有限公司。
1.2 实验方法
1.2.1 酸枣仁不同溶剂部位获取 采用传统的水煎煮法,取酸枣仁饮片,置于圆底烧瓶中,加入10 倍量蒸馏水,加热煮沸、回流提取2 次,每次2 h。过滤,合并滤液,将提取液浓缩至50 mL。依次使用石油醚、三氯甲烷、乙酸乙酯、正丁醇萃取,萃取体积比为1:1,振摇1 min,静置20 min 后将有机层收集至蒸发皿,每种溶剂萃取三次,合并萃取液,挥干溶剂后分别得水提取物S1(出膏率23.4%)、石油醚萃取物S2(出膏率1.2%)、氯仿萃取物S3(出膏率0.9%)、乙酸乙酯萃取物S4(出膏率2.6%)、正丁醇萃取物S5(出膏率3.3%)。
1.2.2 酸枣仁不同极性部位主要成分含量测定方法1.2.2.1 总多糖测定 参照万晓莹等[13]的方法,以葡萄糖为标准品,取样品0.2 mL 于10 mL 比色管中,加蒸馏水补至2 mL,加入5%苯酚溶液1 mL,混匀,加入浓硫酸5 mL,混匀;37 ℃加热30 min,立即转入冷水浴中冷却至室温,在488 nm 测定吸光度值A。制备得回归方程为y=5.7093x-0.0426(R2=0.9994),以此计算样品中总多糖含量。
1.2.2.2 总皂苷测定 参考崔小芳[14]的方法,以酸枣仁皂苷A 为标准品,取各样品50 μL 于10 mL 比色管中,60 °C 水浴挥干,加入新配制的5%香草醛冰醋酸溶液0.2 mL,高氯酸0.8 mL,混匀,于60 °C 恒温水浴加热15 min,取出。迅速冷却,加冰醋酸5 mL,摇匀。在472 nm 下测定吸光度值A。制备得回归方程为y=3.8374x-0.0022(R2=0.9994),以此计算样品中总皂苷含量。
1.2.2.3 总黄酮测定 参考Kurkina 等[15]的方法,以芦丁为标准品,取各样品1 mL 于10 mL 比色管中,加入5% NaNO2溶液0.3 mL,混匀,静置6 min,再加入10% Al(NO3)3溶液0.3 mL,混匀,静置6 min,再加入4% NaOH 溶液4.0 mL 混匀后静置15 min,最后用80%乙醇定容至10 mL。在510 nm 下测定吸光度值A。制备得回归方程为y=1.2446x-0.0079(R2=0.9992),以此计算样品中总黄酮含量。
1.2.2.4 总酚酸测定 参考杨勇等[16]的方法,以没食子酸为标准品,取各样品0.5 mL 于10 mL 比色管中,加入福林酚试剂0.5 mL,混匀,6 min 后再加入20% Na2CO3溶液1.5 mL,混匀,用蒸馏水稀释至10 mL,室温下反应2 h(避光)。在743 nm 下测定吸光度值A。制备得回归方程为y=10.412x+0.059(R2=0.9979),以此计算样品中总酚酸含量。
1.2.2.5 酸枣仁皂苷A 含量测定 参考2020 版《中国药典》一部酸枣仁项下的含量测定方法[17],以酸枣仁皂苷A 为标准品,HPLC 法测定样品中酸枣仁皂苷A 含量,色谱柱为Apollo-C18(250 mm×4.6 mm,5 μm)。取酸枣仁皂苷A 对照品适量,精密称定,加甲醇制成每1 mL 含0.1 mg 的溶液,即得酸枣仁皂苷A 标准品溶液;精密称量5 种提取物各1 g,放入具塞锥形瓶中,精密量取50 mL 色谱甲醇加入锥形瓶中,超声处理30 min 后,用甲醇补重。吸取1 mL,用0.22 μm 微孔膜过滤,即所得供试品溶液。分别精密吸取对照品溶液5、20 μL,供试品溶液10 μL,注入液相色谱仪,测定,用外标两点法对数方程计算,测定各样品中酸枣仁皂苷A 含量。
1.2.2.6 斯皮诺素含量测定 参考2020 版《中国药典》一部酸枣仁项下斯皮诺素含量测定的方法[17],以斯皮诺素为标准品,HPLC 法测定样品中斯皮诺素含量,色谱柱为Apollo-C18(250 mm×4.6 mm,5 μm)。取斯皮诺素对照品适量,精密称定,加甲醇制成每1 mL 含0.1 mg 的溶液,即得斯皮诺素标准品溶液。精密称量5 种提取物各1 g,放入具塞锥形瓶中,精密量取50 mL 色谱甲醇加入锥形瓶中,超声处理30 min 后,用甲醇补重。吸取1 mL,用0.22 μm 微孔膜过滤,即得供试品溶液。分别精密吸取对照品、供试品溶液各10 μL,注入液相色谱仪,测定各样品中斯皮诺素含量。
1.2.3 抗氧化能力测定 样品预处理:分别取各样品称量0.2、0.4、0.6、0.8、1.0、1.2 mg,溶于1 mL 蒸馏水中,超声30 min,12000 r/min 离心10 min,取上清液作为待测溶液。
1.2.3.1 超氧阴离子清除率测定 采用邻苯三酚自氧化法[18]。Tris-HCl(50 mmol/L,pH8.2)和邻苯三酚溶液(浓度为6 mmol/L)于25 ℃预热20 min。在96 孔板中加入150 μL Tris-HCl、30 μL 样品溶液、30 μL 预热过的邻苯三酚,25 ℃保温4 min,加20 μL浓盐酸,于420 nm 处测定吸光度值A1。以蒸馏水替代样品溶液作为A0。以蒸馏水代替邻苯三酚作为样品对照A2。按下式计算超氧阴离子的清除率:
1.2.3.2 羟基自由基清除率测定 采用水杨酸法[19]测定对羟基自由基的作用,取96 孔板,每孔分别加入50 μL 样品、50 μL 硫酸亚铁溶液(6 mmol/L)、50 μL 过氧化氢(6 mmol/L),于37 ℃恒温加热10 min 后加入50 μL 水杨酸(6 mmol/L),于37 ℃恒温加热30 min 后在510 nm 处测定吸光度值A1。以蒸馏水代替样品液,测定吸光度值A0;以1 mL 蒸馏水代替过氧化氢溶液,测定吸光度值A2。羟基自由基清除率计算公式同1.2.3.1。
1.2.3.3 DPPH 自由基清除率测定 参照陈冰丹等[20]的实验方法,在96 孔板中,每孔加入100 μL 样品水溶液,100 μL DPPH 溶液,于暗室反应30 min,在517 nm 处测定吸光度值A1;以甲醇代替DPPH 溶液作为样品对照组,测定吸光度值A2;以蒸馏水代替样品液作为空白对照组,测定吸光度值A0。DPPH 自由基清除率计算公式同1.2.3.1。
1.2.3.4 ABTS+自由基清除率测定 参照羌宇等[21]的实验方法,将2 mL 7.4 mmol/L ABTS 储备液与35.2 μL 2.6 mmol/L K2S2O8混匀,静置12~16 h,配成ABTS 工作液。取1 mL ABTS 工作液,用pH 为7.4 的PBS 溶液稀释,要求在常温下734 nm 处吸光值为0.7±0.2。将0.2 mL ABTS 工作液与10 μL 不同浓度样品混合,常温避光反应6 min,在734 nm 波长测定吸光度,平行3 次。ABTS+自由基清除能力由下式计算:
式中,A1为样品+ABTS 溶液吸光度值,A0为PBS 溶液+ABTS 溶液的吸光度。
1.2.3.5 对H2O2所致SH-SY5Y 细胞氧化损伤保护能力测定 参考张妹等[22]方法,采用DME/F-12 1:1 培养基(10% FBS,1% P/S)培养SH-SY5Y 细胞,取对数生长期的SH-SY5Y 细胞以5×103个/孔均匀接种于96 孔板中,待细胞贴壁后,弃去培养液,分别称取S1、S2、S3、S4、S5,溶于培养基中,按生药量记母液浓度为1.2 g/L,用培养基稀释至5、10、20、40、60 mg/L,每孔给药10 μL。用酸枣仁不同提取部位对细胞预保护6 h,再与250 μL H2O2共同作用于SH-SY5Y 细胞株24 h 后,采用CCK-8 法检测细胞活力。
1.3 数据处理
使用SPSS 22.0 统计学软件对数据进行统计学分析,应用方差分析进行显著性分析,以P<0.05(双侧)为差异有统计学意义。采用皮尔逊法进行相关性分析;运用SPSS 26.0 进行偏最小二乘回归分析[23]。
2 结果与分析
2.1 酸枣仁不同极性部位成分含量分析结果
酸枣仁皂苷A、斯皮诺素含量测定HPLC 色谱图见图1、图2。由表1 可知,在五种不同极性萃取部位中,总黄酮、总皂苷、酸枣仁皂苷A、斯皮诺素在S5 萃取部位中成分含量最高,分别为(23.18±0.20)、(21.62±0.23)、(0.3119±0.017)、(0.70±0.024)mg/g,根据相似相溶原理,说明酸枣仁中所含有的总黄酮类、皂苷类、酸枣仁皂苷A、斯皮诺素被中强极性(正丁醇)溶剂富集,可能是因为这些物质属于中强极性物质;总酚酸、总多糖在S1 萃取部位成分含量最高,分别为(7.52±0.09)、(17.40±0.47)mg/g,说明酸枣仁中所含有的酚酸、多糖类化学物质可被强极性(水)溶剂富集,推测这些物质属于强极性物质。
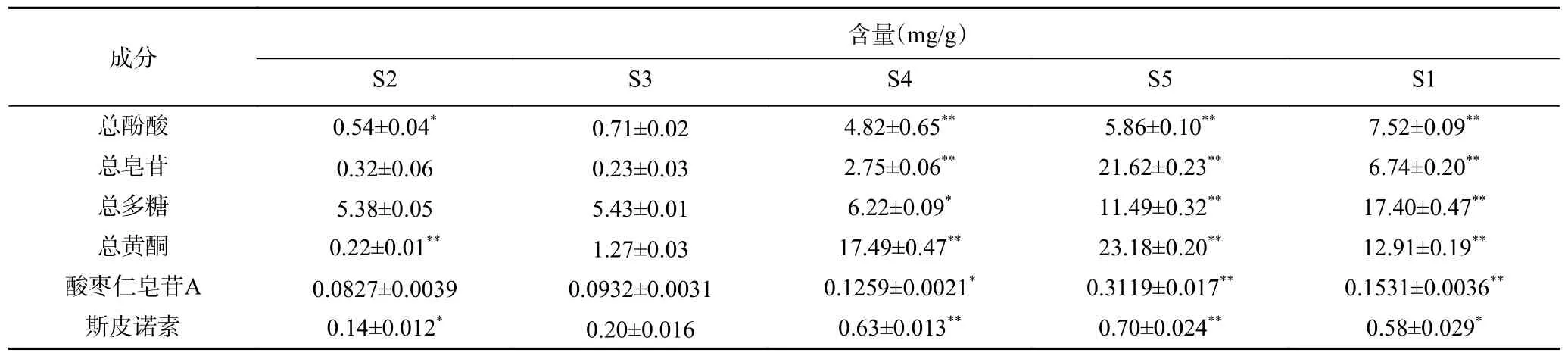
表1 酸枣仁不同极性部位成分含量Table 1 Contents of components in different polar parts of Semen Ziziphi Spinosae

图1 酸枣仁皂苷A 高效液相色谱图Fig.1 High performance liquid chromatogram of jujuboside A
图2 斯皮诺素高效液相色谱图Fig.2 High performance liquid chromatogram of spinozol
2.2 酸枣仁不同极性部位的抗氧化活性
2.2.1 酸枣仁不同极性部位对DPPH 自由基的清除作用 由表2 可知,酸枣仁不同极性部位提取物对DPPH 自由基均有一定的清除能力。随着浓度的增加,不同提取物对DPPH 自由基清除率与其浓度呈良好的线性正相关关系。在相同浓度下不同极性部位对DPPH 自由基清除能力大小顺序为:VC>S5>S1>S2>S3>S4,其中在浓度为1.2 mg/mL 时,S5 萃取部位对DPPH 自由基清除能力最强,为87.94%,接近于阳性对照组VC的清除能力。这可能是由于在酸枣仁S5 萃取部位中总黄酮类、总皂苷类化学物质成分含量较高,DPPH 自由基可与其很好地结合,因此对DPPH 自由基的清除能力较强。该结果与谢红[24]酸枣仁皂苷体外抗氧化活性研究结果一致,具有一定科学性。表明酸枣仁S5 萃取部位对DPPH 自由基有较强的清除能力。
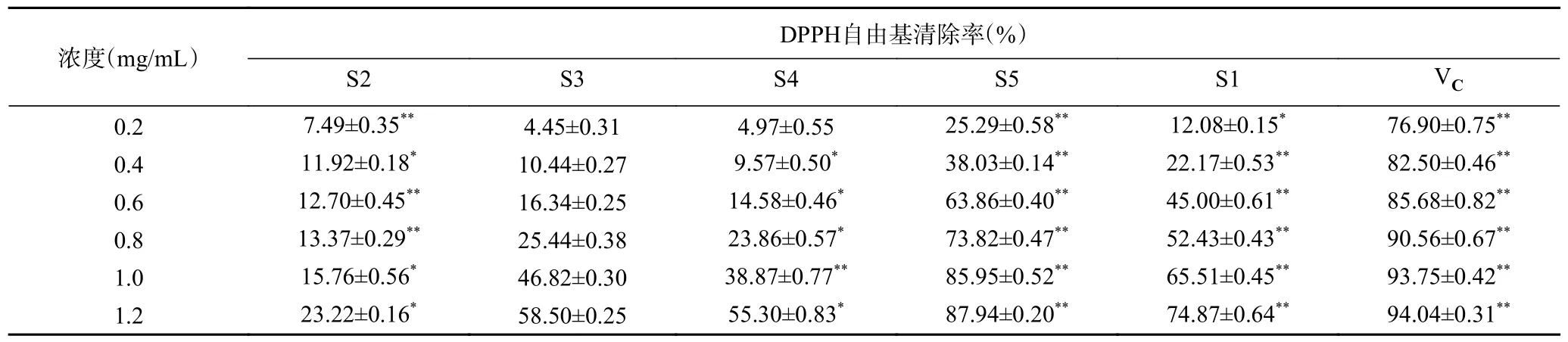
表2 酸枣仁不同极性部位对DPPH 自由基清除能力Table 2 Ability of different polar parts of Semen Ziziphi Spinosae to remove DPPH free radicals
2.2.2 酸枣仁不同极性部位对ABTS+自由基的清除作用 提取物溶液加入ABTS+自由基溶液后,ABTS+自由基溶液会与提取物抗氧化成分发生反应,生成稳定化合物,溶液褪色,因此说明清除能力越好抗氧化活性越高[25]。由表3 可知,酸枣仁不同极性部位提取物对ABTS+自由基均有较强的清除作用,且在0.2~1.2 mg/mL 范围内时,酸枣仁不同极性部位提取物对ABTS+自由基清除活性随质量浓度的增加而增强。在相同浓度下不同极性部位对ABTS+自由基清除能力大小顺序为:VC>S5>S1>S4>S3>S2,其中浓度为1.2 mg/mL 时,S5 萃取部位对ABTS+自由基清除率最高,为93.25%±0.74%,接近于VC标准品。表明S5 萃取部位具有较强的ABTS+自由基清除能力,可以进一步地研究开发。
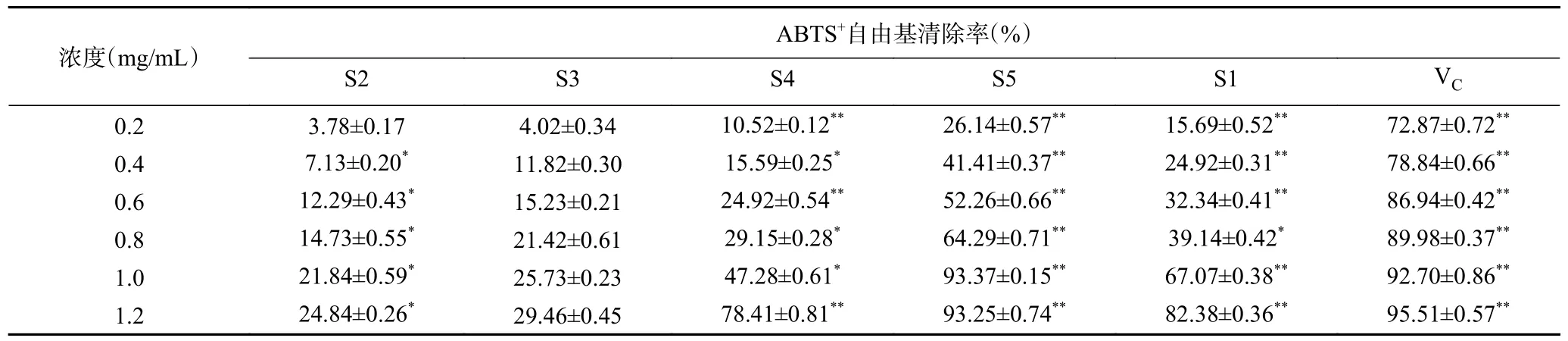
表3 酸枣仁不同极性部位对ABTS+自由基的清除能力Table 3 Ability of different polar parts of Semen Ziziphi Spinosae to remove ABTS+ free radicals
2.2.3 酸枣仁不同极性部位对超氧阴离子自由基的清除作用 由表4 可知,在0.2~1.2 mg/mL 范围内,酸枣仁不同极性部位提取物对超氧阴离子自由基清除率与其浓度呈较好的正相关关系。其中,S5 萃取物清除能力最强,相同浓度下优于及其他萃取物,当浓度达到1.2 mg/mL 时具有最高清除活性,清除率为64.27%±0.31%;对超氧阴离子自由基清除能力较差的为S2 与S1,在浓度1.2 mg/mL 时清除率仅为36.43%±0.20%、55.33%±0.52%。该结果可能与正丁醇萃取物中的黄酮类成分具有活泼的酚羟基,在遇到活性氧自由基时,易失去酚羟基上的氢,具有直接清除或淬灭超氧阴离子、羟基自由基、H2O2等活性氧、自由基的作用有关[26]。
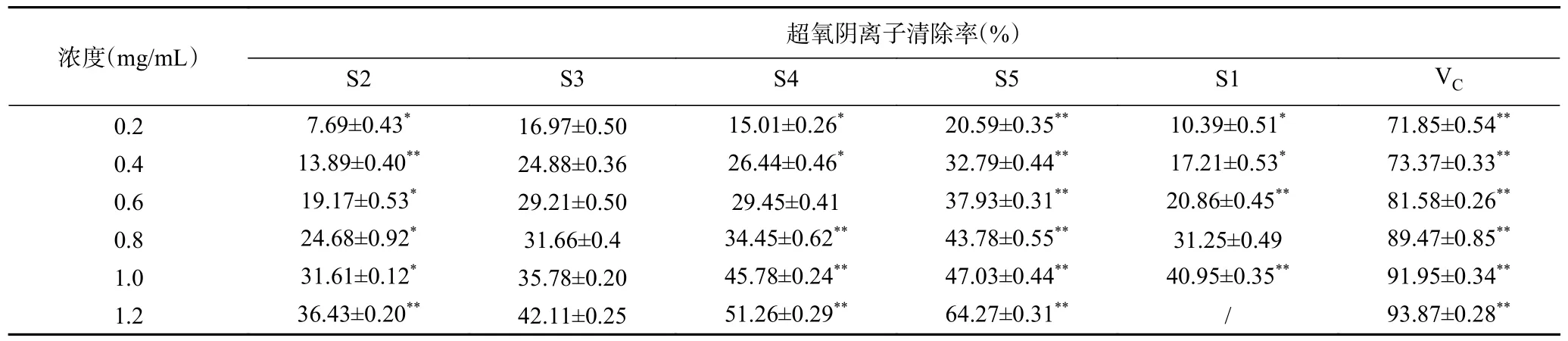
表4 酸枣仁不同极性部位对超氧阴离子自由基清除能力Table 4 Removal ability of superoxide anion free radicals in different polar parts of Semen Ziziphi Spinosae
2.2.4 酸枣仁不同极性部位羟基自由基分析结果由表5 可知,酸枣仁不同极性部位提取物对羟基自由基有良好清除能力,且在0.2~1.2 mg/mL 范围内,随着质量浓度的增加清除能力逐渐增强。在相同浓度下不同极性部位对羟基自由基清除能力大小顺序为:VC>S5>S1>S4>S3>S2,其中,在1.2 mg/mL 时,S5 的清除能力最强,为78.86%±0.45%,接近于VC标准品。以上研究结果表明,酸枣仁不同极性部位均具有一定的羟基自由基清除能力,其中S5 萃取部位效果最好。
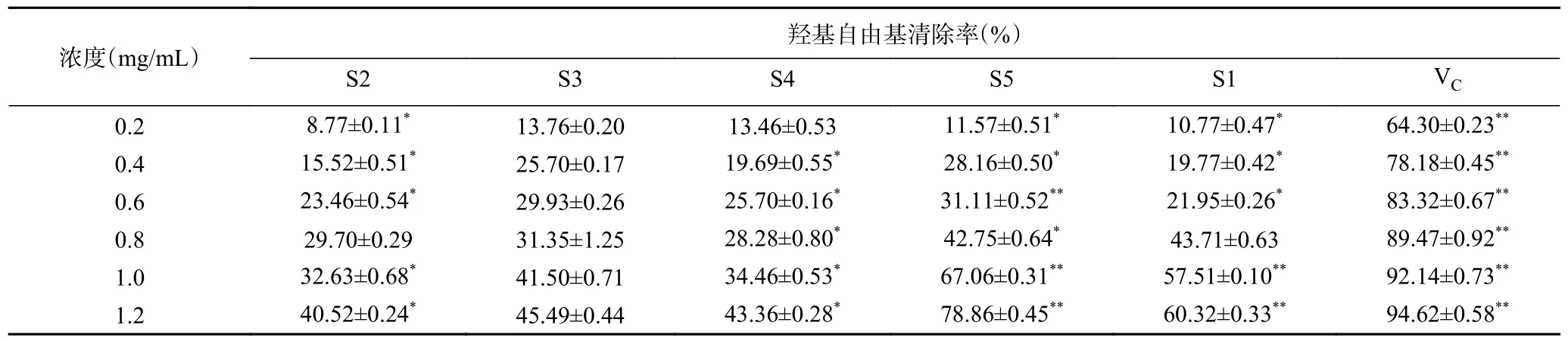
表5 酸枣仁不同极性部位的羟基自由基清除能力Table 5 Removal ability of hydroxyl radicals in different polar parts of Semen Ziziphi Spinosae
2.2.5 酸枣仁不同极性部位清除自由基IC50值分析结果 如表6 所示酸枣仁不同极性部位清除自由基的IC50值可知,S5(正丁醇部位)对DPPH 自由基、羟基自由基、ABTS+自由基和超氧阴离子自由基的清除率IC50值均低于其他部位的IC50值,该研究表明酸枣仁正丁醇部位具有更强的抗氧化活性。
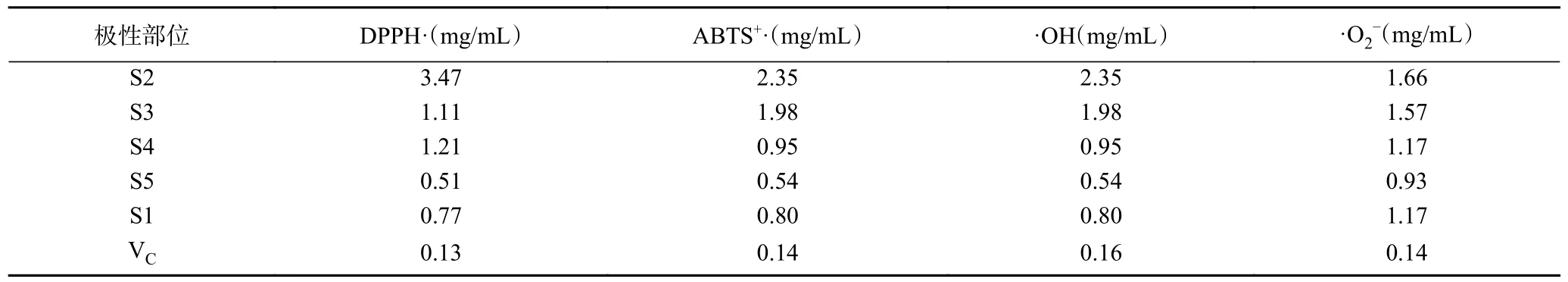
表6 酸枣仁不同极性部位抗氧化活性IC50 值Table 6 IC50 value of antioxidant activity of different polar parts of Semen Ziziphi Spinosae
2.2.6 酸枣仁不同极性部位细胞氧化损伤保护能力分析结果 除上述对酸枣仁不同极性部位抗氧化能力进行测定外,本研究通过测定不同给药组的细胞相对活力,来比较酸枣仁不同极性部位对H2O2所致SH-SY5Y 细胞氧化损伤保护能力的大小,旨在选出酸枣仁对氧化损伤细胞保护的最佳活性部位。如图3 所示,相比于模型组,SH-SY5Y 细胞在空白组正常贴壁状态下呈上皮样,有短触角延伸,成簇生长。在应用H2O2诱导损伤后,细胞形态变大变圆,轮廓不清晰。给药处理后,镜下见细胞形态接近于正常状态。如表7 所示,酸枣仁不同萃取部位对H2O2诱导的SH-SY5Y 细胞氧化损伤有保护能力。与模型组相比,各组样品均提高了细胞存活率。表明,酸枣仁不同极性萃取部位可以改善H2O2诱导的细胞氧化损伤,其中S5 萃取部位对细胞氧化损伤保护能力相对最强,而S2 萃取部位最弱。

表7 酸枣仁不同极性部位的细胞相对活力Table 7 Relative cell viability of different polar parts of Semen Ziziphi Spinosae

图3 酸枣仁不同极性部位对H2O2 所致SH-SY5Y 细胞氧化损伤保护能力对比图Fig.3 Comparison of the protection ability of SH-SY5Y cells caused by H2O2 in different polar parts of Semen Ziziphi Spinosae
2.3 酸枣仁不同极性部位抗氧化活性及成分含量相关性分析结果
2.3.1 酸枣仁不同极性部位各项指标相关性分析结果 皮尔逊相关系数[27]是描述2 个定距变量间联系紧密程度,衡量变量X 和Y 之间的线性相关关系的参数,其值介于-1 与1 之间,一般用r表示,该算法运算效率高且实用性强。由表8 可知,酸枣仁6 个化学组分含量和4 个抗氧化活性指标以及保护氧化损伤细胞能力之间存在良好的线性相关性,其中ABTS+自由基IC50值与总酚酸、总黄酮呈高度线性负相关且显著(P<0.05),与斯皮诺素含量呈高度线性负相关且极显著(P<0.01),相关系数分别为0.938、0.950、0.982;超氧阴离子自由基IC50值与总酚酸呈高度线性负相关且显著(P<0.05),与总黄酮、斯皮诺素含量呈高度线性负相关且极显著(P<0.01),相关系数分别为0.884、0.983、0.982;保护氧化损伤细胞能力与总黄酮、斯皮诺素含量呈高度线性正相关且极显著(P<0.01),相关系数分别为0.995、0.961。上述研究结果表明,酸枣仁中6 个化学组分含量与4 个抗氧化指标均为线性相关关系,推测上述组分均具有良好的抗氧化活性,其中总黄酮、斯皮诺素与抗氧化活性指标和保护氧化损伤细胞能力之间线性关系显著,这可能是因为酸枣仁中总黄酮、斯皮诺素为主要抗氧化活性部位。
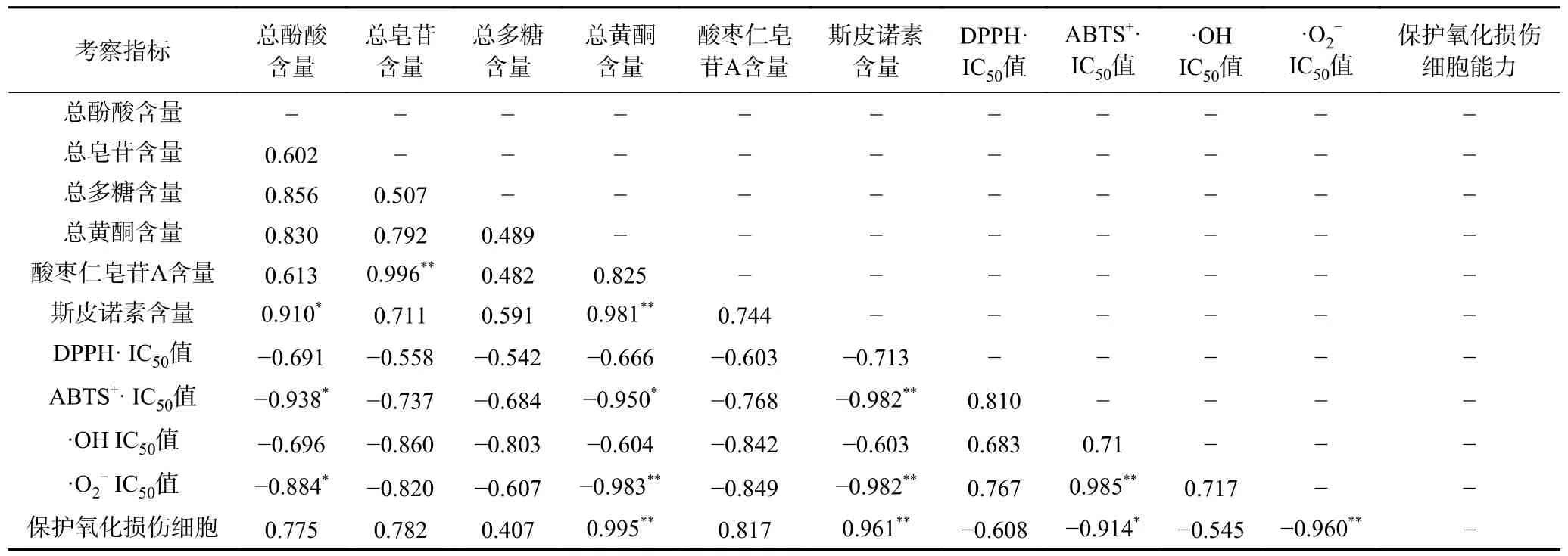
表8 酸枣仁不同极性部位各项指标的皮尔逊相关系数及其相关性检验结果Table 8 Pearson correlation coefficients and correlation test results of different polar parts of Semen Ziziphi Spinosae
2.3.2 酸枣仁不同极性部位抗氧化活性与功能成分偏最小二乘回归分析结果 PLS 方法中,通常通过变量投影重要性指标(VIP)[28]来表征各成分含量对抗氧化活性指标的解释能力大小,其值越大说明该自变量对因变量的解释能力越强,基于VIP 对各成分含量进行筛选后再采用PLS 建模。由表9 可知总黄酮、总酚酸、斯皮诺素变量重要性值较大,在解释变量Y 时具有显著重要性;总皂苷、总多糖变量重要性值较小。
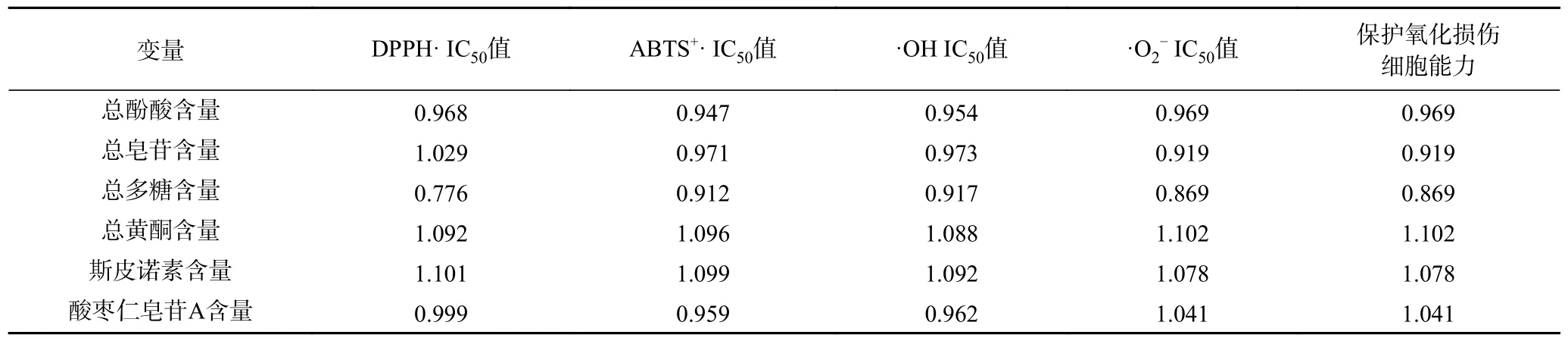
表9 自变量VIP(累积投影重要性)汇总Table 9 Summary of independent variable VIP (emportance of cumulative projection)
采用偏最小二乘回归分析法,对酸枣仁不同极性部位抗氧化活性进行分析,选择酸枣仁不同极性部位成分含量作为自变量X,其中X1为总酚酸含量、X2为总皂苷含量、X3为总多糖含量、X4为总黄酮含量、X5为斯皮诺素含量、X6为酸枣仁皂苷A,其抗氧化指标作为因变量,其中YⅠ为DPPH 自由基清除率、YⅡ为ABTS+自由基清除率、YⅢ为羟基自由基清除率、YⅣ为超氧阴离子清除率、YⅤ为保护氧化损伤细胞能力。得到回归表10 所示方程,由表10可知,回归系数的正、负代表各成分对抗氧化能力的正相关或负相关,回归系数绝对值越大,表明该自变量对抗氧化能力影响越大。按照回归系数绝对值大小排序,可知各成分含量对DPPH 自由基、ATBS+自由基、羟基自由基清除能力以及保护氧化损伤细胞能力的影响由大到小均为:X2>X3>X5>X4>X6>X1,该结果与表9 结果一致,因此推测出总酚酸、总黄酮、斯皮诺素含量对酸枣仁发挥抗氧化能力及氧化损伤细胞保护能力影响较大。

表10 酸枣仁不同极性部位抗氧化活性与成分含量最小二乘回归分析结果Table 10 Results of the partial least squares regression analysis of antioxidant activity and ingredient content in different polar parts of Semen Ziziphi Spinosae
3 讨论与结论
本文以体外抗氧化活性及对H2O2所致SHSY5Y 细胞损伤保护能力结合酸枣仁各部位成分含量变化来挖掘酸枣仁抗氧化能力与酸枣仁不同成分的关系,明确酸枣仁发挥抗氧化作用的物质基础,结果表明酸枣仁不同极性部位均具有良好的抗氧化活性,但抗氧化能力强弱并不一致,其中S5 萃取部位抗氧化活性优于其他部位,因此推断正丁醇萃取部位可能是酸枣仁抗氧化的主要活性部位。采用紫外分光光度法,HPLC 法测定了酸枣仁不同萃取部位成分含量,发现S5 部位总黄酮、总皂苷含量较高,说明黄酮类、皂苷类成分在正丁醇部位进行了富集。植物黄酮类成分由于其含多个酚羟基的结构特性,被称为天然的抗氧化活性物质[29],酸枣仁皂苷因其具有多个氧化和还原官能团,且具有烯丙型稳定结构的多位点活性中心,具较强的抗氧化活性[30],因此,推断酸枣仁提取物抗氧化活性跟黄酮类、皂苷类成分含量相关。其不同极性部位抗氧化活性的变化趋势与其总黄酮、总皂苷含量具有一致性,因此推断其黄酮类、皂苷成分可能为酸枣仁发挥抗氧化作用的潜在物质基础。
采用PLS 相关分析探究各活性部位成分含量与抗氧化指标的对应关系,将各指标与各组分进行相关性分析,各活性部位成分含量对DPPH 自由基、ABTS+自由基、羟基自由基清除能力以及保护氧化损伤细胞能力的影响由大到小均为:X2>X3>X5>X4>X6>X1。由此可说明总皂苷、总黄酮、斯皮诺素含量对酸枣仁发挥抗氧化能力及氧化损伤细胞保护能力影响较大。相关性分析结果表明,不同成分含量之间存在着互相影响、互相牵制的关系,总皂苷、总黄酮等成分含量的变化可能会导致其他成分含量与抗氧化能力的改变;偏最小二乘回归分析研究再次表明酸枣仁中总皂苷、总黄酮、斯皮诺素含量对其抗氧化能力影响最大。因此,本研究不仅测定了酸枣仁中主要成分的含量,而且明确了主要化学成分对抗氧化的影响,可为酸枣仁在保健食品等方面的开发利用提供参考。
