超声波辅助DES 提取肉苁蓉多酚的工艺优化、动力学及抗氧化活性研究
2023-08-13魏玉萍宋丽军潘磊庆侯旭杰
魏玉萍,赵 岩,宋丽军 ,潘磊庆,侯旭杰
(1.塔里木大学生命科学学院,新疆阿拉尔 843300;2.河北科技师范学院食品科技学院,河北秦皇岛 066600;3.南京农业大学食品科技学院,江苏南京 210095)
管花肉苁蓉(Cistanche. tubulosa(Schrenk). R.Wight)广泛分布于中国西北荒漠地区,为列当科(Orobanchaceae)根寄生植物,又名大芸、金笋等[1]。管花肉苁蓉具有与荒漠肉苁蓉相似的化学成分和药理活性,于2005 年被列入《中国药典》,为“食药同源”原料[2]。在传统中医学中,肉苁蓉味甘、性温,具有“主五劳七伤,补中,除茎中寒热痛,养五脏,强阴,益精血”之功效,亦有“沙漠人参”之称[3]。最新研究表明,肉苁蓉具有抗衰老、抗氧化、润肠通便、降血脂、降血糖、保肝等药理活性[4-8]。肉苁蓉的药理活性与其所含的多种功能性成分密切相关,如多酚类、多糖类、低聚糖类和糖苷类等[3,9-10]。研究表明,肉苁蓉中含有松果菊苷、毛蕊花糖苷和异毛蕊花糖苷等多酚类物质,具有内分泌调节、抗神经退行性疾病活动、抗肿瘤、抗炎、保肝、抗氧化等生理功能[11-16]。
多酚的提取方式主要有溶剂浸提法、索氏提取法、超声波辅助法等。其中超声波辅助提取引入高频波使溶质-溶剂混合物发生扰动、细胞壁破裂和溶剂扩散;具有成本低,效率高,操作简等优点。但是该方法普遍采用有机溶剂作为萃取剂,导致的溶剂残留问题与绿色化学的原则相悖[17]。低共熔溶剂(Deep eutectic solvents,DESs)由卤化物盐(即氢键受体)和一个或两个氢键供体(HBDs)组成,具有生物降解性、低毒性和低成本等优点,是分离、材料科学、生物催化和有机合成的领域的优质溶剂。目前,DESs已广泛应用于不同原料中多酚类、黄酮类、多糖类、蛋白质类等成分的提取。Cvjetko 等[18]以草酸-氯化胆碱基为萃取溶剂,利用超声辅助溶剂提取葡萄皮酚类化合物并取得了良好效果;Bajkacz 等[19]使用超声波辅助低共熔溶剂提取大豆异黄酮,Bosiljkov 等[20]利用超声辅助低共熔提取酒糟花青素。
目前采用超声波辅助DES 提取肉苁蓉多酚的研究鲜见报道。利用超声辅助DES 提取肉苁蓉多酚,其提取效率受多种因素影响,为分析各因素的影响及相互作用,采用响应面优化对提取过程进行数学分析及优化。本文以新疆管花肉苁蓉为原料,首先从19 种 DESs 中筛选最佳 DES 作为萃取溶剂,进而在单因素实验的基础上,采用响应面法优化超声波辅助DES 提取肉苁蓉多酚的最佳工艺,并进一步研究提取动力学及其体外抗氧化活性,为新疆管花肉苁蓉多酚的绿色制备提供理论依据。
1 材料与方法
1.1 材料与仪器
管花肉苁蓉 于2020 年4 月15 日采自新疆和田地区洛浦县,采集大小均匀(直径5 cm 左右,长度20 cm 左右)、无病虫害及机械损伤的样品。样品经切分并冷冻干燥,粉碎后过60 目筛,并于-18 ℃密封、避光保存备用;氯化胆碱、葡萄糖、1,4-丁二醇、1,3-丁二醇、脯氨酸、木糖醇、甜菜碱、乳酸、乙酰丙酸、丙三醇 分析纯,阿拉丁试剂公司;甲醇、乙腈、甲酸 色谱纯,德国Merck 公司;抗坏血酸(≥98%)、2,2-联氮-双(3-乙基苯并噻唑啉-6-磺酸)(ABTS,≥98%)、二苯基苦味酰基苯肼基自由基(DPPH,≥98%)等试剂均为分析纯 北京索莱宝科技有限公司。
KQ-50DB 数控超声波清洗器 昆山市超声仪器有限公司;LGJ-25C 冷冻干燥机 北京四环科学仪器厂有限公司;D-SY96S 全波长酶标仪 山东竞道广电科技有限公司;BK-FD10P 高速冷冻离心机广州吉迪仪器有限公司;752S 紫外分光光度计 上海棱光仪器有限公司。
1.2 实验方法
1.2.1 低共熔溶剂的制备 根据Hadidi 等[21]的方法制备DESs:分别以氯化胆碱、甜菜碱、脯氨酸为氢键受体,以多元醇类(丙三醇、1,4-丁二醇、1,3-丁二醇、木糖醇)、酰胺类(尿素)、糖类(葡萄糖)和羧酸类(乳酸、乳糖、苹果酸、乙酰丙酸)为氢键供体。将各组分溶剂按照不同摩尔比混合,在80 ℃条件下持续搅拌4~6 h,直至形成无色透明的均匀液体,冷却至室温即可制得不同类型的DESs(表1)。
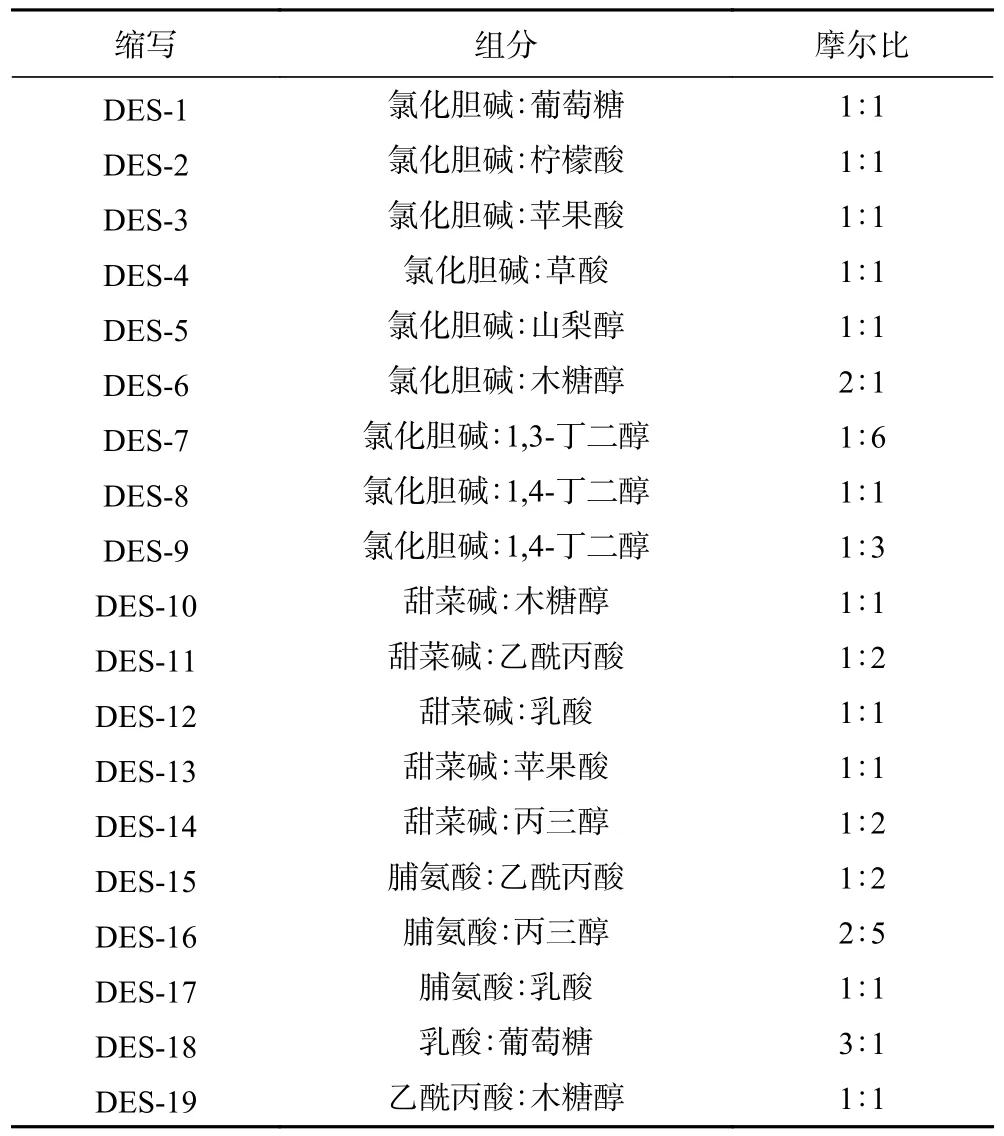
表1 不同低共熔溶剂的组成及缩写Table 1 Composition and abbreviations of the studied DESs
1.2.2 低共熔溶剂的筛选 在温度40 ℃、含水率40%、液料比50:1 g/mL、超声时间30 min 条件下,分别采用不同DESs 提取肉苁蓉多酚并计算提取率。
1.2.3 超声辅助低共熔溶剂提取肉苁蓉多酚
1.2.3.1 单因素实验 准确称取样品粉末2.00 g,在固定超声温度40 ℃、超声时间30 min、液料比50:1 mg/mL、含水量40%条件下,分别研究不同含水率(10%、20%、30%、40%、50%、60%),液料比(20:1、30:1、40:1、50:1、60:1、70:1 mg/mL),超声温度(25、30、40、50、60、70 ℃),超声时间(10、20、30、40、50 min)对肉苁蓉多酚的提取效果。提取完成后,混合液经6000 r/min 离心10 min,取上清液减压浓缩后定容至25 mL,测定其多酚含量。
1.2.3.2 响应面优化试验 在单因实验的基础上(超声温度40 ℃、超声时间30 min、含水率40%、料液比1:40 g/mL),采用Box-Behnken(BBD)进行试验设计,选择含水率(A)、温度(B)、时间(C)、料液比(D)为自变量,多酚提取率(mg/g DW)为响应值(Y)进行响应面优化试验,其因素和水平如表2 所示。

表2 响应面试验因素水平设计Table 2 Factors and levels of response surface design
1.2.3.3 超声辅助DESs 提取肉苁蓉多酚的动力学研究 根据二阶吸附动力学方程[22]对提取过程进行拟合:
式中:KB为二级反应速率常数(mL·mg-1·min-1);Ceq为反应平衡浓度(mg/L);Ct是在t 时刻的提取浓度(mg/L)。
h 是t 接近0 时的初始提取率(g·L-1·min-1):
因此,提取速率即简化为关于提取时间t 的函数:
1.2.4 肉苁蓉多酚含量测定 总多酚含量采用Folin-Ciocalteu(FC)法测定:肉苁蓉多酚提取物按一定比例稀释后,取1.0 mL 与5.0 mL FC 试剂混合均匀,用蒸馏水稀释10 倍,添加4.0 mL 碳酸钠(7.5%,w/v)并充分混合,避光静置30 min 后,在765 nm 处测定吸光度,结果以没食子酸当量表示(GAE/g DW)。多酚得率计算公式如下:
式中:W 表示多酚的得率mg/g;C 表示计算通过标准曲线计出的溶液质量浓度,mg/mL;V 表示溶液的体积,mL;m 表示肉苁蓉取样量,g。
1.2.5 肉苁蓉多酚体外抗氧化活性研究
1.2.5.1 DPPH 自由基清除能力 参考Baba 等[23]的方法略加修改:分别取50 μL 不同浓度(0.1、0.25、0.5、1.0、2.0、3.0、4.0、5.0、10 mg/mL)的肉苁蓉多酚提取液加入96 孔板中,分别加入150 μL 浓度为1 mmol/L 的DPPH·乙醇溶液,混匀后于37 ℃下避光静置30 min。在517 nm 处测定其吸光度,根据式(6)计算:
式中:A1代表样品的吸光度; A2为蒸馏水代替样品的吸光度。
1.2.5.2 ATBS+自由基清除能力 参照Mejri 等[24]的方法略加修改:取19.2 mg ABTS 溶解于过硫酸钾溶液(2.45 mmol/L),在室温、黑暗条件下静置12~16 h得即ABTS 储备液(7 mmol/L)。用乙醇稀释ABTS储备液使其在734 nm 处吸光度为0.700±0.020。分别取10 μL 不同浓度(0.1、0.25、0.5、1.0、2.0、3.0、4.0、5.0、10.0 mg/mL)的肉苁蓉多酚提取液加入96 孔板中,然后分别加入150 μL ABTS 溶液,混匀后于37 ℃下避光静置30 min,在734 nm 处测定其吸光度,根据式(7)计算:
式中: Ao代表样品在734 nm 处的吸光值; Ai为蒸馏水代替样品在734 nm 处的吸光值。
1.3 数据处理
所有数据平行测定三次,结果以平均值±标准差(SD)表示。动力学模型的参数通过非线性回归拟合、决定系数R2和估计的标准误评估拟合效果。数据分析处理采用SPSS 17.0 进行,使用Origin 2021对实验数据进行绘图。
2 结果与分析
2.1 DESs 的筛选
图1 为不同DESs 对肉苁蓉多酚得率的影响。由图1 可知:氢供体为多元醇和羧酸的DESs 表现出更佳的提取性能,DES-9(氯化胆碱:1,4-丁二醇=1:3)的得率最高,为37.15 mg/g DW;其次是DES-16(脯氨酸:丙三醇=2:5),得率为36.55 mg/g DW。可能原因是以多元醇和羧酸为氢供体的DESs对肉苁蓉多酚具有更强的氢键作用力,且具有更低的粘度和更好的流动性[25]。根据Wang 等[26]的研究,以羧酸为氢键供体的DESs 可以在高温下与细胞壁发生反应,增强对细胞壁的破坏作用。Zuo 等[27]研究发现,醇基DESs 具有更高的导电性,表现出更好的提取效率。显著性分析发现,DES-9 和DES-16 差异不显著,综合考虑低共熔溶剂制备条件、经济等因素,选择脯氨酸:丙三醇(摩尔比2:5)为提取溶剂进行后续研究。
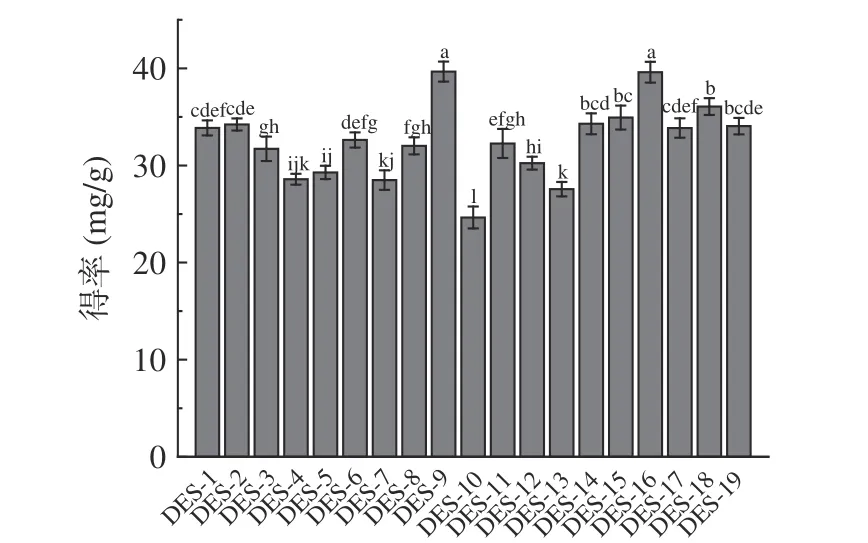
图1 不同DESs 对肉苁蓉多酚得率的影响Fig.1 Effect of various DESs on the yield of polyphenols
2.2 超声波辅助提取条件优化
2.2.1 单因素实验结果
2.2.1.1 低共熔溶剂含水率对肉苁蓉多酚得率的影响 在相同的超声辅助提取条下加入不同比例的水,所制备的低共熔溶剂的粘度、极性及表面张力有所不同,会对多酚得率产影响。如图2 所示:当含水率达到40%,多酚的得率达到峰值,为36.97 mg/g;当含水率大于40%时,多酚得率逐渐下降。分析认为,随着含水率的增大,DESs 溶剂的粘度减小,有利于酚类物质的溶出,而过多的水则会削弱低共熔体系和各组分之间相互作用,从而降低提取效率[28]。故后续响应面优化试验最佳低共熔溶剂含水率为40%。
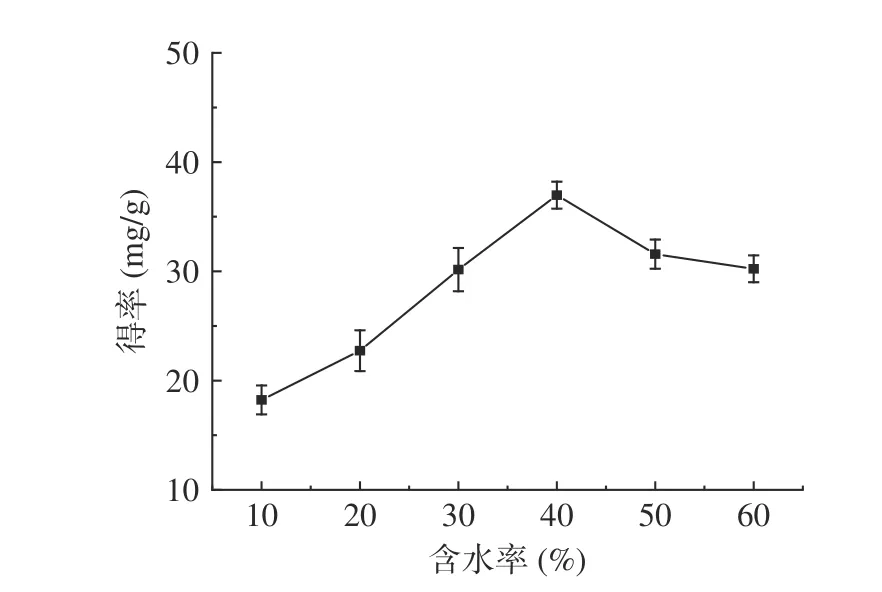
图2 低共熔溶剂含水率对多酚得率的影响Fig.2 Effect of low eutectic solvent water content on the yield of polyphenols
2.2.1.2 液料比对肉苁蓉多酚得率的影响 如图3所示:当液料比达到50:1 mg/mL,多酚的得率达到峰值38.74 mg/g;当液料比大于50:1 g/mL,多酚得率逐渐下降。本文实验结果与栾朝霞[29]的研究结果一致,在提取过程中干物质会吸收水分,液料比太小,吸水能力较低,会影响提取效率,但液料比过高,则会导致提取效果不明显并造成溶剂的浪费。随着液料比的提高,溶剂的用量也会随之增加,从而使超声波与肉苁蓉粉末的相互作用减弱[28],因此后续响应面优化实验最佳液料比选择50:1 g/mL。
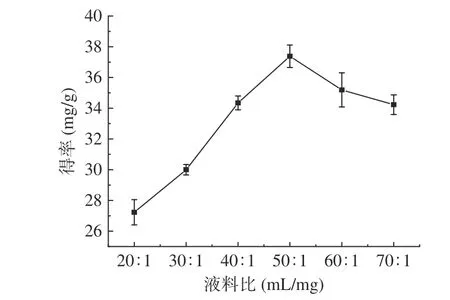
图3 液料比对多酚得率的影响Fig.3 Effect of liquid to material ratio on the yield of polyphenols
2.2.1.3 超声温度对肉苁蓉多酚得率的影响 如图4 所示:当超声温度达到40 ℃,多酚的得率达到峰值(35.20 mg/g);当超声温度大于40 ℃时,多酚得率逐渐下降。随着超声温度的不断升高,乙醇溶液的粘性降低,分子的热运动速度逐渐加快,多酚的得率也随之增加;而多酚成分热稳定较差,高温易导致部分热敏性多酚类化合物降解[30],故后续响应面优化试验最佳超声温度选择为为40 ℃。
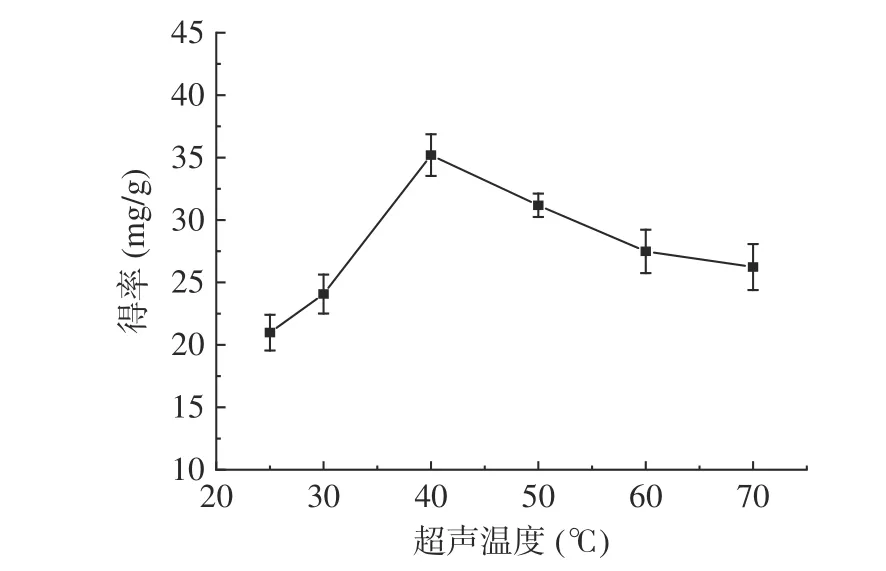
图4 超声温度对多酚得率的影响Fig.4 Effect of ultrasonic temperature on polyphenol yield
2.2.1.4 超声时间对肉苁蓉多酚得率的影响 超声时间时影响肉苁蓉多酚得率得重要因素之一,从图5可知,在10~30 min 的超声时间与得率呈明显的正相关关系,超声30 min 多酚的得率为37.45 mg/g。30 min 后,超声时间与多酚得率下降。这可能是由于超声波在水中的作用时间越久,产生的能量越大,在溶液中空穴作用也越大,对肉苁蓉细胞壁的损伤越大,多酚得率也随之增加,但是超声波的产热会导致多酚的分解,造成多酚得率降解[31]。故后续响应面优化试验最佳超声时间选择为30 min。
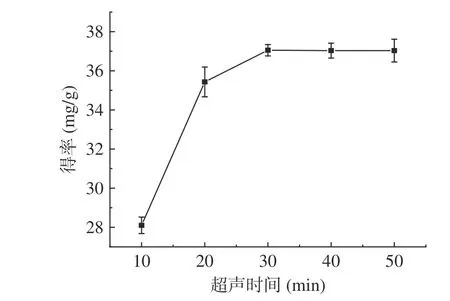
图5 超声时间对多酚得率的影响Fig.5 Effect of sonication time on the yield of polyphenols
2.2.2 模型的建立及检验 响应面试验设计与结果如表3 所示,用多元线性回归拟合得到多酚提取率率(Y)与DESs 含水率(A)、超声温度(B)、超声时间(C)、液料比(D)的回归方程:

表3 响应面分析方案及试验结果Table 3 Response surface analysis scheme and test results
模型方差分析结果如表4 所示:该模型极显著(F值为30.19,P<0.0001),失拟项不显著(F=3.71,P=0.1092)。各项显著性因素统计分析表明,其显著性大小顺序为:D>B>C>A,即料液比>超声温度>超声时间>含水率,AC、AD、BC,A2、B2、C2、D2对肉苁蓉多酚提取率影响显著(P<0.05)。模型的决定系数R2=0.9679,表明模型可以预测实验结果。校正决定系数R2adj=0.9359,变异系数C.V.=1.89%,结果表明模型具有可复制性。综上所述,实验拟合的模型预测性良好。
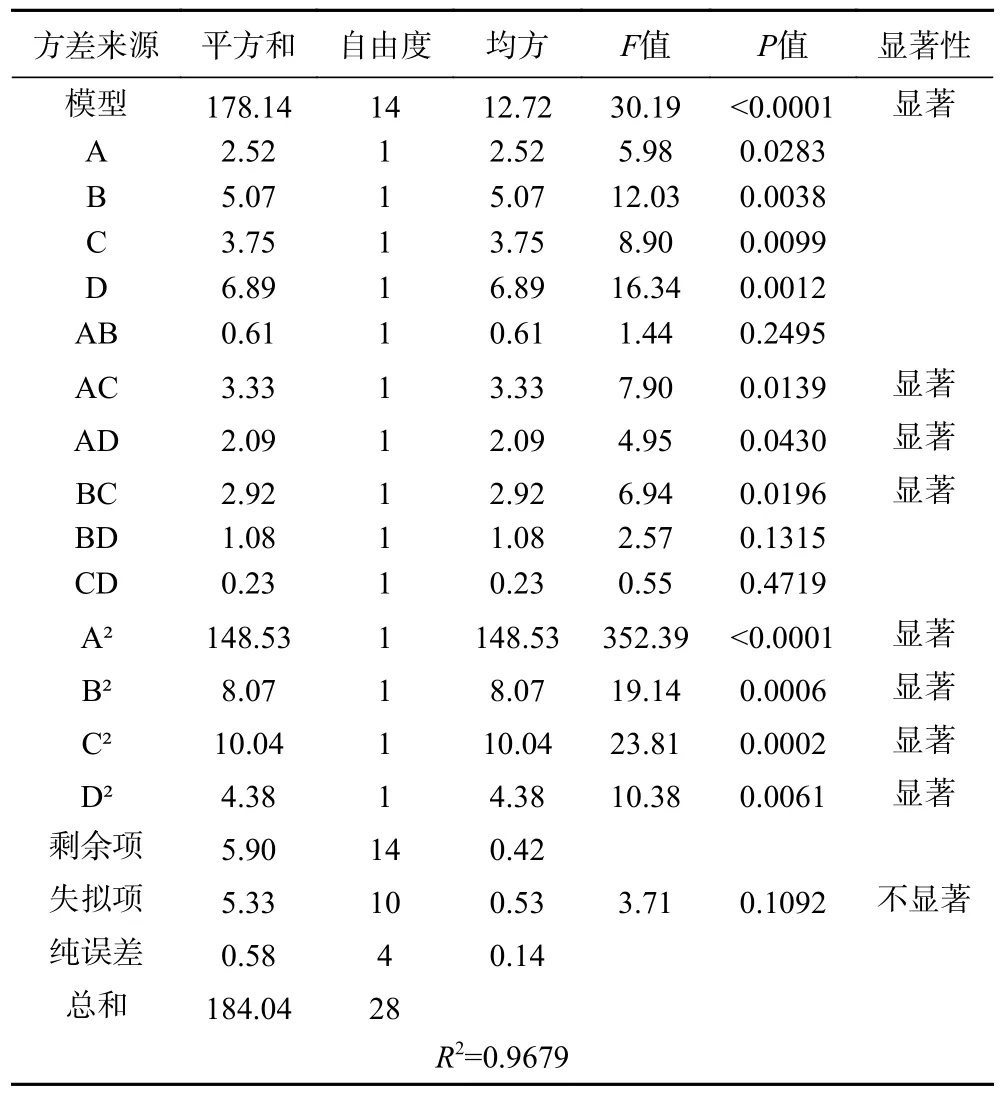
表4 模型方差分析结果Table 4 Model analysis of variance
2.2.3 各因素的交互作用对多酚提取率的影响 通过3D 响应面图可以直观地解释不同变量相互作用对多酚得率的影响。由图6a 可知:随着含水率和超声温度的增大,肉苁蓉多酚得率也逐渐升高。较高的温度可以减少植物次生代谢产物与基质之间的物理吸附和化学相互作用,增加DES 的渗透性,促进多酚从植物基质内部向DES 溶剂的传质[32-33]。但当温度超过39 ℃,含水率超过40%时,多酚得率开始下降。多酚得率随着含水率和提取时间的增大而逐渐增加,但当提取时间超过27.5 min 时,多酚得率开始下降(图6b)。类似的结果如图6c 所示:随着含水率和液料比的增加,多酚得率随之上升,但当液料比超过45 g/mL 时,得率开始下降。
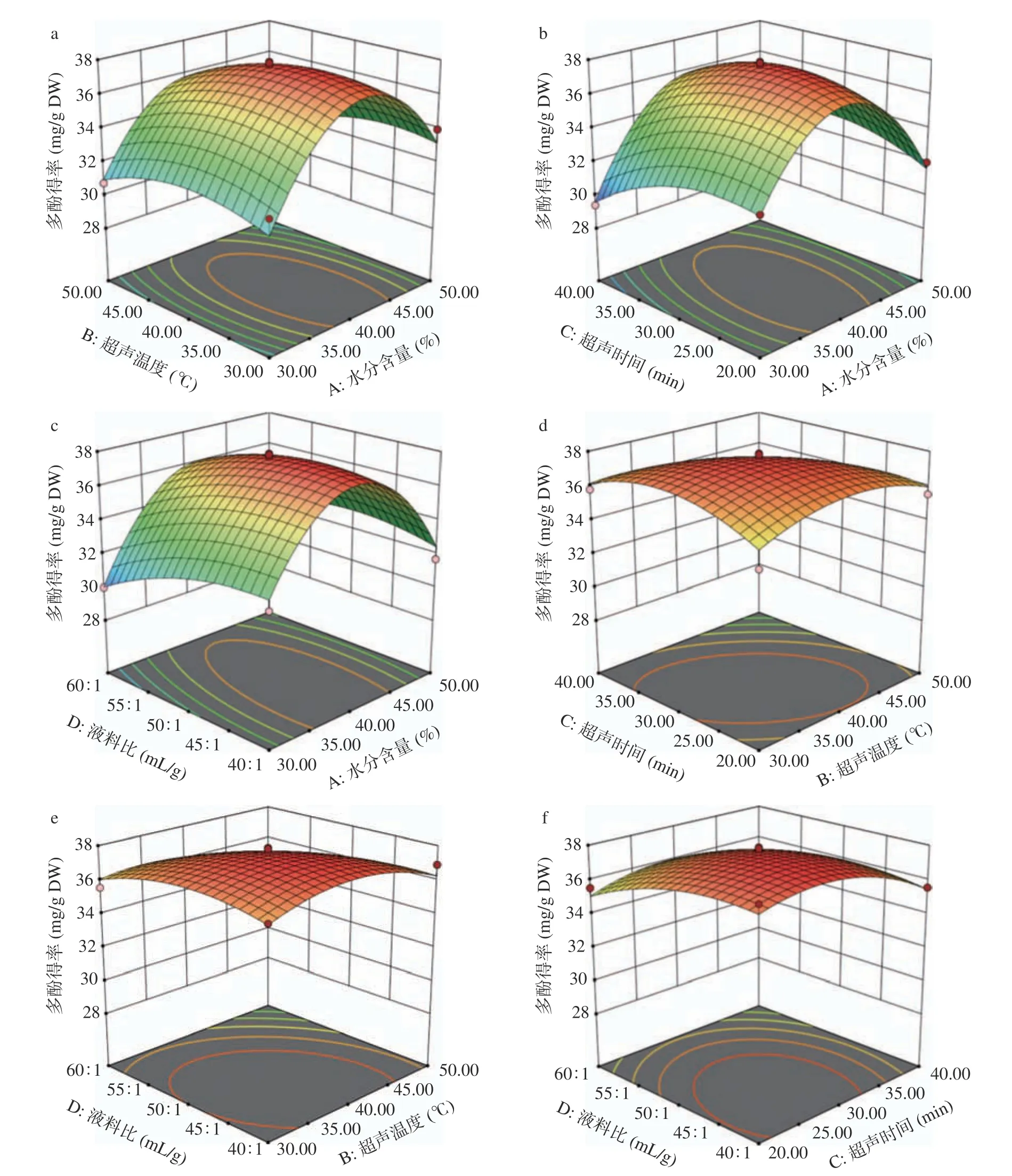
图6 不同因素交互作用对肉苁蓉多酚得率的影响Fig.6 Effect of interaction of different factors on the yeild of polyphenols
综上所述,为了从肉苁蓉中获得最高的多酚得率,利用Designe Expert 软件中的优化模块得到了肉苁蓉多酚的最佳提取条件为:超声温度39.13 ℃,液料比45.28 g/mL、含水率39.92%、超声时间27.57 min,此条件下预测多酚得率为37.84 mg/g。
2.3 超声辅助DESs 提取肉苁蓉多酚的动力学分析
2.3.1 提取温度对肉苁蓉多酚提取动力学的影响图7 为不同温度下DESs 提取肉苁蓉多酚的拟合曲线。由图7 可知:多酚浸出率在提取初期增长迅速;当提取时间超过25 min 后,多酚浸出率增长速率减缓。管花肉苁蓉多酚最初的快速浸出可归因于水的驱动力[34]。
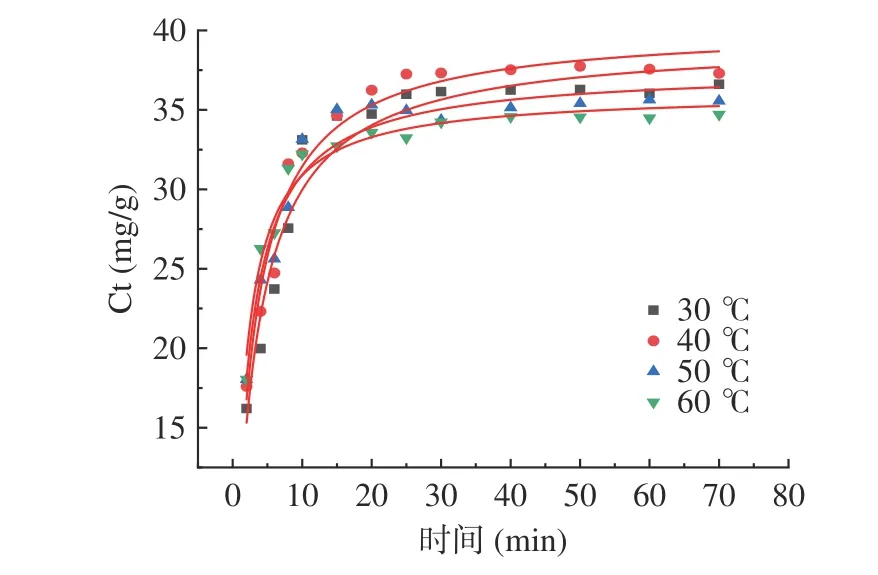
图7 不同温度下DESs 提取肉苁蓉多酚的拟合曲线Fig.7 Fitting curve of polyphenols extracted at different temperatures using DESs
根据二级动力学数据绘制二级浸出模型,图8为“t/Ct-浸出时间”的关系图。由图可知:二级浸出模型与实验结果的一致性证实了如下假设:即在管花肉苁蓉多酚的浸出过程中,主要有两种现象:最初阶段(0~25 min)多酚存在强烈的溶解作用,期间发生了最大程度的浸出;第二个阶段(25~70 min)多酚浸出主要取决于外部扩散,与基质中残留多酚的量有关,因此其提取速率缓慢[22]。
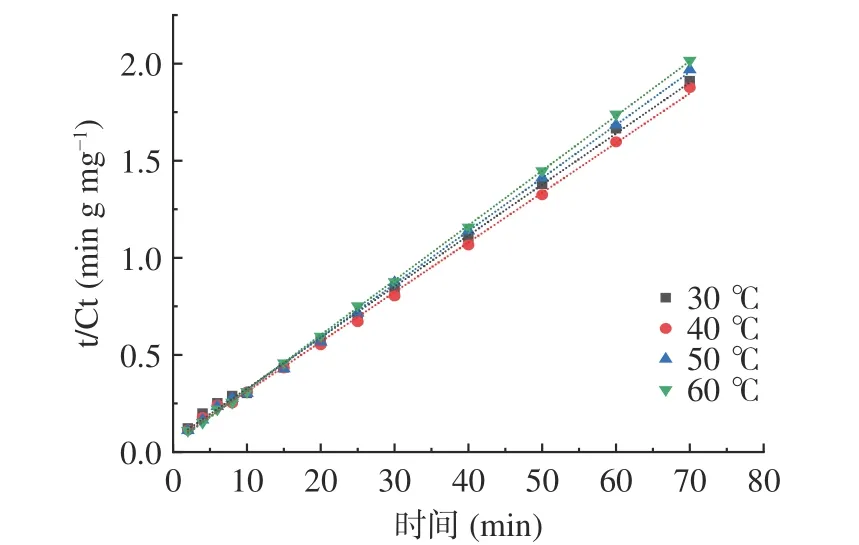
图8 不同温度下DESs 提取肉苁蓉多酚动力学Fig.8 Kinetics of polyphenols extracted at different temperatures using DESs
表5 为不同温度下DESs 提取肉苁蓉多酚的二级动力学参数,包括饱和时浸出多酚含量Ceq、浸出速率常数kB、初始浸出速率h 和决定系数R2。由表5 可知:初始浸出速率h 随温度升高而增加,变化范围为15.68 至25.85 g·L-1·min-1;温度从30 ℃升高到60 ℃过程中,速率常数kB也从0.0108 增加到0.200 mg·g-1·min-1,二级浸出速率常数随温度增加而增加。

表5 不同温度下DESs 提取肉苁蓉多酚的二级动力学参数Table 5 Secondary kinetic parameters of polyphenols extraction using DESs at different temperatures
2.3.2 含水率对肉苁蓉多酚提取动力学的影响 图9为不同含水率DESs 提取肉苁蓉多酚拟合曲线。根据二级动力学数据绘制二级浸出模型,图10 为t/Ct-浸出时间的关系图。由图9、图10 可知:肉苁蓉多酚的浸出率在提取初期增长迅速,在浸出后期增速非常缓慢。
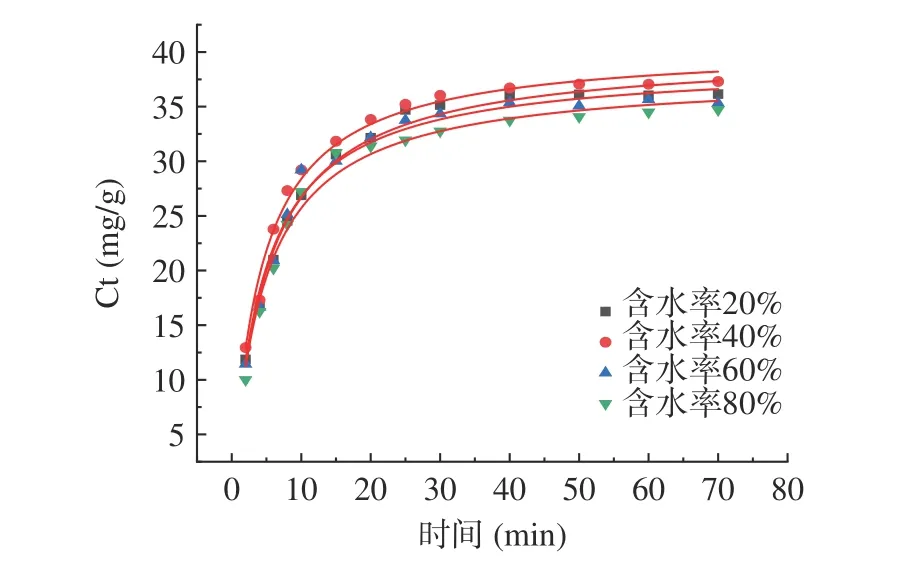
图9 不同含水率DESs 提取肉苁蓉多酚拟合曲线Fig.9 Fitting curve of polyphenols extracted using DESs with different moisture contents
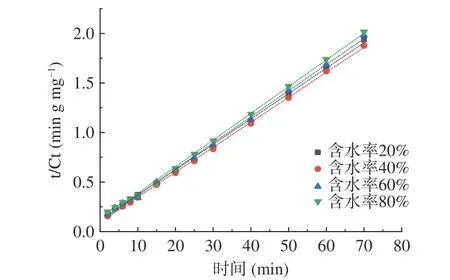
图10 不同含水率DESs 提取肉苁蓉多酚动力学Fig.10 Kinetics of polyphenols extracted using DESs with different moisture contents
表6 为不同含水率DESs 提取肉苁蓉多酚的二级动力学参数。由表6 可知:初始浸出率h 的变化范围为8.9429 至10.4015 g·L-1·min-1,含水率为40%时初始浸出率最高。
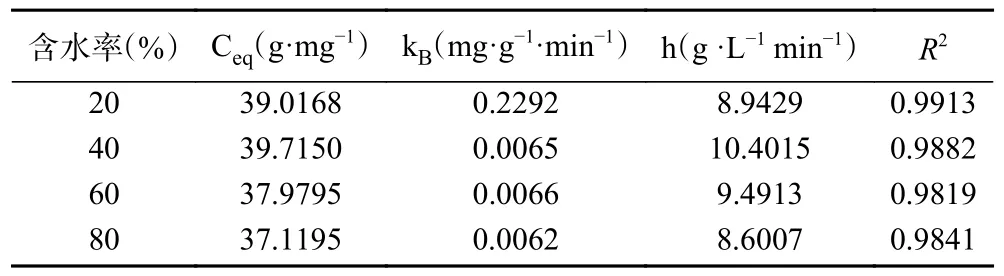
表6 不同含水率DESs 提取肉苁蓉多酚的二级动力学参数Table 6 Secondary kinetic parameters of polyphenols extraction using DESs at different moisture contents
2.4 模型验证
基于预测模型得到的最佳提取条件,结合实际操作的可行性,将最佳提取条件修改为:超声温度39 ℃,液料比45 mL/g、含水率40%、提取时间28 min。在此条件下进行三次验证实验,多酚提取率平均值为37.76±0.12 mg/g,与回归模型预测值(37.835±0.996 mg/g)相符,表明本实验得到的最优条件是可靠的。
2.5 肉苁蓉多酚提取物的抗氧化活性
图11、图12 分别为肉苁蓉多酚提取物对DPPH和ABTS+自由基清除能力。由图可知:随着提取物浓度的越大,其对DPPH 和ABTS+自由基的清除能力也越强。当提取物的浓度为5 mg/mL 时,对两种自由基的清除率分别达到73.69%和88.06%,随后其清除能力趋于平缓,其IC50值分别为0.875 和0.501 mg/mL。在相同浓度条件下,多酚提取物对两种自由基的清除能力均低于抗坏血酸。此结果与刘伯言[35]研究结果一致。多酚提取物的抗氧化作用可能与其结构有关,肉苁蓉多酚中酚羟基含量越丰富,生物活性就越强,同时分子中共轭体系增加,活性增强。
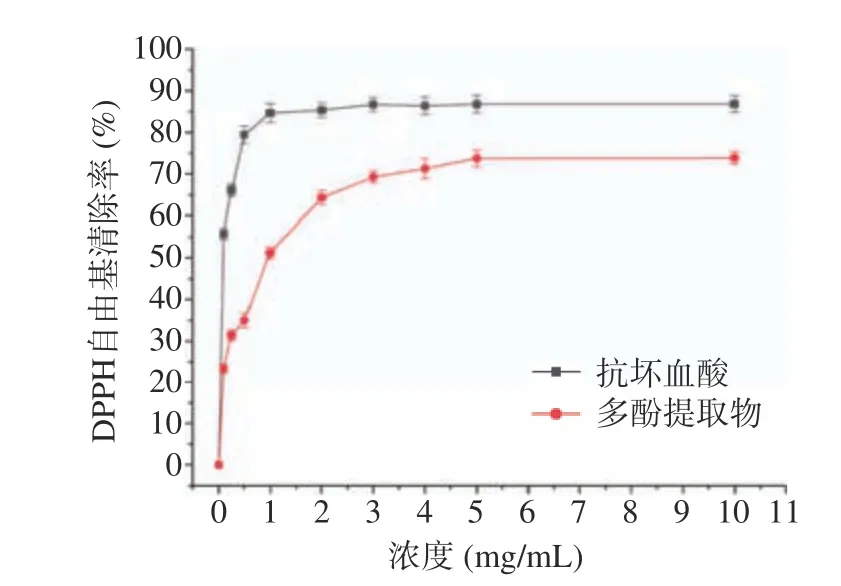
图11 多酚提取物对DPPH 自由基的清除能力Fig.11 DPPH radical scavenging activity of polyphenol extracts
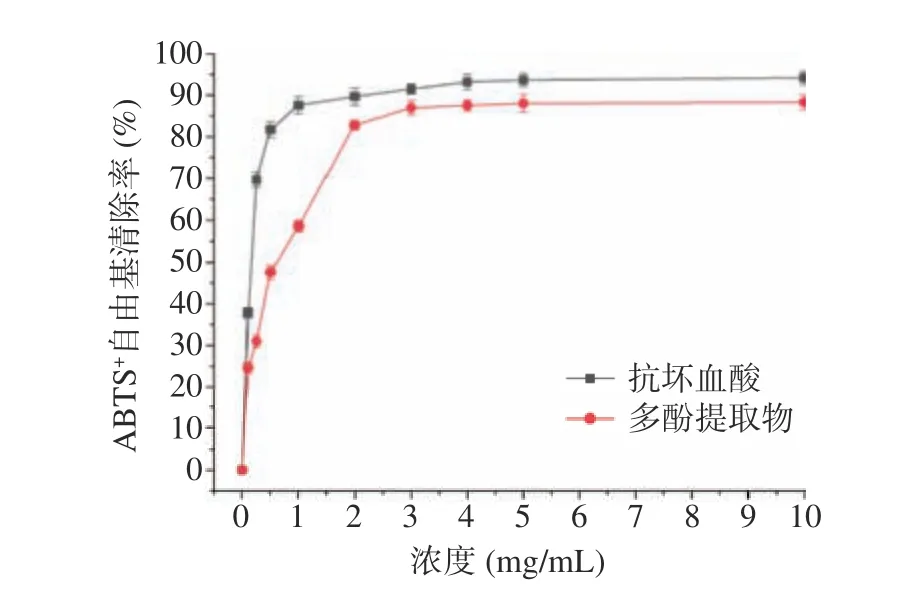
图12 多酚提取物对ABTS+自由基的清除能力Fig.12 ABTS+ radical scavenging activity of polyphenol extracts
3 结论
本文建立了一种绿色、快速的从肉苁蓉中提取多酚类化合物的方法。以脯氨酸-丙三醇(摩尔比2:5)制备的低共熔溶剂(DES)为萃取溶剂,在单因素实验的基础上采用响应面法优化了超声波辅助低共熔溶剂(UAE-DES)提取肉苁蓉多酚的最佳提取工艺:超声温度40 ℃,液料比45 mL/g、含水量40%、超声时间28 min,在此条件下多酚得率为37.76 mg/g DW。UAE-DES 提取肉苁蓉多酚的过程符合Fick 定律,并建立了肉苁蓉多酚超声波辅助提取的二级动力学模型。肉苁蓉多酚提取物对DPPH 和ABTS+自由基具有较强的清除能力,其IC50值分别为0.875 和0.501 mg/mL。UAE-DES 具有环境友好、成本低廉、萃取效率高等优点,后续将对UAE-DES 提取成本、环境污染等方面继续进行研究,为从植物材料中提取多酚类生物活性化合物提供了理论依据。
